冬小麦膨胀素基因TaEXPB8、TaEXPB10的克隆及低温表达分析
2017-03-01王明晶王晓磊徐永清李凤兰彭丽娜董佳敏张俊峰胡宝忠
王明晶,王晓磊,徐永清,李凤兰,王 旭,彭丽娜,李 飞,董佳敏,张俊峰,胡宝忠,*
(1.东北农业大学 生命科学学院,黑龙江 哈尔滨 150030; 2.哈尔滨学院,黑龙江 哈尔滨 150086)
冬小麦膨胀素基因TaEXPB8、TaEXPB10的克隆及低温表达分析
王明晶1,王晓磊2,徐永清1,李凤兰1,王 旭1,彭丽娜1,李 飞1,董佳敏1,张俊峰1,胡宝忠1,2*
(1.东北农业大学 生命科学学院,黑龙江 哈尔滨 150030; 2.哈尔滨学院,黑龙江 哈尔滨 150086)
以冬小麦强抗寒品种东农冬麦1号为试验材料,从其根中克隆膨胀素基因TaEXPB8、TaEXPB10,并分析其在低温条件下的表达情况,为研究膨胀素基因与植物抗寒性之间的关系奠定基础。结果表明,在冬小麦强抗寒品种东农冬麦1号根中克隆得到膨胀素基因TaEXPB8、TaEXPB10,二者分别编码273、271个氨基酸,二者序列与GenBank上公布的序列同源性分别达到99.2%、99.6%。4 ℃、-10 ℃和-20 ℃的低温胁迫处理均可诱导TaEXPB8、TaEXPB10基因在冬小麦强抗寒品种东农冬麦1号根中表达,尤其是TaEXPB10基因,其受诱导程度高于TaEXPB8;两基因在低抗寒品种济麦22号中总体上不受诱导,甚至受到抑制。综合比较发现,4 ℃、-10 ℃和-20 ℃低温胁迫下,TaEXPB8、TaEXPB10基因在强抗寒品种东农冬麦1号中的表达量均明显高于低抗寒品种济麦22号。据此推测膨胀素基因TaEXPB8、TaEXPB10与冬小麦根系的低温胁迫耐受能力具有重要的相关性,有助于进一步深入了解冬小麦根系的抗寒机制。
冬小麦; 膨胀素; 低温处理; 表达分析
小麦是我国重要的粮食作物,可分为春小麦和冬小麦,我国以冬小麦的种植为主[1]。低温是影响冬小麦生长的主要因素之一[2-3]。在寒冷的黑龙江省,只有强抗寒冬小麦品种东农冬麦1号可以越冬,其可耐-30 ℃低温,返青率大于85%[4-5]。因此,挖掘强抗寒冬小麦品种东农冬麦1号中的抗寒基因对于植物抗寒育种具有重要意义[6-8]。判断寒地冬小麦经历了寒冷的冬季后第2年能否存活的关键是分蘖节和根系是否遭到侵害及损害[9]。根对植物的地上部分起着固着与支撑的作用,也是植物与外界环境进行物质交换的场所,根还具有贮存合成有机物质的功能,对植株生长、发育具有重要作用[10]。因此,研究强抗寒冬小麦品种东农冬麦1号中的根系生长发育相关基因对于植物抗寒育种具有重要意义。
近年来,已经发现了多个与植物根系生长发育相关的基因,而膨胀素基因就是最典型的一类[11]。膨胀素是一类重要的引起细胞壁松弛的蛋白质,在植物的生长发育方面特别是根形态建成方面具有非常重要的作用,如细胞生长、根毛形成、根系生长、种子萌发、叶原基形成、叶子生长发育、果实成熟、器官脱离、花粉管生长等[12-13];另外,其在细胞壁修饰过程中及植物抗逆方面也具有不可忽视的作用[14-20]。膨胀素基因多属于诱导表达型基因,易受激素、温度、干旱、病原菌、机械损伤等各种因素诱导表达[21-24]。研究发现,膨胀素基因TaEXPB8、TaEXPB10在农大3338号根中表达量较高[25]。为此,克隆强抗寒冬小麦品种东农冬麦1号根中膨胀素基因TaEXPB8、TaEXPB10,并分析其在低温条件下的表达情况,这对研究膨胀素基因与植物抗寒性之间的关系具有重要意义,同时也可为抗寒育种提供抗寒基因资源。
1 材料和方法
1.1 试验材料
试验材料为寒地冬小麦品种东农冬麦1号,属强抗寒品种(Ⅰ级);对照试验材料济麦22号,为正常冬小麦品种(Ⅳ级),均由东北农业大学农学院小麦育种研究室提供。
1.2 试验方法
1.2.1 低温处理及取样 东农冬麦1号、济麦22号种子经过精选后,在培养室盆栽种植,按照常规种植管理。待其分蘖,分别将其移植到低温培养箱中培养48 h,培养箱温度分别为4 ℃、-10 ℃和-20 ℃,在处理0(对照)、6、12、24、36、48 h时取小麦根系,置于-80 ℃保存备用。
1.2.2 RNA的提取及反转录 小麦根总RNA的提取使用天泽基因植物RNA提取试剂盒(天泽基因工程有限公司),参照反转录试剂盒(海基生物科技有限公司)说明书反转录成cDNA。
1.2.3TaEXPB8、TaEXPB10基因的克隆 根据GenBank中TaEXPB8(登录号为AY543542.1)、TaEXPB10(登录号为AY543544.1)的序列,使用Primer Premier 5.0软件在CDS两侧设计特异性引物,各得到1对能有效扩增TaEXPB8、TaEXPB10编码区的引物(表1),引物由上海博仕生物医学服务中心合成。以第1链cDNA为模板进行扩增,PCR反应体系为20 μL,包含cDNA 4.52 μL、RNase-free water 2.48 μL、随机引物(100 pmol/L)1 μL、2×TS Reaction Mix 10 μL、Enzyme Mix 1 μL、gDNA Remover 1 μL;PCR反应条件为94 ℃ 5 min;94 ℃ 30 s、61 ℃ 30 s、72 ℃ 90 s,35个循环;72 ℃10 min。反应产物经1%琼脂糖凝胶电泳检测后回收,连接到pEASY-T3克隆载体中,转化大肠杆菌DH5α,提取质粒鉴定后由北京金唯智公司测序。测序结果用DNAMAN软件分析,并利用NCBI(http://ncbi.nlm.nih.gov/)的BLAST在线进行序列比对。
1.2.4 Real-time PCR(RT-PCR)扩增 根据GenBank中TaEXPB8(登录号为AY543542.1)、TaEXPB10(登录号为AY543544.1)的序列,通过Primer Premier 5.0 设计RT-PCR引物(表2),引物由上海博仕生物医学服务中心合成。所用内参基因为β-actin。采用SYBR Green荧光定量PCR试剂盒(北京全式金生物技术有限公司)进行RT-PCR扩增,扩增体系为20 μL,包含SYBR®qPCR Mix 10 μL、PCR 上下游引物(10 pmol/μL)各 0.5 μL、ROX Reference Dve(50×) 0.4 μL、cDNA 2.0 μL、ddH2O 6.6 μL;扩增程序为94 ℃ 30 s;94 ℃ 5 s、60 ℃ 30 s, 40个循环;95 ℃ 15 s、60 ℃ 30 s、95 ℃ 30 s。采用2-ΔΔCt法计算目的基因的相对表达量。
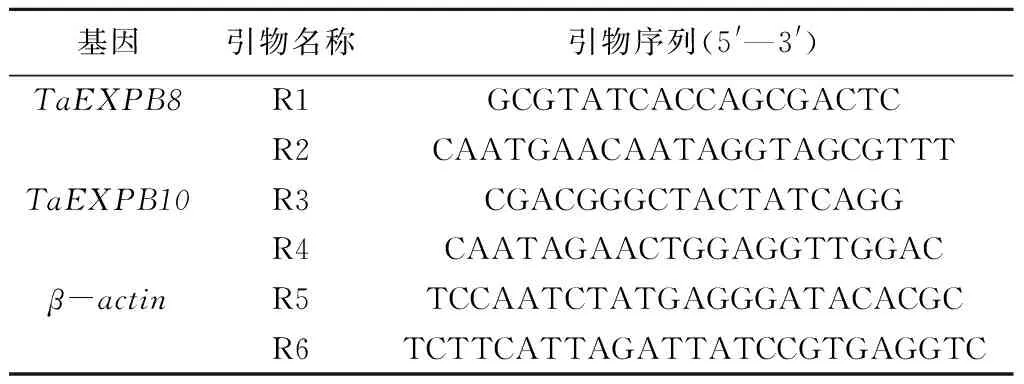
表2 RT-PCR引物及其序列
1.3 数据处理
数据方差分析釆用DPS 7.05,差异显著性多重比较釆用Duncan氏新复极差法,相关性分析釆用SPSP 19.0,图表制作采用Excel 2013。
2 结果与分析
2.1TaEXPB8和TaEXPB10基因的克隆及序列分析
将强抗寒冬小麦品种东农冬麦1号根总RNA反转录后获得cDNA,然后用设计好的TaEXPB8、TaEXPB10编码区引物进行PCR扩增,分别得到大约820、810 bp的条带(图1),与预期TaEXPB8、TaEXPB10的大小相符,初步推测为目的基因。将PCR产物与pEASY-T3载体连接,转化DH5α后,经蓝白斑筛选挑选阳性克隆进行测序。测序发现,寒地冬小麦东农冬麦1号的TaEXPB8、TaEXPB10基因CDS分别为819、813 bp,分别编码273、271个氨基酸。将其序列经DANMAN及BLAST进行序列比对发现,所测序列与GenBank中的TaEXPB8(登录号为AY543542.1)、TaEXPB10(登录号为AY543544.1)序列的同源性分别达到99.2%、99.6%,表明TaEXPB8和TaEXPB10克隆成功。
M.DNA分子量标准2000; 1.TaEXPB8; 2.TaEXPB10图1 TaEXPB8、TaEXPB10基因的PCR扩增结果
2.2TaEXPB8和TaEXPB10基因在低温条件下的表达分析
2.2.1 4 ℃ 由图2可知,在正常条件下,东农冬麦1号和济麦22号根中TaEXPB8、TaEXPB10基因表达量基本一致。在4 ℃条件下,东农冬麦1号根中TaEXPB8基因表达量总体随低温处理时间延长先升高后降低并趋于平稳,在6 h迅速升高,达到最大值,而后迅速下降,推测4 ℃条件下东农冬麦1号根中TaEXPB8基因对低温胁迫的响应是一个快速的过程;而济麦22号根中TaEXPB8基因表达量总体随胁迫时间延长无明显变化;TaEXPB8基因在东农冬麦1号根中的诱导表达程度高于济麦22号,尤其在低温胁迫6 h时。
济麦22号和东农冬麦1号根中TaEXPB10基因表达量总体均随着低温胁迫时间的延长先升高后降低,济麦22号在低温胁迫6 h达到最大值,东农冬麦1号在24 h达到最大值,但济麦22号峰值提高幅度远低于东农冬麦1号;TaEXPB10基因在东农冬麦1号根中的诱导表达程度高于济麦22号,尤其在低温胁迫24 h时,其表达量迅速升高,推测4 ℃条件下在东农冬麦1号根中TaEXPB10基因对低温胁迫的响应是一个缓慢的过程。
综合比较发现,4 ℃低温胁迫可以诱导TaEXPB8、TaEXPB10基因在东农冬麦1号根中表达,尤其是TaEXPB10基因,其受诱导程度高于TaEXPB8基因;4 ℃低温胁迫可以诱导TaEXPB10基因在济麦22号根中表达。推测在4 ℃低温胁迫条件下TaEXPB8、TaEXPB10基因可能促进冬小麦根系生长,尤其是TaEXPB10基因。

A.TaEXPB8; B.TaEXPB10; DN1.东农冬麦1号; JM22.济麦22号;**、*分别表示与对照差异极显著(P<0.01)、显著(P<0.05),下同图2 4 ℃条件下TaEXPB8和TaEXPB10基因在冬小麦根中的表达情况
2.2.2 -10 ℃ 由图3可知,在-10 ℃条件下,东农冬麦1号根中TaEXPB8基因表达量总体随着低温胁迫时间的延长先升高后降低,在24 h时迅速升高,达到峰值,而后迅速下降,推测-10 ℃条件下东农冬麦1号根中TaEXPB8基因对低温胁迫的响应是一个缓慢的过程;而济麦22号根中TaEXPB8基因表达量总体随胁迫时间延长无明显变化,仅48 h明显降低。东农冬麦1号根中TaEXPB10基因表达量总体随着低温胁迫时间的延长先升高后降低,在6 h时出现明显的升高,在12 h时达到最大值,而后有所下降,但表达量仍处于相对较高的水平,推测-10 ℃条件下东农冬麦1号根中TaEXPB10基因对低温胁迫的响应是一个快速且持久的过程;而济麦22号根中TaEXPB10基因表达量总体随胁迫时间延长呈降低趋势而后趋于平稳。综上,东农冬麦1号根中TaEXPB8、TaEXPB10基因受-10 ℃低温胁迫诱导表达,且TaEXPB10基因持续高表达时间比较久。
2.2.3 -20 ℃ 由图4可知,在-20 ℃条件下,东农冬麦1号根中TaEXPB8基因表达量总体随着低温胁迫时间的延长先升高后降低,在12 h时迅速升高,达到最大值,而后迅速下降,推测-20 ℃条件下东农冬麦1号根中TaEXPB8基因对低温胁迫的响应是一个缓慢的过程;而济麦22号根中TaEXPB8基因表达量总体随胁迫时间延长无明显变化。东农冬麦1号根中TaEXPB10基因表达量总体随着低温胁迫时间的延长先升高后降低,在6 h时出现明显的升高,而后有所下降,但表达量仍处于相对较高的水平,48 h时才明显下降,推测-20 ℃条件下东农冬麦1号根中TaEXPB10基因对低温胁迫的响应是一个快速且持久的过程;而济麦22号根中TaEXPB10基因表达量总体随胁迫时间延长无明显变化。综上,东农冬麦1号根中TaEXPB8、TaEXPB10基因受-20 ℃低温胁迫诱导表达,且TaEXPB10基因持续高表达时间比较久。
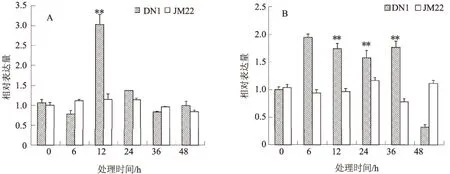
图4 -20 ℃条件下TaEXPB8和TaEXPB10基因在冬小麦根中的表达情况
3 结论与讨论
低温寒害是冬小麦生长过程中经常遇到的逆境危害,严重时会造成冬小麦死亡。因此,研究冬小麦抗寒基因的表达对高寒地区尤为重要[26-28]。本研究结果表明,低温胁迫会诱导TaEXPB8和TaEXPB10基因在东农冬麦1号的根系中表达,4 ℃低温胁迫条件下,TaEXPB8基因快速响应低温胁迫,但持续时间较短;TaEXPB10基因慢速响应低温胁迫,且持续时间较长。-10 ℃低温胁迫下,TaEXPB8基因缓慢响应低温胁迫,持续时间较短且不平稳;TaEXPB10基因快速响应低温胁迫,持续时间持久且相对稳定。-20 ℃低温胁迫下,TaEXPB8基因缓慢响应低温胁迫,持续时间短;TaEXPB10基因快速响应低温胁迫,持续时间持久且相对稳定。说明这2个膨胀素基因可能参与东农冬麦1号抵御低温胁迫的过程。TaEXPB8和TaEXPB10基因在不同的温度、时期,其表达量存在一些明显差异,说明虽是同一个亚家族的成员,但其功能也存在着一些明显的差异。其中,TaEXPB10基因与寒地冬小麦根系生长和发育的关系更紧密一些,且可能与东农冬麦1号具有抗寒性的特性有较大的关系。
已有研究表明,冬小麦根系的生长发育与膨胀素基因以及土壤中水分含量均有着密切的关系[29]。就整个生长期来看,单个基因及单种外界因素不能决定冬小麦的抗寒性,冬小麦的抗寒性应该是多个基因以及多种外界因素共同协作的结果[30-31]。在膨胀素基因家族中,不同的亚家族成员之间可能还存在着主效基因和从效基因的区别。从本研究结果来看,TaEXPB10基因的表达相对更重要一些。综合本研究结果推测,TaEXPB8和TaEXPB10基因的过量表达有可能促进寒地冬小麦根系生长发育,提高其抗寒性,但这还需要进一步的深入研究验证。
[1] 于晶,张林,苍晶,等.冬小麦抗寒性的研究进展[J].东北农业大学学报,2008,39(11):123-127.
[2] 刘祖祺,张石城.植物抗性生理学[M].北京:中国农业出版社,1994.
[3] 简令成.植物抗寒性的细胞及分子生物学研究进展[J].细胞生物学进展,1990(2):296-320.
[4] 王晓楠,谢冬微,付连双,等.不同抗寒性冬小麦叶鞘质膜的稳定性表现[J].麦类作物学报,2013,33(3):477-482.
[5] Hurry V,Strand A,Tobiaeson M,etal.Cold hardening of spring and winter wheat and rape results in differential effects on growth,carbon metabolism,and carbohydrate content[J].Plant Physiology,1995,109(2):697-706.
[6] 谢冬微.冬小麦低温下基因表达谱分析及海藻糖基因家族研究[D].哈尔滨:东北农业大学,2014.
[7] 刘炜,杨君林,许安民,等.不同根区温度对冬小麦生长发育及养分吸收的影响[J].干旱地区农业研究,2010,28(4):197-201.
[8] 宋吉仁.冬小麦越冬期生理指标的比较及蔗糖代谢酶基因的表达[D].哈尔滨:东北农业大学,2014.
[9] 王晓楠,付连双,李卓夫,等.低温驯化及封冻后不同抗寒性小麦品种的形态建成及生理基础分析[J].作物学报,2009,35(7):1313-1319.
[10] Li J M,Inanaga S,Li Z H,etal.Optimizing irrigation scheduling for winter wheat in the North China Plain[J].Agricultural Water Management,2005,76(1):8-23.
[11] 文文乙豪,黄俊丽,邹寒艳,等.膨胀素对植物根系生长发育的调控[J].生命科学,2013,25(9):922-931.
[12] Mcqueen-Mason S,Cosgrove D.Expansin mode of action on cell walls.Analysis of wall hydrolysis,stress relaxation,and binding[J].Plant Physiology,1995,107(1):87-100.
[13] Kwasniewski M,Szarejko I.Molecular cloning and characterization of β-expansin gene related to root hair formation in barley[J].Plant Physiology,2006,141(3):1149-1158.
[14] Cosgrove D.Relaxation in a high-stress environment:The molecular bases of extensible cell walls and cell enlargement[J].The Plant Cell,1997,9(7):1031-1041.
[15] Guo W,Zhao J,Li X,etal.A soybean β-expansin geneGmEXPB2 intrinsically involved in root system architecture responses to abiotic stresses[J].The Plant Journal,2011,66(3):541-552.
[16] Daras G,Rigas S,Tsitsekian D,etal.Potassium transporter TRH1 subunits assemble regulating root-hair elongation autonomously from the cell fate determination pathway[J].Plant Science,2015,231:131-137.
[17] Sun T,Zhang Y X,Chai T Y.Cloning,characterization,and expression of theBjEXPA1 gene and its promoter region fromBrassicajunceaL[J].Plant Growth Regulation,2011,64(1):39-51.
[18] Zenoni S,Fasoli M,Tornielli G B,etal.Overexpression ofPhEXPA1 increases cell size,modifies cell wall polymer composition and affects the timing of axillary meristem development inPetuniahybrida[J].New Phytologist,2011,191(3):662-677.
[19] Park Y B,Cosgrove D J.Changes in cell wall biomechanical properties in the xyloglucan-deficientxxt1/xxt2 mutant ofArabidopsis[J].Plant Physiology,2012,158(1):465-475.
[20] Son S H,Chang S C,Park C H,etal.Ethylene negatively regulatesEXPA5 expression inArabidopsisthaliana[J].Physiologia Plantarum,2012,144(3):254-262.
[21] Han Y Y,Zhou S,Chen Y H,etal.The involvement of expansins in responses to phosphorus availability in wheat,and its potentials in improving phosphorus efficiency of plants[J].Plant Physiology and Biochemistry,2014,78:53-62.
[22] Chen J,Dai L,Wang B,etal.Cloning of expansin genes in ramie (BoehmerianiveaL.) based on universal fast walking [J].Gene,2015,569(1):27-33.
[23] Bibikova T N,Jacob T,Dahse I,etal.Localized changes in apoplastic and cytoplasmic pH are associated with root hair development inArabidopsisthaliana[J].Development,1998,125(15):2925-2934.
[24] Cho H T,Cosgrove D J.Regulation of root hair initiation and expansin gene expression inArabidopsis[J].The Plant Cell,2002,14(12):3237-3253.
[25] 林展.小麦膨胀素基因的分离、克隆与功能鉴定[D].北京:中国农业大学,2005.
[26] 于晶.寒地冬小麦东农冬麦1号抗寒机理研究[D].哈尔滨:东北农业大学,2009.
[27] 苍晶,于晶,崔红,等.寒地冬小麦对低温逆境的生理适应[J].核农学报,2011,25(5):1017-1022.
[28] 冯玉磊,王晓楠,付连双,等.寒地冬小麦返青期抗氧化特性[J].麦类作物学报,2012,32(3):547-550.
[29] 李晶,车代弟,李馨园,等.种植方式对寒地冬小麦土壤水分利用及产量的影响[J].作物杂志,2012(3):86-88.
[30] Palapol Y,Kunyamee S,Thongkhum M,etal.Expression of expansin genes in the pulp and the dehiscence zone of ripening durian (Duriozibethinus) fruit[J].Journal of Plant Physiology,2015,182:33-39.
[31] 李卓夫,晁美丽,王晓楠,等.寒地冬小麦CBF转录因子的克隆与表达分析[J].东北农业大学学报,2013,44(4):30-35.
Cloning of TaEXPB8 and TaEXPB10 in Winter Wheat and Their Expression Analysis under Low Temperature Condition
WANG Mingjing1,WANG Xiaolei2,XU Yongqing1,LI Fenglan1,WANG Xu1,PENG Lina1,LI Fei1,DONG Jiamin1,ZHANG Junfeng1,HU Baozhong1,2*
(1.College of Life Science,Northeast Agricultural University,Harbin 150030,China;2.Harbin University,Harbin 150086,China)
The cold-resistant winter wheat variety Dongnongdongmai No.1 was used as experimental material.The expansin genesTaEXPB8 andTaEXPB10 were cloned from its roots,and their expression profiles were analyzed under low temperature conditions,so as to lay a foundation for study of the relationship between expansin genes expression and the plant cold resistance.The results showed that the expansin genesTaEXPB8 andTaEXPB10 were cloned from cold-resistant winter wheat variety Dongnongdongmai No.1,which coded 273 and 271 amino acids,respectively.In addition,they shared 99.2% and 99.6% homology separately with the published sequence in GenBank.Besides,4 ℃,-10 ℃ and -20 ℃ could induce the expression ofTaEXPB8 andTaEXPB10 in roots of Dongnongdongmai No.1.Especially forTaEXPB10,it had higher inducing level thanTaEXPB8.However,these two genes were not induced in Jimai No.22 (cold susceptible variety) on a whole,even were suppressed.Taken together,we found that under 4 ℃,-10 ℃ and -20 ℃,the expression level ofTaEXPB8 andTaEXPB10 in Dongnongdongmai No.1 (cold resistant variety) were all significantly higher than that in Jimai No.22(cold susceptible variety).Thus,it had been postulated that the expansin genesTaEXPB8 andTaEXPB10 had great relevance with low temperature stress tolerance ability of the roots of Dongnongdongmai No.1.It also provided further understanding on the cold resistance mechanism in winter wheat root system.
winter wheat; expansin; low temperature treatment; expression analysis
2016-07-20
国家基础科学人才培养基金(J1210069)
王明晶(1989-),女,黑龙江铁力人,在读硕士研究生,研究方向:植物学。E-mail:648336388@qq.com
*通讯作者:胡宝忠(1962-),男,吉林吉林人,教授,博士,主要从事植物学研究。E-mail:bzhu@neau.edu.cn
S512
A
1004-3268(2017)02-0006-06
