重庆中国三峡博物馆小环境空气微生物种属与数量的动态研究
2017-03-01范文奇张丽龙
唐 欢,范文奇,王 春,张丽龙
(1. 重庆中国三峡博物馆,重庆 400015; 2. 重庆市疾病预防控制中心,重庆 400042)
重庆中国三峡博物馆小环境空气微生物种属与数量的动态研究
唐 欢1,范文奇1,王 春1,张丽龙2
(1. 重庆中国三峡博物馆,重庆 400015; 2. 重庆市疾病预防控制中心,重庆 400042)
为了发现文物展陈环境中潜在的微生物病害,为馆藏文物的预防性保护提供科学依据,结合传统的纯培养技术和基于细菌16SrRNA基因的PCR-DGGE(PCR-Denaturing gradient gel electrophoresis)技术,综合分析博物馆小环境中可培养细菌的种属、数量及其时空动态变化特征。结果表明,博物馆小环境内可培养的空气微生物存在季节差异,在数量和多样性上均表现为夏季显著高于冬季,其主要优势菌群包括Acinetobactersp.、Staphylococcussp.、Pseudomonassp.和Advenellasp.。此外,夏季空气的特征菌属为Acinetobactersp.和Micrococcussp.,冬季典型菌种为Bacillussp.。
博物馆环境;预防性保护;PCR-DGGE;空气微生物
0 引 言
博物馆环境是指收藏与展示各类可移动文物的相对密闭空间的总体[1],主要包括以囊匣、展柜为代表的微环境,以展厅、库房为代表的小环境,整个博物馆建筑空间为代表的大环境以及博物馆外部环境[2]。除了温湿度、光照、污染气体等常见环境因素之外,微生物、昆虫等生物因素亦是博物馆环境研究的重要内容之一。随着文物预防性保护理念的日益深入,监测文物展陈环境中的空气微生物组成、控制博物馆小微环境中的微生物污染已成为近年来文物预防性保护研究的一个新方向,比利时、法国、波兰以及国内部分博物馆均开展了博物馆内空气微生物的研究[3-6]。
以往对博物馆展厅内空气微生物开展的研究主要聚焦于特定时间点的微生物数量和种类,但空气微生物是动态变化的,会随着时间、季节和参观人流量等因素的变化而发生改变,因此,对其进行连续动态的监测才能更好地发现其数量和种属的演替规律,为潜在的文物微生物病害提供科学的预判依据。
变性梯度凝胶电泳(Denaturing gradient gel electrophoresis,DGGE)技术自1993年被Muyzer引入微生物生态学研究以来,现已被广泛地应用于环境微生物群落的多样性和动态性分析。该技术不仅可以研究微生物结构的时间空间变化特征,还可以通过对凝胶上的特定条带进行回收并测序,进而鉴定条带对应的菌落种属[7]。本研究通过传统的菌落培养检测博物馆小环境中的空气微生物数量,结合PCR-DGGE技术研究菌落的结构和组成,对博物馆小环境中冬季和夏季的空气微生物数量与种类进行了时空动态分析。
1 材料与方法
1.1 主要设备及试剂
空气浮游菌采样器型号为ZR2050型(青岛众瑞);手持式温度/相对湿度采集器型号为U12-011型(HOBO);细菌培养用生化培养箱为SPX-250B型(上海跃进);PCR仪为C1000型(Bio-Rad);核酸定量仪为Nano Drop 2000型(Thermo);凝胶成像系统为Gel Doc XR+(Bio-Rad);变性梯度凝胶电泳仪为DCodeTMUniversal Mutation Detection System(Bio-Rad)。细菌总数检测用营养琼脂平板购自重庆庞通医疗器械有限公司,细菌总菌DNA提取试剂盒为QIAGEN(51604, QIAamp Fast DNA Stool Mini Kit);EXTaq DNA聚合酶购自TaKaRa。
1.2 空气微生物采样、培养及计数
采样展厅为位于博物馆一楼的壮丽三峡展厅,该展厅是博物馆参观人流量最大的展厅。本研究在该展厅设置了4个采样点,分别编号为ZL1、ZL2、ZL3、ZL4,采样点在展厅中的位置如图1所示。整个展厅做了大量隔断,布局较为复杂。ZL1采样点靠近展厅入口处,该处为开放式陈列,空间宽敞,存放动物标本等有机质藏品;ZL2采样点位于展厅最内侧,展示刺绣等有机质文物,同时是该展厅全年平均湿度最大的检测位点;ZL3号采样点位于展厅内侧,展示有纺织品、皮革制品等文物; ZL4号采样点位于展厅出口附近,展示竹木制品、刺绣等民族文物。可见,四个采样点处展览的文物均以有机质文物为主,对于文物的微生物病害较为敏感。
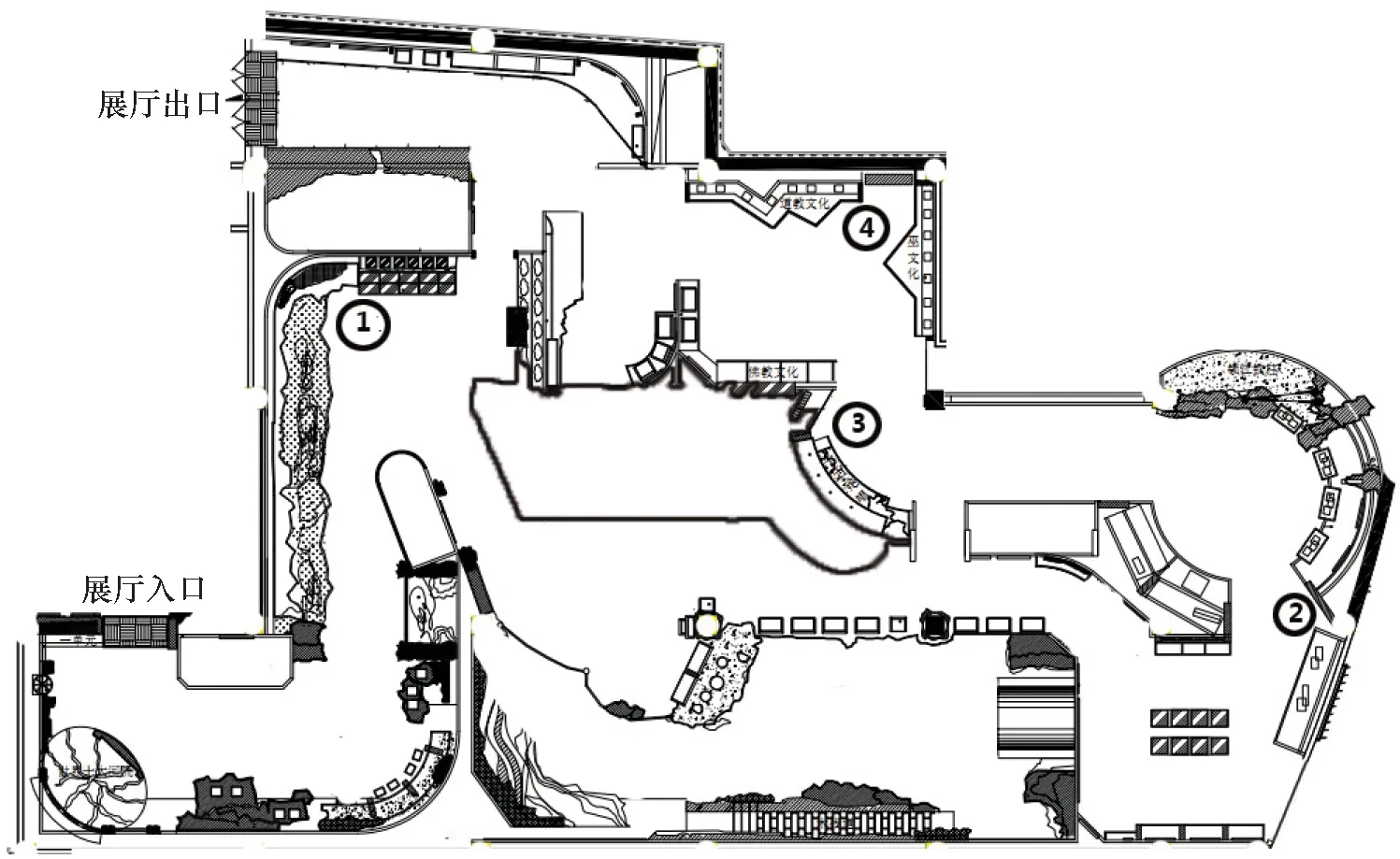
图1 采样点位置布局图
本研究于夏季(2013年6、7、8月)和冬季(2013年11、12月及2014年1月)对该展厅进行了空气微生物样品的采集。具体采样时间分别为2013年6月24日,7月23日,8月22日,11月29日,12月25日及2014年1月15日。
采样方法参照我国《室内空气质量标准》(GB/T18883—2002)的相关要求进行。空气浮游菌采样器置于距地面1.2m高处进行空气样本采集,采样流量参数设置为10 L/min,采样时长设置为5min。采集后的培养皿放入生化培养箱中,37 ℃条件下倒置培养48 h后计数。计数完成后,营养琼脂上的全部菌落经无菌去离子水充分冲洗后冻存,进行空气微生物细菌总DNA提取。
1.3 空气微生物总菌DNA的提取
细菌总菌DNA的提取按照QIAGEN试剂盒提供的protocol进行。 提取后的DNA经Nano Drop 2000测定样品的浓度及纯度,经琼脂糖凝胶电泳(1%)检测样品的完整性。
1.4 PCR扩增[8]
细菌16SrRNA基因 V3区的扩增引物由Takara公司合成, 序列分别为V3-357f-GC (5’-CGCCCGGGGCGCGCCCCGGGCGGGGCGGGGGCACGGGGGGTACGGGAGGCAGCAG-3′)和 V3-518r (5′-ATTACC GCGGCTGCTGG-3′), PCR产物长度大小预计为217bp。PCR反应体系为25μL,其中模板DNA量为20ng,10×EXTaq buffer 2.5μL,dNTP用量为2.5μL,ExTaq酶0.25μL,引物357f-GC、518r各0.5μL,添加无菌双蒸水至终体积25μL。PCR循环条件为94℃预变性5min;94℃ 30s,56℃ 30s,72℃ 1min,30个循环;最后72℃延伸10min。
按照Thompson和Xiong等的方法[9,10]进行Reconditioning PCR,以此去除PCR引物二聚体对DGGE进行的影响。Reconditioning PCR的模板为第一次PCR的产物(用量为5μL),终体系为25μL,循环次数减少至5个循环,其他条件均与第一次PCR的条件相同。
1.5 DGGE电泳及特殊条带鉴定
按照DCode System的说明书,参照Muyzer[11]和Walter[12]等报道的DGGE条件和方法,对16SrRNA基因V3区序列扩增产物进行DGGE电泳。DGGE使用8%的聚丙烯酰胺,变性梯度为35%~65%,电泳缓冲液为1×TAE(pH=8.4)。220V条件下预电泳10min后,130V的固定电压电泳4.5h。电泳结束后的聚丙烯酰胺凝胶进行EB染色,由凝胶成像系统捕捉图像后,用Quantity One软件(BioRad,Hercules,California,USA)进行条带数量、位置、亮度等信息的统计分析,并通过软件获取的数据矩阵进行UPGMA相似性聚类分析。
用无菌刀片将凝胶上的特定条带切割下来,使用1×EXTaq buffer 漂洗2次,将其捣碎,加入40μL×EXTaq buffer,4℃条件下浸泡过夜。以浸泡液作为模板,重新进行PCR扩增,引物序列为357f(5′-TACGGGAGGCAGCAG-3′)和518r(5′-ATTACCGCGGCTGCTGG-3′),PCR条件同1.4[13]。PCR产物经二次DGGE跑胶后, 确认与原切割条带位置一致的,经T-A克隆后进行测序[14,15],返回序列在Genbank进行BLAST比对,网址为www.ncbi.nlm.nih.com。
1.6 数据分析
1.6.1 多样性分析 通过DGGE图谱进行的微生物群落多样性分析包括:丰富度(richness,S),即 图谱上每条泳道内的条带数;微生物区系的Shannon-Wiener 指数(H′),计算方法为H′=-∑Pi lnPi,其中, Pi为第i条带的吸光度与该泳道所有条带吸光度总和的比值[16,17]。

图2 展厅冬夏两季的温湿度和菌落总数检测结果
表1是对于该展厅内四个不同的采样点进行的数据分析。结果显示,虽然博物馆大环境受中央空调的调控,但四个采样点夏季的温度仍然极显著高于冬季(p<0.01),湿度在不同的采样位置中未见明显变化(p>0.05)。在检测数据中,最高温度25.5℃,最低温度14.1℃,最大湿度74%RH,均出现于ZL1采样点;湿度最低为50%RH,出现于ZL4采样点。1号及4号采样点分别接近展厅的入口与出口,温湿度变化可能更易受博物馆大环境和参观人流的影响,因此波动较大。此外,所有采样点的湿度几乎均在60%RH以上,这与重庆市本身年均湿度超过70%有关。
空气微生物总数最高检出点为ZL3号采样点,其次为ZL2采样点。这两个采样点均位于展厅中部,展厅蜿蜒的设计使其空气流动性较差,因此容易滋生微生物。此外,这两个采样点的菌落总数也表现出了季节性差异(p<0.01),即在这两个地点,夏季空气中的微生物总量极显著地高于冬季。
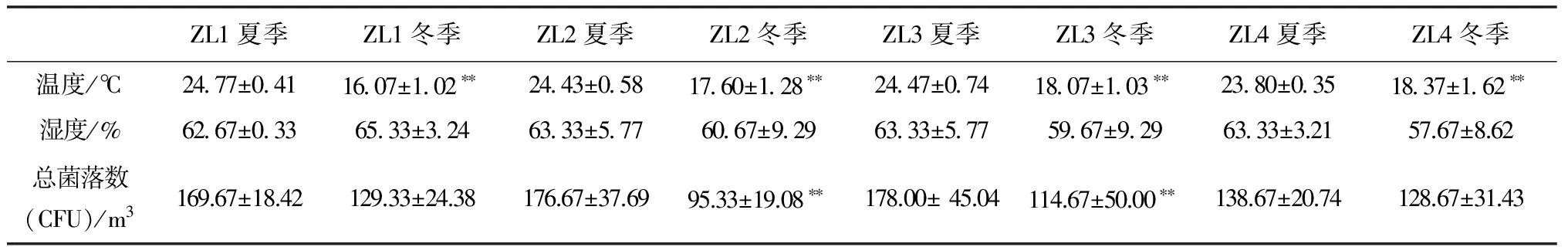
表1 4个采样点冬夏两季的温湿度和菌落总数检测结果
注:**,与夏季数据相比,p<0.01
2 冬夏两季博物馆小环境空气微生物多样性的比较
首先,从图3 ①的微生物纯培养结果可直观看出,夏季(6~8月)2号采样点的采样平板上菌落密布,数量明显多于冬季三个月(11~1月)的采样平板。如果对如此之多的菌落分别单独进行种属鉴定,不仅工作量庞大,而且可能存在大量相同结果。因此,使用DGGE的方法对细菌种类进行分析就显得尤为方便高效了。
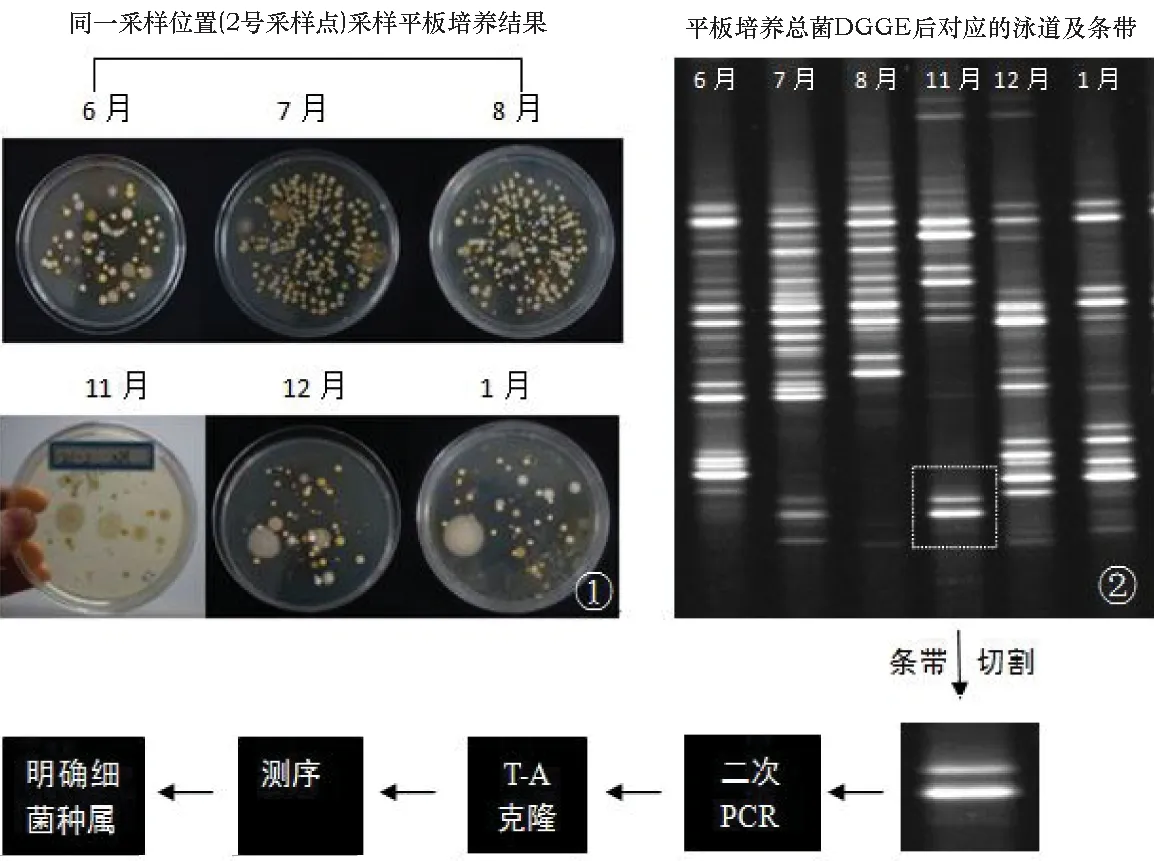
图3 利用PCR-DGGE对采集的空气微生物样品进行种属鉴定的过程
利用PCR-DGGE技术对采集的空气微生物样品种属进行鉴定的过程如图3所示:将不同平板上的所有细菌菌落混合冲洗下来作为独立的总DNA进行提取,接下来对这个总DNA样本进行PCR扩增并进一步实施变性梯度电泳后,一个平板上所有细菌的信息就转化到图3②中每一个单独的泳道内。根据DGGE的原理,泳道内的每一个条带理论上分别对应了一种细菌,而不同泳道间同一水平位置的条带代表相同种类的细菌[11,18,19]。条带越粗越亮,则代表该样品中,这个条带对应的某种细菌数量越多。为了了解不同条带究竟是哪一种细菌,需要对目的条带进行切胶回收以收集其DNA,通过二次PCR后,进一步测序比对而明确细菌种属[20-22]。
首先, 从本实验获得的DGGE图谱(图4)上可以明显看到,在四个采样点夏季与冬季的24个空气微生物样品中,大部分样品泳道中具有共同的条带C、D、E、H、J和K。经过对条带回收并测序后发现,对应的微生物分别为Acinetobacterlwoffii(相似性99%)、Staphylococcushominis(相似性99%)、Advenellasp.(相似性100%)、Staphylococcussp.(相似性100%)、Pseudomonassp.(相似性100%)和Staphylococcuswarneri(相似性100%)。由此可见,在壮丽三峡展厅这个博物馆小环境中,全年空气微生物的主要群落为不动杆菌属、葡萄球菌属、铜绿假单胞菌和Advenella属,其中又以葡萄球菌属最为优势。虽然C和D条带分别对应的Acinetobacterlwoffii和Staphylococcushominis几乎贯穿了24个泳道,既24个样品中都有检出,但从条带的亮度可见,代表夏季月份的泳道1~3中,这两个条带的亮度基本都比代表冬季的4~6号泳道亮度高,从侧面说明这两种菌的数量在夏季比在冬季数量多。
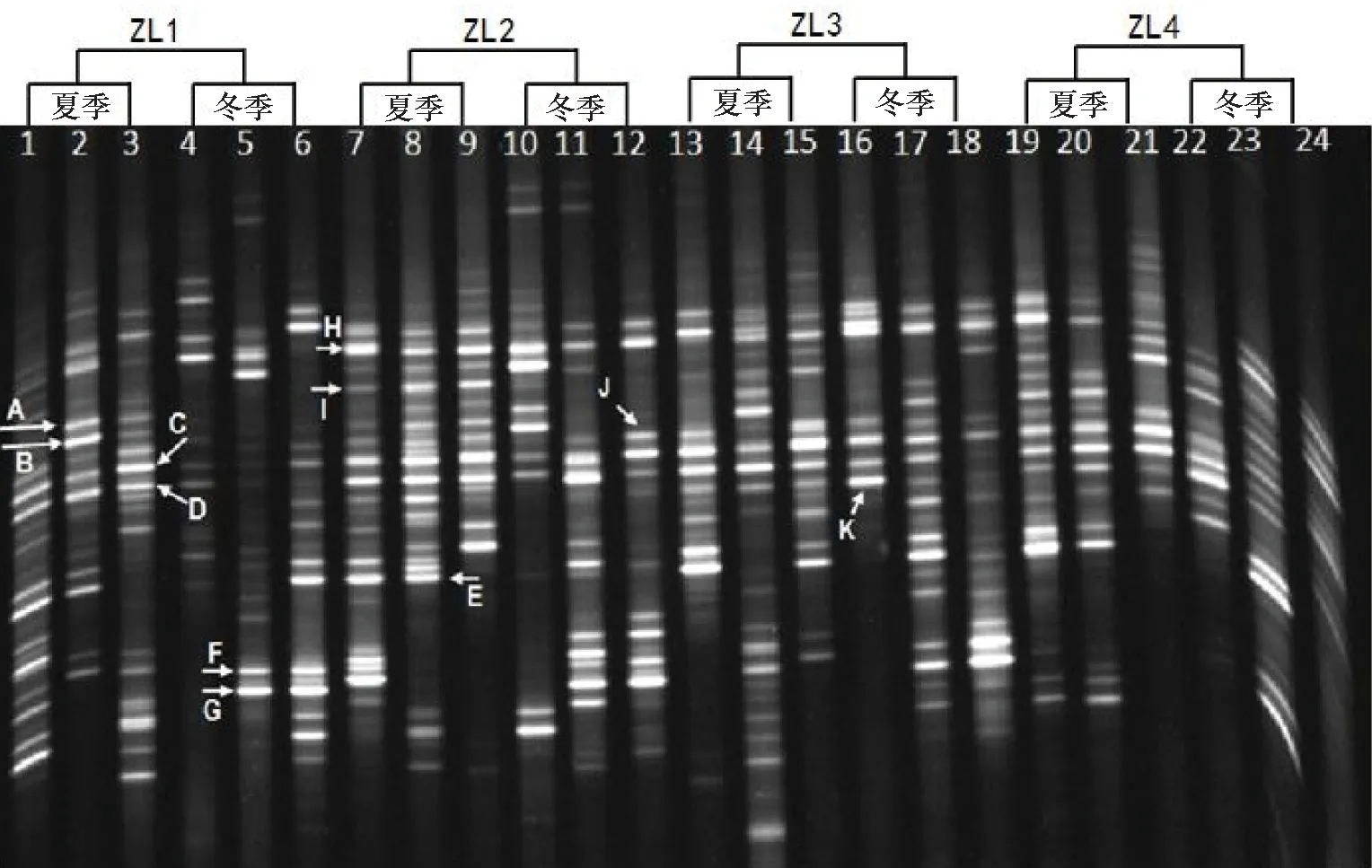
图4 四个采样点冬夏季空气微生物的PCR-DGGE谱图
与上述条带不同的是,A、B和I条带较多的出现在夏季空气微生物的样品中,而在冬季样品中很少出现。经过比对发现,它们分别为Acinetobacterbaumannii.(相似性99%)、Acinetobacterbaumannii. (相似性100%)和Micrococcussp. (相似性100%);条带F和G则在ZL1、2、3号采样点的冬季样品中出现,夏季样品中条带极其微弱或未检出,它们经测序发现均为Bacillusthuringiensis.(相似性分别为99%和100%)。这些结果表明:在该展厅的空气微生物组成中,除了拥有共同的优势菌群之外,冬夏两个季节各自具有不同的典型菌种:夏季的特征菌属为不动杆菌属和微球菌属,而冬季芽孢杆菌属更为活跃。特征条带的测序结果见表2。
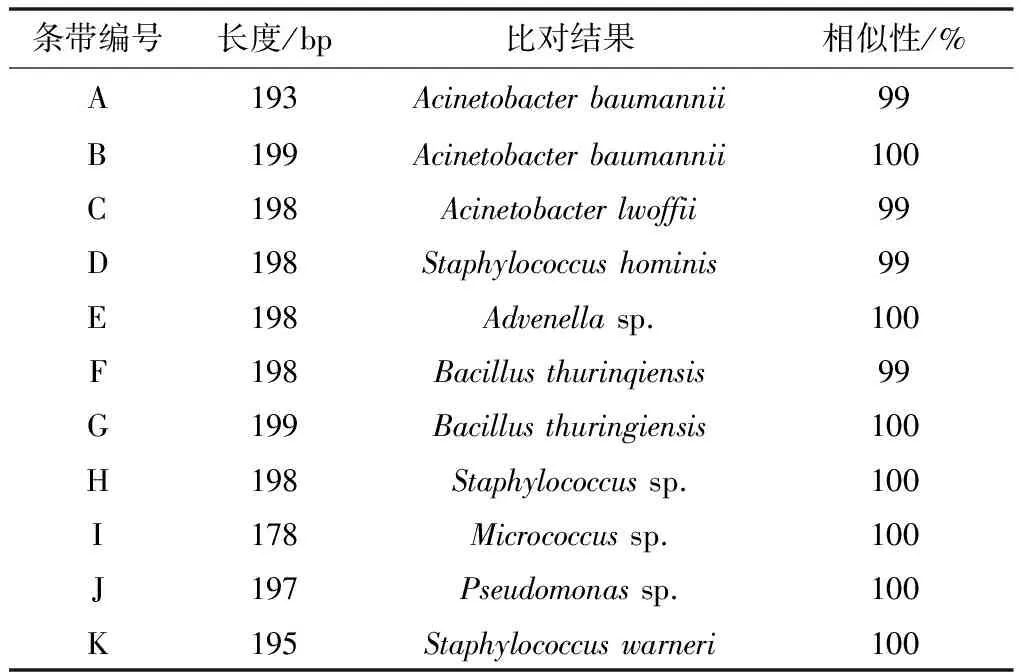
表2 DGGE条带测序比对结果
此外,DGGE电泳图中还可以直观看出夏季样品条带的数量多于冬季样品,说明夏季空气微生物的种类要多于冬季。对24个泳道的条带数量和亮度进行分析后发现,夏季样品的微生物种类显著高于冬季样品(p<0.05)(图5),且夏季空气微生物的多样性指数极显著地高于冬季(p<0.01)(图6)。详细对4个采样点进行分析可以看出,丰富度和多样性指数最高的采样点为ZL2号位置,且与3号采样点差异不显著,该结果与微生物数量统计结果类似。同时,1、2、3号采样点的微生物丰富度和多样性指数在冬夏两季均高于4号采样点(p<0.01)(表3)。
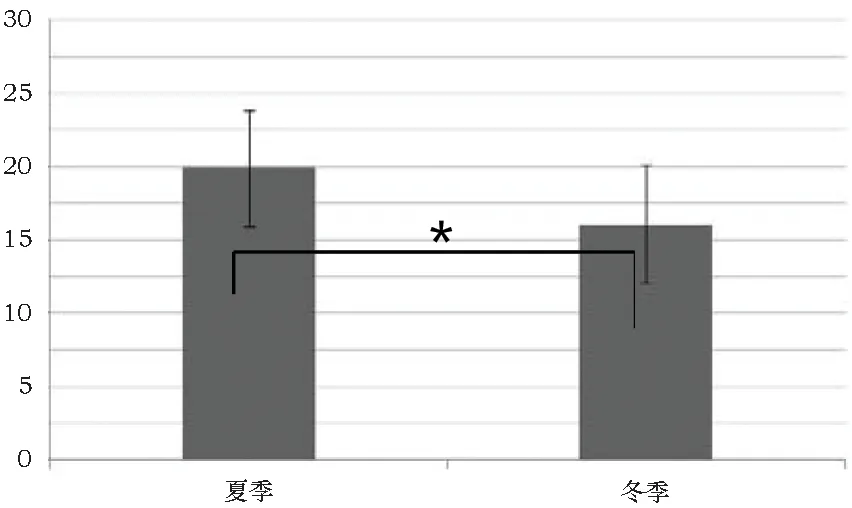
图5 冬夏两季空气微生物丰富度的比较
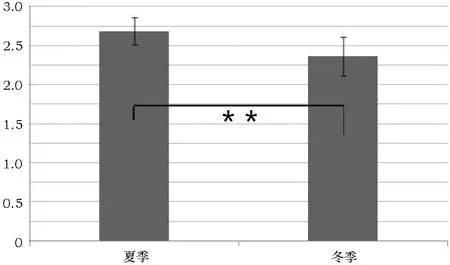
图6 冬夏两季空气微生物多样性指数的比较

ZL1夏季ZL1冬季ZL2夏季ZL2冬季ZL3夏季ZL3冬季ZL4夏季ZL4冬季丰富度21.00±2.6518.67±3.5121.33±4.1617.33±2.5321.67±3.7917.33±6.0315.67±3.06∗∗13.00±2.65∗∗多样性指数2.66±0.112.43±0.172.80±0.142.51±0.072.74±0.182.53±0.462.53±0.21∗∗2.22±0.08∗∗
注:**,与夏季相比,p<0.01
从UPGMA聚类分析的结果可以看出(图7),每个采样点的数据基本能够较好地聚为一簇,表明各个采样点在可培养空气微生物的组成上分别具有较大的相似性。在3号采样点,6、7、8三个夏季月份空气微生物在组成上的相似程度为61%,说明整个夏季该采样位置的空气微生物种类较为稳定。4号采样点在11、12及1月三个月中,空气微生物的种类相似性达到70%,说明整个冬季该采样点的空气中,微生物种类未发生明显波动。

图7 DGGE图谱UPGMA聚类分析结果
3 讨 论
1) PCR-DGGE分析技术的优点。从技术上看,PCR-DGGE本身是建立在不依赖于培养的条件下,对微生物群落多样性和群落变化动态开展检测分析的技术,广泛应用于医学、环境、农业、林业及食品研究等领域[23-25]。在文博行业,2015年,Lech T等应用PCR-DGGE技术研究了波兰国家档案馆及国内最大的博物馆Krakow博物馆库房及展厅内空气微生物菌群的组成[4]。除了对多样性进行分析外,PCR-DGGE技术还可以直接鉴定微生物群落组成,研究者可对DGGE图谱上感兴趣的特定条带切割回收并进行菌种鉴定。因此,在微生物的种属分析方面DGGE具有直观、快速的独特优势。利用其一个条带对应一种微生物的特点,但国蓉等利用可培养的标准菌株制备成marker,对微生态药品中的益生菌进行了PCR-DGGE的种属分类[26], Shanqimuge等结合纯培养技术和PCR-DGGE技术对大曲的菌种进行直接快速的鉴定[27]。以本研究为例,若夏季样品中培养菌落数大于200CFU,如果分别挑取单个克隆进行菌落PCR再进行测序比对,工作量非常巨大,效率明显较低。本研究借鉴不依赖培养的微生物的研究方法,以一个混合样作为一个整体,进行混合菌落的总DNA提取,再通过DGGE的条带分割将混合信息直观呈现于胶上,选取具有特征或研究意义的条带进行切割、测序、比对,大大提高了工作效率,且更容易发现优势菌群,如该小环境中冬夏两季的样品泳道中均出现了C、D、E、H、J和K条带,则直观说明这些条带所对应的微生物菌落为贯穿整个小环境的冬夏两季的优势菌群。
2) 博物馆环境内空气微生物的主要种类。在组成上,对于博物馆小环境中空气微生物种类的研究中,武望婷等曾报道首都博物馆内空气微生物细菌组成以微球菌为主,还包括杆菌、芽孢杆菌、考克氏菌和假单胞菌[28];Gaüzère等对于卢浮宫内的空气微生物进行了连续6个月的监测,经过高通量测序显示其空气微生物的优势菌属分别为副球菌属、不动杆菌属、铜绿假单胞菌、栖水菌属、鞘氨醇单胞菌属、链球菌属和葡萄球菌属等[5]。本研究通过对DGGE条带的割胶测序发现,展厅内样品可培养的空气微生物主要优势菌群为不动杆菌属、铜绿假单胞菌、葡萄球菌属及Advenellasp.,与Gaüzère等的研究基本相吻合。高通量测序虽然获得了更丰富的多样性数据,但对于微生物组成的季节性演替和组成特征却不如DGGE图谱直观,如本研究的图谱分析可见夏季空气的特征菌属为Acinetobactersp.和Micrococcussp.,冬季典型菌种为Bacillussp.。另外,关于类似博物馆这一密闭空间中空气真菌的研究,马燕天等对于莫高窟洞窟空气微生物的研究发现,在9月份窟外真菌数量检出在24~32CFU/m3,在密闭的洞窟内,真菌数量比窟外更少[29];本课题组也曾对临时展厅中空气微生物真菌进行计数,可培养的真菌数量较少,5~8月真菌平均数量低于15CFU/m3[30]。在本实验中部分采样位点甚至未检出(数据未给出),因此在本研究中并未对真菌进行数量统计和多样性分析。
3) 影响空气微生物稳定性的因素。在空气微生物的稳定性上,Tringe等的研究结果给予的提示是,与户外环境不同,影响密闭的室内环境中空气微生物组成的主要原因可能是由于小环境空气中的选择性抗力,氧化损伤及干燥过程、铁限制等均会影响微生物群落的构成,也可能与人流活动有关[31]。而本实验DGGE图谱UPGMA聚类分析结果显示,ZL3采样点冬季空气微生物的种类相似程度最高达到73%,ZL1和ZL2号采样点的夏季空气微生物组成相似性最高甚至达到83%。类似的研究结果还见于马燕天等对莫高窟窟内环境微生物的调查[29]。其结果显示,游客人数只对窟外环境有影响,而对封闭的洞窟内的微生物无影响。可见,在参观人员不断发生改变的情况下,微生物组成并未发生较大变化。因此,影响博物馆内空气微生物多样性的主要原因还是小环境本身,季节的变化和参观者的扰动,对于封闭环境的稳态影响不大。
综合展厅这一博物馆小环境的空气微生物数量及种类分析结果,湿度的稳定对于微生物组成可能具有一定影响,而温度则可能影响其数量,因此对于小环境内的温湿度控制仍然是控制室内微生物的重要措施[32]。此外,博物馆中央空调系统的湿润器、滤网等组件上往往是微生物积存和繁殖的场所,可通过管网向通风下游散播,因此也不能忽视博物馆小环境中的空调送风系统对空气微生物的影响,需定期进行空调系统的维护。
4 结 论
1) 在博物馆小环境微生物数量上,在全年湿度较为稳定,而夏季温度极其显著高于冬季的条件下,该展厅内空气微生物菌落总数在夏季显著高于冬季。
2) 在微生物组成上,该展厅冬夏两个季节的可培养空气微生物组成稳定性高于39%,且夏季样品中的微生物种类显著高于冬季样品。不动杆菌属、葡萄球菌属、铜绿假单胞菌和Advenella属的微生物在冬夏两季都是整个展厅空气内的优势菌群,在展厅的4个采样点均可采集到。此外,夏季空气的特征菌属为不动杆菌属和微球菌属,冬季典型菌种为芽孢杆菌属。
3) 保持展厅内环境的稳态有助于保持微生物组成的稳定,恒温恒湿、加强展厅空调送风系统的微生物控制工作对控制博物馆小环境的微生物污染具有重要作用。
[1] 陈元生,解玉林. 博物馆文物保持环境质量标准研究[J]. 文物保护与考古科学,2002,14(S1):152-191. CHEN Yuan-sheng,XIE Yu-lin. Studies on museum environmental standards[J]. Sci Conserv Archaeol, 2002,14(S1):152-191.
[2] 吴来明,徐方圆,黄 河. 博物馆环境监控及相关物联网技术应用需求分析[J]. 文物保护与考古科学,2011,23(3):96-102. WU Lai-ming, XU Fang-yuan, HUANG He. The demand analysis of museum environment monitoring and the application of Internet of things[J]. Sci Conserv Archaeol, 2011,23(3):96-102.
[3] Gysels K, Delalieux F, Deutsch F,etal.Indoor environment and conservation in the royal museum of fine arts, antwerp, belgium[J]. J Cultl Herit, 2004,5(2):221-230.
[4] Lech T, Ziembinska-Buczynska A. Evaluation of a modified sampling method for molecular analysis of air mciroflora[J]. Genet Mol Res, 2015,14(2):3200-3208.
[5] Gaüzère C, Moletta-Denat M, Blanquart H,etal. Stability of airborne microbes in the Louvre Museum over time[J]. Indoor air, 2014,24(1):29-40.
[6] Chen Y P, Cui Y, Dong J G. Variation of airborne bacteria and fungi at Emperor Qin’s Terra-Cotta Museum, Xi’an, China, during the “Oct. 1” gold week period of 2006[J]. Environ Sci Pollut Res Int, 2010,17(2):478-485.
[7] Su C, Lei L, Duan Y,etal. Culture-independent methods for studying environmental microorganisms: methods, application, and perspective[J]. Appl Microbiol Biotechnol, 2012, 93(3):993-1003.
[8] Liu J, Wu D, Ahmed A.etal. Comparison of the gut microbe profiles and numbers between patients with liver cirrhosis and healthy individuals[J]. Curr Microbiol, 2012,65(1):7-13.
[9] Thompson J R, Marcelino L A, Polz M F. Heteroduplexes in mixed-template amplifications: formation, consequence and elimination by’reconditioning PCR’[J]. Nucl Acids Res, 2002,30(9):2083-2088.
[10] Xiong X, Hu Y, Yan N,etal. PCR-DGGE analysis of the microbial communities in three different Chinese “Baiyunbian” liquor fermentation starters[J]. J Microbiol Biotechnol, 2014,24(8):1088-1095.
[11] Muyzer G, de Waal E C, Uitterlinden A G. Profiling of complex microbial populations by denaturing gradient gel electrophoresis analysis of polymerase chain reaction-amplified genes coding for 16S rRNA[J]. Appl Environ Microbiol, 1993, 59(3):695-700.
[12] Walter J, Tannock GW, Tilsala-Timisjarvi A,etal. Detection and identification of gastrointestinal lactobacillus species by using denaturing gradient gel electrophoresis and species-specific PCR primers[J]. Appl Environ Microbiol, 2000, 66(1):297-303.
[13] Wu D, Hou C, Li Y,etal. Analysis of the bacterial community in chronic obstructive pulmonary disease sputum samples by denaturing gradient gel electrophoresis and real-time PCR[J]. BMC Pulm Med, 2014, 14:179.
[14] Zhengyu Du, Tomas Hudcovic, Jakub Mrazek,etal. Development of gut inflammation in mice colonized with mucosa-associated bacteria from patients with ulcerative colitis[J]. Gut Pathog, 2015, 7: 32.
[15] Heilig H G, Zoetendal E G, Vaughan E E,etal. Molecular diversity ofLactobacillusspp. and other lactic acid bacteria in the human intestine as determined by specific amplification of 16S ribosomal DNA[J]. Appl Environ Microbiol, 2002,68(1):114-123.
[16] Scanlan P D, Shanahan F, O’Mahony C,etal.Culture-independent analyses of temporal variation of the dominant fecal microbiota and targeted bacterial subgroups in Crohn’s disease[J]. J Clin Microbiol, 2006, 44(11):3980-3988.
[17] Fromin N, Hamelin J, Tarnawski S,etal. Statistical analysis of denaturing gel electrophoresis (DGE) fingerprinting patterns[J]. Environ Microbiol, 2002, 4(11):634-643.
[18] Matsushita Y, Yamamura K, Morimoto S.etal. Analysis of variations in band positions for normalization in across-gel denaturing gradient gel electrophoresis[J]. J Microbiol Methods, 2015,112:11-20.
[19] 陈章宝,向少能,江震献,等. PCR-DGGE研究微生物种群中多条带产生原因分析[J]. 微生物学通报, 2010, 37(1):147-154. CHEN ZHANG-Bao, XIANG SHAO-Neng, JIANG ZHEN-xian,etal. Analysis on cuses of multi-bands in researching on microbe population by PCR-DGGE[J]. Microbiol China, 2010, 37(1):147-154.
[20] Kuar D, Avgu tin G. Optimization of the DGGE band identification method[J].Folia Microbiol (Praha), 2012,57(4):301-306.
[21] Xu X L, Cheng T Y, Yang H,etal. Identification of intestinal bacterial flora in Rhipicephalus microplus ticks by conventional methods and PCR-DGGE analysis[J]. Exp Appl Acarol, 2015, 66(2):257-68.
[22] Shimano S, Sambe M, Kasahara Y. Application of nested PCR-DGGE (denaturing gradient gel electrophoresis) for the analysis of ciliate communities in soils[J]. Microbes Environ, 2012, 27(2):136-41.
[23] Ercolini D. PCR-DGGE fingerprinting: novel strategies for detection of microbes in food[J]. J Microbiol Methods, 2004, 56(3):297-314.
[24] 刘慧杰,杨彩云,田 蕴,等. 基于PCR-DGGE技术的红树林区微生物群落结构[J].微生物学报,2010,50(7):923-930. LIU Hui-Jie, YANG Cai-Yun, TIAN Yun,etal. Analysis of microbial community structure in mangrove sediments by PCR-DGGE technique[J]. Acta Microbiol Sin, 2010,50(7):923-930.
[25] 刘有胜,杨朝晖,曾光明,等. PCR-DGGE技术对城市餐厨垃圾堆肥中细菌种群结构分析[J]. 环境科学学报, 2007, 27(7):1151-1156. LIU You-Sheng, YANG Chao-Hui, ZENG Guang-Ming.etal. Application of PCR-DGGE to analyzing bacterial communities in culinary waste corn post[J]. Acta. Sci Circumstant, 2007, 27(7):1151-1156.
[26] 但国蓉,袁 静,唐 欢,等. 5种医用益生菌产品的微生物数量和种属分析[J]. 中国药房, 2006, 17(7):530-532. DAN Guo-Rong, YUAN Jing, TANG Huan,etal. Numbers and Species of Microorganisms of 5 Probiotic Products for Medicinal Purposes[J]. China Pharmacy, 2006, 17(7):530-532.
[27] Shanqimuge, Liang H, Zhang C,etal. A DGGE marker-mediated fast monitoring of bacterial diversity and comprehensive identification of high-temperature Daqu starter[J]. J Food Sci, 2015,80(7):1519-1525.
[28] 武望婷,何海平,闫 丽,等.首都博物馆空气中细菌的分离鉴定及在文物保护中的意义[J].文物保护与考古科学,2012,24(1):76-82. WU Wang-ting,HE Hai-ping,YAN Li,etal.The isolation and identification of bacteria in the air of Capital Museum and their significance for protection of cultural relics[J].Sci Conserv Archaeol,2012,24(1):76-82.
[29] 马燕天,汪万福,马 旭,等. 敦煌莫高窟洞窟内外空气中微生物的对比研究[J]. 文物保护与考古科学,2011, 23(1):13-18. MA Yan-Tian, WANG Wan-Fu, MA Xu,etal. The comparative study of airborne microorganisms between close cave and outside cave environments in Mogao Grottoes, Dunhuang[J]. Sci Conserv Archaeol, 2011, 23(1):13-18.
[30] 唐 欢,范文奇,周理坤,等. 重庆中国三峡博物馆临时展厅内空气微生物调查检测[J]. 中国微生态学杂志, 2014,26(4):420-424. TANG Huan, FAN Wen-Qi, ZHOU Li-Kun,etal. Investigation of airborne microbial content in the temporary exhibition halls of China Three Gorges Museum[J]. Chin J Microecol, 2014,26(4):420-424.
[31] Tringe S G, Zhang T, Liu X,etal. The airborne metagenome in an indoor urban environment[J]. Plos One, 2008,3(4): e1862-e1862.
[32] 王丽娜,修光利,詹天真,等. 送风方式对文物保存展柜微环境气流分布的影响[J]. 文物保护与考古科学,2013,25(4):8-13. WANG Li-Na,XIU Guang-Li, ZHAN Tian-zhen,etal. Impact of inlet airflow pattern on the showcase microenvironment in museums[J]. Sci Conserv Archaeol,2013,25(4):8-13.
(责任编辑 潘小伦)
A dynamic study on the species and quantity of microorganisms in the micro-environment, Chongqing China Three Gorges Museum
TANG Huan1, FAN Wen-qi1, WANG Chun1, ZHANG Li-long2
(1.ChongqingChinaThreeGorgesMuseum,Chongqing400015,China; 2.Chongqingcenterfordiseasecontrolandprevention,Chongqing400042,China)
In this study, both traditional colony counting and PCR-DGGE (PCR-Denaturing gradient gel electrophoresis) technology were used to analyze the quantity and species characteristics of microorganisms in the micro-environment, Chongqing China Three Gorges Museum. The results showed that the species and quantity of cultivable microorganism in the air of the museum micro-environment was significantly higher in summer than in winter. Species ofAcinetobacter,Staphylococcus、PseudomonasandAdvenellawere found to predominate. In addition,Acinetobactersp. andMicrococcussp. were dominant in summer whileBacillussp. predominated in winter. The results were helpful in terms of evaluating potential microbial pollution and to providing scientific evidence for preventive protection of exhibited or collected cultural relics in museums.
Museum environment; Preventive conservation; PCR-DGGE; Air microorganisms
2016-01-19;
2016-07-11
重庆中国三峡博物馆项目资助(3GM2013-KTZ03)
唐 欢(1979—),女,2001年毕业于西南师范大学生物教育专业,副研究馆员,研究方向为文物微生物病害防治,E-mail: tanghuan3gm@163.com
张丽龙,E-mail: tmmulong@sina.com
1005-1538(2017)01-0035-09
K879.2
A
