氧化性与漂白原理的区别与联系
2017-02-27张婷婷
张婷婷
【摘 要】本文介绍了漂白、氧化性等概念,以及常见的氧化性漂白剂及漂白原理。同时,对漂白规律与氧化性规律做了系统的归纳比较与辨析。
【关键词】漂白 氧化性 漂白规律 氧化性规律
【中图分类号】G 【文献标识码】A
【文章编号】0450-9889(2016)11B-0083-02
漂白性与氧化性有许多相似之处,但又有很多不同。在实际应用中发现,二者很容易混淆,从而导致一些不必要的错误,有时甚至产生一些歧义。本文拟对此知识点做一归纳总结,以飨各位读者。
一、概念的不同
氧化性是指物质得电子的能力,其强弱主要是指得到电子的难易程度。需要指出的是氧化性的强弱与得失电子数目没有必然的联系。即氧化性强,得电子数不一定多;反之,得电子数少,氧化性不一定弱。
漂白性是指本色或带颜色的纤维、织品等变为白色,也可理解为有机色质在某些条件下的褪色现象。无机物的褪色如:溴水褪色、氯水褪色、酸性高锰酸钾的褪色等不属于漂白范围。
二、涉及的类型不同
(一)高中化学的漂白从原理分析,大体分为以下三大类。
1.强氧化性漂白(永久性漂白)
原理:将有机色质内部“生色团”破坏,氧化成无色物质。
常见的强氧化性漂白剂如:HClO、Ca(ClO)2(漂白粉的有效成分)、NaClO、H2O2、Na2O2、O3 等。分述如下:
HClO:有强氧化性,因为 HClO 中 C l为 +1 价,处于不稳定状态,易得电子,可用于自来水消毒(氯气通入水)。
Ca(ClO)2 :Ca(ClO)2、CO2和H2O生成HClO而呈漂白性,常用于衣服、织物的漂白。
H2O2:H2O2 中 O 为 -1 价,易得 1 个电子生成 H2O2,质量分数 3% 的双氧水用于医疗消毒。
Na2O2:其中 O 为 -1 价,易得 1 个电子生成 NaOH,用于麦秆、织物、麦秆等漂白。
2.化合性漂白
原理:与有色有机物加成或化合成无色的物质,无色的新物质分解后颜色消失。
常见漂白剂:二氧化硫。
品红可与二氧化硫发生加成反应,生成 N- 亚磺酸亚硫酸副品红碱,此物质为无色有机物,受热易分解红色的三氨基三苯甲烷氯化物。它又分为酸性品红和碱性品红。从化学原理分析,是 SO2 使品红中的不饱和键变为饱和键从而使品红的颜色消失。品红是三氨基三苯甲烷氯化物 ,它的产物是 N- 亚磺酸亚硫酸副品红碱,反应机理如下:
该产物受热就分解,品红颜色恢复。而品红对 SO2 的吸收量少,不能用它来吸收大量的 SO2。因此,常用品红检验 SO2 的存在。
SO2 漂白除去漂白品红溶液外还可漂白很多物质,如黄色的植物秸秆经 SO2 漂白就会变白,日常用秸秆造的纸也可用 SO2 漂白。
但要注意,SO2 不能与氧化性的漂白剂混用,SO2 中 +4 价硫有还原性,会发生氧化还原反应,从而失去漂白性质。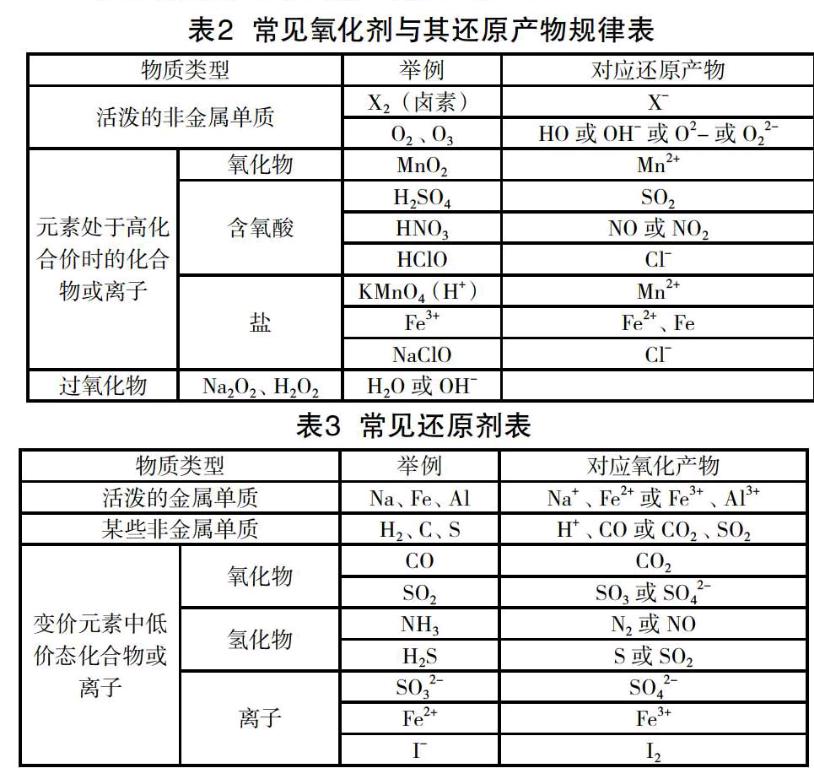
3.物理吸附性漂白
原理:將有机色质吸附而褪色。
常见的此类物质有:活性炭、胶体。
据此原理,活性炭可以做脱色剂、除臭剂、去味剂、防毒面具的滤毒罐等。
(二)氧化性物质的分类
1.强氧化剂与弱氧化剂
物质氧化性与氧化剂相对应,而还原性与还原剂相对应。所谓的强弱实质上是物质得失电子难易程度,即物质越易夺得电子,则反应出其氧化性越强,越难夺得电子则说明其氧化性越弱;反之,物质越易失去电子,则表明其还原性越强,越难失去电子,则反映其还原性越弱。
2.无机氧化剂与有机氧化剂
一般的无机物、有机物能做氧化剂的分别叫做无机氧化剂、有机氧化剂。如酸性高锰酸钾是无机氧化剂,对有机物而言越是不饱和(如碳碳双键,碳氧双键)其氧化性越强。碳碳三键比碳碳双键更不饱和,所以乙炔的氧化性比乙烯强。碳氧双键比碳碳双键氧化性强是因为氧的电负性比碳大,至于碳氧双键比碳碳三键强是从实验现象得来的,醇就不提了,它在多数情况体现还原性。
3.固体氧化剂和液体氧化剂
根据物质状态分类。如:液体氧化剂有过氧乙酸、双氧水、浓硝酸、浓硫酸等一些高价酸。固体氧化剂有六氟化铂,一种常温下为暗红色固体但具有较强挥发性的极强的固体氧化剂和氟化剂。像过硫酸盐、过二硫酸盐和铋酸钠等强氧化剂尽管较为常用,但其氧化性都无法与六氟化铂相提并论。
三、规律的不同
(一)漂白性规律
1.SO2 的漂白性
SO2 能使许多有色物质褪色,但其褪色原理不同:
(1)还原性褪色:SO2 能使溴水、酸性 KMnO4 溶液褪色,利用 SO2 的还原性。
(2)漂白性褪色:SO2 能使品红溶液褪色,利用 SO2 的漂白性。
(3)酸性褪色:SO2 能使滴有酚酞的 NaOH 溶液褪色,利用 SO2 的酸性氧化物的性质。
2.常见的用于漂白的物质的比较
常见的用于漂白的物质的特点比较如下: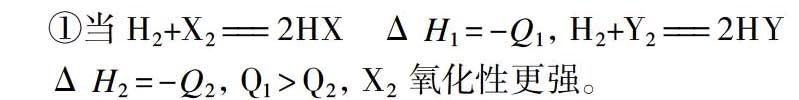
(二)氧化性的规律
1.反应关系规律
氧化剂得到电子,化合价降低,被还原为还原产物;而还原剂失去电子,化合价升高被氧化为氧化产物。据此知,任意一个氧化还原反应,氧化剂的氧化能力大于氧化产物的氧化能力,还原剂的还原能力大于还原产物的还原能力。
2.知识线索关系规律
3.常见氧化剂与其还原产物规律
常見氧化剂与其还原产物规律如下:
4.常见还原剂
常见还原剂如下:
5.氧化剂的强弱判断规律
(1)方法 1 ,依据“三度”判断(“三度”即浓度、温度、酸碱度)
一般情况下,浓度越大,温度越高,氧化剂的氧化性(或还原剂的还原性)越强;酸碱度是影响氧化性强弱的重要因素。例如①热HNO3的氧化性强于冷HNO3的氧化性;②HNO3浓的氧化性强于稀HNO3的氧化性;③KMnO4 在酸性条件下具有较强的氧化性,常温下即可和浓盐酸反应制取氯气。
(2)方法 2,根据“三表”判断
①根据元素周期表判断
同主族元素(从上到下):非金属原子(或单质)氧化性逐渐减弱,对应阴离子还原性逐渐增强;金属原子还原性逐渐增强,对应阳离子氧化性逐渐减弱。
同周期主族元素(从左到右):单质还原性逐渐减弱,氧化性逐渐增强;阳离子氧化性逐渐增强,阴离子还原性逐渐减弱。
②根据金属活动性顺序表判断
③根据非金属活动性顺序表判断
(3)方法 3 ,依据“两池”判断
①用惰性电极电解混合溶液时,在阴极先得电子的阳离子氧化性较强,在阳极先失电子的阴离子还原性较强。
②两种不同的金属构成原电池的两极。负极是电子流出的极,正极是电子流入的极。则两种金属的还原性:正极小于负极。
(4)方法 4 ,依据反应条件来判断
当不同的氧化剂作用于同一还原剂时,若氧化产物价态相同,可依据反应条件的难易程度来判断氧化剂氧化性的相对强弱,一般来说反应条件越苛刻,说明反应越难发生(即氧化剂得电子越困难),则对应氧化剂的氧化性越弱。
(5)方法 5 ,依据反应的能量变化判断
①当 H2+X2 === 2HX Δ H1=-Q1,H2+Y2 === 2HY
Δ H2=-Q2,Q1>Q2,X2 氧化性更强。
②当原子得电子(相同数目)形成稳定结构的阴离子时,放出的能量越多,生成的离子越稳定,其原子氧化性越强。
③当元素原子失去相同数目电子形成阳离子时,放出的能量越多,越易失电子,其还原性越弱。
综上所述,有氧化性的基本都可以用来漂白,只是漂白的速率、效果有区别而已,但能漂白的不一定是有氧化性的物质。
(责编 卢建龙)
