薄荷酮对内毒素致炎症模型小鼠的保护作用研究
2017-02-27温桃群桑文涛
王 凤,温桃群,徐 锋,桑文涛,陈 仁,曾 南
(成都中医药大学药学院中药材标准化教育部重点实验室,四川省中药资源系统研究与开发利用省部共建国家重点实验室培育基地,四川 成都 611137)
薄荷酮对内毒素致炎症模型小鼠的保护作用研究
王 凤,温桃群,徐 锋,桑文涛,陈 仁,曾 南
(成都中医药大学药学院中药材标准化教育部重点实验室,四川省中药资源系统研究与开发利用省部共建国家重点实验室培育基地,四川 成都 611137)
目的 观察薄荷酮对内毒素(LPS)致炎症模型小鼠的保护作用,并初步探讨与NLRP3炎症小体激活相关的调控作用机制。方法 ♂ C57BL/6J小鼠按体质量分层随机分为空白对照组、模型对照组、地塞米松组(5 mg·kg-1)、薄荷酮0.25 g·kg-1及0.5 g·kg-1剂量组。除地塞米松组实验当日腹腔注射给药1次外,其余各组小鼠连续灌胃给药5 d,每天1次。各组小鼠末次给药30 min后,除空白组小鼠外,其余各组小鼠腹腔注射LPS(15 mg·kg-1,10 mL·kg-1)制备炎症反应模型,造模12 h后,小鼠取血分离血清,采用ELISA及液相蛋白芯片技术测定炎症因子IL-18、IL-1β、IL-5、TNF-α、IFN-γ、粒细胞集落刺激因子(G-CSF)、粒细胞-巨噬细胞集落刺激因子(GM-CSF)及巨噬细胞炎性蛋白-1β(MIP-1β)的水平;取小鼠全血进行白细胞(WBC)计数;剖取肺组织计算肺脏指数,并测定肺组织中NO含量,进行肺组织病理组织学检查;RT-PCR法检测肺组织中NLRP3、caspase-1及IFN-α mRNA表达;免疫组化法观察肺组织中cathepsin B、P2X7R蛋白表达。结果 0.5 g·kg-1薄荷酮明
薄荷酮;内毒素;炎症因子;NLRP3炎症小体;cathepsin-B;P2X7R
薄荷酮属于单萜类化合物,存在于薄荷、荆芥、黄芩和藿香等多种植物的挥发油中,现代研究表明薄荷酮具有抗病毒、抗炎、利胆、促渗等作用[1-2],其缩氨基硫脲和缩氨基脲衍生物还具有抗HIV-1(ⅢB)和 HIV-2 (ROD)的作用[3]。关于薄荷酮的抗炎作用,已有报道认为与其抑制炎症因子的释放有关,但多从体外实验进行探讨[4-5],而体内研究报道较少。本研究采用内毒素(LPS)诱导的小鼠炎症模型,探讨薄荷酮预防性给药是否对内毒素所致炎症模型小鼠具有保护作用,并从NLRP3炎症小体激活角度初步探讨其作用机制,以期进一步明确该化合物的抗炎作用。
1 材料
1.1 实验动物 SPF级C57BL/6J小鼠,♂,体质量18 g~22 g,北京维通利华实验动物有限公司提供,许可证号:SCXK(京)2012-0001。动物合格证号11400700130007。
1.2 药物与试剂 薄荷酮(百灵威科技有限公司,556084-25mL,批号:A0303645),纯度85%,实验时用体积分数为0.35%的吐温-80溶液配制使用。给药剂量分别为其LD50的1/20和1/10,即0.25 g·kg-1、0.5 g·kg-1。地塞米松(Sigma,D-4902-25mg,批号:WXBB713V);LPS(Sigma,Escherichia coil 055:B5,批号:044M4004V);Mouse IL-18 ELISA kit(E-bioscience,批号:118018007);MILLIPLEX®MAP Mouse Cytokine/Chemokine Magnetic Bead Panel-Immunology Multiplex Assay(Millipore,批号:2683668);Cathepsin B兔多克隆抗体(Abcam,批号:ab58802);P2X7R兔多克隆抗体(Abcam,批号:ab09054);生物素化山羊抗兔IgG(H+L)(北京中杉金桥,批号:13152A11);浓缩型DAB试剂盒(北京中杉金桥,批号:K135925C);AxyPrep 总 RNA 小量制备试剂盒(吴江康宁生命科学有限公司,批号 12113KD1);Quant cDNA 第一链合成试剂盒(北京天根生化科技有限公司,批号 L1116);SuperReal PreMix Plus(SYBR Green)(北京天根生化科技有限公司,批号 P4224)。NLRP3、caspase-1、IFN-α引物序列均由Invitrogen设计。NO试剂盒(碧云天生物技术,批号:S0021)。
1.3 仪器 LuminexMagpix液相悬浮芯片仪(Millipore);3001 酶联免疫分析仪(Thermo Fisher Scientific,Finland);Sorvall ST 16R离心机(Thermo Fisher);ZHWY-100H恒温培养振荡器(上海智成分析仪器制造有限公司);MEK-6318K全自动血液分析仪(日本Nihon Kohden);BS323S电子天平(北京赛多利斯仪器系统有限公司);2015型转轮式切片机(德国徕卡仪器有限公司);TSJ-Ⅱ型全自动封闭式组织脱水机(常州市中威电子仪器有限公司);BA200Digital数码三目摄像显微摄像系统(麦克奥迪实业集团有限公司);CFX96TM Real-Time PCR Dectection System(美国 Bio-Rad 公司)。
2 方法
2.1 内毒素致炎症模型小鼠的建立与给药 取健康C57BL/6J ♂小鼠,按体质量分层随机分为空白组、模型组、地塞米松(5 mg·kg-1)组、薄荷酮0.25 g·kg-1与0.5 g·kg-1组。除地塞米松组外,其余给药组小鼠按0.02 mL·g-1体积灌胃给药,空白组与模型组给予等体积0.35%吐温-80溶液,连续给药4 d。动物禁食不禁水12 h,d 5(地塞米松组ip给药,剂量为5 mg·kg-1)给药后30 min,小鼠腹腔注射LPS(15 mg·kg-1,0.01 mL·g-1)造模。造模后12 h,小鼠取血分离血清,采用液相芯片法测定小鼠血清中IL-1β、IL-5、TNF-α、IFN-γ、G-CSF、GM-CSF、MIP-1β的含量,采用ELISA法测定小鼠血清IL-18的含量。另取小鼠全血 20 μL至装有2 mL稀释液的EP管中,混匀,进行白细胞计数。剖取小鼠肺脏,称重,计算肺指数。将右肺保存于-80℃备用,取各组小鼠左肺置于体积分数为10%的中性福尔马林中,用于观察小鼠肺组织病理形态学变化。
2.2 薄荷酮对内毒素致炎症模型小鼠肺组织病理形态学的影响 将固定于体积分数为10%中性福尔马林中的各组小鼠肺组织进行取材制片,每叶肺取材2~3 mm,乙醇脱水,石蜡包埋,切片,HE 染色,置于显微镜下观察各组小鼠肺组织的病理损伤。并对小鼠肺400倍镜图片上的嗜中性粒细胞进行计数,方法:每叶肺400倍镜下取上、中、下3张图片,肺叶尖为上,支气管进入处最下端为下,两端之间为中部,取图片时尽可能让整个图片都布满肺组织。每只动物取6张图片,计数每张图片上的嗜中性粒细胞数量,计算其算数平均值作为该例标本嗜中性粒细胞的数目。
2.3 实时荧光定量 PCR检测模型小鼠肺组织中NLRP3、caspase-1、IFN-α mRNA表达 RNA提取实验中所需所有实验材料按照相关要求浸泡、灭菌,烘干备用。取各组小鼠冻存肺组织样本,按照AxyPrep总RNA小量制备试剂盒说明书提取总RNA, 并检测RNA的纯度及含量,按照Quant cDNA 第一链合成试剂盒进行逆转录获得cDNA,随后运用RT-PCR法检测NLRP3、caspase-1、IFN-α mRNA表达。引物序列见Tab 1。
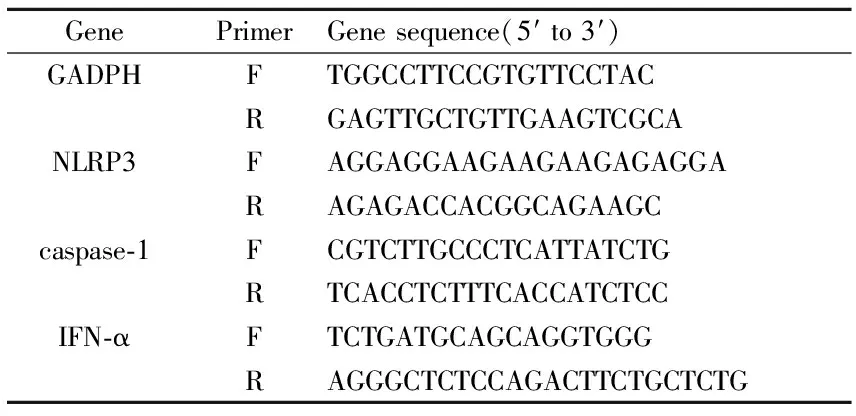
Tab 1 Gene sequences of primers
2.4 免疫组化分析模型小鼠肺组织中cathepsin B、P2X7R表达 各组小鼠肺组织经过固定、脱水、透明、浸蜡、包埋后,切片(厚4~5 μm),切片常规脱蜡至水,3% H2O2室温孵育10 min灭活内源性过氧化物酶,蒸馏水洗3次,热修复抗原,滴加山羊血清封闭液,室温孵育20 min,滴加稀释的一抗cathepsin B抗体(1 ∶200)或P2X7R抗体(1 ∶200),4℃过夜,PBS洗3次后,滴加生物素化山羊抗兔IgG二抗,37℃孵育 30 min,PBS洗3次后,滴加辣根过氧化酶标记链霉素卵蛋白试剂 ,37℃孵育 30 min,PBS洗4次后DAB显色,蒸馏水洗涤后苏木精轻度复染、脱水、透明、中性树胶封片。显微镜下观察,细胞膜或细胞质内出现浅黄色或棕黄色的颗粒物质为阳性表达,蓝色为阴性表达。采用Image-Pro Plus 6.0图像分析系统测定所采集全部图像的平均光密度(平均光密度=黄色或棕黄色部分的累积光密度值/照片面积)。
2.5 模型小鼠肺组织中NO含量检测 按试剂盒说明书制备肺组织匀浆,采用Griess法进行NO含量测定。
3 结果
3.1 薄荷酮对内毒素致炎症模型小鼠全血白细胞计数及肺指数的影响 如Fig 1所示,与空白对照组比较,模型组小鼠全血白细胞计数明显升高(P<0.05),肺指数明显增加(P<0.01),提示内毒素能诱导小鼠出现炎症反应,肺指数的增加提示肺组织有炎性渗出表现。与模型组比较,0.5 g·kg-1薄荷酮对全血白细胞计数及肺指数的增高表现出降低趋势(P>0.05)。
3.2 薄荷酮对内毒素致炎症模型小鼠血清炎性因子水平的影响 与空白对照组比较,模型组小鼠血清IL-1β、IL-18、IL-5、TNF-α、MIP-1β、IFN-γ、G-CSF和GM-CSF水平均明显增加(P<0.05或P<0.01)。与模型组比较,0.5、0.25 g·kg-1薄荷酮均能明显降低模型小鼠血清IL-1β、IL-5、TNF-α及MIP-1β的含量(P<0.05);0.5 g·kg-1薄荷酮亦明显降低模型小鼠血清IL-18、IFN-γ、G-CSF和GM-CSF水平(P<0.05或P<0.01)。见Fig 2。
3.3 薄荷酮对内毒素致炎症模型小鼠肺组织病理形态学的影响 镜下观察发现,造模组的小鼠肺组织的肺泡膈内有炎性细胞浸润表现,主要以嗜中性粒细胞为主,小血管内亦充满嗜中性粒细胞,使肺泡膈出现不同程度的增厚。由于肺泡膈增厚的主要原因为炎细胞浸润造成,因此本实验对各组小鼠肺组织的病变程度采用肺泡膈与小血管内的嗜中性粒细胞数量进行评价,结果见Fig 3。与空白对照组比较,模型对照组小鼠肺组织的肺泡膈增厚,肺泡隔内嗜中性粒细胞浸润明显,肺组织小血管内充满嗜中性粒细胞,嗜中性粒细胞计数明显高于空白对照组(P<0.01),提示LPS可诱导肺组织的炎性表现,亦表明本次实验模型成立。与模型对照组比较,0.5 、0.25 g·kg-1薄荷酮预防给药能明显减少小鼠肺组织中的嗜中性粒细胞数量(P<0.01),减轻肺泡膈增厚,表明薄荷酮能对抗LPS所致的炎症反应。
3.4 薄荷酮对内毒素致炎症模型小鼠肺组织NLRP3、caspase-1、IFN-α mRNA表达的影响 如Fig 4所示,与空白对照组比较,模型组小鼠肺组织中NLRP3、caspase-1 mRNA表达明显上调(P<0.01或P<0.05);与模型组比较,0.5 g·kg-1薄荷酮明显下调模型小鼠肺组织NLRP3、IFN-α mRNA的表达(P<0.05),对caspase-1 mRNA表达亦有较明显的下调趋势。
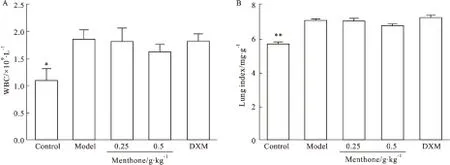
Fig 1 Effect of menthone on WBC(A) and lung index(B) in inflammation mice induced by±s,n=11)


A~H:The levels of IL-1β, IL-18, IL-5, TNF-α, IFN-γ, G-CSF, GM-CSF and MIP-1β in serum of inflammation mice induced by endotoxin.*P<0.05,**P<0.01vsmodel

Fig 3 Level of neutrophilic granulocyte and pathological picture of lung tissue in inflammation mice induced by endotoxin±s,n=6)
A: Effect of menthone on level of neutrophilic granulocyte in lung tissue of inflammation mice induced by endotoxin.**P<0.01vsmodel; B: Pathological picture of the lung tissue in inflammation mice induced by endotoxin, exemplary show is neutrophilic infiltrate and thickening of alveolar septum (HE×400).
3.5 薄荷酮对内毒素致炎症模型小鼠肺组织cathepsinB、P2X7R表达的影响 对小鼠肺组织进行SP免疫组化染色后发现,与空白组比较,模型组小鼠肺组织中cathepsinB、P2X7R蛋白表达明显升高(P<0.01),与模型组比较,0.5 g·kg-1薄荷酮能明显下调模型小鼠肺组织cathepsin B、P2X7R的蛋白阳性表达水平(P<0.01或P<0.05),0.25 g·kg-1薄荷酮对P2X7R蛋白阳性表达水平亦有明显抑制表现(P<0.01)。见Fig 5。
3.6 薄荷酮对内毒素致炎症模型小鼠肺组织NO含量的影响 由Fig 6可知,与空白组相比,模型组小鼠肺组织中NO含量明显升高(P<0.01),与模型组比较,0.25、0.5 g·kg-1薄荷酮均能明显降低肺组织中NO的含量(P<0.05)。
4 讨论
内毒素(endotoxin)具有广泛的生物学活性,是革兰阴性细菌细胞壁外膜的主要组成成分,其化学本质为脂多糖(lipopolysaccharide,LPS),为诱发炎症反应过程的主要病理成分。内毒素进入机体后,能直接作用于细胞生物膜,并通过单核-巨噬细胞介导的细胞吞噬作用使机体防御系统过度释放多种炎症细胞因子,如肿瘤坏死因子、干扰素、白细胞介素(IL)-1、IL-6、IL-5等,上述细胞因子过量则会引起机体发热、血管通透性增加、中性粒细胞增多等炎症病理生理反应[6-7],过量的内毒素刺激还会引起内毒素血症,甚至内毒素休克。大量研究表明,实验动物腹腔或静脉注射LPS诱导的内毒素中毒模型,具有全身炎症反应表现,该模型具有易操作、重现性好的特点,常被用来观察药物的抗炎作用与机制研究。本研究中,小鼠腹腔注射LPS(15mg·kg-1)之后,逐渐出现呼吸急促、活动减少表现,双眼出现一些白色分泌物,全血白细胞计数增高,血清中众多炎性因子如IL-1β 、IL-18、 TNF-α、IL-5、IFN-γ等水平异常升高,且模型动物的肺脏组织呈现明显的炎性病理表现,嗜中性粒细胞浸润增加,上述表现与文献报道相符[8-9],亦表明本研究中的炎症动物模型制备成功。实验结果发现,薄荷酮预处理小鼠的全血白细胞计数及肺指数均呈现降低趋势,0.5 g·kg-1薄荷酮明显减少肺组织切片中嗜中性粒细胞的数量,减轻肺泡膈的增厚,提示薄荷酮对内毒素所致的炎症模型小鼠有保护作用。
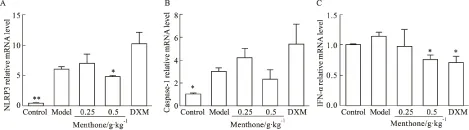
Fig 4 Effect of menthone on expression of NLRP3(A), caspase-1(B), IFN-α(C) mRNA in lung tissue of inflammation mice induced by±s,n=4)
*P<0.05,**P<0.01vsmodel
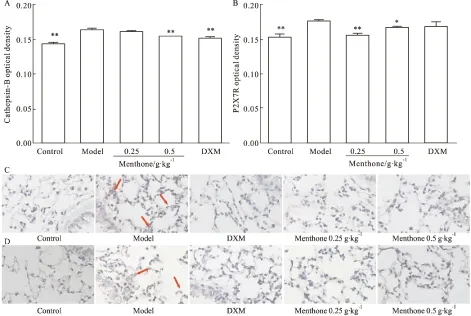
Fig 5 Effect of menthone on protein expression of cathepsin B and P2X7R in lung tissue of inflammation mice induced by endotoxin±s,n=4)
A and B: Optical density of cathepsin B and P2X7R in lung tissue of inflammation mice induced by endotoxin ; C and D: Protein expression of cathepsin B and P2X7R in lung tissue of inflammation mice induced by endotoxin , exemplary show is cathepsin B or P2X7R SP staining(IHC×400).*P<0.05,**P<0.01vsmodel.
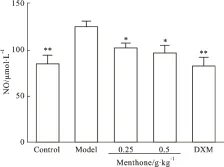
Fig 6 Effect of menthone on level of NO in lung tissue of inflammation mice induced by±s,n=6)*P<0.05,**P<0.01vsmodel
IL-1β、IL-18、IL-5、TNF-α和IFN-γ是目前研究较多的促炎因子,参与各种炎症反应,亦是较重要的炎症因子。其中,IL-1β 的生物学效应广泛,可在局部或全身发挥作用,引起发热、炎症反应等。而且,IL-1β 和 IL-18 能够提高其他致炎因子如IL-6 、TNF-α 的表达,上调黏附分子的表达,促进炎性细胞的渗出[10-11]。促炎因子TNF-α主要由单核细胞、巨噬细胞和T细胞产生,不仅对肿瘤细胞有杀伤作用,而且能刺激T细胞产生各种炎症因子,产生致炎、加剧炎症反应和免疫调节作用。炎症反应过程中,嗜酸性粒细胞能通过释放其颗粒中的内容物,引起组织损伤,加剧炎症反应,而炎症因子IL-5的主要功能则是刺激嗜酸性粒细胞增殖、分化及活化,因此表现出促炎效应。促炎因子 IFN-γ主要由 Th1 细胞分泌,具有较强的激活吞噬细胞和中性粒细胞的作用。本研究发现,模型小鼠血清中IL-1β 、IL-18、 TNF-α、IL-5和IFN-γ的含量均明显升高,提示动物呈现一定的全身炎性反应,但经薄荷酮预处理过的小鼠则对上述促炎因子的异常升高有较好的对抗作用,提示薄荷酮的抗内毒素作用与抑制促炎因子的过度释放有关。
本研究中,除观察薄荷酮对常见促炎因子的影响外,还探讨了其对模型动物血清粒细胞集落刺激因子(G-CSF)、粒细胞-巨噬细胞集落刺激因子(GM-CSF)及巨噬细胞炎性蛋白-1β (macrophage inflammatory protein- 1β,MIP-1β) 水平的影响。G-CSF是一种多肽类细胞因子,细菌感染时所释放的内毒素作用于巨噬细胞,促进其分泌 IL-1 ,进而激活T淋巴细胞,使其分泌 IL-3、4、5 等细胞因子,上述因子则进一步作用于单核细胞、巨噬细胞、成纤维细胞及内皮细胞,致使其分泌 G-CSF[12]参与炎症反应。GM-CSF则是体内重要的炎症细胞趋化因子和活化因子,可促进单核巨噬细胞的致炎作用。MIP-1β亦是体内重要的趋化因子,主要作用是作为化学引诱物引领细胞迁移,从而诱导炎症细胞向炎症部位浸润[13]。实验结果发现,LPS所诱导的炎症模型小鼠血清中G-CSF、GM-CSF与MIP-1β的含量明显升高,进一步反映出该模型小鼠的炎性反应状态,而采用薄荷酮预处理过的小鼠在造模后,其血清中上述趋化因子含量的增高明显受到抑制,进一步证实了薄荷酮的抗炎作用与其抑制体内促进炎症反应发生的活性物质的释放有关。
固有免疫为机体的第一道防御系统,能引导机体对外来病原体产生免疫性应答,通过模式识别受体(PRR)来识别病原体的保守结构即病原体相关分子模式(PAMP),常见的PAMP包括鞭毛蛋白、LPS及一些微生物的核酸分子,这些PAMP能被PRR识别,进而激活下游信号通路,引起机体发生炎症反应。目前已发现3类PRR:Toll样受体(TLR)、RIG-I样受体(RLR)和NOD样受体(NLR)。本文实验选择NLR中研究较多的NLRP3炎症小体作为切入点,探讨薄荷酮抗炎作用的调控机制。NLRP3炎症小体由核心蛋白NLRP3、接头蛋白ASC和效应蛋白caspase-1组成,NLRP3受到内源性或外源性危险信号刺激后,效应蛋白caspase-1会负责将无活性的炎症因子pro-IL-18和pro-IL-1β剪切为成熟的IL-18和IL-1β[14]。NLRP3炎症小体能被尿酸晶体、病毒和细菌等多种物质激活,如胞外的ATP使胞内的钾离子外流,激活NLRP3炎症小体,同时,胞外的ATP 与嘌呤能离子通道型受体7(P2X7R)结合后利用通道蛋白 Pannexin-1 在细胞膜上形成开放的孔道,使胞外的激活剂进入胞质中诱导 NLRP3 炎症小体的激活。尿酸晶体等NLRP3炎症小体激活剂被内吞后可导致溶酶体损伤或破裂,使其中一些蛋白酶被释放到胞质中(如组织蛋白酶cathepsin-B),进而诱导NLRP3炎症小体的激活[15]。本研究发现,模型小鼠肺组织中NLRP3、caspase-1 mRNA表达及cathepsin B、P2X7R的蛋白表达明显升高,且模型小鼠血清中IL-1β、IL-18、TNF-α等多种炎症因子表达明显增加,提示NLRP3炎症小体被激活,而0.5 g·kg-1薄荷酮对模型小鼠肺组织核心蛋白NLRP3 mRNA的表达有明显下调作用,对效应蛋白caspase-1 mRNA的表达有下调趋势,并对NLRP3炎症小体激活的诱导分子cathepsin B与P2X7R的蛋白表达均表现出明显抑制作用,提示0.5 g·kg-1薄荷酮可能通过改变离子通道及减轻溶酶体损伤来抑制NLRP3炎症小体的激活,减少炎症活性物质的释放。此外,研究表明NO能抑制NLRP3炎症小体的激活[16],本研究发现0.25、0.5 g·kg-1薄荷酮均能明显对抗模型小鼠肺组织NO含量的异常升高,提示薄荷酮可能通过NO途径抑制NLRP3炎症小体的激活。
综上,可认为薄荷酮预处理对内毒素致炎症模型小鼠具有保护作用,作用发挥与抑制各类炎症因子的释放,从而减轻炎症细胞浸润,抑制炎症反应的病理进程有关,其抗炎作用的发挥可能与通过改变离子通道、减轻溶酶体损伤或影响NO释放等途径,干扰NLRP3炎症小体的激活有关,其具体机制有待进一步深入研究。
[1] 何 婷,汤 奇,曾 南,等. 荆芥挥发油及其主要成分抗流感病毒作用与机制研究[J]. 中国中药杂志,2013,38(11):1772-7.
[1] He T, Tang Q, Zeng N, et al. Study on effect and mechanism of volatile oil of Schizonepetae Herba and its essential components against influenza virus[J].ChinaJChinMaterMed, 2013,38(11):1772-7.
[2] Hu G Y, Yuan X, Zhang S Y, et al. Research on choleretic effect of menthol, menthone, pluegone, isomenthone, and limonene in DanShu capsule[J].IntImmunopharmacol, 2015, 24(2): 191-7.
[3] Mishra V, Pandeya S N, Pannecouque C, et al. Anti-HIV activity of thiosemicarbazone and semicarbazone derivatives of (+/-)-3-menthone[J].ArchPharm,2002, 335(5): 183-6.
[4] Ku C M, Lin J Y. Anti-inflammatory effects of 27 selected terpenoid compounds tested through modulating Th1/Th2 cytokine secretion profiles using murine primary splenocytes[J].FoodChem, 2013,141(2):1104-13.
[5] Cheng H M, Hsiang C Y, Chen G W, et al. Inhibition of lipopolysaccharide-induced interleukin-1β and tumor necrosis factor-α production by menthone through nuclear factor-κB signaling pathway in HaCat cells[J].ChinJPhysiol, 2008,51(3):160-6.
[6] 郭 萌,李冠民,黄清泉. 细菌内毒素研究进展[J]. 中国实验动物学报,2009,17(5):397-401.
[6] Guo M, Li G M, Huang Q Q.Advances in research of bacterial endotoxin[J].ActaLabAnimSciSin, 2009,17(5):397-401.
[7] 郭媛魏,筱 华,谢 珺,等.内毒素血症的免疫学发病机制[J].中华临床医师杂志(电子版),2011,5(2):454-6.
[7] Guo Y W, Xiao H, Xie J, et al. Immunological pathogenesis of endotoxemia[J].ChinJClin(ElectronEd) ,2011,5(2):454-6.
[8] 吴 颖,孙 冰,肖 静,等. 三七皂苷R1对LPS诱导的小鼠心肌损伤的保护作用[J]. 中国药理学通报,2013,29(2):179-84.
[8] Wu Y, Sun B, Xiao J, et al.Protective effect of Notoginesenoside R1 on lipopolysaccharide-induced myocardial dysfunction in mice[J].ChinPharmacolBull, 2013,29(2):179-84.
[9] 陆 杨,胡冬梅,文爱东,等. 女贞总苷对急性肝损伤小鼠的保护作用[J]. 中国药理学通报,2016,32(4):588-9.
[9] Lu Y, Hu D M, Wen A D, et al. The protective effect of privet total glycosides on acute liver injury mice[J].ChinPharmacolBull, 2016,32(4):588-9.
[10]Shigematsu Y, Niwa T, Rehnberg E, et al.Interleukin-1β induced by Helicobacter pylori infection enhances mouse gastric carcinogenesis[J].CancerLett,2013,340(1): 141-7.
[11]Yamauchi K, Choi I J, Lu H, et al. Regulation of IL-18 in Helicobacter pylori infection[J].JImmunol,2008,180(2):1207-16.
[12]常立春,贾飞勇. 粒细胞集落刺激因子的测定在人工感染动物上的研究[J]. 中国自然医学杂志,2006,8(3):192-4.
[12]Chang L C, Jia F Y. The application of G-CSF in measuring the infections in hamster[J].ChinJNatMed, 2006,8(3):192-4.
[13]张 晶,李涛涛,马友才,等. 心肌梗死小鼠趋化因子MIP1α和MIP1β对巨噬细胞招募作用的研究[J]. 心肺血管病杂志,2015,34(7):580-4.
[13]Zhang J, Li T T, Ma Y C, et al. Chemokines MIP1α and MIP1β promote the recruitment of macrophages after myocardial infarction in mice[J].JCardiovascPulmDis, 2015,34(7):580-4.
[14]Wen H, Miao E A, Ting J P. Mechanisms of NOD-like receptor-associated inflammasome activation [J].Immunity, 2013, 39(3):432-41.
[15]张 懿,刘 磊,刘韵资,等. NLRP3炎性小体研究新进展[J]. 现代生物医学进展, 2014, 14(9): 1763-5.
[15]Zhang Y, Liu L, Liu Y Z, et al. Recent research progress of the NLRP3 inflammasome[J].ProgModBiomed, 2014, 14(9):1763-5.
[16]Mao K R, Chen S Z, Chen M K, et al. Nitric oxide suppresses NLRP3 inflammasome activation and protects against LPS-induced septic shock[J].CellRes,2013,23(2):201-12.
The protective effects of menthone on endotoxin-induced infalmmation in mice
WANG Feng, WEN Tao-qun, XU Feng, SANG Wen-tao, CHEN Ren, ZENG Nan
(CollegeofPharmacy,ChengduUniversityofTraditionalChineseMedicine,EducationKeyLaboratoryofStandardizationofChineseHerbalMedicine,KeyLaboratoryofSystematicResearch,DevelopmentandUtilizationofChineseMedicineResourcesinSichuanProvince-KeyLaboratoryBreedingBaseCo-foundedbySichuanProvinceandMOST,Chengdu611137,China)
Aim To study the effects of menthone on LPS-induced inflammation in mice and to explore the mechanisms of activating of NLRP3 inflammasome. Methods C57BL/6J male mice were randomly divided into five groups, namely the normal group, model group, dexamethasone group (5 mg·kg-1) and menthone(0.25, 0.5 g·kg-1) groups. The dexamethasone group was given the drugs once by intraperitoneal injection on 5th day, while the other mice were given drugs by oral administration once a day for 5 d. Then, the normal group was injected with the saline and the other groups were injected LPS (15 mg·kg-1,0.01 mL·g-1) after 30 min of the last administration. 12 h after LPS injection, the blood, serum, and lung tissue of mice were collected. The levels of IL-18,IL-1β,IL-5,TNF-α,IFN-γ,G-CSF,GM-CSF and MIP-1β were measured in serum by ELISA and LuminexMagpix. The white cell in blood(WBC) were counted. The lung index and the levels of NO in lung tissue was calculated. The lung histopathology was performed. The relative levels of NLRP3, caspase-1 and IFN-α mRNA in lung tissue were determined by RT-PCR. The expressions of cathepsin B and P2X7R in lung tissue were quantified by immunohistochemical analysis. Results 0.5 g·kg-1menthone significantly reduced the levels of IL-18, IL-1β, IL-5, TNF-α, IFN-γ, G-CSF, GM-CSF, MIP-1β in serum (P<0.05 orP<0.01), and the expression of NLRP3,IFN-α,cathepsin B,P2X7R,NO in lung tissue(P<0.05 orP<0.01). 0.25 g·kg-1menthone inhibited the IL-1β,IL-5,TNF-α,MIP-1β production in serum and the expression of P2X7R,NO in lung tissue(P<0.05). 0.25, 0.5 g·kg-1menthone could attenuate pathological change of the lung tissues by reducing neutrophil infiltration and thickening of alveolar septa. And it slightly reduced the lung index and the level of white cells in blood. Conclusion Menthone has a protective effect on LPS-induced inflammation mice, and its mechanism is related to inhibiting the release of varies of inflammatory cytokines, reducing the inflammation reaction and inhibiting the activation of NLRP3 inflammasome.
menthone; endotoxin; inflammatory cytokines; NLRP3 inflammasome;cathepsin B; P2X7R
时间:2017-1-13 11:38:00
http://www.cnki.net/kcms/detail/34.1086.R.20170113.1138.034.html
2016-10-18,
2016-11-14
国家自然科学基金资助项目(No 81473399);国家基础科学人才培养基金项目(No J1310034-09)
王 凤(1992-),女,硕士生,研究方向:中药药效与毒理,E-mail:972065386@qq.com; 曾 南(1969-),女,博士,教授,研究方向:中药药效与毒理,通讯作者,E-mail:zengnan966@126.com
10.3969/j.issn.1001-1978.2017.02.017
A
1001-1978(2017)02-0227-08
R-332;R284.1;R322.35;R364.5;R392.12
显降低内毒素致炎症模型小鼠血清IL-18、IL-1β、IL-5、TNF-α、IFN-γ、G-CSF、GM-CSF、MIP-1β的水平(P<0.05或P<0.01),下调模型小鼠肺组织NLRP3、IFN-α mRNA表达及cathepsin-B、P2X7R蛋白表达(P<0.05或P<0.01),明显降低模型小鼠肺组织中NO的含量(P<0.05);0.25 g·kg-1薄荷酮明显降低模型小鼠血清中IL-1β、IL-5、TNF-α、MIP-1β含量(P<0.05),下调肺组织中P2X7R蛋白表达及NO水平(P<0.05或P<0.01);病理组织学检查显示0.5、0.25 g·kg-1薄荷酮能明显减少肺组织切片中嗜中性粒细胞数量(P<0.01),减轻肺泡膈的增厚;薄荷酮对模型小鼠全血白细胞计数与肺指数的升高表现出降低趋势。结论 薄荷酮对内毒素致炎症模型小鼠有保护作用,能抑制血清多种炎性细胞因子的释放而减轻肺部炎性损伤,该作用可能与干扰NLRP3炎症小体的激活有关。
