mTOR在炎性自身免疫性疾病中的作用①
2017-02-27白艳梅刘海杰
白艳梅 刘海杰 高 微 高 娟
(河北大学,保定071000)
mTOR在炎性自身免疫性疾病中的作用①
白艳梅 刘海杰②高 微③高 娟④
(河北大学,保定071000)
mTOR(mammalian target of rapamycin,mTOR)是一个非典型的丝氨酸/苏氨酸蛋白激酶,是1991年Heitman等学者在酵母中作为雷帕霉素(Rapamyein)靶蛋白被发现的。mTOR作为一种信号转导蛋白,在细胞内的主要作用是整合胞外细胞代谢信号及控制合成代谢和分解过程,对生长因子、营养物质、机体能量状态等产生应答,从而调节细胞生长、增殖、自噬、代谢、调控细胞周期等,在细胞生长与存活中起重要作用。
自身免疫性疾病是临床较为常见的一大类疾病,包括类风湿性关节炎、系统性红斑狼疮、多发性硬化、银屑病等。目前,关于自身免疫性疾病的发病机制尚未完全明了,研究显示可能与Treg/Th17的失衡有密切关系[1]。Treg和Th17都是CD4+的辅助性T细胞,Treg可以控制炎性效应性T细胞的活性和发育从而抑制炎症反应;Th17则促进趋化因子的产生,主要分泌IL-17、TNF-α等炎性细胞因子,征募单核细胞和中性粒细胞到炎症场所,可以促进炎症反应。而mTOR信号转导通路在Treg/Th17的失衡中起重要作用。因此,阐明mTOR信号通路在自身免疫性疾病中的作用具有非常重要的意义。
雷帕霉素是选择性的mTOR抑制剂,是一种亲脂性大环内酯类抗生素,是从吸水性链球菌发酵液中提取的,易溶于有机溶剂,不溶于水。自20世纪中期开发出来,雷帕霉素便作为T细胞增殖抑制剂来防止器官移植的排斥反应,近年来发现其可抑制人类肿瘤细胞的生长。mTOR抑制剂雷帕霉素除了抗肿瘤、抗增殖的作用,还表现为调节免疫细胞分化、活性和功能[2,3],其用于移植物排斥反应、阿尔茨海默病、结节性硬化症、各种自身免疫性疾病、冠状动脉再狭窄、恶性肿瘤以及对其他治疗方法耐受的自身免疫性恶性淋巴瘤已经处于研究中或用于临床。商品化的mTOR抑制剂除了雷帕霉素,还有Everolimus和Temsirolimus等,同时已经有此类药物进入治疗乳癌的临床研究阶段[4]。但目前上述药物用于自身免疫性疾病的研究较少。
1 mTOR的分子结构
mTOR由多种蛋白结构域组成,从羧基末端到氨基末端依次为FATC、KD结构域、FRB激酶结构域、FAT结构域和HEAT重复序列(图1)[5]。其中FATC结构域可以使mTOR的活性保持稳定;KD结构域为mTOR分子中的激酶功能区,具有活化下游分子作用;FRB结构域是FKBP12-rapamycin复合物的反应位点,这二者结合可以特异性地抑制mTOR的活性[6]。
2 mTOR复合物的组成
研究表明,mTOR的存在形式在哺乳动物中有两种,包括mTORC1和mTORC2。mTORC1参与了多种细胞过程的控制,如转录、翻译、自噬、细胞周期和微管动力学。mTORC2调节肌动蛋白细胞骨架动力学以及控制两种蛋白激酶Akt和PKCa的活性,参与调节细胞周期、骨架及存活。
3 mTOR的主要激活途径
3.1 mTORC1的主要激活途径
3.1.1 AMPK信号途径 细胞的营养水平、能量及缺氧也能调节mTORC1的活性。细胞处于低能量状态及缺氧时,腺苷酸环化酶活化蛋白激酶(AMPK)被激活,接下来使TSC复合体磷酸化,使mTORC1的活性受抑制。AMPK也可以直接使Raptor磷酸化,使mTORC1的活性抑制[7],从而促进自噬的发生,减少炎症因子的产生[8]。

图1 mTOR的组成结构Fig.1 Structure of mTOR
3.1.2 RAS-ERK途径和PI3K-AKT途径(图2)[4]生长因子及其超家族通过mTORC1的上游信号途径(RAS-ERK途径和PI3K-AKT途径)抑制肿瘤抑制蛋白结节性硬化复合体1和2(TSC1 and 2),通过其磷酸化而激活mTORC1,正向调节mTOR功能。TSC复合体对于mTORC1是负向调节的,AKT和ERK磷酸化TSC复合体可使其活性降低[9]。
PI3K/AKT/mTOR信号通路是细胞内信号通路,对维持细胞功能至关重要,同时对细胞增殖、生长、生存、迁移及肿瘤发生同样重要。最近有报告,PI3K-AKT-mTORC1-S6K信号轴通过促进RORγt核转运积极调解Th17的分化,从而促进炎症反应,强调了PI3K-AKT-mTORC1在Th17分化中的重要性[10]。
3.1.3 4EBP1和P70S6K途径 4EBP1和P70S6K是mTORC1下游的两个主要激活途径。4EBP1 mRNA含有遗传信息,是生物合成蛋白质的模板。mTOR信号通路通过使4EBP1磷酸化,促进翻译起始复合物的形成,从而使蛋白质的合成加速。相反,当营养素或生长因子缺乏时,或者存在mTOR抑制物时,4EBP1去磷酸化,抑制翻译起始,使蛋白质合成受限制。P70S6K是核糖体40S小亚基S6蛋白激酶,可使S6激活,而激活的S6可以使含5′-TOR的一类mRNA的翻译效率提高。mTOR可以磷酸化并激活P70S6K,使核糖体40S小亚基易于结合翻译复合物,从而提高5′-TOR mRNA的翻译效率。
3.2 mTORC2的激活途径 mTORC2的激活途径目前尚未完全明了。有研究证明TSC复合体功能缺失可使mTORC2激酶丧失活性。此外,mTORC1与mTORC2之间也可能存在相互作用,从而调节mTORC2的活性。雷帕霉素治疗短期内可以阻断mTORC1信号通路,长期才可阻断mTORC2的活性。
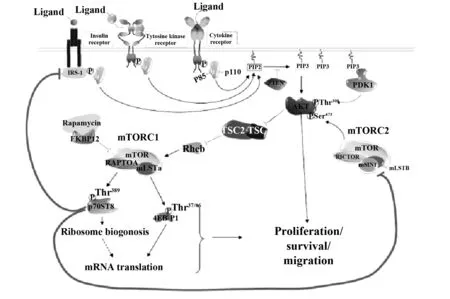
图2 PI3K-AKT途径Fig.2 Signaling pathway of PI3K-AKT
4 mTOR与自身免疫性疾病
4.1 mTOR与多发性硬化 多发性硬化是一种免疫介导的中枢神经系统慢性炎性脱髓鞘性疾病,因时间多发和空间的多发性而得名,全球有超过250万患者受累。研究发现,自身免疫性疾病的发生与Treg和Th17的平衡关系密切,而在Th17的细胞分化过程中,IL-6发挥着重要作用,IL-6的细胞信号转导通路能够被雷帕霉素阻断。通过抑制TGF-β/IL-6来调节Th17分化,对Th17细胞增殖发挥抑制作用,从而使炎性细胞因子的分泌减少。Treg是另一大类CD4+T细胞亚型,它可以全程控制炎性效应性T细胞在自身免疫性疾病中的活性和发育[11]。近些年来,越来越多的证据倾向于多发性硬化发病的主要原因是Treg功能失活,随着Foxp3+(Treg细胞表面标志物)的深入研究更是大大支持了这种观点。例如,扩增Treg会缓解或抑制自身免疫性脑脊髓炎的病情,而删除小鼠的Treg将会引起自身免疫性疾病的发生[12]。雷帕霉素诱导Foxp3+Treg细胞可能是其特异作用机制。雷帕霉素不仅通过部分JAK/STAT-IL-2信号通路来维持或诱导Foxp3表达,还可以通过抑制mTOR选择性的阻断PI3K信号通路,干扰致炎性T细胞的功能,干扰Th细胞蛋白合成或者降低其增殖能力,从而杀死效应性Th细胞。
有临床实验证明,临床确诊的多发性硬化接受雷帕霉素治疗后可明显获益,发作次数和新发核磁增强病灶明显减少,且相对安全[13]。雷帕霉素在自身免疫性神经炎动物模型中同样也发挥重要作用,雷帕霉素可以有效控制自身免疫性神经炎发病初期和高峰期的病情。李振飞[14]研究发现,单用大剂量雷帕霉素及亚临床剂量的阿托伐他汀和雷帕霉素联合应用后可以抑制炎性细胞因子IL-17浸润实验性自身免疫性脑脊髓炎小鼠的中枢神经系统,促进实验性自身免疫性脑脊髓炎小鼠的Treg细胞分化,增加外周Treg细胞的比例,改善实验性自身免疫性脑脊髓炎小鼠病情。
4.2 mTOR信号通路与系统性红斑狼疮 系统性红斑狼疮是一种以B细胞过度激活、T细胞缺陷及大量致病性自身抗体产生,以慢性炎症为特征的系统性自身免疫性疾病,可以侵犯人体任何器官[15]。研究发现狼疮肾炎患者血清和外周单个核细胞中有mTOR的表达,肾脏中有mTOR信号通路的活化[16]。在狼疮鼠自身免疫性疾病发展前肝脏里就有代谢的改变和mTOR的高表达[17]。还发现系统性红斑狼疮患者周围血中T细胞分泌的IL-17增加,Th17渗透到所累及脏器中(包括肾脏)[18],循环中Tregs减少或者功能丧失[19]。低的Treg亚群数量以及大量的Th17细胞可能导致系统性红斑狼疮患者由免疫复合物、自身抗体、炎性细胞因子、激活T细胞而引发的器官损伤。Kato等[20]研究发现,mTORC1 增加了系统性红斑狼疮患者Th17、IL-4及CD4-CD8双重否定T细胞的表达,使IFN-γ表达下降,从而使Tregs的表达受抑制;而雷帕霉素可以使mTORC1的活性受抑制,从而抑制IL-17、IL-4的分泌,增加IFN-γ及CD4+CD25+Foxp3+Tregs的表达,从而逆转了系统性红斑狼疮患者促炎因子的失衡。Andras等[21]发现,在氧化应激情况下,mTOR信号通路激活是系统性红斑狼疮的潜在发病因素,mTOR信号激活引起线粒体超极化,使T细胞出现坏死倾向,促进抗核抗体产生、树突细胞活化及炎症的发生。Stylianou等[22]发现PI3K/AKTmTOR通路的激活对狼疮模型鼠肾炎的发生起重要作用,mTOR抑制剂雷帕霉素不仅可以抑制mTOR下游信号的转导,而且本身可以负调节PI3K/AKT/mTOR通路,雷帕霉素单一治疗可以完全阻止鼠肾炎的发生,显著改善病情。Gu等[23]研究表明,雷帕霉素通过抑制mTOR通路可以减轻狼疮肾炎的临床症状并延长狼疮鼠的存活时间,逆转狼疮鼠和系统性红斑狼疮患者的衰老表型,改善间充质细胞的免疫调节。以上研究均提示,PI3K/Akt/mTOR路径的检测为人类系统性红斑狼疮的发病机制提供了新的视角,雷帕霉素可能成为系统性红斑狼疮的有效治疗药物。
4.3 mTOR信号通路与类风湿关节炎 类风湿性关节炎是一种慢性进展的复杂的炎性自身免疫性疾病,影响全世界约1%的人口。其主要侵犯滑膜组织,增生的滑膜血管翳创造了一个缺氧的炎症环境,诱发血管再生,进一步促进血管翳生长和持续的炎细胞和基质降解酶的释放,引起周围韧带、关节软骨和骨质的破坏,从而形成这种疾病的慢性进展过程,临床上主要表现为功能丧失和关节变形[24]。Kim等[25]证明mTOR活性在类风湿关节炎患者滑膜组织尤其是滑膜破骨细胞中高度活化,PI3K/AKT/mTOR通路对破骨细胞分化和存活起重要作用,抑制该通路可以阻止类风湿关节炎的骨破坏。Malemud[26]发现,直接针对PI3K/AKT/mTOR信号通路的小分子抑制剂对类风湿关节炎有治疗作用。血管生成素1(Ang-1)与类风湿关节炎的血管新生和骨质破坏也有密切关系,Hashiramoto等[27]证明Ang-1通过促分裂原活化蛋白激酶(MAPK)和PI3K/AKT/mTOR通路引起类风湿关节炎的关节破坏。还有学者观察到,在自身免疫性疾病如银屑病、类风湿性关节炎中,IL-22 诱导人类角质细胞和纤维母细胞增生,其作用取决于PI3K/AKT/mTOR信号通路,而mTOR抑制剂雷帕霉素有效的阻止此通路,对自身免疫性疾病起到治疗作用[28]。多项研究显示,PI3K/AKT/mTOR信号通路在类风湿关节炎中起如下作用:PI3K/AKT/mTOR活化可以上调嗜中性粒细胞、巨噬细胞,使肥大细胞脱颗粒,促进T细胞和B细胞的成熟和生存;促进滑膜细胞的增生,增加 IL-17 的产生;相反的,PI3K/AKT/mTOR的激活也引起免疫细胞的增生,促进凋亡。同时,雷帕霉素通过抑制mTOR通路显著降低类风湿关节炎大鼠成纤维样滑膜细胞入侵,这表明,雷帕霉素可以减少由成纤维样滑膜细胞造成的关节破坏及侵蚀性变化[29]。
4.4 mTOR信号通路与其他免疫性疾病 近年来发现,许多肿瘤如乳腺癌、前列腺癌、肺癌中都有mTOR信号通路的调节异常,mTOR抑制剂可以抑制由于该信号通路异常引起的肿瘤的生长、肿瘤血管生成和癌基因的转化。Zhou等[30]研究发现,Ciclopirox olamine(CPX)通过激活AMPK,抑制mTORC1信号发挥抗癌效应而被认为是一种潜在的抗癌剂。但Pool等[31]学者报道,mTOR抑制剂依维莫司可促使胰腺神经内分泌肿瘤大鼠模型发生转移。Ⅰ型糖尿病是由自身反应性T细胞介导的产生胰岛素的胰腺B细胞破坏所致。胰岛素通过激活PI3K/AKT/mTOR途径和抑制依赖Foxo这一自噬关键基因的转录而抑制自噬。研究证明,雷帕霉素既可诱导免疫耐受,发挥免疫抑制作用,又可通过自噬直接破坏胰岛从而加重Ⅰ型糖尿病代谢紊乱和并发症[32],所以实际应用时应权衡利弊。Jiang等[33]研究发现,巨噬细胞mTORC1信号通路中断可以减轻肥胖鼠的炎症反应,并通过阻止HFD-软脂酸诱导的IRE1α/JNK/NF-κB通路激活减轻胰岛素抵抗。另外,还有学者研究发现,mTOR信号通路和银屑病、干燥综合征等自身免疫病的发生发展有关,值得我们进一步深入研究。
[1] Alunno A,Bartoloni E,Bistoni O,etal.Balance between regulatory T and Th17 cells in systemic lupus erythematosus:the old and the new[J].Clin Dev Immunol,2012,2012:823085.
[2] Katholnig K,Linke M,Pham H,etal.Immune responses of macrophages and dendritic cells regulated by mTOR signalling[J].Biochem Soc Trans,2013,41(4):927-933.
[3] Narita M,Young AR,Arakawa S,etal.Spatial coupling of mTOR and autophagy augments secretory phenotypes[J].Science,2011,332(6032):966-970.
[4] Fouqué A,Jean M,van de Weghe P,etal.Review of PI3K/mTOR inhibitors entering clinical trials to treat triple negative breast cancers[J].Recent Pat Anticancer Drug Discov,2016,Epub ahead of print.
[5] Wang NN,Wu RJ,Cheng XH,etal.New insights into mTOR structure and regulation[J].Chin Sci Bull,2014,59(24):2927-2935.
[6] Chong ZZ,Shang YC,Zhang L,etal.Mammalian Target of rapamycin:hitting the bull′s-eye for neurological disorders[J].Oxidative Med Cell Longevity,2010,3(6):374-391.
[7] Agarwal S,Bell CM,Rothbart SB,etal.AMP-activated protein kinase (AMPK) control of mTORC1 is p53- and TSC2-independent in pemetrexed-treated carcinoma cells[J].J Biol Chem,2015,290(46):27473-27486.
[8] Yan HM,Zhou HF,Hu Y,etal.Suppression of experimental arthritis through AMP-activated protein kinase activation and autophagy modulation[J].J Rheum Dis Treat,2015,1(1):5.
[9] Wong M.Mammalian target of rapamycin(mTOR)inhibition as a potential antiepic eptogenic therapy:From tuberous sclerosis to common acquired epilepsies[J].Epilepsia,2010,51(1):27-36.
[10] Laplante M,Sabatini DM.mTOR signaling in growth control and disease[J]. Cell,2012,149(2):274-293.
[11] Battaglia M,Stabilini A,Roncarolo MG.Rapamycin selectively expands CD4tCD25tFoxP3t regulatory T cells[J].Blood,2005,105(12):4743-4748.
[12] Zozulya AL,Wiendl H.The role of regulatory T cells in multiple sclerosis[J].Nat Clin Pract Neurol,2008,4(7):384-398.
[13] Kappos L,Barkhof F,Desmet F,etal.The effect of oral temsirolimus on new magnetic resonance imaging scan lesions,brain atrophy,and the number of relapses inmultiple sclerosis:results from a randomized,controlled,clinical trial[J].Neurol,2005,252Suppl:S46.
[14] 李振飞,陈丽萍,牛小莉,等.阿托伐他汀通过免疫调节作用治疗实验性自身免疫性脑脊髓炎[J].脑与神经疾病杂志,2014,22(2):81-85.
[15] Tsokos GC.Systemic lupus erythematosus[J].N Engl J Med,2011,365(22):2110-2121.
[16] 李玉婷,付 萍.Treg细胞及mTOR信号通路与狼疮性肾炎发病机制的研究进展[J].皮肤病与性病,2016,,3(2):105-108.
[17] Vilà L,Roglans N,Baena M,etal.Metabolic alterations and increased liver mTOR expression precede the development of autoimmune disease in a murine model of lupus erythematosus[J].PLoS One,2012,7(12):e51118.
[18] Wong CK,Lit LC,Tam LS,etal.Hyperproduction of IL-23 and IL-17 in patients with systemic lupus erythematosus:implications for Th17-mediated inflammation in auto-immunity[J].Clin Immunol,2008,127(3):385-393.
[19] Bonelli M,Smolen JS,Scheinecker C.Treg and lupus[J].Ann Rheum Dis,2010,69(suppl 1):i65-i66.
[20] Kato H,Perl A.Mechanistic target of rapamycin complex 1 expands Th17 and IL-4+ CD4-CD8-double-negative T cells and contracts regulatory T cells in systemic lupus erythematosus[J].J Immunol,2014,192(9):4134-4144.
[21] Andras P,Robert H,Lai ZW,etal.Comprehensive metabolome analysis reveal N-acetylcysteine-responsive accumulation of kynurenine in systemic lupus erythematosus:implications for activation of the mechanistic target of rapamycin[J].Metabolomics,2015,11(5):1157-1174.
[22] Stylianou K,Petrakis I,Mavroeidi V,etal.The P13K/Akt/mTOR path-way is activated in murine lupus nephritis and downregulated by rapamycin[J].Nephrol Dial Transplant,2011,26(2):498-508.
[23] Gu Z,Tan W,Ji J,etal.Rapamycin reverses the senescent phenotype and improves immunoregulation of mesenchymal stem cells from MRL/lpr mice and systemic lupus erythematosus patients through inhibition of the mTOR signaling pathway[J].Aging (Albany NY),2016,8(5):1102-1114.
[24] McInnes IB,Schett G.Cytokines in the pathogenesis of rheumatoid arthritis[J].Nat Rev Immunol,2007,7(6):429-442.
[25] Kim TH,Choi SJ,Lee YH,etal.Combined therapeutic application of mTOR inhibitor and vitamin D(3)for in?ammatory bone destruction of rheumatoid arthritis[J].Med Hypotheses,2012,79(6):757-760.
[26] Malemud CJ.The PI3K/Akt/PTEN/mTOR pathway:a fruitful target for inducing cell death in rheumatoid arthritis?[J].Future Med Chem,2015,7(9):1137-1147.
[27] Hashiramoto A,Sakai C,Yoshida K,etal.Angiopoietin 1 directly induces destruction of the rheumatoid joint by cooperative,but independent,signaling via ERK/MAPK and phosphatidylinositol 3-kinase/Akt[J].Arthritis Rheum,2007,56(7):2170-2179.
[28] Mitra A,Raychaudhuri SK,Raychaudhuri SP.IL-22 induced cell proliferation is regulated by PI3K/Akt/mTOR signaling cascade[J].Cytokine,2012,60(1):38-42.
[29] Laragione T,Gulko PS.mTOR regulates the invasive properties of synovial fibroblasts in rheumatoid arthritis[J].Mol Med,2010,16(9-10):352-358.
[30] Zhou H,Shang C,Wang M,etal.Ciclopirox Olamine inhibits mTORC1 signaling by activation of AMPK[J].Biochem Pharmacol,2016,S0006-2952(16):30170-30178.
[31] Pool SE,Bison S,Koelewijn SJ,etal.mTOR inhibitor RAD001 promotes metastasis in a rat model of pancreatic neuroendocrine cancer[J].Cancer Res,2013,73(1):12-18.
[32] Zdychová J1,Kazdová L,Pelikanová T,etal.Renal activity of Akt kinase in obese Zuckerrats[J].Exp Biol Med,2008,233(10):1231-1241.
[33] Jiang H,Westerterp M,Wang C,etal.Macrophage mTORC1 disruption reduces inflammation and insulin resistance in obese mice[J].Diabetologia,2014,57(11):2393-2404.
[收稿2016-04-10 修回2016-08-02]
(编辑 张晓舟)
10.3969/j.issn.1000-484X.2017.02.030
①本文受河北省科学技术研究与发展计划项目(10206128D)资助。
白艳梅(1990年-),女,在读硕士,主要从事神经免疫与脱髓鞘疾病研究,E-mail: abaiyanmei@163.com。
及指导教师:高 娟(1972年-),女,博士,主任医师,主要从事神经免疫与脱髓鞘疾病研究,E-mail:gaojuzhulia@163.com。
R393
A
1000-484X(2017)02-0301-04
②天津医科大学总医院康复医学科,天津300052。
③天津医科大学,天津300052。
④河北大学附属医院,保定071000。
