黄芩素和U0126体外抗人乳腺癌的作用及机制研究①
2017-02-27安宏元向川南喻小兰唐小平张宇骄夏纪毅
安宏元 向川南 喻小兰 唐小平 张宇骄 夏纪毅⑤
(四川省泸州市人民医院乳腺外科,泸州646000)
·中医中药与免疫·
黄芩素和U0126体外抗人乳腺癌的作用及机制研究①
安宏元 向川南 喻小兰②唐小平③张宇骄④夏纪毅③⑤
(四川省泸州市人民医院乳腺外科,泸州646000)
目的:探讨黄芩素和U0126体外对乳腺癌的作用及其机制。方法:用黄芩素、U0126单独处理以及二者联合处理人乳腺癌细胞株MCF-7细胞,采用CCK8检测细胞增殖变化;流式细胞术检测MCF-7细胞周期以及凋亡变化;显微镜观察细胞数量变化; TUNEL法检测细胞凋亡改变;划痕实验分析细胞迁移情况; Western blot实验检测细胞凋亡相关因子的蛋白水平变化,分析黄芩素与U0126对乳腺癌细胞的增殖、凋亡和迁移的影响。结果:黄芩素或U0126可抑制细胞的增殖且具有浓度依赖性(P<0.05);黄芩素阻滞MCF-7细胞周期进入S期,增加G0~G1期细胞比例(P<0.05),降低S期细胞比例(P<0.05),诱导细胞凋亡(P<0.05);降低ERK1/2和JNK蛋白的磷酸化水平和CyclinD1的蛋白水平表达;黄芩素与U0126联合处理MCF-7细胞,与黄芩素单独处理组相比较,S期细胞比例明显降低(P<0.05),细胞凋亡更加明显(P<0.05), ERK1/2和JNK的磷酸化水平(P<0.05)、CyclinD1的蛋白表达量降低更加明显(P<0.05);同时黄芩素可有效抑制人乳腺癌细胞株MCF-7细胞的迁移(P<0.05)。结论:黄芩素和U0126通过降低ERK1/2、JNK的磷酸化水平表达,降低CyclinD1的水平表达,有效抑制MCF-7细胞增殖和迁移,诱导MCF-7细胞凋亡并且二者具有协同作用。因此,黄芩素和U0126联合有望用于临床治疗乳腺癌。
黄芩素;U0126;人乳腺癌细胞株MCF-7;凋亡;迁移
乳腺癌是当前社会的重大公共卫生问题,严重威胁着女性身心健康[1]。乳腺癌的增殖、凋亡和转移受多种信号通路的调控,如CyclinD1、ERK1/2和JNK等[2]。ERK1/2和JNK是有丝分裂原激活的蛋白激酶(MAPK)家族的重要成员,二者可被多种蛋白激酶磷酸化并活化,然后进入细胞核,缩短G1期,促进细胞提前进入S期,介导细胞增殖失控、凋亡和恶性转移[3]。
黄芩素是黄芩中具有活性的黄酮类化合物,具有抗菌消炎和抗感染的功效。目前,已有研究报道,黄芩素抑制部分癌症细胞的转移,如宫颈癌、肺癌和前列腺癌等[4-6],具有良好的临床应用前景,但其在乳腺癌中的作用效果还知之甚少[7]。U0126是ERK1/2的特异性抑制剂[8],可抑制与癌症细胞增殖和转移相关的信号通路活性,与黄芩素等中药联合使用具有协同效应,有望在临床上得到广泛应用[9]。
乳腺癌细胞增殖失控和恶性转移是其致死的重要原因之一,人乳腺癌细胞株MCF-7具有低侵袭、低转移能力,为体外研究中西药对乳腺癌转移的影响提供了很好的细胞模型[10]。抑制乳腺癌细胞恶性增殖和转移,促进癌细胞凋亡是治疗乳腺癌的重要策略之一,因此本研究主要探讨黄芩素和U0126对MCF-7增殖、凋亡和转移的影响以及相关的分子机制。
1 材料与方法
1.1 细胞株与试剂 人乳腺癌细胞株MCF-7购于上海肯强仪器有限公司;RPMI1640(美国Gibco公司)胎牛血清购于杭州四季青公司;青霉素和链霉素购于北京索莱宝公司;胰酶购于华美公司;黄芩素购于普瑞法科技有限公司;抑制剂U0126购于碧云天生物科技有限公司;TUNEL试剂盒购于ROCHE公司;小鼠抗人GAPDH内参、辣根过氧化物酶标记羊抗小鼠IgG及辣根过氧化物酶标记羊抗兔IgG 购于碧云天生物科技公司;CyclinD1、ERK1/2、JNK引物均由上海生工合成;兔抗人CyclinD1抗体、兔抗人ERK1/2抗体、兔抗人P-ERK1/2抗体、兔抗人JNK抗体及兔抗人P-JNK抗体均购于CST公司。
1.2 方法
1.2.1 细胞培养 人乳腺癌细胞株MCF-7由上海肯强科技有限公司提供,采用RPMI1640(含有10%胎牛血清、100 U/ml青霉素和100 U/ml链霉素)培养液培养。培养条件:37℃,5%CO2的培养箱。
1.2.2 CCK8检测细胞增殖 对数生长期细胞制备细胞悬液,将100 μl 含2×104ml-1的MCF-7细胞悬液接种至96孔板中,贴壁后,按照不同浓度加入0、1、2、5、10、20、50、100、200、300 μmol/L的黄芩素和按照使用说明书给出的适用范围分别加入0、2、5、10、20 μmol/L的U0126,同时设置空白对照以及DMSO对照组, 37℃培养4 h;加入10 μl CCK8,混匀,培养4 h,生成Formazan,测定450nm吸光度(OD值)。设定空白对照1:在不含细胞的培养基中加入CCK8,测定450nm的吸光度(OD值),空白对照2:在不含细胞加入黄芩素或U0126的培养基中加入CCK8,测定450nm的吸光度,实验重复3次。
1.2.3 流式细胞术检测细胞周期以及细胞凋亡情况 将1 ml 1.25×105ml-1的MCF-7细胞接种至12孔板,贴壁后,用黄芩素、U0126及黄芩素联合U0126处理细胞24 h,收集细胞,室温PBS洗涤两次,加入1 ml 70%预冷乙醇固定,过夜,离心去除乙醇;PBS重悬,加入RNase至终浓度为100 mg/L, 37℃水浴30 min,加入PI染色液至终浓度为50 mg/L,4℃避光染色3 min,用488nm的激发波长检测细胞周期分布。用细胞周期拟合软件进行分析结果,记录亚二倍体峰,即凋亡细胞峰sub-G1期、G0/G1期、S期、G2/M期细胞比例。检测早期凋亡和晚期凋亡按照相关的试剂盒步骤进行操作。结果采用CellQuest软件进行分析。实验重复3次。
1.2.4 细胞显微摄影检测细胞数量变化 分别加入0、1、2、5、10、20、50、100、200、300 μmol/L黄芩素处理MCF-7细胞24 h,低倍镜下观察黄芩素对MCF-7细胞的数量变化。
1.2.5 TUNEL法检测细胞凋亡 MCF-7细胞经10 μmol/L黄芩素及10 μmol/L U0126处理24 h后,移除培养液,PBS漂洗2遍,4%PFA室温固定10 min,PBS漂洗2遍,3%过氧化氢浸泡10 min,抑制内源性过氧化氢酶,PBS漂洗2遍,蛋白酶室温孵育30 min,PBS洗2遍,加入50 μl TUNEL反应液,室温湿盒中孵育1 h,PBS洗3遍,加convert-POD,室温30 min后,PBS再漂洗3遍,DAB显色,苏木素复染,梯度酒精脱水后中性树胶封片,显微镜下摄片分析结果。
1.2.6 Western blot检测增殖和凋亡相关蛋白水平 20 μmol/L黄芩素和10 μmol/L U0126处理MCF-7细胞后,用4℃预冷的PBS冲洗细胞2次,离心去上清,加入含5%蛋白酶抑制剂的裂解液(RIPA强),置冰上裂解30 min,转移蛋白液至已标记的Eppendorf管中,超声破碎后,10 000 r/min离心后取上清液,沸水变性5 min后,降至室温,-20℃保存备用。取5 μl蛋白进行10%SDS-PAGE电泳,转膜到0.2 μmol/L PVDF膜上,5%脱脂奶粉的1×TBST封闭1 h,去除封闭液,PBS漂洗2次,10 min/次。一抗(ERK1/2稀释比例为1∶1 000,P-ERK1/2稀释比例为1∶800,JNK稀释比例为1∶1 000,P-JNK稀释比例为1∶800,CyclinD1稀释比例为1∶700,GAPDH稀释比例为1∶2 000)4℃孵育过夜。1×TBST漂洗3次,10 min/次,HRP羊抗小鼠IgG及HRP羊抗兔IgG(二抗稀释比例均为1∶2 000)室温孵育1 h,1×TBST漂洗3次,10 min/次,BIO-RAD凝胶成像仪成像后,Quantity one软件进行平均光密度值(Mean optical dengsity,MOD)分析,计算相关因子蛋白水平表达,实验重复3次。
1.2.7 划痕实验检测MCF-7细胞迁移 将0.5 ml 5×105个/ml的MCF-7细胞接种于24孔板,培养24 h后,形成单层细胞。用10 μl移液枪头在单层细胞上呈“一”字划痕,用PBS洗3遍,然后加入所需的黄芩素或U0126,每组处理平行3个样本。培养24 h后,显微镜下观察黄芩素或U0126对MCF-7细胞迁移的影响。
2 结果
2.1 黄芩素或U0126抑制人乳腺癌细胞株MCF-7
细胞增殖 MCF-7细胞经不同浓度的黄芩素、U0126处理24 h后,CCK8实验结果表明,黄芩素或U0126可显著抑制MCF-7细胞增殖且具有浓度依赖性(P<0.05),见图1。
2.2 黄芩素或U0126阻滞人乳腺癌细胞株MCF-7细胞周期 与空白对照组和DMSO对照组相比,人乳腺癌细胞株MCF-7经20 μmol/L黄芩素处理24 h后,G0~G1期细胞比例明显增多(P<0.05,图2),S期细胞比例明显下降(P<0.05,图2),采用20 μmol/L黄芩素与10 μmol/L U0126联合处理MCF-7细胞24 h后,S期细胞比例明显降低(P<0.05,图2)。此研究结果表明,黄芩素可显著增加MCF-7细胞G1期细胞比例,降低S期细胞比例,U0126可显著降低S期细胞比例。
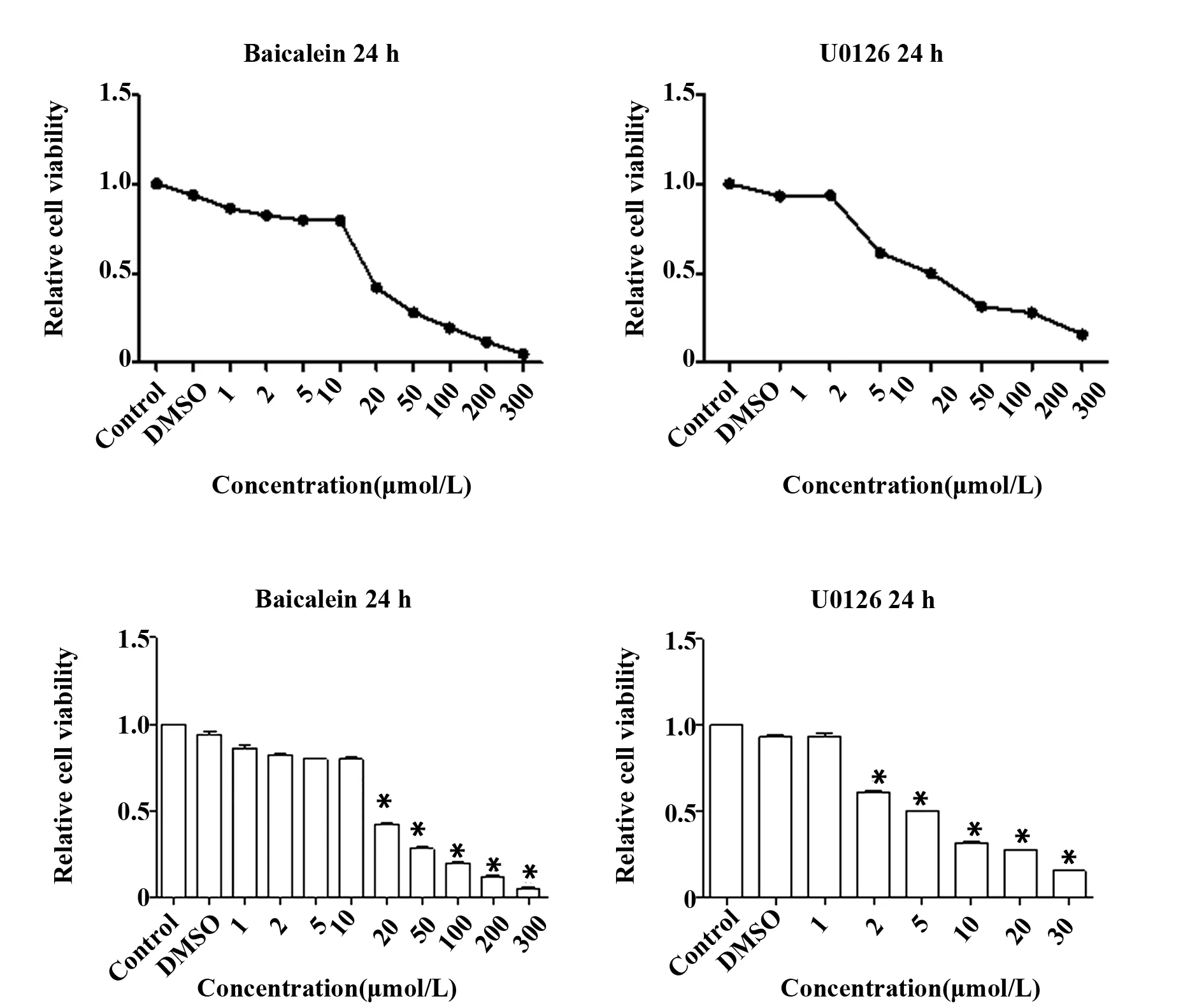
图1 黄芩素或U0126抑制人乳腺癌细胞株MCF-7细胞增殖Fig.1 Baicalein or U0126 inhibited human breast cancer cell line MCF-7Note: *.P<0.05 vs control.

图2 黄芩素或U0126阻滞人乳腺癌细胞株MCF-7细胞周期Fig.2 Effect of Baicalein or U0126 on cell cycle of MCF-7Note: 1.Control;2.DMSO;3.Baicalein-20 μmol/L;4.20 μmol/L-baicalein+10 μmol/L-U0126;*.P<0.05 vs 1.
2.3 黄芩素或U0126诱导人乳腺癌细胞株MCF-7细胞凋亡 为进一步探讨黄芩素和U0126联合抗乳腺癌的作用,我们镜下观察黄芩素/U0126对乳腺癌细胞凋亡的影响。与空白对照组和DMSO组相比,不同浓度黄芩素处理MCF-7细胞24 h后, MCF-7细胞数量明显减少,且随着使用黄芩素浓度越高,乳腺癌细胞的数量减少越明显(图3)。
2.4 TUNEL法检测黄芩素或U0126诱导人乳腺癌细胞株MCF-7细胞凋亡 与空白对照组和DMSO组相比,TUNEL实验结果表明人乳腺癌细胞株MCF-7经20 μmol/L黄芩素单独处理24 h后,细胞凋亡现象明显(P<0.05),MCF-7经20 μmol/L黄芩素和10 μmol/L U0126联合处理后,细胞凋亡现象更明显(P<0.05)(图4)。
2.5 黄芩素或U0126对MCF-7早期凋亡和晚期凋亡的影响 为进一步确认黄芩素/U0126影响细胞凋亡的具体过程,我们利用流式细胞术检测 MCF-7细胞经20 μmol/L黄芩素单独处理24 h后,MCF-7细胞的早期凋亡和晚期凋亡情况,结果显示黄芩素处理MCF-7细胞组与空白组或者DMSO组相比,早期凋亡和晚期凋亡均显著增多(P<0.05),MCF-7细胞经20 μmol/L黄芩素和10 μmol/L U0126联合处理后,与两者单独处理组相比,早期凋亡和晚期凋亡均显著增多(P<0.05)。此研究结果表明,黄芩素和U0126均可诱导人乳腺癌细胞株MCF-7早期凋亡和晚期凋亡,且二者具有协同效应(图5)。
2.6 划痕实验检测黄芩素对人乳腺癌细胞株MCF-7细胞迁移的影响 与空白对照组和DMSO组相比,人乳腺癌细胞株MCF-7经20 μmol/L黄芩素处理0、1、3和6 h后,划痕实验表明,细胞迁移距离受到明显抑制(P<0.05)。此研究结果表明,黄芩素可显著抑制人乳腺癌细胞株MCF-7迁移能力(图6)。
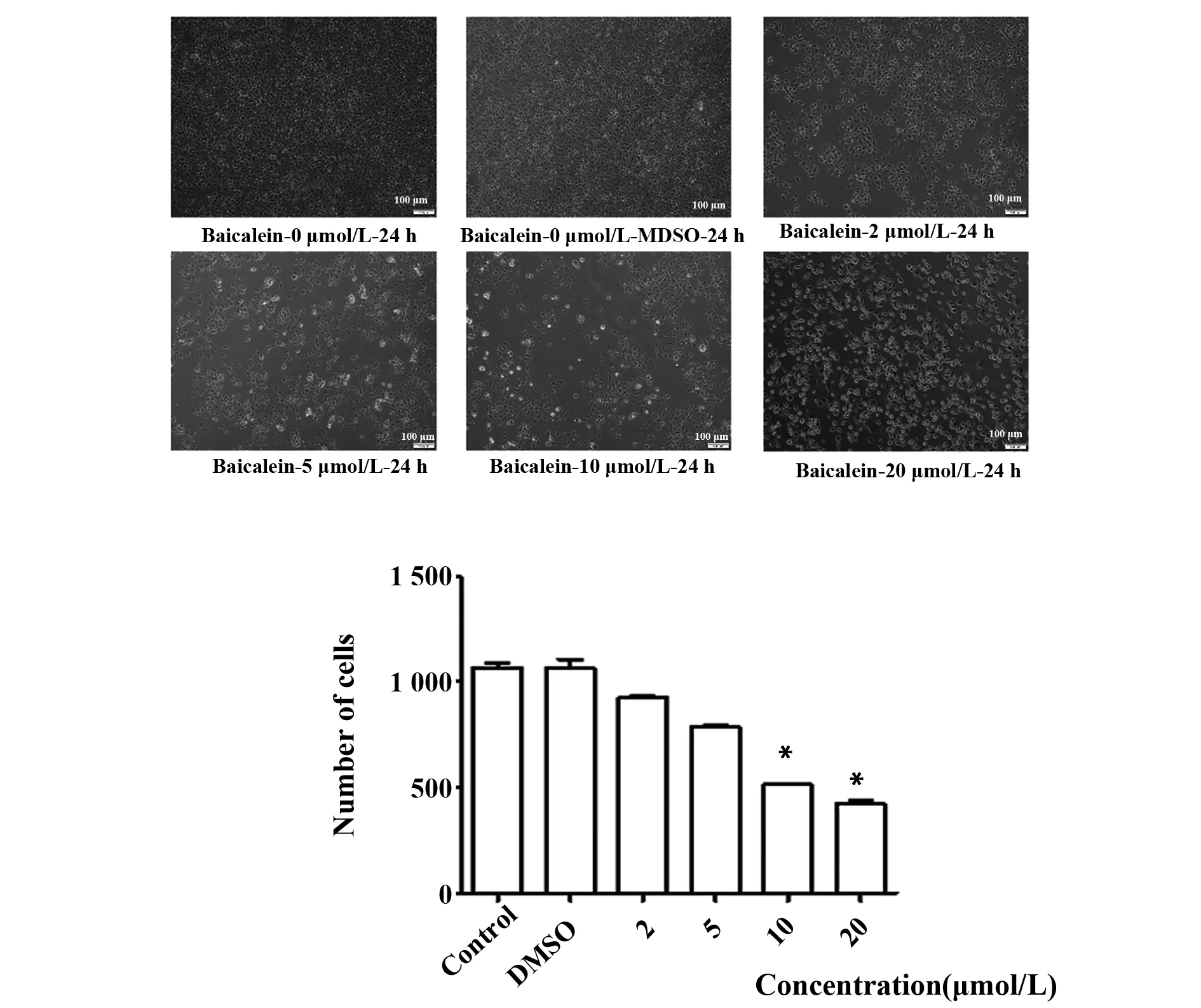
图3 黄芩素诱导人乳腺癌细胞株MCF-7细胞数量减少Fig.3 Effect of Baicalein on number of MCF-7 cells in human breast cancer cell lineNote: *.P<0.05 vs control.

图4 黄芩素或U0126诱导人乳腺癌细胞株MCF-7细胞凋亡Fig.4 Baicalein or U0126 induced MCF-7 apoptosis in human breast cancer cell lineNote: 1.Control;2.DMSO;3.Baicalein-20 μmol/L-24 h;4.Baicalein-20 μmol/L+U0126-10 μmol/L;*.P<0.05 vs 1.
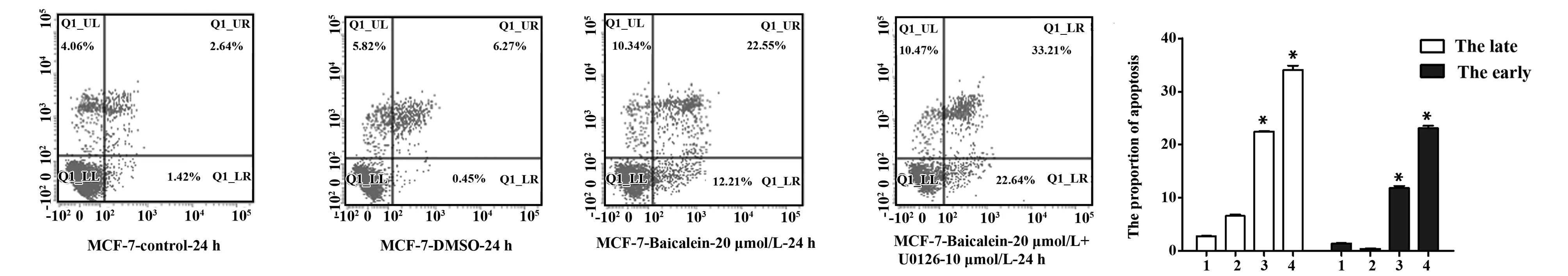
图5 黄芩素或U0126对MCF-7早期凋亡和晚期凋亡的影响Fig.5 Effect of baicalein or U0126 on early apoptosis and late apoptosis of MCF-7Note: 1.Control;2.DMSO;3.Baicalein-20 μmol/L-24 h;4.Baicalein-20 μmol/L+U0126-10 μmol/L;*.P<0.05 vs 1.
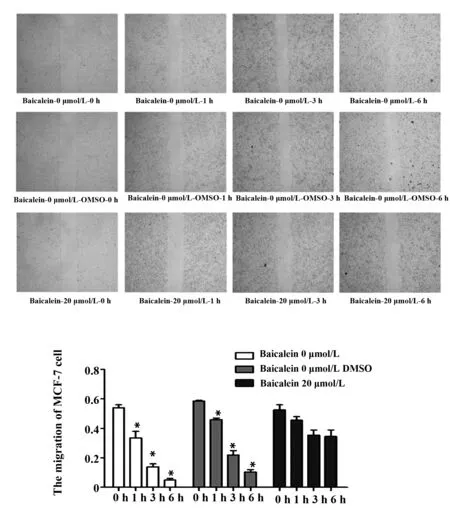
图6 黄芩素对人乳腺癌细胞株MCF-7细胞迁移的影响Fig.6 Effect of baicalein on migration of MCF-7 cells in human breast cancer cell lineNote: *.P<0.05 vs baicalein 0 μmol/L.
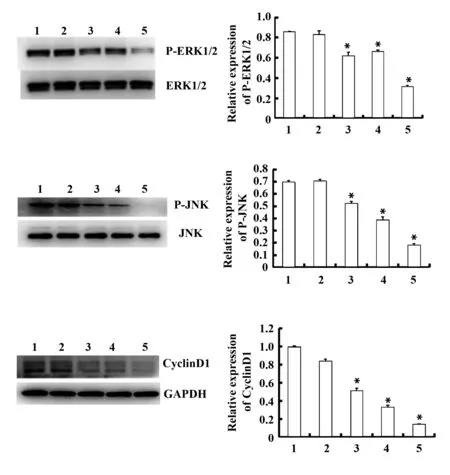
图7 黄芩素或U0126降低MCF-7凋亡抑制蛋白活性及表达水平Fig.7 Effect of baicalein or U0126 on inhibition of MCF-7 apoptosis and expression level in human breast cancer cell lineNote: 1.Control;2.Control+DMSO;3.Baicalein-20 μmol/L;4.U0126-10 μmol/L;5.Baicalein-20 μmol/L+U0126-10 μmol/L;*.P<0.05 vs 1.
2.7 黄芩素/U0126体外抗乳腺癌的分子机制 为探讨黄芩素与U0126抑制MCF-7细胞增殖的分子机制,我们利用Western blot检测 ERK1/2、JNK蛋白的磷酸化情况,利用Real-time PCR和Western blot 检测周期、增殖相关的蛋白CyclinD1表达水平,结果显示,与对照组以及黄芩素/U0126单独处理MCF-7细胞组相比,黄芩素与U0126联合作用MCF-7细胞24 h可以明显降低ERK1/2、JNK蛋白的磷酸化水平以及CyclinD1的mRNA和蛋白水平(图7)。
3 讨论
乳腺癌在乳腺疾病中是常见的恶性肿瘤,致死率较高。乳腺癌的恶性增殖、凋亡以及迁移是多基因参与的、复杂的病理学过程,因此探究乳腺癌的增殖、凋亡和迁移的分子机制,寻找乳腺癌的新疗法具有重要意义。
黄芩素和U0126具有明显的抗癌作用,前期研究表明黄芩素作为一种中药,通过增加凋亡相关蛋白Bax表达,抑制CDC2激酶活性等多种途径抑制肿瘤细胞增殖、诱导细胞凋亡[11]。U0126通过特异性抑制ERK信号通路活性诱导细胞凋亡[8]。我们的研究表明黄芩素/U0126可以抑制乳腺癌细胞MCF-7细胞株的增殖并诱导细胞凋亡且具有浓度依赖性,二者联合使用组,相对于单独使用组,诱导乳腺癌细胞凋亡的作用更加显著。
已有研究报道,高转移倾向乳腺癌细胞和组织中,ERK1/2的表达水平和磷酸化水平增高[12]。ERK1/2的磷酸化激活是细胞周期进入S期的关键,它促进细胞由G1期向S期转化,从而促进细胞增殖[13]。CyclinD1是经典Wnt/β-catenin信号通路的下游靶基因,可促进细胞进入S期,Halleskog等[14]报道ERK1/2可促进β-catenin进入细胞核,从而调控CyclinD1的表达,进而影响乳腺癌细胞生长和细胞周期改变。这与本研究实验结果一致:黄芩素/U0126可以降低ERK1/2和JNK的磷酸化水平,进一步调控其信号通路下游分子CyclinD1,降低其表达水平。CyclinD1作为周期相关蛋白,表达量降低阻滞细胞进入S期,从而导致S期细胞所占比例降低同时G1期细胞增多。
促进癌细胞凋亡是治疗癌症的策略之一。Bcl-2家族蛋白由抑制细胞凋亡蛋白(Bcl-2、Bcl-x/L)和促进细胞凋亡蛋白(Bax、Bad等)组成,两者相互作用调控细胞凋亡[15]。已有研究报道,ERK激酶活化后可调节线粒体途径引起的凋亡[16]。本研究结果表明:不同浓度的黄芩素和U0126处理MCF-7细胞后,降低ERK1/2和JNK的磷酸化水平,促进癌细胞凋亡,包括早期凋亡和晚期凋亡。
癌症恶性转移是导致高致死率的重要原因,乳腺癌最常发生转移的部位有骨转移(肋骨、胸骨等)、肺及胸膜转移、肝转移和脑转移[17]。目前,已经研制了多种癌症抗转移药物,如血小板凝集抑制剂、血管生成抑制因子、内皮稳定因子、干扰素-α和其他化学药物[18],但由于药物的局限性,寻找新型抗转移的药物是十分必要的。黄芩素联合小分子抑制剂U0126可以显著抑制乳腺癌细胞MCF-7的迁移作用,这为二者在临床使用提供重要的理论依据。
综上所述,黄芩素和U0126可通过调控ERK1/2和JNK信号通路,显著抑制人乳腺癌细胞株MCF-7增殖、凋亡和转移,因此二者有望用于乳腺癌临床治疗。
[1] Venkatesan P.Internal mammary node irradiation and breast cancer survival[J].Lancet Oncol,2016,17(1):e9.
[2] Ventura C,Venturino A,Miret N,etal.Chlorpyrifos inhibits cell proliferation through ERK1/2 phosphorylation in breast cancer cell lines[J].Chemosphere,2015,120:343-450.
[3] Castro AF,Campos T,Babcock JT,etal.M-Ras induces Ral and JNK activation to regulate MEK/ERK-independent gene expression in MCF-7 breast cancer cells[J].J Cell Biochem,2012,113(4):1253-1264.
[4] 卢科莲,喻小兰,夏纪毅,等.黄芩素对宫颈癌Hela细胞增殖的抑制作用及机制探讨[J].山东医药,2014,54(27):4-7.
[5] 李现东.汉黄芩素对肺癌细胞株 A549 的体外作用研究[J].重庆医科大学学报,2011,36(7):790-793.
[6] 阮兴举,刘玉娥,郑政隆,等.姜黄素对前列腺癌 PC3 细胞的增殖和凋亡的研究[J].成都中医药大学学报,2013,36(1):65-66.
[7] Chang HT,Chou CT,Kuo DH,etal.The Mechanism of Ca(2+) movement in the involvement of baicalein-induced cytotoxicity in ZR-75-1 human breast cancer cells[J].J Nat Prod,2015,78(7):1624-1634.
[8] Zhang C,Li L,Zhao B,etal.Ghrelin protects against dexamethasone-induced INS-1 cell apoptosis via ERK and p38MAPK signaling[J].Int J Endocrinol,2016,2016:4513051.
[9] Rose HM,Stuiver M,Thongwichian R,etal.Quantitative NMR analysis of Erk activity and inhibition by U0126 in a panel of patient-derived colorectal cancer cell lines[J].Biochim Biophys Acta,2013,1834(7):1396-1401.
[10] Zhou N,Zhang Y,Zhang X,etal.Exposure of tumor-associated macrophages to apoptotic MCF-7 cells promotes breast cancer growth and metastasis[J].Int J Mol Sci,2015,16(6):11966-11982.
[11] Peng Y,Guo C,Yang Y,etal.Baicalein induces apoptosis of human cervical cancer HeLa cells in vitro[J].Mol Med Rep,2015,11(3):2129-2134.
[12] Targowska-Duda KM,Wnorowski A,Budzynska B,etal.The positive allosteric modulator of alpha7 nicotinic acetylcholine receptors,3-furan-2-yl-N-p-tolyl-acrylamide,enhances memory processes and stimulates ERK1/2 phosphorylation in mice[J].Behav Brain Res,2016,302:142-151.
[13] de Tomaso Portaz AC,Caimi GR,Sánchez M,etal.Hexachlorob-enzene induces cell proliferation,and aryl hydrocarbon receptor expression (AhR) in rat liver preneoplastic foci,and in the human hepatoma cell line HepG2.AhR is a mediator of ERK1/2 signaling,and cell cycle regulation in HCB-treated HepG2 cells[J].Toxicology,2015,336:36-47.
[14] Halleskog C,Schulte G.Pertussis toxin-sensitive heterotrimeric G(alphai/o) proteins mediate WNT/beta-catenin and WNT/ERK1/2 signaling in mouse primary microglia stimulated with purified WNT-3A[J].Cell Signal,2013,25(4):822-828.
[15] Groe L,Wurm CA,Brüser C,etal.Bax assembles into large ring-like structures remodeling the mitochondrial outer membrane in apoptosis[J].EMBO J,2016,35(4):402-413.
[16] Yang F,Tang XY,Liu H,etal.Inhibition of mitogen-activated protein kinase signaling pathway sensitizes breast cancer cells to endoplasmic reticulum stress-induced apoptosis[J].Oncol Rep,2016,35(4):2113-2120.
[17] Sharma B,Varney ML,Saxena S,etal.Induction of CXCR2 ligands,stem cell-like phenotype,and metastasis in chemotherapy-resistant breast cancer cells[J].Cancer Lett,2016,372(2):192-200.
[18] Bartkowiak K,Kwiatkowski M,Buck F,etal.Disse minated tumor cells persist in the bone marrow of breast cancer patients through sustained activation of the unfolded protein response[J].Cancer Res,2015,75(24):5367-5377.
[收稿2016-08-08]
(编辑 倪 鹏)
Anti-cancer by baicalein combined with U0126 on human breast cancer in vitro
ANHong-Yuan,XIANGChuan-Nan,YUXiao-Lan,TANGXiao-Ping,ZHANGYu-Jiao,XIAJi-Yi.
TheDepartmentofBreastSurgery,SichuanProvinceLuzhouPeople′sHospital,Luzhou646000,China
Objective:To investigate the effects and mechanisms of anti-cancer by bacailein combined with U0126 on human breast cancer in vitro.Methods: The human breast cancer cell line MCF-7 was treated by baicalein,U0126 and baicalein combined with U0126 respectively.CCK8 assay measured cell proliferation of MCF-7;flow cytometry tested the cell cycle and apoptosis of MCF-7;microscopy observed the amount;TUNEL assay evaluated the apoptosis of MCF-7;Western blot detected the protein level of proliferation and apoptosis related protein;scratch assay measured the ability of migration.Results: Human breast cancer cell line MCF-7 was treated by baicalein or U0126 at different concentration for 24 h,CCK8 assay suggested that both of them can dramatically inhibit MCF-7 proliferation in a dose-dependent way (P<0.05).Compared to the blank and DMSO groups,the human breast cancer cell line MCF-7 was treated with baicalein for 24 h,the cellular rate at G0-G1 phase increased a lot (91%) (P<0.05),while the cellular rate at S phase reduced dramatically (P<0.05),cell apoptosis increased dramatically by microscopy and TUNEL assay(P<0.05),the level of ERK1/2,CyclinD1 and JNK reduced quickly (P<0.05).Compared to the baicalein group,MCF-7 was treated by baicalein combined with U0126,the cellular rate at S phase decreased remarkably (P<0.05),apoptosis was much obvious (P<0.05),the phosphorylation level of ERK1/2 and JNK reduced a lot (P<0.05),and the proliferation accelerator CyclinD1 highly decreased (P<0.05);the scratch assay demonstrated that cell migration was dramatically inhibited when MCF-7 was treated by 20 μmol/L baicalein(P<0.05).Conclusion: Both of baicalein and U0126 can inhibit the proliferation and migration,induce the apoptosis of human breast cancer cell line MCF-7 through decreasing the level of ERK,JNK and CyclinD1.Baicalein and U0126 can provide some novel avenues to treat breast cancer in clinic.
Baicalein;U0126;Human breast cancer cell line MCF-7;Apoptosis
安宏元(1985年-),女,在读硕士,医师,主要从事乳腺癌的机制研究。
及指导教师:夏纪毅(1979年-),男,硕士,高级实验师,主要从事肿瘤的分子机制研究,E-mail:xjyi0615@163.com。
R73
A
1000-484X(2017)02-0206-06
①本文为四川省科技厅项目(14JC01353-LH67)和四川省泸州市科技局项目(2014-S-44)。
②西南医科大学附属中医医院妇产科,泸州646000。
③西南医科大学附属医学实验中心,泸州646000。
④西南医科大学附属医院妇产科,泸州646000。
⑤西南医科大学信息与工程学院现代教育技术中心,泸州646000。