布鲁氏菌病患者血清sTim-3/HMGB1水平及外周血单个核细胞产生TGF-β斑点形成细胞的变化①
2017-02-27朱玥洁胡金伟甫拉提热西提张峰波丁剑冰
庞 盼 朱玥洁 胡金伟 贾 斌 甫拉提·热西提 张峰波 丁剑冰
(新疆医科大学第一附属医院检验科,乌鲁木齐830011)
·临床免疫学·
布鲁氏菌病患者血清sTim-3/HMGB1水平及外周血单个核细胞产生TGF-β斑点形成细胞的变化①
庞 盼 朱玥洁②胡金伟 贾 斌 甫拉提·热西提③张峰波 丁剑冰
(新疆医科大学第一附属医院检验科,乌鲁木齐830011)
目的:探讨布鲁氏菌病患者体内可溶性T细胞免疫球蛋白黏蛋白分子3(sTim-3)、高迁移率族蛋白1(HMGB1)和转化生长因子-β(TGF-β)的变化特点,分析这些变化与布鲁氏菌感染的关联性。方法:28例未经治疗布鲁氏菌病患者为布病病例组,28例在年龄和性别上与布病病例组匹配的健康人为对照组,采用ELISA法检测了布病病例组和对照组血清中sTim-3和HMGB1的水平,通过ELISPOT法检测了这些患者外周血单个核细胞(PBMC)经布鲁氏菌抗原刺激产生TGF-β的斑点形成细胞(SFC)。结果:与正常对照组相比,布鲁氏菌病患者血清中sTim-3和HMGB1水平及PBMC中产生TGF-β的SFC均明显增高(P<0.01);产生TGF-β的SFC与血清HMGB1水平呈正相关性(P<0.05)。结论:布鲁氏菌病患者血清中sTim-3和HMGB1升高,且在布鲁氏菌抗原刺激后PBMC中产生TGF-β的SFC亦升高,这些分子可能参与了布鲁氏菌感染发生发展的过程,并与免疫逃避有关。
sTim-3;HMGB1;TGF-β;布鲁氏菌病
布鲁氏菌病(Brucellosis)简称布病,是由布鲁氏菌(Brucella)感染引起的最常见的人畜共患传染病[1-3]。全球每年大约50多万例新发布病患者[4],以青壮年男性居多,高发于以畜牧业基地为主的农牧区[5]。人主要通过接触感染的动物或被污染的肉、奶制品等经皮肤和消化道等不同途径感染布鲁氏菌[6]。该菌侵入机体后被吞噬细胞吞噬,成为胞内寄生菌,到淋巴结繁殖形成感染灶;突破淋巴结进入血循环形成菌血症,表现为发热。该菌随后又侵入宿主肝、脾和骨髓等器官,发热消退,在寄生的脏器中大量繁殖,再次入血形成菌血症而致体温升高,如此反复,形成临床上的波浪热,伴随关节痛和全身乏力等症状。
共抑制分子Tim-3(T-cell immunoglobulin and mucin domain-containing protein-3,Tim-3)主要表达于CD4+辅助性T1细胞(T helper 1,Th1)和CD8+细胞毒性T细胞(Cytotoxic lymphocyte,TCL)、调节性T细胞、自然杀伤细胞(Natural killer cell,NK)和树突状细胞(Dendritic cells,DCs)的表面,通过与其配体半乳凝素9(Gal-9)结合,抑制T细胞活化和增殖,从而负性调控机体的免疫应答[7]。可溶性Tim-3(soluble Tim-3,sTim-3)是膜型Tim-3的可溶性分子;作为共抑制分子,同样在T细胞介导的免疫应答和细胞凋亡中起重要作用[8,9]。文献报道已证实,膜型Tim-3和可溶性Tim-3的高表达在机体慢性病毒感染、肿瘤免疫逃逸等的发生发展中均扮演重要角色[10-12]。可作为T细胞功能耗竭的主要标志分子之一。HMGB1(High mobility group box 1,HMGB1)是sTim-3的配体,也是重要的促炎细胞因子,可诱导机体产生多种细胞因子、趋化因子和活性氧等,进而导致炎症或细胞组织损伤[13]。sTim-3/HMGB1的相互作用可抑制核酸介导的固有免疫应答,导致肿瘤发生[14,15]。然而,sTim-3/HMGB1在布病患者中的表达变化目前并不清楚,因此很有必要了解布病患者血清中的sTim-3及其配体HMGB1的变化特点,分析sTim-3/HMGB1与布病的关系,为布病治疗提供新的靶点。
1 资料与方法
1.1 资料 收集2015年2月至2016年1月在新疆医科大学第一附属医院感染科就诊的28例未治疗且已明确诊断的布病患者,年龄为24~58岁,中位年龄为38岁,其中男性患者19例,女性患者9例。布病的诊断标准按照布鲁氏菌病诊断标准(WS268-2007),临床表现为发热、骨关节痛、全身乏力等,采用虎红平板凝集试验进行初筛,阳性者进一步采用试管凝集试验检测血清中抗布鲁氏菌特异性抗体,滴度≥1∶50为阳性。选取28例同期体检的健康人群作为正常对照组,年龄和性别均与病例组匹配。所有对照及患者均签署知情同意书,本研究经新疆医科大学第一附属医院医学伦理委员会批准(20150225-94)。
1.2 方法
1.2.1 血清sTim-3和HMGB1的检测 采用酶联免疫吸附试验(ELISA)检测布病患者组和正常对照组血清中sTim-3及HMGB1的含量,将收集到的28例布病患者组与28例正常对照组血清置-80℃的冰箱中保存备用。人sTim-3 ELISA 试剂盒和人HMGB1 ELISA 试剂盒均购自武汉贝茵莱生物科技有限公司,检测的操作严格按照试剂盒中说明书进行。将sTim-3及HMGB1标准品梯度稀释后制作标准曲线各浓度,空白调零,以吸光度值为纵坐标,标准品为横坐标,绘制标准曲线。xMark酶标仪(Bio-Rad)进行吸光值读数,计算待测血清sTim-3及HMGB1的浓度值。
1.2.2 酶联免疫斑点法(ELISPOT)检测转化生长因子-β(TGF-β) 采用ELISPOT法检测布病患者组和正常对照组外周血PBMC中TGF-β的斑点形成细胞数(Spot forming cells,SFC),检测试剂盒购于美国R&D公司。采抗凝血3 h内分离PBMC,在包被特异性抗人TGF-β抗体的96孔ELISPOT板,每孔加入100 μl培养液调至终浓度为2×105个PBMC。每份PBMC样本加3个孔,即100 μl PBS为阴性对照孔;终浓度为5 μg/ml植物血凝素(PHA)为阳性对照孔;终浓度为5 μg/ml布鲁氏菌重组蛋白抗原(rOMP31)(新疆医科大学第一附属医院检验科制备)为实验刺激孔,置37℃二氧化碳培养箱培养24 h,整个操作步骤严格按照试剂盒说明书进行。将ELISPOT板置于ELISPOT自动读板仪(AID Elispot Reader,德国AID公司)内,调节好合适的参数,进行斑点计数。

2 结果
2.1 正常对照组和布病患者组血清sTim-3的水平 用ELISA法检测布病患者组血清sTim-3的水平为(13.20±1.83) ng/ml,正常对照组血清sTim-3的水平为(7.09±3.23) ng/ml。与正常对照组相比,布病患者组血清中sTim-3的表达明显增高,差异具有统计学意义(P<0.01,图1)。
2.2 正常对照组和布病患者组血清HMGB1的水平 用ELISA法检测布病患者组血清中HMGB1水平为(23.34±5.57) ng/ml,正常对照组血清中HMGB1水平为(12.85±6.68) ng/ml。与正常对照组相比,布病患者组血清中HMGB1的表达明显增高,差异具有统计学意义(P<0.01,图2)。

图1 布病患者组与正常对照组血清中sTim-3的水平Fig.1 Patients infected with brucella group and control group sTim-3 level in serumNote: Patients infected with brucella vs control,*.P<0.01.
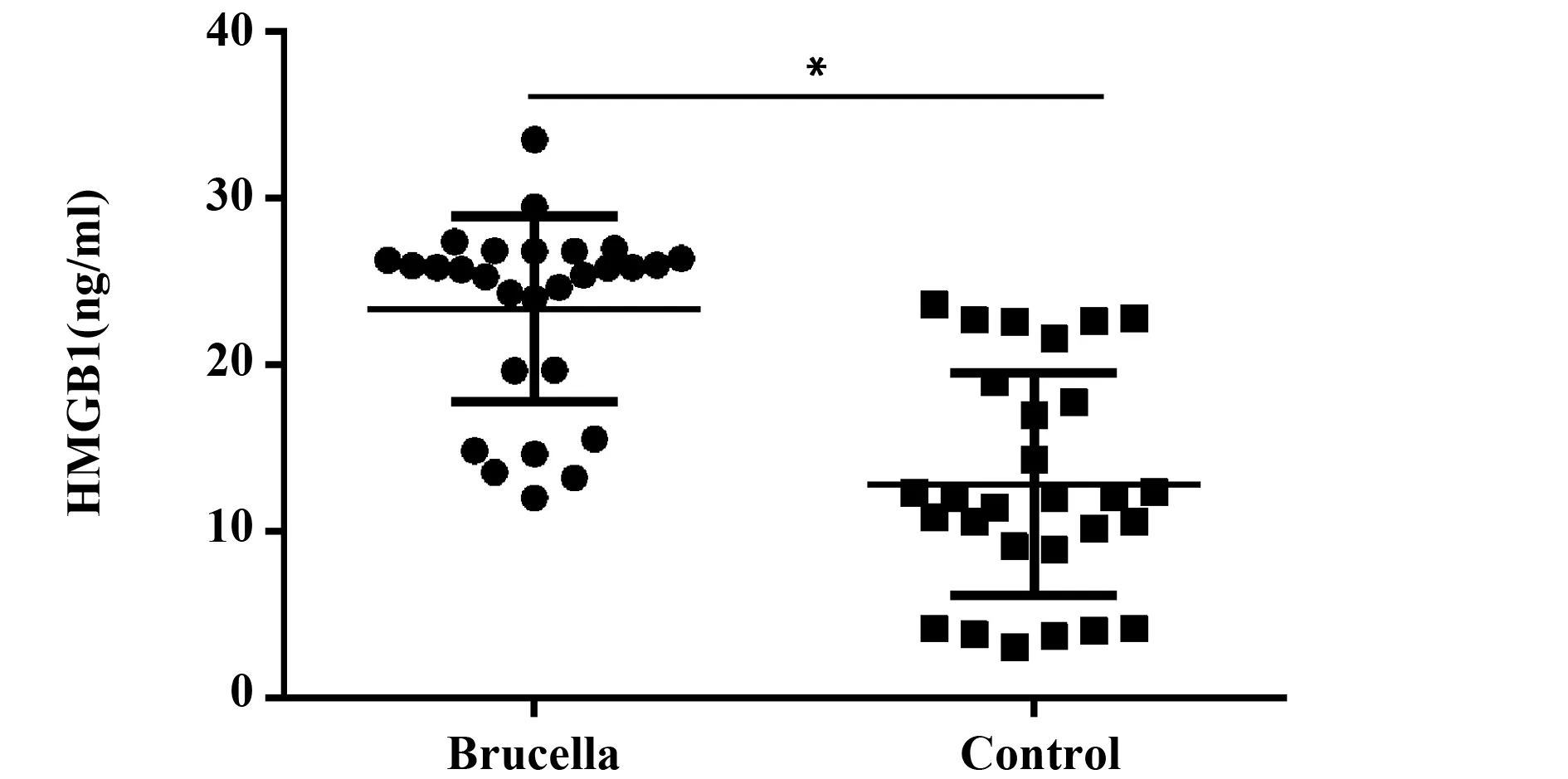
图2 布病患者组与正常对照组血清中HMGB1的水平Fig.2 Patients infected with brucella group and control group HMGB1 level in serumNote: Patients infected with brucella vs control,*.P<0.01.
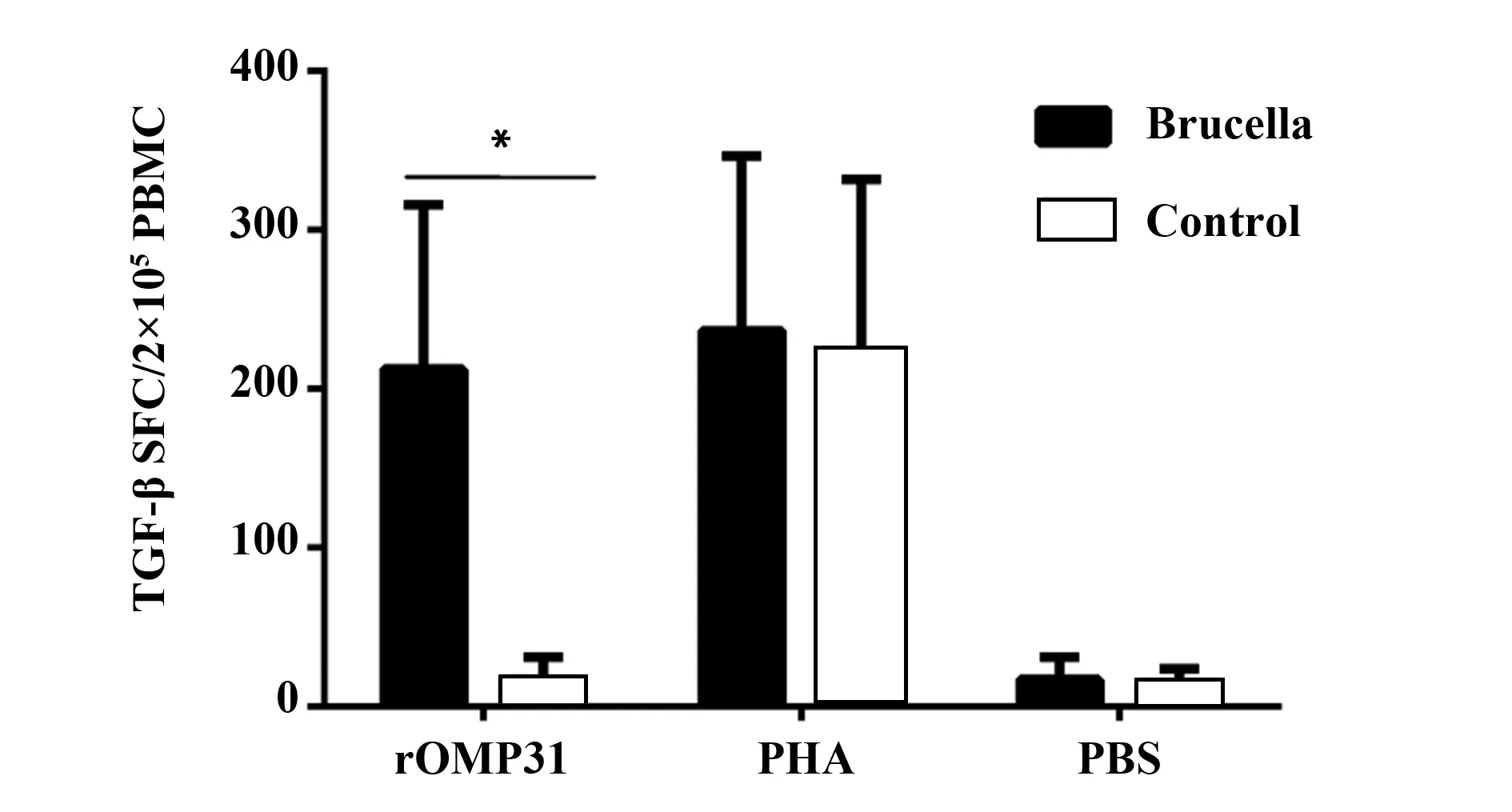
图3 ELISPOT检测布鲁氏菌重组抗原(rOMP31)刺激PBMC分泌TGF-β的SFCFig.3 Spot forming cells of secreting TGF-β from peripheral blood mononuclear cell stimulated by rOMP31Note: Patients infected with brucella vs control,*.P<0.01.
2.3 ELISPOT法检测布病患者组和正常对照组TGF-β的SFC 在重组蛋白OMP31刺激下,布病患者分泌TGF-β的SFC中位数为151(182,281),正常对照组分泌TGF-β的SFC中位数为13(4.5,28);布病患者组PBMC中分泌TGF-β的SFC数远远大于正常对照组,差异具有统计学意义(P<0.01,图3和图4)。然而,在PHA和PBS条件下,布病患者和正常对照组PBMC中分泌TGF-β的SFC中位数无统计学差异。经重组蛋白OMP31刺激的布病患者组PBMC中分泌TGF-β的SFC显著高于阴性对照下的相同个体SFC,差异具有统计学意义。
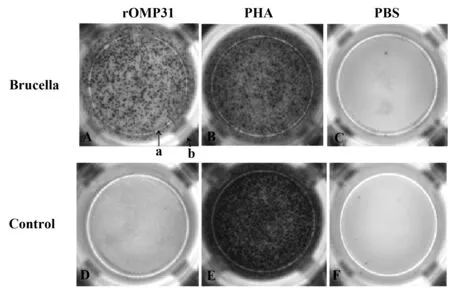
图4 ELISPOT检测PBMC中分泌TGF-β的SFC照片Fig.4 Spot forming picture of secreting TGF-β by ELISPOTNote: A,B and C represents secreting of TGF-β in the brucellosis group;D,E and F represents secreting of TGF-β in the control group ;A and D by stimulating rOMP31 protein;B and E by stimulating PHA; C and F by stimulating PBS.a represents count range,b represents the hole wall.
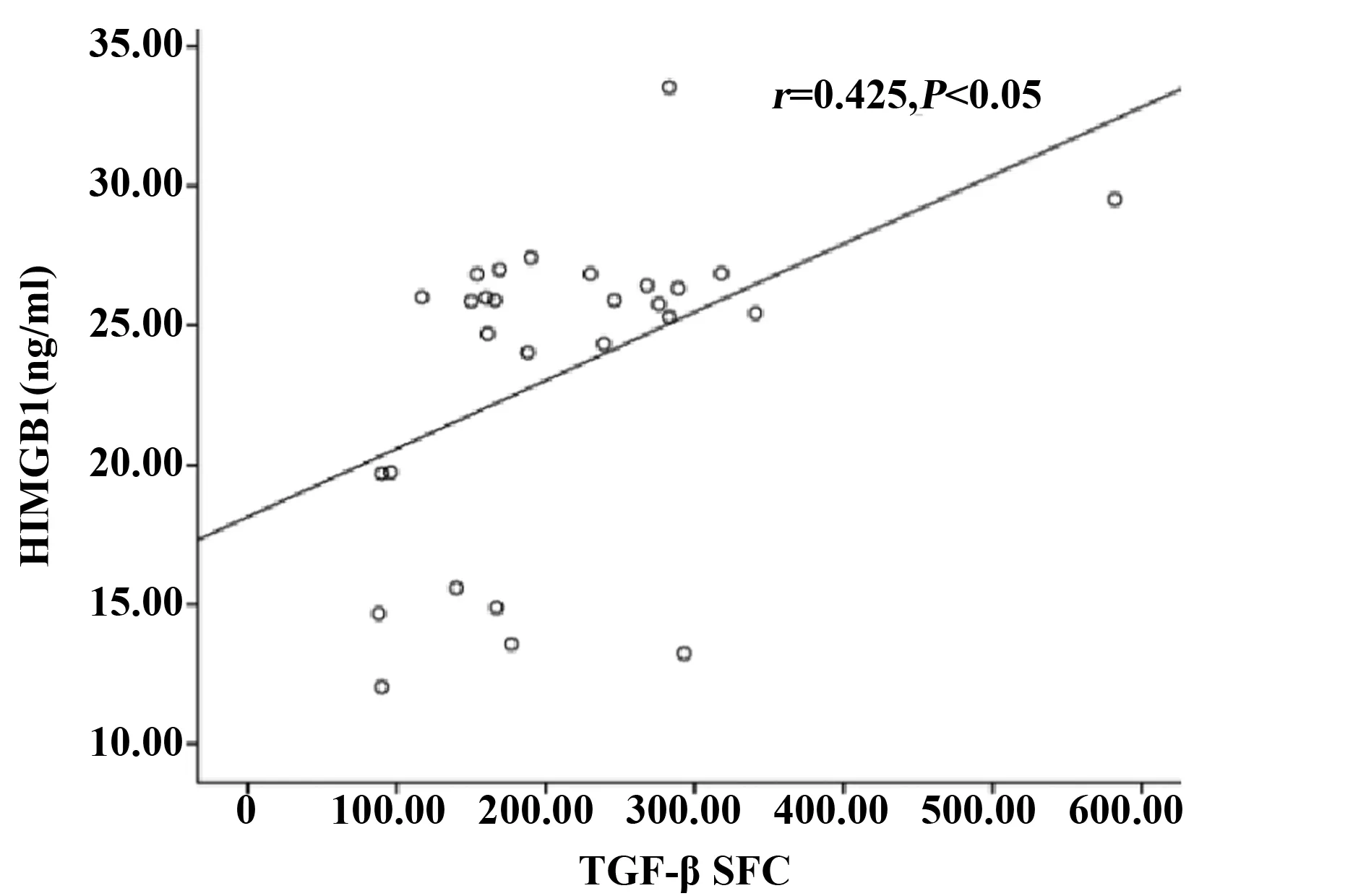
图5 布病患者组PBMC中分泌TGF-β SFC与血清HMGB1水平的相关性分析Fig.5 Correlation analysis of spot forming cells secreting TGF-β and HMGB1
2.4 布病患者组PBMC中分泌TGF-β斑点数与血清sTim-3和HMGB1水平的相关性分析 通过Spearman法进行相关性分析发现,布病患者组PBMC中分泌TGF-β的SFC与血清中sTim-3水平不相关(P>0.05),但与血清中HMGB1的水平呈正相关(r=0.425,P=0.024,图5)。
4 讨论
布病的早期症状多不明确,容易发生诊断不清,耽误治疗,使病情拖延至慢性期而导致患者终身难愈[16,17]。目前缺乏有效的治疗慢性布病的方法,因此,研究布病的发病机制,寻找布病的治疗靶点就显得尤为重要。
布鲁氏菌作为胞内寄生菌感染宿主后,主要以CD4+T淋巴细胞引起的细胞免疫为主,且Th1细胞分泌的细胞因子起关键保护作用[18]。当布鲁氏菌感染至慢性期,转为以Th2细胞介导的免疫应答为主,不利于宿主对体内布鲁氏菌的清除[19]。已知,免疫分子Tim-3和sTim-3均可与T细胞表面的配体结合抑制Th1细胞的增殖和功能[20]。Ren等[21]认为sTim-3在脓毒血症、细粒棘球蚴病和结核病中升高,可抑制Th1分泌IFN-γ,导致Th1/Th2细胞失衡,在病原体感染中起重要的免疫抑制作用。亦有研究表明,HMGB1与受体Tim-3结合,可阻断机体的抗肿瘤免疫应答,导致肿瘤生长和浸润[22-24]。当HMGB1异常高表达,可促进Treg细胞的分泌,减少Treg细胞凋亡以及增强Treg细胞介导的免疫抑制作用[25]。本研究结果显示,布鲁氏菌患者血清中sTim-3 和HMGB1的表达均显著高于正常对照组,可能造成Tim-3与其配体HMGB1的结合增加,从而负性调控特异性T细胞介导的免疫应答,不利于机体抵抗布鲁氏菌的侵入。TGF-β1作为一个细胞抑制因子,能在布病患者体内抑制IFN-γ激活巨噬细胞的杀菌功能和促进Treg细胞的免疫抑制功能而发挥重要的负性调控作用[26,27]。本研究发现,与正常人比较,在布鲁氏菌重组蛋白(rOMP31)的刺激下,布病患者PBMC分泌TGF-β的细胞斑点数显著增多。进一步相关性分析显示,布病患者PBMC中分泌TGF-β的细胞斑点数与血清HMGB1水平呈正相关。
总之,根据本研究的发现,我们推测布鲁氏菌感染可以刺激机体sTim-3/HMGB1信号通路的激活,抑制Th1细胞的免疫功能,并产生较多的TGF-β。TGF-β是Treg细胞等分化和发挥功能必需的细胞因子,Treg细胞数量的增多和功能增强又进一步抑制机体的免疫功能。同时,布病患者体内高表达HMGB1也可促进Treg细胞分泌TGF-β,使感染的细菌逃避宿主的免疫攻击,有助于在体内增殖扩散。然而,由于本研究观察的布鲁氏菌病患者数量有限,且尚未进行免疫功能的评价。因此,亟待加大临床样本量,并通过各种功能性研究以验证我们的推测。
[1] Byndloss MX,Tsolis RM.Brucella spp.virulence factors and immunity [J].Annu Rev Anim Biosci,2016,4:111-127.
[2] Zhang H,Dou X,Li Z,etal.Expression and regulation of the ery operon of Brucella melitensis in human trophoblast cells[J].Exp Ther Med,2016,12(4):2723-2728.
[3] Li T,Liu T,Jiang Z,etal.Diagnosing pyogenic,brucella and tuberculous spondylitis using histopathology and MRI:A retrospective study[J].Exp Ther Med,2016,12(4):2069-2077.
[4] de Figueiredo P,Ficht TA,Rice-Ficht A,etal.Pathogenesis and immunobiology of brucellosis:review of Brucella-host interactions [J].Am J Pathol,2015,185(6):1505-15017.
[5] Zhang FB,Li ZW,Ma XM,etal.Multiple-locus variable-number tandem-repeat analysis of Brucella isolates from patients in Xinjiang China[J].Int J Clin Exp Med,2015,8(9):15716-15723.
[6] Tumwine G,Matovu E,Kabasa JD,etal.Human brucellosis:sero-prevalence and associated risk factors in agro-pastoral communities of Kiboga District,Central Uganda[J].BMC Public Health,2015,15:900.
[7] Anderson AC,Joller N,Kuchroo VK.Lag-3,Tim-3,and TIGIT:co-inhibitory receptors with specialized functions in immune regulation [J].Immunity,2016,44(5):989-1004.
[8] Möller-Hackbarth K,Dewitz C,Schweigert O,etal.A disintegrin and metalloprotease (ADAM) 10 and ADAM17 are major sheddases of T cell immunoglobulin and mucin domain 3 (Tim-3)[J].J Biol Chem,2013,288(48):34529-34544.
[9] Chen Z,Qing J,Hu L.Interactions of human T cell immunoglobin mucins with apoptotic cells[J].J Huazhong Univ Sci Technolog Med Sci,2012,32(1):9-16.
[10] Clayton KL,Douglas-Vail MB,Nur-ur Rahman AK,etal.Soluble T cell immunoglobulin mucin domain 3 is shed from CD8+T cells by the sheddase ADAM10,is increased in plasma during untreated HIV infection,and correlates with HIV disease progression[J].J Virol,2015,89(7):3723-3736.
[11] Ji XJ,Ma CJ,Wang JM,etal.HCV-infected hepatocytes drive CD4+CD25+Foxp3+regulatory T-cell development through the Tim-3/Gal-9 pathway[J].Eur J Immunol,2013,43(2):458-467.
[12] Yan W,Liu X,Ma H,etal.Tim-3 fosters HCC development by enhancing TGF-β-mediated alternative activation of macrophages[J].Gut,2015,64(10):1593-1604.
[13] Feng X,Wu C,Yang M,etal.Role of PI3K/Akt signal pathway on proliferation of mesangial cell induced by HMGB1 [J].Tissue Cell,2016,48(2):121-125.
[14] Chiba S,Baghdadi M,Akiba H,etal.Tumor-infiltrating DCs suppress nucleic acid-mediated innate immune responses through interactions between the receptor TIM-3 and the alarmin HMGB1 [J].Nat Immunol,2012,13(9):832-842.
[15] Patel J,Bozeman EN,Selvaraj P.Taming dendritic cells with TIM-3:another immunosuppressive strategy used by tumors [J].Immunotherapy,2012,4(12):1795-1798.
[16] Rahman AA,Berkvens D,Saegerman C,etal.Seroprevalence of brucellosis in patients with prolonged fever in Bangladesh[J].J Infect Dev Ctries,2016,10(9):939-946.
[17] Sikarwar B,Singh VV,Sharma PK,etal.DNA-probe-target interaction based detection of Brucella melitensis by using surface plasmon resonance[J].Biosens Bioelectron,2016,87:964-969.
[18] Vitry MA,Hanot Mambres D,De Trez C,etal.Humoral immunity and CD4+Th1 cells are both necessary for a fully protective immune response upon secondary infection with Brucella melitensis[J].J Immunol,2014,192(8):3740-3752.
[19] 曹志然,张雷芳,王 蓓,等.负载布氏菌 WboA-/-S2株的树突状细胞对淋巴结T细胞的活化作用[J].中国免疫学杂志,2012,28(12):1073-1077.
[20] Geng H,Zhang GM,Li D,etal.Soluble form of T cell Ig mucin 3 is an inhibitory molecule in T cell-mediatedimmune response[J].J Immunol,2006,176(3):1411-1420.
[21] Ren F,Li J,Jiang X,etal.Plasma soluble Tim-3 emerges as an inhibitor in sepsis:sepsis contrary to membrane Tim-3 on monocytes[J].Tissue Antigens,2015,86(5):325-332.
[22] 辛 燕,张峰波,李艳华,等.棘球蚴病患者血清中可溶性TIM-3/Galactin9的变化[J].免疫学杂志,2014,30(10):910-913.
[23] 张 佳,张峰波,李奇凤,等.肺结核患者血清中可溶性T细胞免疫球蛋白黏蛋白分3(sTim-3)和IL-4水平升高但IFN-γ水平降低[J].细胞与分子免疫学杂志,2016,32(7):968-971.
[24] Chiba S,Baghdadi M,Akiba H,etal.Tumor-infiltrating DCs suppress nucleic acid-mediated innate immuneresponses through interactions between the receptor TIM-3 and the alarmin HMGB1[J].Nat Immunol,2012,13(9):832-842.
[25] 谢鸿玉,梁炎春,姚书忠,等.HMGB1调节Treg细胞参与子宫内膜异位症发病的免疫机制[J].国际生殖健康计划生育杂志,2016,35(2):160-164.
[26] Sepanjnia A,Eskandari-Nasab E,Moghadampour M,etal.TGF-β1 genetic variants are associated with an increased risk of acuteBrucellosis[J].Infect Dis (Lond),2015,47(7):458-464.
[27] Pollak CN,Wanke MM,Estein SM,etal.Immunization with Brucella VirB proteins reduces organ colonizationin mice through a Th1-type immune response and elicits a similar immune response in dogs[J].Clin Vaccine Immunol,2015,22(3):274-281.
[收稿2016-06-14 修回2016-10-12]
(编辑 倪 鹏)
Changes of sTim-3/HMGB1 and Spot forming cells of TGF-β secreting from peripheral blood mononuclear cell in patients infected with brucella
PANGPan,ZHUYue-Jie,HUJin-Wei,JIABin,REXITI·Fulati,ZHANGFeng-Bo,DINGJian-Bing.
DepartmentofClinicalLaboratory,theFirstAffiliatedHospitalofXinjiangMedicalUniversity,Urumqi830011,China
Objective:To investigate the changes of sTim-3,HMGB1 and TGF-β in the brucellosis patients and to analyse the relationship between the changes of these molecules and brucella infection.Methods: 28 cases of brucellosis patient untreated and 28 healthy control cases in the age and gender matched with brucellosis cases were collected.The serum levels of sTim-3 and HMGB1 were detected by ELISA,and the levels of Spot forming cells secreting TGF-β were measured by ELISPOT in patients and healthy control group.Results: Compared with healthy controls,sTim-3/HMGB1 expression levels and Spot forming cells secreting TGF-β were significantly increased in the brucellosis patients (P<0.01).The changes of Spot forming cells secreting TGF-β were positively correlated with the levels of HMGB1 (P<0.05).Conclusion: The serum levels of sTim-3/HMGB1 and Spot forming cells of secreting TGF-β from peripheral blood mononuclear cell are significantly increased in the brucellosis patients.Those molecules may be involved in the process of brucella infection and may play a significant role in the immune escape of patients infected with brucella.
sTim-3;HMGB1;TGF-β;Brucellosis
10.3969/j.issn.1000-484X.2017.02.017
①本文为国家自然科学基金项目(81560322)、新疆维吾尔自治区自然科学基金项目(2015211C100)和新疆医科大学科学创新基金(XYDCX201507)。
庞 盼(1990年-),女,在读硕士,主要从事布鲁氏菌感染方面的研究,E-mail: 2449579487@qq.com。
及指导教师:张峰波(1982年-),男,博士,主管技师,主要从事病原学方面的研究,E-mail: 765219598@qq.com。 丁剑冰(1960年-),女,博士,教授,免疫教研室主任,博士生导师,主要从事感染免疫和生殖免疫方面的研究,E-mail: djbing002@sina.com。
R392.11 R378.5
A
1000-484X(2017)02-0247-05
②共同第一作者。
③新疆医科大学基础医学院,乌鲁木齐830011。
