血清中抗磷脂酶A2受体特异性抗体的两种检测方法比较
2017-02-27程桂雪刘建华王玉珏秦晓松
程桂雪 刘建华 王玉珏 刘 勇 秦晓松
(中国医科大学附属盛京医院检验科,沈阳110004)
血清中抗磷脂酶A2受体特异性抗体的两种检测方法比较
程桂雪 刘建华 王玉珏 刘 勇 秦晓松
(中国医科大学附属盛京医院检验科,沈阳110004)
目的:比较两种不同方法检测特发性膜性肾病 (Idiopathic membranous nephropathy,IMN) 患者血清磷脂酶A2受体(M-Phospholipase A2 Receptor,PLA2R)抗体检出率,评价两种方法检测抗体对疾病的诊断价值。方法:病例为2014年12月至2015年10月中国医科大学附属盛京医院收治的IMN及其他明确病理诊断的入院患者,分为IMN组和非IMN组,整理临床资料;采用间接免疫荧光法(Indirect immunofluorescence assay,IFA)和酶联免疫吸附试验(Enzyme linked immunosorbent assay,ELISA)对患者血清抗PLA2R抗体进行检测。结果:IFA方法与ELISA方法检测抗PLA2R抗体的敏感度分别为71.3%、68.5%,特异度均为100%,两者ROCAUC分别为0.860、0.839,两种方法的诊断效能无统计学差异(P>0.05),且两种方法有较好的一致性 (κ=0.876),一致率达93.8%;抗体阳性的患者,易出现血清血白蛋白水平的降低 (P<0.05);抗体滴度越高患者的低蛋白血症越严重,发生大量蛋白尿比例越高(P<0.05)。结论:两种方法检测血清中PLA2R抗体均有较高的敏感度和特异度,该抗体可作为IMN患者良好的诊断指标。
特发性膜性肾病;磷脂酶A2受体;抗体
膜性肾病按病因分为特发性膜性肾病(Idiopat-hic membranous nephropathy, IMN)和继发性膜性肾病(Secondary membranous nephropathy, SMN)。 IMN占膜性肾病的70%~80%,被认为是一种自身免疫性疾病,男女比例约为1.3∶1~2.2∶1[1]。自2009年,Beck等[2]在IMN患者中发现,肾小球足细胞膜表达的M型磷脂酶A2受体(PLA2R)为IMN致病的靶抗原,且大多数患者有高水平的PLA2R抗体,这使人们对IMN发病机制有了更加深入的研究,并且将抗PLA2R抗体的检测作为IMN诊断及鉴别诊断的主要手段。近年来,涌现出多种PLA2R抗体的检测方法也多种多样,如:免疫印迹法、间接免疫荧光法(Indirect immunofluorescence assay, IFA)、可定位激光小珠免疫测定法、酶联免疫吸附试验(Enzyme linked immunosorbent assay,ELISA)等,使抗PLA2R抗体的检出更加精确,并逐步应用于临床[2-9]。本研究对IFA法和ELISA法检测血清抗PLA2R抗体的性能特征进行评价,并分析抗体与临床表现之间的关系,为临床诊断提供更充分的依据。
1 资料与方法
1.1 研究对象
1.1.1 IMN组 2014年12月至2015年10月期间我院肾内科住院患者143例,入选患者均行经皮肾活检,所有病理标本经过光镜、电镜、荧光显微镜的检测,确诊为膜性肾病,通过整理患者临床资料,并结合实验室检查,排除感染性疾病、自身免疫性疾病、肿瘤及药物等引起的SMN,而确诊为IMN。患者样本血清均在患者进行肾活检前留取。
1.1.2 非IMN组 随机选取同期诊断其他肾脏病理类型51例,其中糖尿病肾病4例,紫癜性肾炎7例,IgA肾病12例,肾小球微小病变型肾病13例、狼疮性肾炎15例。
1.2 方法
1.2.1 样本收集 收集所有入组患者清晨空腹状态下采集的静脉血,3 000 r/min,离心10 min。分离血清,并分装保存于-80℃冰箱待用。
1.2.2 收集临床资料 收集所有患者的基本信息及病史,包括:性别、年龄、入选距活检时间、激素和免疫抑制剂使用情况、是否患有高血压、是否患有糖尿病及其他肾脏疾病;同时收集入选时实验室检查信息,包括:肌酐、尿素氮、胱抑素C 、总蛋白、血清白蛋白、24 h尿蛋白、自身抗体检测、乙肝病毒标志物和乙型肝炎病毒DNA。
1.2.3 间接免疫荧光法定性测定血清抗PLA2R抗体 该方法检测的试剂盒购自德国欧蒙公司,荧光显微镜(Olympus)下观察结果。存放于-80℃冰箱的待测血清样本解冻并混匀,测定时按1∶10稀释。待测血清与转染PLA2R抗原的细胞孵育,再与FITC标记的羊抗人IgG孵育,操作后封片保存于-20℃冰箱。结果判定标准:根据试剂盒说明书,滴度<1∶10,记录结果为阴性。荧光结果由两位医师分别判读,对有异议的结果,讨论后给出最终结果。
1.2.4 采用ELISA方法定量测定血清抗PLA2R抗体 该方法检测的试剂盒购自德国欧蒙公司,酶标仪(Tecan)测量光密度(OD值)及浓度。存放于-80℃冰箱的待测血清样本解冻并混匀,测定时按1∶101稀释,试验操作按照试剂盒内的说明书进行。阳性结果判定标准:根据试剂盒说明书,抗PLA2R抗体浓度<14 RU/ml,记录结果为阴性。
1.2.5 应用Image-Pro Plus(IPP)软件分析荧光图片 对IFA方法检测的抗PLA2R抗体的生物膜片的荧光结果在相同的曝光时间下进行图片拍摄,通过IPP软件将荧光图片转换为灰度图,再进行黑白逆转,采用指数光密度曲线读取生物膜片上荧光染色的SUM AREA和SUM IOD,并计算出平均荧光密度Mean Density=SUM AREA/SUM IOD。生物膜片的平均荧光密度与患者血清样本中抗体含量成正相关,从而进行半定量分析。

2 结果
2.1 两组基本信息及实验室检查结果比较 纳入IMN组患者143例,男88例,女55例,平均年龄(50.92±12.50)岁;非IMN组51例,男23例,女28例,平均年龄(38.71±17.59)岁,基线资料详见表1。
2.2 两种方法对血清抗PLA2R抗体检测结果及诊断评价 IFA法检测结果显示IMN组143例患者中,抗体阳性者有102例;非IMN组患者数51例,未检测到抗体阳性者。该方法测定抗PLA2R抗体的敏感度为71.3%,特异度为100%,准确率79.3%。ELISA法测定抗PLA2R抗体结果显示:IMN组143例患者中,抗体阳性者有98例;非IMN组患者数51例,未检测到抗体阳性者,该检测方法的敏感度为68.5%,特异度为100%,准确率76.3%。详见表2。两种检测方法诊断试验 ROC曲线下面积分别为0.860[95%CI为(0.810~0.910)]、0.839[95%CI为(0.786~0.893)],见图1。 两种诊断试验的诊断效能比较差异无统计学意义(P>0.05)。
2.3 IFA法与ELISA法对抗PLA2R抗体检出率的一致性和差异性的比较 两种方法对抗体检出率的一致性达93.8%,其Kappa值为0.876,P>0.05,差异无统计学意义,两种检测方法有较高的一致性。对两种方法差异性检验也无统计学意义(P>0.05)。见表3。
表1 IMN组与非IMN组基本资料
Tab.1 Major information between IMN group and non-IMN group
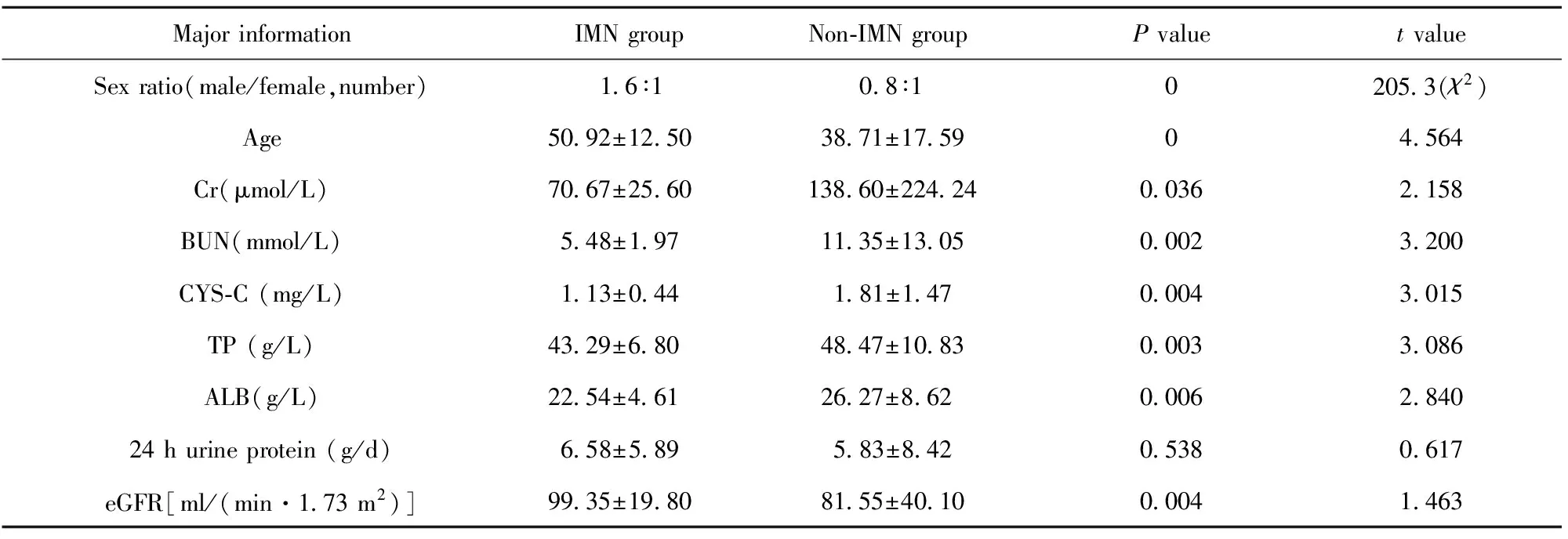
MajorinformationIMNgroupNon⁃IMNgroupPvaluetvalueSexratio(male/female,number)16∶108∶102053(χ2)Age5092±12503871±175904564Cr(μmol/L)7067±256013860±2242400362158BUN(mmol/L)548±1971135±130500023200CYS⁃C(mg/L)113±044181±14700043015TP(g/L)4329±6804847±108300033086ALB(g/L)2254±4612627±8620006284024hurineprotein(g/d)658±589583±84205380617eGFR[ml/(min·173m2)]9935±19808155±401000041463
Note:eGFR.estimated glomerular filtration rate.
表2 IFA法和ELISA法检测血清抗PLA2R抗体诊断试验结果评价
Tab.2 Evaluation of diagnostic test detecting serum anti-PLA2R antibodies

TestACCSeSpPV+PV⁃LR+LR⁃IFAtest793%713%100%100%560%+∞0280ELISAtest763%685%100%100%526%+∞0322
Note:ACC.Accuracy;Se.Sensitivity;Sp.Specificity;PV+.Positive predictive value; PV-.Negative predictive value;LR+.Positive likelihood ratio;LR.Negative likelihood ratio.
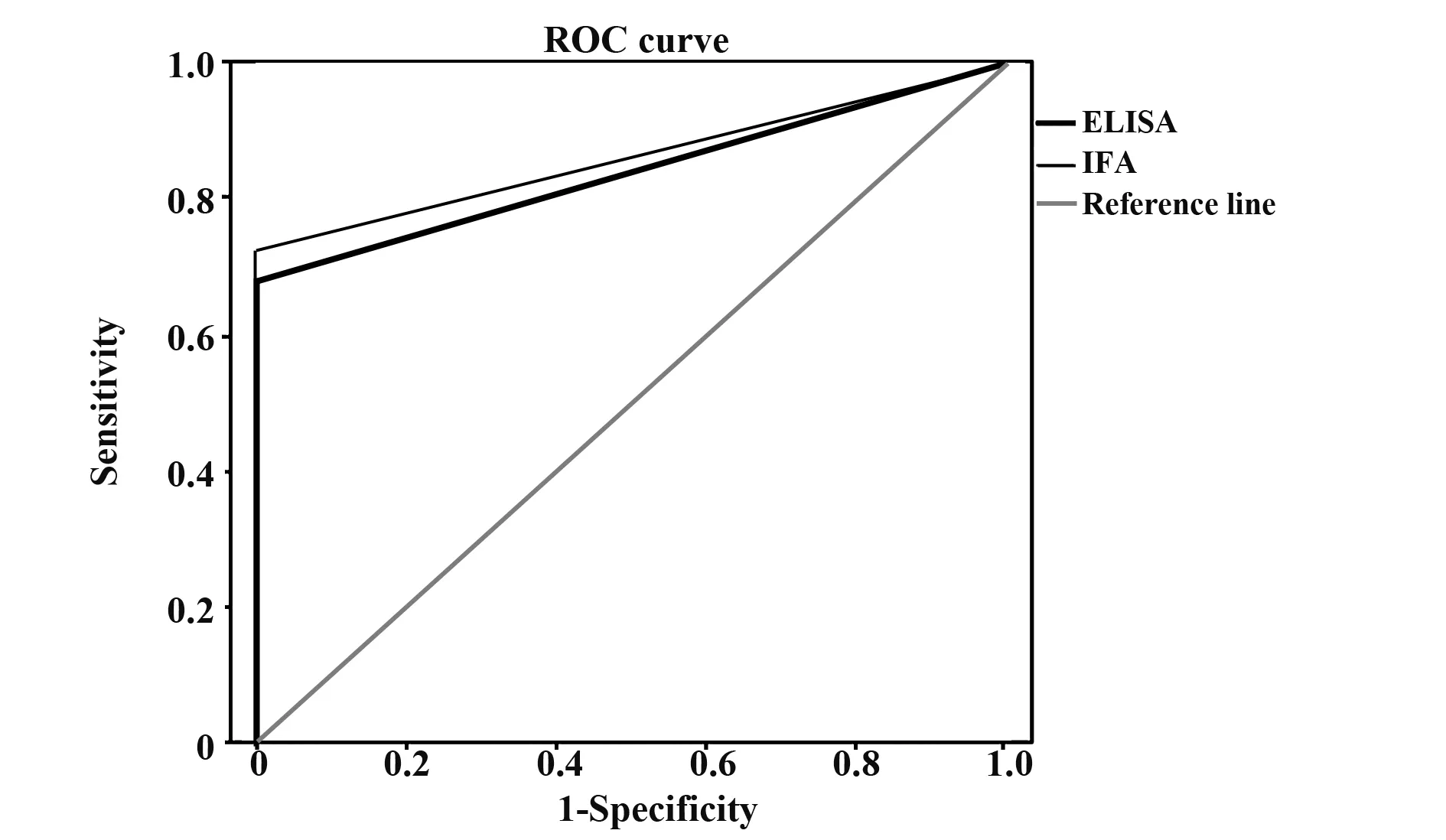
图1 ROC曲线Fig.1 ROC curve
表3 IFA法与ELISA法抗PLA2R抗体检出一致性及差异性的比较
Tab.3 Consistency and diversity detecting serum anti-PLA2R antibodies in IFA test or ELISA test
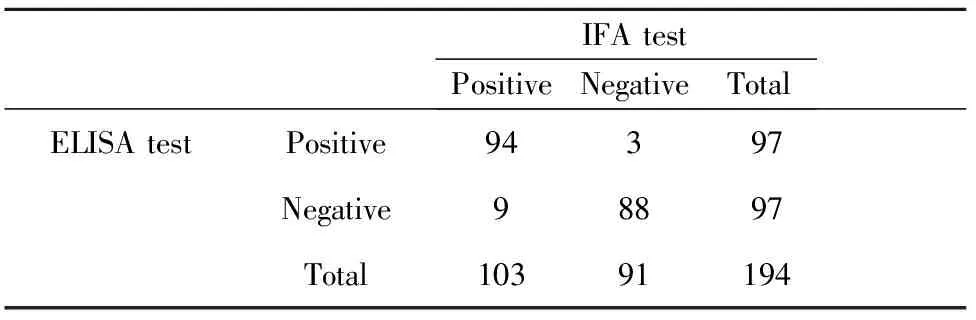
IFAtestPositiveNegativeTotalELISAtestPositive94397Negative98897Total10391194
表4 抗PLA2R抗体阳性组和阴性组基本资料
Tab.4 Basic information in serum anti-PLA2R antibody positive and negative group

ParametersPLA2R+PLA2R-PvalueSexratio(male/female,number)(58/36)94(22/15)370194Age5100±12185097±14310991Cr(μmol/L)71037±24966868±30820653BUN(mmol/L)546±208544±1840996CYS⁃C(mg/L)118±050104±0280123TP(g/L)4274±7214498±5940990Alb(g/L)2184±4662453±42600021)24hurineprotein(g/d)7064±597578±6310296eGFR[ml/(min·173m2)]9864±199110200±21000991
Note:eGFR.estimated glomerular filtration rate;1)P<0.05 was considered significant.
2.4 IMN组抗PLA2R抗体阳性组与阴性组基线资料比较 在IMN组患者中对抗PLA2R抗体阳性和阴性的患者临床情况的比较,纳入为IFA法和ELISA法检测抗体结果一致的样本,共131例,结果见表4。抗PLA2R抗体阳性与阴性两组间,患者年龄、性别、血肌酐、尿素氮、24 h蛋白尿及eGFR在两组间无统计学差异;但抗体阳性组和阴性组血清白蛋白的差异有统计学意义(P<0.05)。
表5 不同滴度抗PLA2R抗体的IMN患者血清白蛋白、大量蛋白尿情况
Tab.5 ALB and heavy proteinuria status of IMN patients in different anti-PLA2R antibody titer
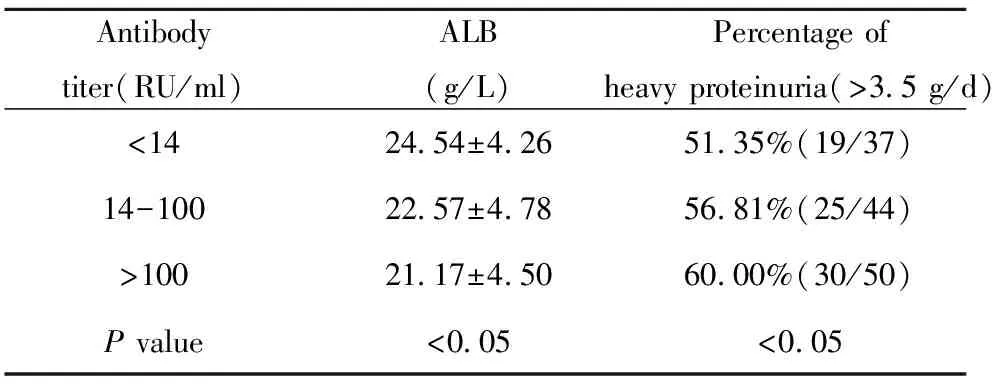
Antibodytiter(RU/ml)ALB(g/L)Percentageofheavyproteinuria(>35g/d)<142454±4265135%(19/37)14-1002257±4785681%(25/44)>1002117±4506000%(30/50)Pvalue<005<005
表6 不同平均荧光密度下IMN患者血清白蛋白、大量蛋白尿情况
Tab.6 ALB and heavy proteinuria status of IMN patients in different MFI
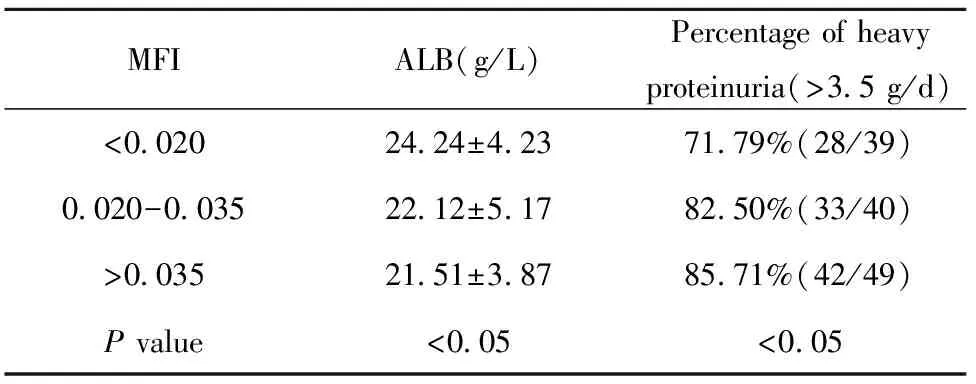
MFIALB(g/L)Percentageofheavyproteinuria(>35g/d)<00202424±4237179%(28/39)0020-00352212±5178250%(33/40)>00352151±3878571%(42/49)Pvalue<005<005
2.5 IMN患者抗PLA2R抗体滴度与一般实验室检查的关系 不同水平抗体滴度的IMN患者间,血肌酐、尿素氮、胱抑素C及eGFR无统计学差异(P值分别为0.25、0.29、0.31和0.27);但患者低蛋白血症及大量蛋白尿的临床症状与该抗体水平有明显相关性,即抗体浓度越高,发生上述两种症状的程度越明显(P<0.05),见表5。
2.6 抗PLA2R抗体的荧光密度测定 非IMN组与IMN组两组进行荧光密度比较,其中非IMN组阳性率为0,而IMN组抗体阳性率达71.3%,表明血清抗PLA2R抗体水平在两组中的差异有统计学差异(P<0.05)。根据不同平均光密度(Mean fluorescence intensity,MFI)将IMN患者分为荧光密度阴性组(<0.020)、低水平组(0.020~0.035)、高水平组(>0.035),PLA2R抗体的MFI与血清白蛋白、血肌酐、尿素氮、胱抑素C、eGFR及24 h蛋白尿进行分析,结果显示血清白蛋白和24 h蛋白尿的水平都与抗体水平有相关性(P<0.05),而与血肌酐、尿素氮、胱抑素C及eGFR 不相关(P值分别为0.32、025、0.25、0.18)。见表6。
3 讨论
目前IMN患者体内肾小球靶抗原的发现使人们对膜性肾病有了新的认识,多种足细胞抗原的发现,在某种程度上揭示了人膜性肾病的发病机制。患者血清中靶抗原的特异性抗体的存在成为膜性肾病诊断及监测疾病活动性的生物标志物。本试验为回顾性研究,收集本次入院时肾脏病理活检确诊为膜性肾病的患者为病例组,其他肾脏病理诊断患者为病例对照组,两组患者在性别、年龄及肾脏损伤程度上有一定差异,这主要由于每种疾病的发病人群及肾脏受累的程度不同。近年来文献报道免疫印迹方法、IFA法及ELISA法等检测不同种族、地区的IMN患者血清抗PLA2R抗体的阳性率为52%~82%,本试验的血清样本研究结果的阳性检出率与文献报道相符[10-14],有些研究进一步证实肾组织沉积物中PLA2R检出率要较血清样本检出率高,敏感度强[11]。既往研究中指出在SMN的患者中,血清中抗PLA2R抗体和肾组织中PLA2R抗原的检出率极低[2,13-15],在本实验中纳入的51例其他肾病的对照组中,两种方法均未在血清中检测出抗PLA2R抗体。作为临床诊断指标,抗PLA2R抗体检测具有很高的诊断及鉴别诊断价值。
比较两种方法的诊断效能,IFA法和ELISA法检测抗PLA2R抗体敏感性分别为71.3%、68.5%,特异性均为100%,ROCAUC分别为0.860、0.839,两种方法的诊断效能接近,无差异。在诸多研究中,敏感性指标有一定差异,可能由以下几种原因造成:①已有文献报道了机体产生抗PLA2R抗体IgG有不同亚型[4,16],采用不同测量方法,所测得的抗体含量未能包括机体产生的全部抗体亚型;②除PLA2R外,其他足细胞抗原,如1型血小板反应蛋白7A域、阳离子化牛血清白蛋白;以及其他足细胞胞浆蛋白抗原也可能参与疾病的发生[17-19];③IMN的疾病进程中,发生自发缓解的比率较高,部分研究中的研究对象在纳入研究之前,已被活检诊断为膜性肾病,纳入研究时可能进入自发缓解状态;④在发病过程中由于肾小球损伤引起持续大量的蛋白尿对血液中产生的抗体起到了清除的作用,使患者机体中抗体含量下降[20];⑤IMN组患者可能存在临床尚未发现的继发因素。早期研究报道肿瘤相关性MN占MN患者的5%~20%,且大约50%肾脏疾病的诊断先于肿瘤的发现,从MN诊断到肿瘤发现平均会延迟1年。两种检测方法对抗PLA2R抗体的检出率在一致性较好。两种方法在该抗体的检出率上无差异性。本研究比较两种方法一致率达93.8%,与以往的报道结果相近(94%~97%)[4,21,22]。
PLA2R参与的自身免疫反应目前被认为是IMN发病的主要机制,患者体内抗体水平与疾病进展密切相关。将研究中两种方法检测结果一致的IMN组通过抗PLA2R抗体检测结果分为阳性组及阴性组,对其临床资料及实验室检测指标进行分析。本试验结果显示IMN患者中抗PLA2R抗体阳性者较抗体阴性者易出现低蛋白血症的临床表现。血清中抗体与足细胞表面PLA2R结合引起肾小球的损伤,大量蛋白质经尿液流失,使得患者的肾病综合征症状更加明显。对于临床症状严重的患者,未经肾脏病理活检确诊前,便使用免疫抑制剂进行治疗,该类患者机体内抗体水平可因治疗而下降[10,23-25],本次研究中有3个患者在进行肾脏穿刺前使用了免疫抑制剂,且该类药物的使用可能降低血清中的抗体水平,虽然3个患者的抗体定性检测为阳性,但其浓度的高低可能由于用药而有所改变。ELISA方法对抗体进行定量检测,其检测结果表明阳性患者的抗体滴度越高,低蛋白血症越严重,而出现大量蛋白尿的患者比例越高;本研究还通过IFA法检测抗PLA2R抗体,并利用IPP软件检测光密度,进行半定量分析,随着平均光密度的升高,患者所发生的低蛋白血症越严重,发生大量蛋白尿的比例越高,故两种检测方法均说明抗体浓度的高低与疾病的严重情况相关[21,26]。
本研究评价了两种检测方法对于血清中抗PLA2R抗体的诊断价值,其敏感性、特异性及ROCAUC相近,且具有很高的诊断效能,均可用于IMN的诊断。IFA方法可以完成抗体的定性及半定量检测,但在结果的判读时受主观因素的影响较大,如果利用IPP软件分析平均荧光密度,则可有效避免人为因素带来的误差。而ELISA可以对抗体进行定量检测,操作更方便。本研究还发现定量检测的抗体滴度与疾病轻重及活动性相关。为已经商品化的两种检测方法在临床上的应用提供了基础数据,有助于临床对疾病的诊断、鉴别及病情检测。
本研究还存在以下不足,虽然有研究发现免疫抑制剂等药物治疗与抗体的检出率相关[10,23-25],但在本研究中,只对患者进行了药物使用前的抗体检测,并未进行长期的监测,故还需进行长期随访研究,明确其相关性,并进一步探讨抗体滴度变化是否与疾病的缓解相关。
[1] Mathieson PW.Membranous nephropathy[J].Clin Med,2012,12(5):461-466.
[2] Beck LH Jr,Bonegio RG,Lambeau G,etal.M-type phospholipase A2 receptor as target antigen in idiopathic membranous nephropathy[J].N Engl J Med,2009,361(1):11-21.
[3] Behnert A,Fritzler MJ,Teng B,etal.An anti-phospholipase A2 receptor quantitative immunoassay and epitope analysis in membranous nephropathy reveals different antigenic domains of the receptor[J].PLoS One,2013,8(4):e61669.
[4] Hofstra JM,Debiec H,Short CD,etal.Antiphospholipase A2 receptor antibody titer and subclass in idiopathic membranous nephropathy[J].J Am Soc Nephrol,2012,23(10):1735-1743.
[5] Dahnrich C,Komorowski L,Probst C,etal.Development of a standardized ELISA for the determination of autoantibodies against human M-type phospholipase A2 receptor in primary membranous nephropathy[J].Clin Chim Acta,2013,421:213-218.
[6] Timmermans SA,Damoiseaux JG,Heerings-Rewinkel PT,etal.Evaluation of anti-PLA2R1 as measured by a novel ELISA in patients with idiopathic membranous nephropathy:a cohort study[J].Am J Clin Pathol,2014,142(1):29-34.
[7] Behnert A,Schiffer M,Muller-Deile J,etal.Antiphospholipase A(2) receptor autoantibodies:a comparison of three different immunoassays for the diagnosis of idiopathic membranous nephropathy[J].J Immunol Res,2014,2014:143274.
[8] 唐小波,吴月平,黄承先,等.M型磷脂酶A2受体抗体检测在老年膜性肾病诊断中的价值[J].中国老年学杂志,2015,35(16):4634-4635.
[9] 牛广华,高玉洁,王柏山,等.磷脂酶 A2受体抗体在特发性膜性肾病中的诊断价值[J].中华检验医学杂志,2015,38(9):595-599.
[10] Hoxha E,Harendza S,Zahner G,etal.An immunofluorescence test for phospholipase-A(2)-receptor antibodies and its clinical usefulness in patients with membranous glomerulonephritis[J].Nephrol Dial Transplant,2011,26(8):2526-2532.
[11] Hayashi N,Akiyama S,Okuyama H,etal.Clinicopathological characteristics of M-type phospholipase A2 receptor (PLA2R)-related membranous nephropathy in Japanese[J].Clin Exp Nephrol,2015,19(5):797-803.
[12] Hofstra JM,Beck LH Jr,Beck DM,etal.Anti-phospholipase A(2) receptor antibodies correlate with clinical status in idiopathic membranous nephropathy[J].Clin J Am Soc Nephrol,2011,6(6):1286-1291.
[13] Oh YJ,Yang SH,Kim DK,etal.Autoantibodies against phospholipase A2 receptor in Korean patients with membranous nephropathy[J].PLoS One,2013,8(4):e62151.
[14] Qin W,Beck LH Jr,Zeng C,etal.Anti-phospholipase A2 receptor antibody in membranous nephropathy[J].J Am Soc Nephrol,2011,22(6):1137-1143.
[15] Hoxha E,Kneissler U,Stege G,etal.Enhanced expression of the M-type phospholipase A2 receptor in glomeruli correlates with serum receptor antibodies in primary membranous nephropathy[J].Kidney Int,2012,82(7):797-804.
[16] Huang CC,Lehman A,Albawardi A,etal.IgG subclass staining in renal biopsies with membranous glomerulonephritis indicates subclass switch during disease progression[J].Mod Pathol,2013,26(6):799-805.
[17] Gödel M,Grahammer F,Huber TB,etal.Thrombospondin type-1 domain-containing 7A in idiopathic membranous nephropathy[J].N Engl J Med,2014,371(24):2277-2287.
[18] Fresquet M,Jowitt TA,Gummadova J,etal.Identification of a major epitope recognized by PLA2R autoantibodies in primary membranous nephropathy[J].J Am Soc Nephrol,2015,26(2):302-313.
[19] Prunotto M,Carnevali ML,Candiano G,etal.Autoimmunity in membranous nephropathy targets aldose reductase and SOD2[J].J Am Soc Nephrol,2010,21(3):507-519.
[20] Debiec H,Ronco P.PLA2R autoantibodies and PLA2R glomerular deposits in membranous nephropathy[J].N Engl J Med,2011,364(7):689-690.
[21] 林伟锋,李 航,李雪梅,等.抗磷脂酶A2受体抗体与特发性膜性肾病的关系[J].中华内科杂志,2015,9(54):783-788.
[22] 符克英,蔡俊宏,符生苗.IIF与ELISA在抗磷脂酶A2受体抗体检测中相关性[J].中国热带医学,2015,4(15):457-459.
[23] Beck LH Jr,Fervenza FC,Beck DM,etal.Rituximab-induced depletion of anti-PLA2R autoantibodies predicts response in membranous nephropathy[J].J Am Soc Nephrol,2011,22(8):1543-1550.
[24] Hoxha E,Harendza S,Pinnschmidt H,etal.PLA2R antibody levels and clinical outcome in patients with membranous nephropathy and non-nephrotic range proteinuria under treatment with inhibitorsof the renin-angiotensin system[J].PLoS One,2014,9(10):e110681.
[25] Hoxha E,Thiele I,Zahner G,etal.Phospholipase A2 receptor autoantibodies and clinical outcome in patients with primary membranous nephropathy[J].J Am Soc Nephrol,2014,25(6):1357-1366.
[26] 曹鹏龙,李士军,郐婷婷,等.血清抗M型磷酯酶A2受体抗体与成人特发性膜性肾病的相关性[J].实用医学杂志,2014,15:2441-2444.
[收稿2016-07-19 修回2016-10-09]
(编辑 许四平)
Comparison of two methods to detect M-phospholipase A2 receptor antibodies in serum
CHENGGui-Xue,LIUJian-Hua,WANGYu-Jue,LIUYong,QINXiao-Song.
DepartmentofClinicalLaboratory,ShengjingHospitalAffiliatedtoChinaMedicalUniversity,Shenyang110004,China
Objective:To compare the difference of serum levels of M-phospholipaseA2 receptor(PLA2R) antibodies in patients with idiopathic membranous nephropathy(IMN) detected by two different methods and evaluate the diagnostic value of two methods.Methods: Patients diagnosed as membranous nephropathy and other diseases with biopsy-proven from december 2014 to october 2015 in Shengjing Hospital of China Medical University were enrolled and devided into IMN group and non-IMN group.The serum levels of anti-PLA2R antibody were detected by both indirect immunofluorescence assay(IFA) and enzyme linked immunosorbent assay(ELISA).Results: The sensitivity of IFA and ELISA in IMN were 71.3% and 68.5%,and the specificities of two methods were the same as 100%.The area under ROC curves of anti-PLA2R antibody for IMN diagnosis were 0.860 and 0.839.The diagnostic value of IFA and ELISA was no statistically significant differences in IMN(P>0.05),and the consistency of two methods was better(κ=0.876).The IMN patients of positive anti-PLA2R antibody be susceptible to the low level of serum albumin (P<0.05).The higher levels of PLA2R antibody were linked with the worse hypoproteinemia and the higher rate of nephrotic-range proteinuria in IMN patients.Conclusion: Two methods of detecting sera PLA2R antibody have higher sensitivity and specificity,so the sera anti-PLA2R antibody was a better biomarker in the diagnosis of idiopathic membranous nephropathy.
Idiopathic membranous nephropathy;M-phospholipase A2 receptor;Antibodies
10.3969/j.issn.1000-484X.2017.02.016
程桂雪(1990年-),女,在读硕士,主要从事膜性肾病分子诊断方面的研究。
及指导教师:秦晓松(1972年-),女,博士,教授,主要从事肾病分子诊断方面研究,E-mail:qinxs@sj-hospital.org。
R392
A
1000-484X(2017)02-0242-06
