IL—6对结直肠癌耐药相关性研究
2017-02-23林琳庞雄昊刘爱学李美香
林琳 庞雄昊 刘爱学 李美香
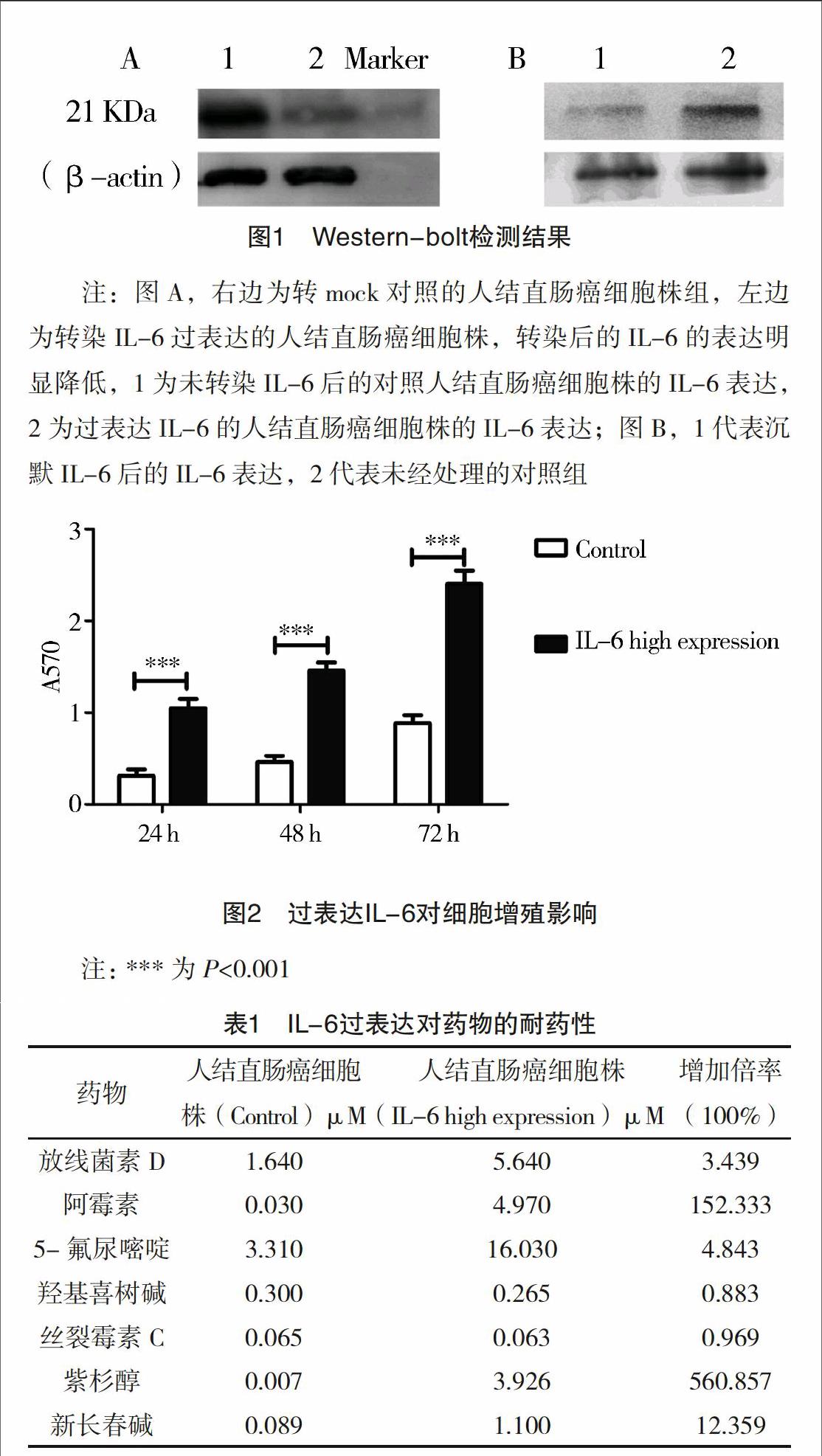

【摘要】 目的:探讨白介素6的表达对结直肠癌耐药性的影响。方法:运用RNA过表达技术对原代培养的结直肠癌患者细胞株进行IL-6的过表达,Western-blot进行过表达的验证,确保IL-6在细胞中过表达,检测过表达IL-6和其相应的对照组(mock对照)两种细胞株的耐药性,药物选择为放线菌素D、阿霉素、5-氟尿嘧啶、羟基喜树碱、丝裂霉素C、紫杉醇、新长春碱,MTT实验检测这些药物的细胞活力(每个药物至少5个浓度),敏感度用IC50表示。考虑到实验的严谨性,运用si干扰技术干扰IL-6的过表达,然后检测干扰和IL-6后耐药性是否与过表达的细胞株相反。结果:蛋白印迹结果检测IL-6在转入原代培养的结直肠癌患者细胞株中高表达,利用MTT结果将其换算成IC50,耐药性检测结果显示过表达IL-6的结直肠癌患者细胞株的IC50高于其对照组,尤其a阿霉素和紫杉醇两种药物,其IC50相对于对照组分别为152和560倍数,在干扰后耐药性检测其IC50下降。结论:IL-6过表达可以加速结直肠癌患者细胞株耐药性。
【关键词】 结直肠癌; 耐药性; IL-6; 相关性分析
Drug-resistent Relativity Analysis of IL-6 in Colorectal Carcinoma Cell/LIN Lin,PANG Xiong-hao,LIU Ai-xue,et al.//Medical Innovation of China,2017,14(02):028-031
【Abstract】 To discuss the drug-resistent influence of IL-6 in colorectal carcinoma cell.Method:Overexpression IL-6 in colorectal cancer cells by RNA technology,to make sure IL-6 overexpress,we tested it by Western-blot.The drug-resistent relativity of those cells we tested it by IC50,which conversed by MTT,those drug contains Actinomycin D,Doxorubicin,5-Fluorouracil,Hydroxycamptothecin,Mitomycin C,Paclitaxel,Vincristine.Seriously,we used siIL-6 to explain it on the other hand,and then tested drug-resistent.Result:The result of Western-blot showed that IL-6 was overexpression in colorectal carcinoma cell,IC50,which conversed by MTT,showed that the group of overexpress IL-6 was more higher than that of the control group,especially Doxorubicin and Paclitaxel,the increase 152 and 560 folds,but it become reduce after interfence.Conclusion:IL-6 overexpression in colorectal carcinoma cell can accelerate drug-resistent.
【Key words】 Colorectal carcinoma; Drug-resistent; IL-6; Relativity analysis
First-authors address:Shenzhen No.2 Peoples Hospital,Shenzhen 518037,China
doi:10.3969/j.issn.1674-4985.2017.02.008
結直肠癌以其复发率高、转移快、侵袭性强、恶性程度高著称,目前越来越受到科学研究者的关注[1]。现在市场上用来抵抗结直肠癌的药物如阿霉素等为阻断主要抑制DNA合拓扑异构酶Ⅱ,5-氟尿嘧啶、喜树碱(CPT)等类似物作用机制独特主要抑制拓扑异构酶Ⅰ[2-3]。药物耐药性已成为临床上比较棘手的问题,特别是在肿瘤治疗方面,关于其耐药性机制的有关研究已有很多报道,在这些研究报道中研究较多的是MDR1编码的P糖蛋白,过表达MDR相关的转运蛋白,如P糖蛋白和MRP1会导致肿瘤细胞抵抗化疗药物[4-6]。
细胞因子作为细胞间链接的中介物,起到非常重要的作用,包括细胞增殖、分化、凋亡、信号转导和体内稳态,体内细胞因子的紊乱会导致各种疾病,包括乳腺癌、宫颈癌、卵巢癌,有些细胞因子能限制肿瘤细胞的生长,有些则能抑制肿瘤细胞的生长,据报道细胞因子的失调与肿瘤的进程有关系[7-10]。
白细胞介素6(IL-6),能使B细胞前体成为产生抗体的细胞,和集落刺激因子协同,能促进原始骨髓源细胞的生长和分化,增强自然杀伤细胞的裂解功能。最初其发现在白细胞中发挥作用,随着研究的深入发现在部分骨髓细胞和肿瘤细胞也可以产生和分泌IL-6[11-13]。IL-6作为一种多效应的细胞因子能调节细胞各种功能,包括细胞增殖和分化,免疫防疫。也有报道研究表示IL-6与肿瘤发生发展关系密切,其机制在于通过干预细胞粘附和表面抗原的表达来影响肿瘤的进展[14-17]。但是IL-6在结直肠癌中的耐药性问题报到少见,基于此笔者集中在研究IL-6与结直肠癌耐药性的关系。现报道如下
1 材料与方法
1.1 细胞株选择 人结直肠癌细胞株选自结直肠癌患者肿瘤原代培养,10%FBS的DMEM培养基中(青霉素和链霉素各100 U/mL),置于37 ℃,5%CO2中培养,25 g/L胰酶消化,实验用细胞均处于生长对数期。
1.2 实验方法
1.2.1 稳定转染过表达的IL-6和低表达的结直肠癌细胞 将处于对数期的人结直肠癌细胞株种于六孔板中,保证每孔细胞量为(3~8)×105,lipo2000加入5 μL用100 μL无血清培养基混匀,静置5 min,同时过表达IL-6的质粒12 μL于100 uL无血清的培养基中混匀,5 min后两者混匀20 min,然后加入1800 μL的无血清培养基,48 h后提蛋白Western-blot检测。
1.2.2 蛋白的提取 (1)运用碧云天蛋白试剂盒提取细胞上清蛋白(由于IL-6是外分泌蛋白所以需要提取细胞上清进行蛋白检测)。(2)用BCA进行定量。按照A液比B液以50∶1的比例进行配置BCA溶液。取收集的细胞上清2 μL,加入18 μL PBS,200 μL AB混合液。(3)将所有蛋白样品用补足液调至等浓度,同时加入1X的溴酚蓝,占比总体积的1/5。
1.2.2.1 SDS-PAGE 电泳:(1)上样前将胶板下的气泡赶走;(2)所有蛋白样品调至等浓度后上样,蛋白上样量保证在一定浓度上进行,同时加入6 μL蛋白marker;(3)以初始电压为80 V跑浓缩胶,然后升至120 V跑分离胶;(4)在目的蛋白泳动至距胶下缘1 cm以上结束;浸泡PVDF膜:将PVDF膜泡在甲醇中5 min。转膜:切除浓缩胶,将分离胶至于滤纸上,胶的上面为PVDF膜,按顺序铺上膜与每侧1张(干转每侧3张)滤纸。恒流250 mA,90 min,然后将膜从电转槽中取出,TBST稍加漂洗,5%脱脂牛奶封闭液中缓慢摇荡1 h。TBST稍加漂洗,一抗孵育过夜,第2天将其放在常温复温40 min,然后TBST漂洗膜3次,5 min/次。根据一抗来源选择二抗,室温轻摇1 h。二抗孵育结束后,用TBST漂洗膜3次,5 min/次。对洗后的PVDF膜发光显影,用ECL发光液进行发光显影,配置方法为A液比B液1∶1进行配置,进行发光显影。
1.2.2.2 耐药性检测 (1)接种细胞:用含10%胎小牛血清得培养液配成单细胞悬液每孔1000~10 000细胞接种96孔板每孔体积200 μL。(2)待人結直肠癌细胞株贴壁后,每孔加MTT(噻唑蓝)溶液(5 mg/mL用PBS配制pH=7.4)20 μL。继续孵育
4 h终止培养小心吸弃孔内培养上清液对于悬浮细胞需要离心再吸弃孔内培养上清液每孔加150 μL DMSO振荡10 min使结晶物充分融解。(3)选择490 nm波长酶标仪上测定各孔光吸收值记录结时间,横坐标吸光值纵坐标绘制细胞生长曲线。(4)IC50是半抑制率,意思是抑制率50%的时候药物的浓度。将药品稀释成不同的浓度,然后计算各自的抑制率,以药品的浓度为横坐标,抑制率为纵坐标作图,然后得到50%抑制率时候的药品浓度,就是IC50。
1.3 试剂 胎牛血清FBS购于Hyclone,MTT配置MTT 0.5 g,溶于100 mL磷酸缓冲液(PBS),用0.22 μm滤膜过滤以除去溶液里的细菌,放4 ℃避光保存即可,siIL-6购于广州锐博生物公司,IL-6 antibody 购于Santa(SC1269),二抗均购自于北京中衫金桥公司。
1.4 统计学处理 本研究所有数据均采用SPSS 18.0统计软件包和Sigmaplot软件分析作图,采用t检验比较各组间是否具有统计学差异,P<0.05为差异有统计学意义。
2 结果
2.1 直肠癌细胞株转染效率检测 为了构建IL-6过表达和低表达的人结直肠癌细胞株细胞株,将IL-6过表达的质粒按照上述转染方法转染人结直肠癌细胞株,Western-bolt检测结果,见图1。
2.2 过表达的IL-6和未经转染的人结直肠癌细胞株细胞系中耐药性检测 将未转染的细胞和转染过表达IL-6的人结直肠癌细胞株细胞株中进行耐药性检测,耐药性检测多采取MTT法,取24、48、72 h三个时间点测量在波长570 nm时的吸光度值,见图2,相比于未转染组IL-6过表达组对肿瘤细胞系起到促进生长作用,表1为各个药物对两种细胞系的IC50值,相比来说未经转染的人结直肠癌细胞株药物浓度相比转染过表达IL-6的结直肠癌细胞更高,尤其是阿霉素和紫杉醇两种药物。
2.3 沉默IL-6后表达耐药性检测 正向实验已经证实在IL-6高表达时人结直肠癌细胞系的耐药性增高,但是反向实验未得到证实,如低表达IL-6的IL-6后耐药性的检测。笔者同样采取MTT增值实验检测其对细胞增殖的影响,同理检测其IC50后发现之前过表达IL-6时的7种药物,其IC50均有明显下调,见图3和表2。
3 讨论
随着生活节奏的加剧,结直肠癌的发生率逐年升高。结直肠癌以其复发率高、转移快著称,目前越来越受到科学研究者的关注。在美国,人结直肠癌细胞株的患病率达到每年4000人,虽然现在医疗设施的不断更新,其治疗效果也得到明显改善,但是其耐药性是困扰广大医生和患者的一个难题,所以解决肿瘤耐药性对肿瘤的治疗时具有重要意义的[18-19]。
细胞因子调控药物耐受性的潜在分子机制还未清楚,但是细胞因子可以调控很多药物耐受性基因。有研究报道,IL-6、IL-8在很多种肿瘤中有表达,IL-6促进肿瘤的浸润和药物抗性的机制是通过上调X-linked inhibitor of apoptosis(XIAP)来进行。也有报道IL-6能上调MDR1(multidrug resistance receptor1)的表达,化疗药物不仅能上调P糖蛋白(P-gp),还能加速IL-6、IL-8的累积,但是IL-6、IL-8如何调控MDR蛋白的表达还需更进一步的研究[20-21]。
本研究集中在IL-6和人結直肠癌细胞耐药性的相关性分析,首先通过基因过表达技术在人结直肠癌细胞株中过表达IL-6,并由Western-blot检测,将获得的IL-6过表达人结直肠癌细胞株和相应的其对照组检测放线菌素D、阿霉素、5-氟尿嘧啶、羟基喜树碱、丝裂霉素C、紫杉醇、新长春碱七中药物的耐药性,尤其是阿霉素和紫杉醇两种药物,其耐药性明显高于对照组。初步得出结论,IL-6过表达可以加剧人结直肠癌细胞株耐药性,再次利用反向实验证实这一结果,运用si干扰技术干扰IL-6后再次检测药物耐药性,结果为与对照组相比,其IC50值均明显下降,此正反实验进一步佐证了实验结果。
本研究的亮点在于在国内较早提出IL-6过表达可以加剧人结直肠癌细胞株耐药性,并通过正反实验证实了这一结果。其研究弊端在于没有研究IL-6如何加速人结直肠癌细胞耐药性,或则说其研究机制还需更进一步的研究,但是本次研究为后续的研究提供了基础。
参考文献
[1] Youlden D R,Cramb S M,Dunn N A,et al.The descriptive epidemiology of female breast cancer:an international comparison of screening,incidence,survival and mortality[J].Cancer Epidemiology,2012,36(36):237-248.
[2] Tiwari A K,Sodani K,Dai C L,et al.Revisiting the ABCs of multidrug resistance in cancer chemotherapy[J].Current Pharmaceutical Biotechnology,2010,12(4):570-594.
[3] Foulkes W D,Smith I E,Reis-Filho J S,et al.Triple-negative colorectal carcinoma[J].N Engl J Med,2010,363(20):1938-1948.
[4] Creighton C J,Li X,Landis M,et al.Residual breast cancers after conventional therapy display mesenchymal as well as tumor-initiating features[J].Proceedings of the National Academy of Sciences,2009,106(106):13 820-13 825.
[5] Hennessy B T,Gonzalez-Angulo A M,Stemke-Hale K,et al.Characterization of a naturally occurring breast cancer subset enriched in EMT and stem cell characteristics[J].Cancer Research,2009,69(10):4116-4124.
[6] Markkula A,Hietala M,Henningson M,et al.Clinical profiles predict early nonadherence to adjuvant endocrine treatment in a prospective breast cancer cohort[J].Cancer Prev Res(Phila),2012,5(5):735-745.
[7] Bower J E,Ganz P A,Irwin M R,et al.Cytokine genetic variations and fatigue among patients with breast cancer carcinoma[J].J Clin Oncol,2013,31(13):1656-1661.
[8] Zhou X,Fragala M S,McElhaney J E,et al.Conceptual and methodological issues relevant to cytokine and inflammatory marker measurements in clinical research[J].Curr Opin Clin Nutr Metab Care,2015,13(5):541-547.
[9]Baraldi-Junkins C A,Beck A C,Rothstein G,et al.
Hematopoiesis and cytokines.Relevance to cancer and aging[J].Hematol Oncol Clin North Am,2012,14(1):45-61.
[10] Lin Y,Huang R,Chen L P,et al.Profiling of cytokine expression by biotin-labeled-based protein arrays[J].Proteomics,2013,3(9):1750-1757.
[11] Huang M,Wang L,Ma H,et al.Lack of an association between interleukin-6-174G/C polymorphism and circulating interleukin-6 levels in normal population:a meta-analysis[J].DNA Cell Biol,2013,32(11):654-664.
[12] Cole S W,Arevalo J M,Takahashi R,et al.Computational identification of gene-social environment interaction at the human IL6 locus[J].Proc Natl Acad Sci USA,2010,107(12):5681-5686.
[13] Qian B Z,Li J,Zhang H,et al.CCL2 recruits inflammatory monocytes to facilitate breast-tumour metastasis[J].Nature,2011,475(7355):222-225.
[14] Ma X J,Salunga R,Tuggle J T,et al.Gene expression profiles of human breast cancer carcinoma progression[J].Proc Natl Acad Sci USA,2013,100(10):5974-5979.
[15] Stormes K A,Lemken C A,Lepre J V,et al.Inhibition of metastasis by inhibition of tumor-derived CCL5[J].Breast Cancer Research and Treatment,2005,89(2):209-212.
[16] Khankhanian P,Baranzini S E,Johnson B A,et al.Sequencing of the IL6 gene in a case-control study of cerebral palsy in children[J].BMC Med Genet,2013,14(1):126
[17] Empana J P,Jouven X,Canoui-Poitrine F,et al.C-reactive protein,interleukin 6,fibrinogen and risk of sudden death in European middle-aged men: the PRIME study[J].Arterioscler Thromb Vasc Biol,2015,30(10):2047-2052.
[18] Gottesman M M.Mechanisms of cancer drug resistance[J].Medicine,2002,53(53):615-627.
[19] Youlden D R,Cramb S M,Dunn N A,et al.The descriptive epidemiology of female breast cancer carcinoma:an internationalcomparison of screening, incidence,survival and mortality[J].Cancer Epidemiol,2012,36(3):237-248.
[20] Anderson D R,Poterucha J T,Mikuls T R,et al.Thiele GM IL-6 and itsreceptors in coronary artery disease and acute myocardial infarction[J].Cytokine,2013,62(3):395-400.
[21] Duan Z,Lamendola D E,Penson R T,et al.Overexpression of IL-6 but not IL-8 increases paclitaxel resistance of U-2OS human osteosarcoma cells[J].Cytokine,2013,17(5):234-242.
(收稿日期:2016-11-11) (本文編辑:程旭然)
