FBXW7在结直肠癌中的表达及其与结直肠癌相关性的研究
2017-02-23姜树中花佳佳张玲燕肖明兵
姜树中 花佳佳 张玲燕 肖明兵
【摘要】 目的:闡明FBXW7的表达及与结直肠癌发生、发展及预后之间的关系。方法:收集结直肠癌及癌旁组织新鲜标本16例,利用实时定量PCR测定FBXW7的表达,并与各临床病理参数进行单因素分析及多因素Cox 比例风险回归模型分析,明确其与结直肠癌患者生存期关系。结果:RT-PCR法显示FBXW7在癌组织中的表达明显低于癌旁组织,差异有统计学意义(P<0.05);免疫组化结果显示FBXW7主要表达于细胞核,且其在癌旁组织中表达阳性率(79.7%)明显高于结直肠癌组织(54.2%);结直肠癌患者生存期关系的单因素分析结果显示,肿瘤的分化程度、有无淋巴结转移、有无远处转移、肿瘤浸润深度、Dukes分期及FBXW7的表达与结直肠癌患者生存期长短有相关性(P<0.05),而结直肠癌患者的性别、年龄、肿瘤的部位、肿瘤的直径、肿瘤大体分型与结直肠癌患者生存期长短均无相关性(P>0.05)。FBXW7阳性为影响结直肠癌患者生存期的独立因子,风险度为2.42,差异有统计学意义(P=0.015<0.05)。结论:FBXW7在癌组织中不表达或低表达而在癌旁组织高表达;FBXW7可能是影响结直肠癌患者生存期的独立因子且其表达与结直肠癌发生发展及预后之间有一定关系。
【关键词】 FBXW7; 结直肠癌; 独立因子; 研究
Expression of FBXW7 and Its Correlation with Colorectal Cancer/JIANG Shu-zhong,HUA Jia-jia,ZHANG Ling-yan,et al.//Medical Innovation of China,2017,14(02):008-012
【Abstract】 Objective:To elucidate the expression of FBXW7 and its effect on the occurrence,development and prognosis in colorectal cacer.Method:A total of 16 cases of fresh colorectal cacer and adjacent tissues were collected and detected FBXW7 expression by real-time PCR,then analyzed by univariate analysis and multivariate Cox proportional hazards regression model analysis with various clinicopathological parameters to clarify its relationship with the survival of patients with colorectal cancer.Result:RT-PCR showed that the expression of FBXW7 was lower than that of adjacent tissue(P<0.05).Immunohistochemistry results showed that FBXW7 mainly expressed in the nucleus and its expression in the pericarcinous tissue(79.7%) was significantly higher than that of colorectal cancer tissue(54.2%).According to the results of single factor analysis of the surial in patients with colorectal cancer,the degree of tumor differentiation,having or not lymph node metastasis,with or without distant metastasis,tumor infiltrated depth,Dukes staging and the expression of FBXW7 were correlated with the the survival of colorectal cancer patients(P<0.05),but there were no correlation between sex,age,tumor site,tumor diameter,tumor general classification with the survival of colorectal cancer patients(P>0.05).FBXW7 was the independent factor of the survival of colorectal cancer patients and the risk degree was 2.42,P=0.015<0.05.Conclusion:FBXW7 expresses in pericarcinous tissue and with low or no expression in colorectal cacer.FBXW7 might be the independent factor of the survival of colorectal cancer patients and its expression correlated with the the occurrence,development and prognosis in colorectal cacer.
【Key words】 FBXW7; Colorectal cancer; Independent factor; Study
First-authors address:The Sixth Peoples Hospital of Nantong,Nantong 226011,China
doi:10.3969/j.issn.1674-4985.2017.02.003
结直肠癌是常见的消化系统恶性肿瘤之一,在全世界范围内的发病率位居第三位,仅次于肺癌和胃癌,严重威胁着人类的健康。近二十几年来结直肠癌的5年总体生存率在50%~60%,目前治疗结肠癌的首选治疗方法依旧是手术切除配合化疗或放疗等[1]。在一样的治疗干预下,早期结肠癌5年生存率90%以上,而晚期低于10%,预后很差[2]。所以早期发现、早期诊断和早期治疗,是提高结肠癌患者存活率的关键[3]。可是因为早期结肠癌患者临床症状较轻或者没有显著的临床表现,造成早期发现和诊断相对困难,一旦发现大多处于晚期,预后很差。FBXW7作为抑癌因子和肿瘤转移抑制因子已被证实[4],但其在结直肠癌发生发展中的具体作用机制以及对预后的判断等还不完全明确[5]。本研究将建立合适的实验模型、扩大样本量,采取更多的实验方法来尽可能明确其在结直肠癌关键作用,以期为结直肠癌的早期诊断、判断预后及靶向治疗提供一个新的途径,现报道如下。
1 材料与方法
1.1 主要材料
1.1.1 标本来源 RT-PCR组织标本:收集来自于南通大学附属医院及南通市第六人民医院住院手术治疗的结直肠癌及配对的癌旁组织新鲜标本16例,新鲜组织离体后去除出血、坏死及电灼组织,用生理盐水洗去血污,30 min内置于-70 ℃冰箱内保存,用作RNA提取。免疫组化研究对象及标本:结直肠癌及癌旁石蜡组织标本来源于2004年4月-2015年2月南通大学附属医院住院手术患者,入选结直肠癌及癌旁组织标本共59对。其中男36例,女23例;年龄<69岁29例、≥69岁30例;肿瘤部位在右半结肠33例,左半结肠及直肠26例;肿瘤直径≤5 cm 32例,>5 cm 27例;大体分型为肿块型27例,溃疡型32例;病理类型均为腺癌;分化程度为高分化10例,中分化42例,低分化7例。病理分级采用常用国际Dukes分期法,A期15例,B期26例,C期14例,D期4例;术后中位生存期为50个月。结直肠癌诊断及分期根据国际抗癌联盟(UICC)制定的标准。
1.1.2 实验试剂 TRIZOL RNA抽提试剂购自美国Invitrogen公司,逆转录试剂盒购自美国Fermentas公司,免疫组化染色试剂盒(PV-9003)和DAB酶底物显色试剂盒均购自北京中杉金桥生物技术有限公司,抗FBXW7抗体及二抗购自美国Santa Cruz公司。
1.2 实验流程与方法
1.2.1 RNA抽提、逆转录和RT-PCR 取出高温高压消毒后研钵,切取50~100 mg冰冻组织置于研钵内,倒入液氮,研碎,直至看不见组织和细胞碎片,加入1 mL的TRIZOL后将匀浆标本转移到1.5 mL的EP管中,室温放置5 min;加入0.2 mL的氯仿,加盖摇晃15 s,在15~30 ℃放置2~3 min,离心12 000 r/min,15 min,离心后分成三层,将上层水相转移到另一干净的EP管中, 加入0.5 mL异丙醇,静置10 min,离心12 000 r/min,10 min,去上清,加入1 mL 75%乙醇洗涤RNA沉淀,振荡器混匀,离心7500 r/min,5 min,去上清,置真空或空气中5~10 min,干燥RNA沉淀;用无RNase水重悬RNA沉淀,用枪头反复吹打几次,55~60 ℃静置10 min,测浓度后-20 ℃保存。
在20 μL体系中,加入1 μg总RNA,1 μL gDNA Eraser,2 μL 5×DNA Eraser Buffer和RNase-Free水至10 μL。混匀后于42 ℃保温2 min,4 ℃置于冰上。向反应体系中先后加入5 uL RNase-Free水,
2 μL 5 × PrimeScript Buffer 2,1 μL RT Primer Mix,1 μL PrimeScript RT Enzyme Mix 1,37 ℃孵育15 min,85 ℃孵育5 s,進行逆转录反应;在冰上加入12.5 μL SYBR PremixEX TapTM Ⅱ(2×),1 μL PCR Forward Primer,1 μL PCR Reverse Primer,2 μL cDNA模板,8.5 μL ddH2O进行Real time PCR反应,设置程序:95 ℃ 30 s, 95 ℃ 5 s,60 ℃ 30 s,72 ℃ 30 s,共40个循环;95 ℃ 15 s;58 ℃ 30 s,95 ℃15 s。以2-?CT法(CT代表循环阈值)计算基因的相对表达量。
1.2.2 免疫组织化学法检测组织中FBXW7表达 所需肿瘤组织经由4%福尔马林固定,自动脱水机脱水,透明,浸蜡处理,包埋成蜡块,切成厚度为4~5 μm的薄片,载玻片要防止脱片。PBS冲洗,抗原修复用柠檬酸盐缓冲液,微波中火10min,流水自然冷却,每张切片加50 μL 3%H2O2,室温下孵育10 min以阻断内源性过氧化物酶的活性,PBS冲洗;除去PBS液,每张切片加50 μL 1∶60稀释的FBXW7鼠抗人单克隆抗体,在室温条件下孵育
1 h,PBS冲洗;除去PBS,每张切片加50 μL聚合物增强剂,室温下孵育20 min,PBS冲洗;除去PBS每张切片加50 μL抗鼠聚合物(poly-HRP anti- rat IgG),室温下孵育30 min,PBS冲洗;除去PBS液,每张切片加50 μL新鲜配制的DAB,室温条件下显色5 min,蒸馏水冲洗。苏木素复染,0.1% HCl分化,自来水冲洗,蓝化,切片经梯度酒精脱水干燥,二甲苯透明,中性树胶封固。以出现淡黄色至棕褐色颗粒且染色强度高于背景特异性着色者为阳性细胞。光镜下半定量结果判断,综合考虑染色强度和阳性细胞数。染色强度分数标准:棕褐色3分;棕黄色2分;淡黄色1分;无着色0分。同样物镜下计数阳性细胞数:一个视野内着色细胞>75% 4分;51%~75% 3分;11%~50% 2分;≤10% 1分;阴性0分。两项得分相乘:0~3分为阴性表达“-”;满3分为“+”;4分为“++”;5分以上为“+++”。“+~+++”为阳性表达。
1.3 统计学处理 采用SPSS 15.0统计软件对结果进行统计分析。实时定量PCR分析结直肠癌及其癌旁组织中FBXW7 mRNA表达结果(RQ值)呈偏态分布,故以中位数(检测范围)表示,轶和检验分析癌与癌旁组织中mRNA表达水平的差异;免疫组化结果中FBXW7蛋白在结直肠癌组织与癌旁组织间表达的比较及FBXW7蛋白表达与各临床病理参数间关系的分析均采用轶和检验;单个临床病理参数与结直肠癌患者生存期的分析采用Logrank单因素生存分析;FBXW7表达与结直肠癌患者生存期关系分析采用Kaplan-Meier生存分析;差异有统计学意义的各临床病理参数间的多因素分析采用Cox比例风险回归模型。以P<0.05为差异有统计学意义。
2 结果
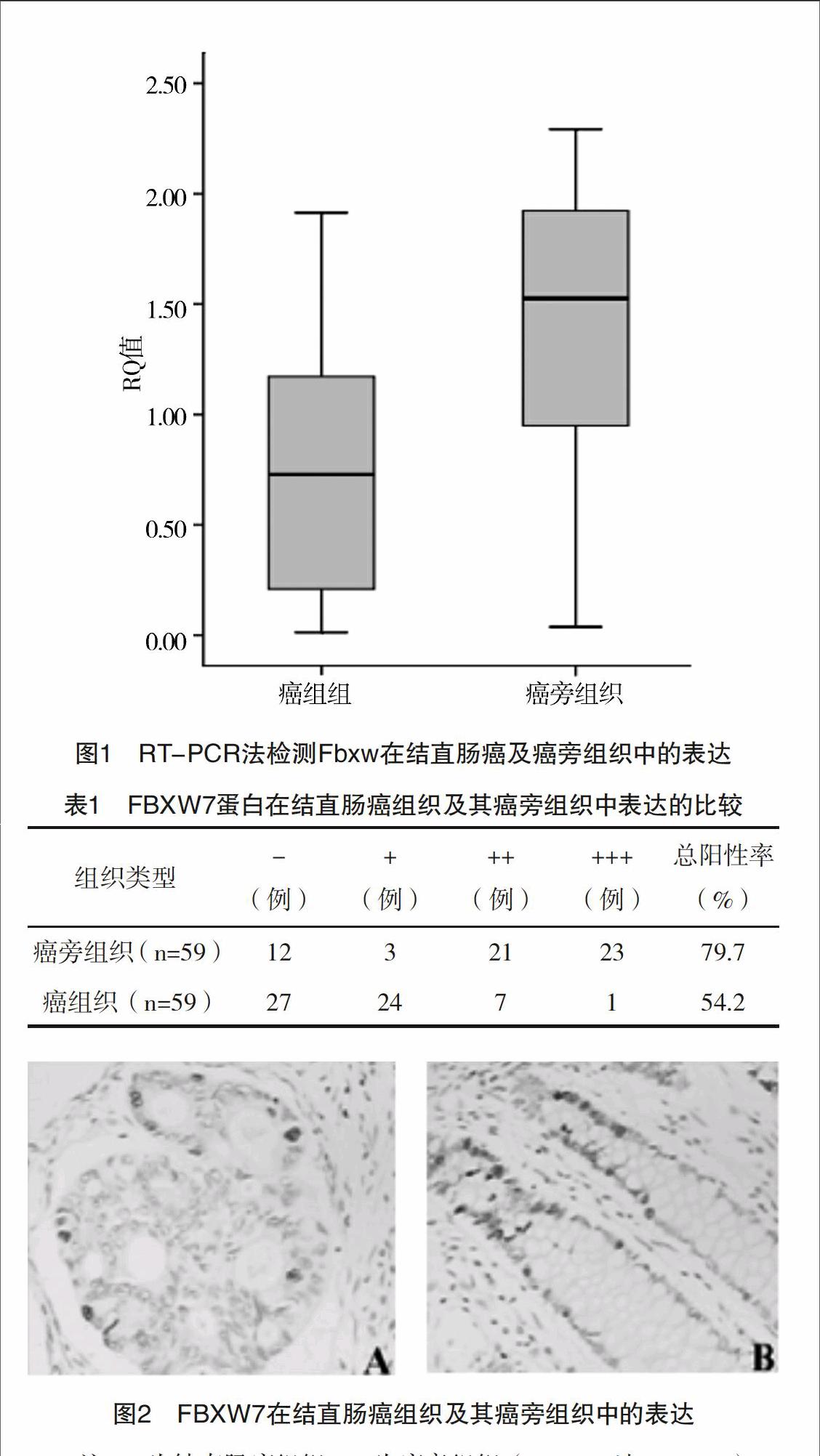
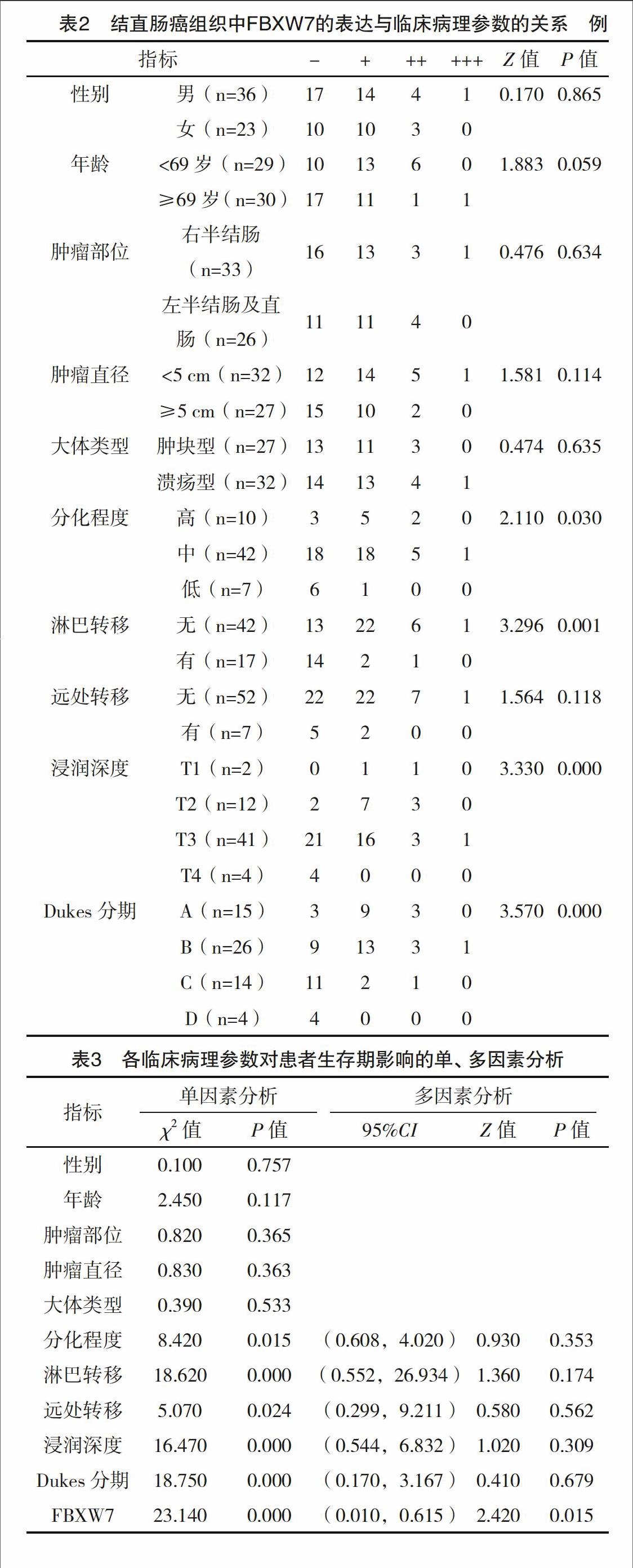
2.1 FBXW7在结直肠癌中低表达而在癌旁组织中高表达 以实时定量PCR测定FBXW7在结直肠癌患者癌及癌旁组织中表达结果。结果显示:FBXW7在癌组织中表达的RQ值为0.693 (0.013~1.914),而在癌旁组织中的结果为1.458 (0.038~2.293),经轶和检验分析,差异有统计学意义(Z=2.374,P=0.0176),说明FBXW7在结直肠癌中低表达而在癌旁组织中高表达,其RQ值箱体图,见图1。免疫组化检测结果显示FBXW7蛋白主要表达于细胞核,随表达强度不同着色可依次表现为淡黄、棕黄至棕褐色不等。59例结直肠癌组织中FBXW7表达阳性率为54.2%(32/59),明显低于癌旁组织79.7%(47/59),且强阳性(++、+++)主要集中在癌旁组织,而结直肠癌组织多为阴性(-、+)表达(Z=5.740,P<0.01),表1和图2。
2.2 结直肠癌组织中FBXW7的表达与临床病理学参数的关系 应用单因素分析结直肠癌组织中FBXW7与临床各病理参数之间的关系。结果显示,肿瘤的分化程度、有无淋巴结转移、有无远处转移、肿瘤浸润深度、Dukes分期及FBXW7阳性与否与结直肠癌患者生存期间长短有相关性(P<0.05)。而结直肠癌患者的性别、年龄、肿瘤的部位、肿瘤的直径、肿瘤大体分型分别与结直肠癌患者生存期间长短均无相关性(P>0.05)。见表2。
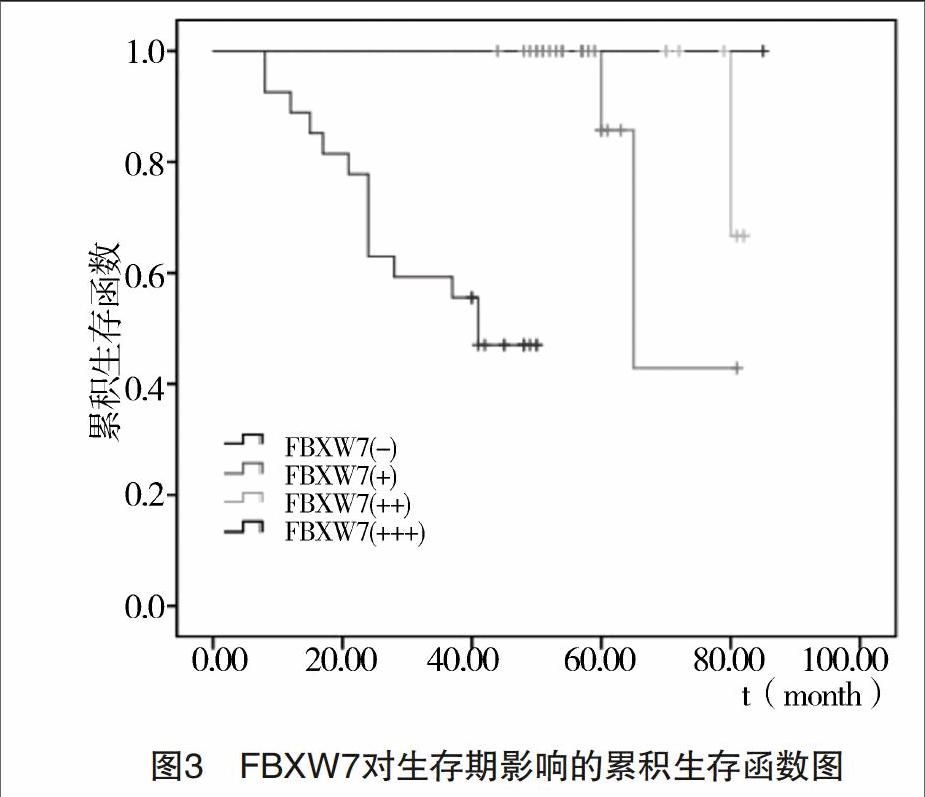
2.3 FBXW7及各临床病理参数与结直肠癌患者生存期Logrank单因素分析及多因素分析 将单因素分析差异有统计学意义的各参数采用多因素Cox 比例风险回归模型进行分析。结果显示:所有因素中FBXW7阳性为影响结直肠癌患者生存期的独立因子,风险度为2.42,P=0.015<0.05,见表3和图3。
3 讨论
泛素蛋白酶体系统(ubiquitin proteasome system,UPS)在调控细胞周期蛋白、细胞的生长和增殖方面起重要作用[6]。泛素化的异常与细胞增殖失调和细胞异常分化有关,被认为是多种人类恶性肿瘤发生的基础[7]。而泛素化作用主要有三种酶组成:泛素激活酶、泛素载体蛋白酶和泛素連接酶,泛素化底物则被26S蛋白酶体选择性识别和降解。SCF类E3复合体作为泛素连接酶(E3)中的一类,由环指蛋白(Rbx1,也称Roc1和Hrt1)、支架蛋白、衔接蛋白(Skp1)和一个F-box蛋白组成,而F-box蛋白类决定了底物特异性[8]。
FBXW7是F-box蛋白家族的一员,作为LIN-12介导(Notch介导)信号通路的负调节因子首次被发现在遗传分析漂亮新小杆线虫中[9]。FBXW7在哺乳动物细胞中也与Notch家族蛋白类相互作用,促进其泛素依赖的更新[10]。而且FBXW7靶向降解数个控制哺乳动物细胞周期进程的蛋白,包括CyclinE、c-Myc和c-Jun等虽不直接参与细胞周期调控的蛋白但也通过FBXW7靶向降解[11]。CyclinE、c-Myc、c-Jun等均是原癌基因的产物,FBXW7能促进降解这些癌蛋白,表明FBXW7作为SCF类泛素连接酶E3复合体中特异性识别底物的一个关键因子,即是一种广泛的肿瘤抑制因子[12]。
已有相关研究表明FBXW7在胆管癌、白血病、宫颈癌等多种人类肿瘤中发生突变[13]。其中在急性T细胞型淋巴细胞白血病、肝癌、食管鳞状细胞癌、肺癌、结直肠癌、胃癌[14]的研究中均已发现FBXW7的表达缺失。FBXW7作为抑癌因子和肿瘤转移抑制因子已被证实,但其在结直肠癌发生发展中的具体作用机制以及对预后的判断等仍未完全明确[15]。
总之,本研究表明FBXW7癌组织中不表达或低表达,癌旁组织高表达,表明FBXW7的表达与结直肠癌发生及发展之间有一定关系;FBXW7阳性为影响结直肠癌患者生存期的独立因子,与结直肠癌的预后有直接关系。下一步可通过研究FBXW7过表达和干扰后对结直肠癌细胞增殖、凋亡、细胞周期和迁徙的影响以期明确其在结直肠癌关键作用,为结直肠癌的早期诊断、判断预后及靶向治疗提供一个新的途径。
参考文献
[1] Yang H,Lu X,Liu Z,et al.FBXW7 suppresses epithelial-mesenchymal transition,stemness and metastatic potential of cholangiocarcinoma cells[J].Oncotarget,2015,6(8):6310-6325.
[2]赵丽中,王宏磊.大肠癌早期诊断研究进展[J].中国肿瘤,2014,23(2):103-108.
[3]邹艳芳,田永,徐峰.Bmi-1和Mel-18基因在大肠癌组织中的表达及意义[J].世界华人消化杂志,2013,21(5):397-402.
[4] Natarajan V,Bandapalli O R,Rajkumar T,et al.NOTCH1 and FBXW7 mutations favor better outcome in pediatric South Indian T-cell acute lymphoblastic leukemia[J].J Pediatr Hematol Oncol,2015,37(1):23-30.
[5] Zhou C,Shen L,Mao L,et al.miR-92a is upregulated in cervical cancer and promotes cell proliferation and invasion by targeting FBXW7[J].Biochem Biophys Res Commun,2015,458(1):63-69.
[6] Tu K,Yang W,Li C,et al.FBXW7 is an independent prognostic marker and induces apoptosis and growth arrest by regulating YAP abundance in hepatocellular carcinoma[J].Mol Cancer,2014,13(1):1-13.
[7]张淑平,吴梦,柯星,等.卵巢癌患者CD4+细胞中调节性T细胞相关分子标志物的表达特点及临床意义[J].实用医学杂志,2015,31(3):370-373.
[8] Yokobori T,Mimori K,Iwatsuki M,et al.Copy number loss of FBXW7 is related to gene expression and poor prognosis in esophageal squamous cell carcinoma[J].Int J Oncol,2012,41(1):253-259.
[9] Yokobori T,Yokoyama Y,Mogi A,et al.FBXW7 mediates chemotherapeutic sensitivity and prognosis in NSCLCs[J].Mol Cancer Res,2014,12(1):32-37.
[10]朱元民,刘玉兰.感染炎症与肿瘤的发生[J].胃肠病学和肝病学杂志,2013,22(2):105-108.
[11]王从玉,邓跃华,刘弋,等.nm23VE6F-C及VEGFR-3在大肠癌中的表达及意义[J].中国肿瘤临床,2008,35(9):1117-1121.
[12] Li L,Sarver A L,Khatri R,et al.Sequential expression of miR-182 and miR-503 cooperatively targets FBXW7, contributing to the malignant transformation of colon adenoma to adenocarcinoma[J].J Pathol,2014,234(4):488-501.
[13] Calcagno D Q,Freitas V M,Leal M F,et al.MYC, FBXW7 and TP53 copy number variation and expression in gastric cancer[J].BMC Gastroenterol,2013,13(36):141.
[14] Li Z,Xiao J,Hu K,et al.FBXW7 Acts as an Independent Prognostic Marker and Inhibits Tumor Growth in Human Osteosarcoma[J].Int J Mol Sci,2015,16(2):2294-2306.
[15] Fu H,Li C,Yang W,et al.FOXP3 and TLR4 protein expression are correlated in non-small cell lung cancer:Implications for tumor progression and escape[J].Acta Histochemica,2013,225(2):151-157.
(收稿日期:2016-10-24) (本文編辑:程旭然)
