hnRNP A2/B1及Mcl-1在乳腺癌中的表达
2017-02-23刘蜀王兰吴培新
刘蜀 王兰 吴培新
hnRNP A2/B1及Mcl-1在乳腺癌中的表达
刘蜀 王兰 吴培新
目的 检测乳腺癌组织中hnRNP A2/B1及Mcl-1的表达水平;分析乳腺癌组织中hnRNP A2/B1与抗凋亡基因Mcl-1表达水平及其相关性。方法 选取贵阳市妇幼保健院2005年1月—2009年1月收治的乳腺癌患者40例,同时选取20例乳腺纤维瘤患者作为对照;采用免疫组化方法检测组织中hnRNP A2/B1及Mcl-1的表达水平。结果(1)40例乳腺癌组织标本中36例有hnRNP A2/B1阳性表达,乳腺纤维瘤组织标本中有3例hnRNP A2/B1阳性表达;40例乳腺癌组织标本中37例有Mcl-1阳性表达,乳腺纤维瘤组织中无表达。乳腺纤维瘤组与乳腺癌组在hnRNP A2/B1及Mcl-1表达水平上差异有统计学意义(P<0.01)。hnRNP A2/B1及Mcl-1的表达水平与乳腺癌的TNM分期、是否发生转移、肿瘤直径、Her-2表达水平显著相关(P<0.01),而与年龄、激素受体、分化程度没有相关性 (P>0.05)。(2)乳腺癌组织标本中hnRNP A2/B1的表达与Mcl-1的表达呈显著性正相关,Pearson相关系数为0.795(P<0.01)。结论 hnRNP A2/B1 及Mcl-1在乳腺癌组织中呈高表达且有明显的相关性,其高表达水平可能与乳腺癌的发生及转移有关。
乳腺癌细胞;hnRNP A2/B1;Mcl-1;细胞凋亡
乳腺癌是危害妇女健康的主要恶性肿瘤,国家原卫生部的统计数据表明2009年以来乳腺癌已经成为中国女性发病率最高的恶性肿瘤。乳腺癌的发生、转移和预后与多种癌基因的突变及异常表达有密切关系。目前认为,信号分子的异常激活在肿瘤发生、转移中起非常重要的作用,其中,以核内不均一性核糖核蛋白(heterogeneous nuclear ribonucleoprotein,hnRNPs)及相关信号分子的激活尤为瞩目[1]。作为hnRNPs家族成员之一的核内不均一核糖核蛋白A2/B1是一个RNA结合蛋白,为hnRNP家族的核心成员,可以通过与下游前体mRNA结合,通过选择性剪切、进行转录后调控[2]。有研究发现hnRNP A2/B1在自身免疫病如系统性红斑狼疮中出现表达上调的现象[3-4],近年来研究发现,hnRNP A2/B1在肺癌及其癌前病变中表达升高,并且与肺癌的上皮间叶转化有关,提示其在肿瘤生成过程中的重要作用[5]。然而,hnRNP A2/B1在乳腺癌中的作用及调控转移的机制目前尚不清楚。
本实验通过检测乳腺癌组织中hnRNPA2/B1及Mcl-1的表达,并对hnRNP A2/B1及Mcl-1表达水平进行相关性分析,探讨二者对乳腺癌发生及转移的影响。
1 材料与方法
1.1 一般资料
1.1.1 实验分组 实验组:女性,40例,选自贵阳市妇幼保健院2005年1月- 2009年1月乳腺癌患者,其中25例发生转移(包括淋巴转移及远处转移),15例未发生转移;对照组:女性,20例,选自贵阳市妇幼保健院2005年1月- 2009年1月乳腺纤维瘤患者。全部病例诊断在术中或术后均经病理学证实,所有乳腺癌病例术前均未接受任何放射治疗或化学疗法。肿瘤组织取出后10分钟内放入福尔马林固定后,做成石蜡切片。
1.1.2 资料 所有患者均记录年龄、肿瘤直径、肿瘤分化程度、乳腺癌TNM分期、是否发生转移、Her-2表达水平,激素受体情况。肿瘤分期根据AJCC(2002,第6版)的乳腺癌TNM分期方法。具体资料见表1。
1.2 主要试剂
hnRNPA2/B1 siRNA(武汉市晶赛生物工程技术有限公司),鼠抗人hnRNP A2/B1单克隆抗体(美国Sigma公司),兔抗人Mcl-1多克隆抗体(武汉博士德生物工程有限公司),SP-9002小鼠免疫组化试剂盒(北京中杉金桥),SP-9005兔免疫组化试剂盒(北京中杉金桥),0.01M PBS (北京中杉金桥),浓缩型DAB试剂盒(北京中杉金桥)。
1.3 免疫组化检测
1.3.1 免疫组化染色 参照免疫组织化学常规方法:脱蜡和水化-去除内源性过氧化物酶的活性-抗原热修复-封闭-Envision多聚体孵育-显色-脱水及透明-中性树胶封片,进行免疫组织化学检测。

表1 乳腺癌患者一般资料
1.3.2 结果判断 每例组织切片随机观察5个高倍(HPFs× 400)视野,并计数500个乳腺癌细胞。按阳性细胞比例将切片分为:(-:无表达<5%;+:5%~25%;++:25%~50%;+++:>50%)。
1.4 统计学处理方法
所有数据应用SPSS 18.0软件进行统计分析,多组均数间的比较采用相关分析和多因素分析的方法,两总体均值的比较采用独立样本秩和检验分析,P<0.05 判定为差异有统计学意义。
2 结果
2.1 免疫组化检测hnRNP A2/B1在乳腺癌细胞中的表达
2.1.1 hnRNP A2/B1表达 在乳腺癌细胞中的表达主要位于胞核内,棕黄色颗粒的为阳性表达,40例乳腺癌组织标本中36例有hnRNP A2/B1阳性表达,而作为对照的20例乳腺纤维瘤组织中只有3例hnRNP A2/B1阳性表达(见表2,图1)。对乳腺癌组与乳腺纤维瘤对照组做两独立样本秩和检验,分析结果显示P<0.01,说明与乳腺纤维瘤相比,hnRNP A2/B1表达水平在乳腺癌组织中显著升高(表格2)。
2.1.2 与临床病理参数的关系 hnRNP A2/B1的表达水平与乳腺癌患者的年龄、分化程度、激素受体水平没有相关性(P>0.1);而与乳腺癌患者的TNM分期、是否发生转移、肿瘤直径及Her-2表达显著相关(P<0.01)(见表3,图1)。

表2 两组组织标本中hnRNP A2/B1阳性表达
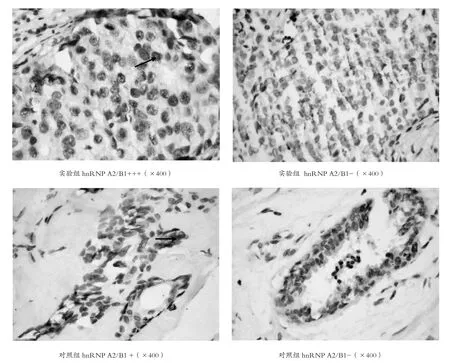
图1 两组组织标本中hnRNP A2/B1的表达
2.2 免疫组化检测乳腺癌细胞中Mcl-1的表达
2.2.1 Mcl-1表达 Mcl-1在乳腺癌细胞中的表达主要位于胞浆内,棕黄色的为阳性表达,40例乳腺癌组织标本中37例有Mcl-1阳性表达,而作为对照的20例乳腺纤维瘤组织中无表达(见表4,图2)。对乳腺癌组与乳腺纤维瘤对照组做两独立样本秩和检验,分析结果显示,P<0.01,说明乳腺纤维瘤组与乳腺癌组在Mcl-1表达水平上存在显著性差异(见表4)。
2.2.2 与临床病理参数的关系 Mcl-1的表达水平与乳腺癌患者的年龄、分化程度、激素受体水平没有相关性(P>0.05);而与乳腺癌患者的TNM分期、是否发生转移、肿瘤直径及Her-2表达显著相关(P<0.01)(见表5,图2)。
2.3 hnRNP A2/B1 与Mcl-1相关性分析
对hnRNP A2/B1表达水平与Mcl-1表达水平做相关分析。两者的Pearson相关系数为0.795(P<0.01),呈明显的正相关性,提示hnRNP A2/B1表达与Mcl-1表达在乳腺癌组织中有显著的相关关系。
3 讨论
核内不均一性核糖核蛋白(hnRNPs)及相关信号分子的激活在肿瘤发生、转移有重要的作用。hnRNP是一种核内的RNA结合蛋白[6],它是由 30多个蛋白质构成的复合体,包括A1-U等 30多个小分子,特别是A、B组为基本核心成分。hnRNP A2/B1是一种重要的RNA连接蛋白,是细胞核中异质性细胞核糖蛋白核心复合体的主要成分,参与许多重要的细胞生理作用,包括RNA 的拼接,Pre-mRNA的成熟和降解,端粒、端粒酶DNA 序列的调节,mRNA 由胞核到胞质的转运、转录后调节,细胞有丝分裂、成熟、分化及凋亡的调节等[7]。目前越来越多的证据支持hnRNP A2/B1与生长调节和癌变存在密切关系[8]。
在本实验中发现40例实验组乳腺癌组织标本中36例hnRNP A2/B1阳性表达,而作为对照组的乳腺纤维瘤组织中只有3例hnRNP A2/B1阳性表达。实验组与对照组在hnRNP A2/B1表达水平上存在显著性差异(P<0.01)。hnRNP A2/B1的表达水平与乳腺癌的TNM分期、是否发生转移、肿瘤直径、Her-2表达水平显著相关(P<0.01),而与年龄、激素受体、分化程度没有相关性(P>0.05)。研究结果表明,hnRNPA2 /B1在正常与良性组织的不表达或低表达,而恶性组织高表达,良性与恶性组织中表达存在明显差异。此外,卢兆桐等[9]在肺癌的研究也发现病变越晚 ,hnRNP A2/B1表达阳性率越高,hnRNP A2/B1的表达水平与乳腺癌TNM分期、肿瘤直径及侵袭转移明显相关。
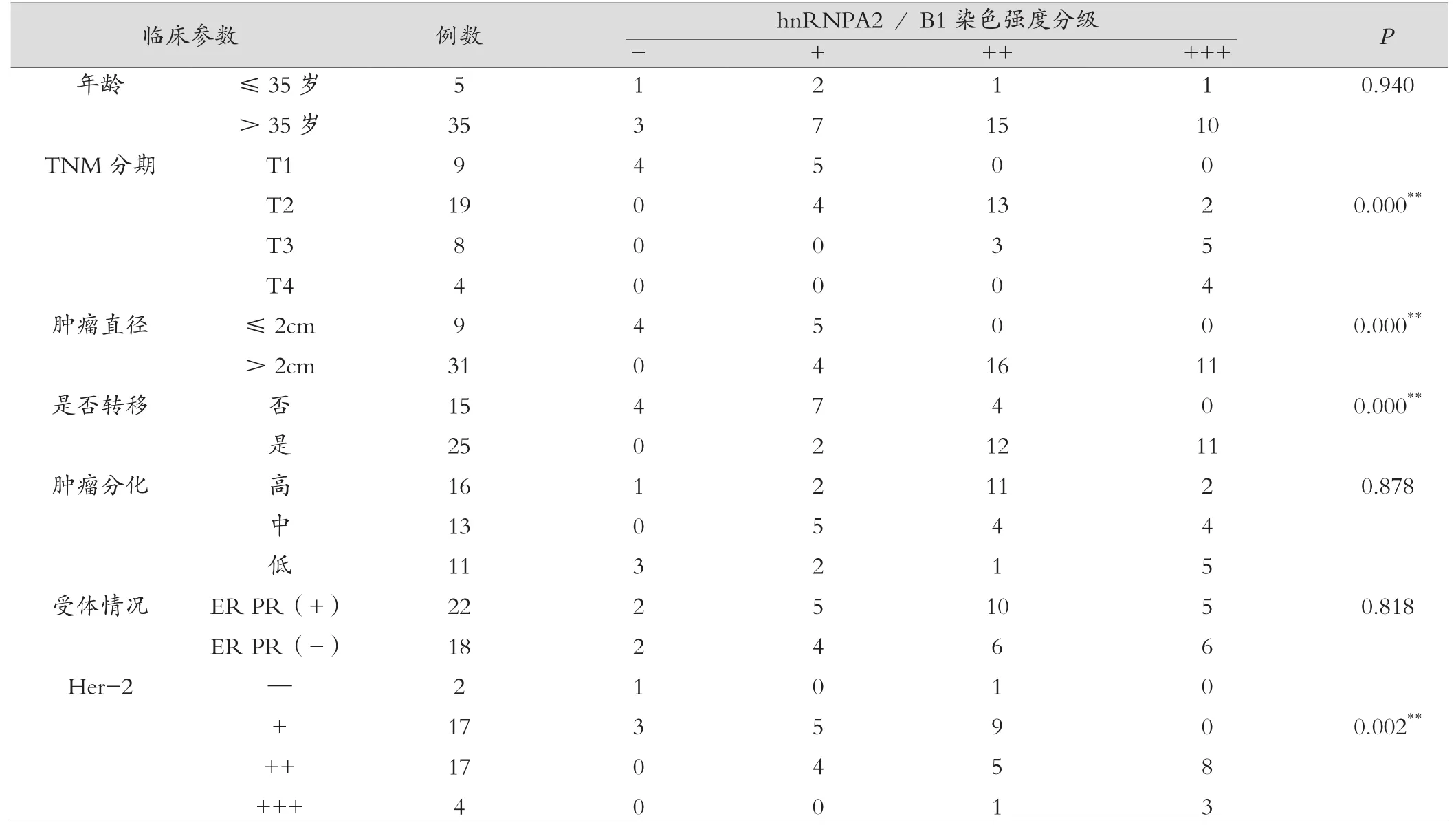
表3 乳腺癌组织标本中hnRNP A2/B1表达水平与临床病理参数之间的关系

表4 两组组织标本中Mcl-1阳性表达

图2 两组组织标本中Mcl-1的表达

表5 乳腺癌组织标本中Mcl-1表达水平与临床病理参数之间的相关性
Bcl-2家族成员在细胞凋亡的基因调控过程中起着至关重要的作用,Mcl-1是Bcl-2家族成员的抗细胞凋亡基因,Mcl- 1基因位于人类染色体 1q21,该区域在肿瘤性疾病及其癌前病变中是一个易变区域,Mcl- 1可与其他蛋白相互作用,调节细胞的凋亡。在实验组的40例乳腺癌组织标本中37例Mcl-1阳性表达,而作为对照组的乳腺纤维瘤组织中无表达,实验组与对照组在Mcl-1表达水平上差异具有统计学意义(P<0.01),而且MCL-1的表达水平与乳腺癌的TNM分期、是否发生转移、肿瘤直径相关(P<0.01),而与年龄、分化程度无关(P>0.05)。表明Mcl-1的表达水平可能与乳腺癌发生及转移有密切关系。本实验还发现hnRNP A2/B1和Mcl-1有明显的相关性,且均与Her-2表达水平呈正相关,而Her-2是乳腺癌的重要预后指标,提示hnRNP A2/ B1和Mcl-1与乳腺癌的预后有关,也提示Mcl-1 的表达水平可以为乳腺癌治疗药物干预提供新的靶点,为乳腺癌的治疗开辟新 途径。
[1] Zech VF,Dlaska M,Tzankov A,et a1. Prognostic and diagnostic relevance of hnRNP A2/ B1,hnRNP B1 and S100 A2 in nonsmall cell lung cancer[J]. Cancer Detect Prev,2006,30(5): 395-402.
[2] Sofola OA,Jin P,Qin Y,et al. RNA-binding proteins hnRNP A2/B1 and CUGBP1 suppress fragile X CGG premutation repeatinduced neurodegeneration in a Drosophila model of FXTAS[J]. Neuron,2007,55(4):565-571.
[3] Pino I ,Pio R,Toledo G,et a l. Altered patterns of expression of members of the heterogeneous nuclear ribonucleo protein(hnRNP) family in lung cancer[J]. Lung Cancer,2009,41(2): 131-143.
[4] E Sueoka,Y Goto,N Sueoka,et al . Heterogeneous nuclear ribonucleoprotein B1 as a new marker of early detection for human lung cancers[J]. Cancer Res,1999,59(7):1404-1407.
[5] Tauler J,Zudaire E,Liu H,et al. hnRNP A2/B1 Modulates Epithelial-Mesenchymal Transition in Lung Cancer Cell Lines[J]. Cancer research,2010,70(18):7137-7147.
[6] 邵志敏. 乳腺癌转移机制的研究及其临床应用[J]. 中华乳腺病杂志(电子版),2009,3(5):475-479.
[7] Zhou J,Mulshine JL,Unsworth EJ,et al. Purification and characterization of a protein that permits early detect ion of lung cancer[J]. J Biol C hem,1996,271(18):10760-10766.
[8] Kamma H,Fujimoto M,Fujiwara M,et al. Interaction of hnRNP A2/B1 Isoforms with Telomeric ssDNA and the in Vitro Function[J]. Biochem Biophys Res Commun,2001,280(3):625-630.
[9] Lu ZT ,Fu Q ,Geng M ,et al. Expression and it s research of het2 erogeneous nuclear ribo nucleoprotein A2/B1 in non2small cell lung cancer[J]. Prac J Med Pharm,2008,20(3):1612-1613.
hnRNP A2/B1 and Mcl-1 Expression in Breast Cancer
LIU Shu WANG Lan WU Peixin Galactophore Department, Guiyang Maternal and Child Health Care Hospital, Guiyang Guizhou 550003, China
Objective To explore the expression of hnRNP A2/B1 and Mcl-1 in breast cancer tissue samples and analyze the correlation between these two genes. Methods 40 breast cancer patients from Guiyang Women and Children’s Hospital since January, 2005 to January, 2009 were included into this study. 20 breast fibroadenoma patients were also included as control. Results (1) 36 of 40 breast cancer tissue samples and 3 of 20 breast fbroadenoma tissue samples were hnRNP A2/B1 positive. 37 of 40 breast cancer tissue samples were Mcl-1 positive, no breast fbroadenoma showed Mcl-1 positive. There was a significant difference of hnRNP A2/B1 and Mcl-1 expression between breast cancer and breast fbroadenoma (P <0.01). The expression of hnRNP A2/B1 and MCL-1 were correlated with breast cancer TNM staging, metastasis, tumor size and Her-2 expression (P < 0.01), while not related with age, hormone receptor and differentiation (P > 0.05). (2) hnRNP A2/B1 and Mcl-1 expression in breast cancer tissue samples showed a positive correlation. The Pearson correlation coeffcient is 0.795 (P < 0.01). Conclulsion hnRNP A2/B1 and Mcl-1 are highly expressed in breast cancer patients and their expressions showed a signifcant positive correlation. The high expression of hnRNP A2/B1 and Mcl-1 may be related with breast cancer carinogenesis and metastasis.
breast cancer cell; hnRNP A2/B1, Mcl-1; apoptosis
R365
A
1674-9316(2017)02-0137-05
10.3969/j.issn.1674-9316.2017.02.087
贵阳市妇幼保健院乳腺科,贵州 贵阳 550003
