携带PEDF基因的骨髓间充质干细胞对小鼠Lewis肺癌的抑制作用
2017-02-22陈巧玲白亦光肖东琴
陈巧玲, 白亦光, 肖东琴, 刘 康 , 冯 刚*
(1川北医学院第二临床医学院,南充市中心医院肿瘤分院,南充 637000; 2川北医学院第二临床医学院,南充市中心医院骨科; 3川北医学院第二临床医学院,南充市中心医院组织工程与干细胞研究所; *通讯作者,E-mail:lssmd18@gmail.com)
携带PEDF基因的骨髓间充质干细胞对小鼠Lewis肺癌的抑制作用
陈巧玲1, 白亦光2, 肖东琴3, 刘 康3, 冯 刚3*
(1川北医学院第二临床医学院,南充市中心医院肿瘤分院,南充 637000;2川北医学院第二临床医学院,南充市中心医院骨科;3川北医学院第二临床医学院,南充市中心医院组织工程与干细胞研究所;*通讯作者,E-mail:lssmd18@gmail.com)
目的 探讨编码色素上皮衍生因子的重组腺病毒(Ad-PEDF)转染的骨髓间充质干细胞(MSCs)对小鼠Lewis肺癌生长和转移的抑制作用。 方法 采用藻酸盐包裹肿瘤细胞实验评估MSCs-PEDF对Lewis肺癌细胞(LL/2)诱导的新生血管形成的抑制作用。C57BL/6小鼠皮下接种LL/2细胞7 d后,将荷瘤小鼠分为4组,每组18只。每组小鼠分别给予尾静脉注射100 μl PBS、1×108PFU Ad-PEDF、5×105MSCs-LacZ或5×105MSCs-PEDF;每3 d用游标卡尺测量一次肿瘤体积。接种后第30天每组处死8只小鼠观察肺转移结节,其余小鼠(n=10)继续观察生存期。 结果 藻酸盐包裹实验显示,与其他三个对照组相比,MSCs-PEDF治疗组的藻酸盐珠表面呈现较少的毛细血管网,FITC标记的葡聚糖摄入量也较其他组低(P<0.01)。MSCs-PEDF组小鼠皮下肿瘤的体积明显小于PBS组、Ad-PEDF组及MSCs-LacZ组[(1 038.8±139.0)mm3vs(2 897.7±274.9)mm3,(2 622.8±359.1)mm3,(3 019.2±360.9)mm3,P<0.01]。MSCs-PEDF组肺转移结节数明显少于PBS组、Ad-PEDF组及MSCs-LacZ组(3.2±2.4vs16.0±4.0,14.6±5.3,16.1±4.9,P<0.05),MSCs-PEDF组小鼠的生存期较其他各对照组显著延长(P<0.01)。 结论 MSCs-PEDF可抑制LL/2皮下瘤的生长和转移,并可延长荷瘤小鼠生存期,提示通过腺病毒转染使MSCs分泌PEDF可作为一种新的针对肺癌的治疗方法。
间充质干细胞; 色素上皮衍生因子; 非小细胞肺癌; 基因治疗
肺癌是人类最常见的恶性肿瘤之一,其中非小细胞肺癌(NSCLC)的发病率较高,是最常见的肺癌类型,约占肺癌总数的85%[1,2]。手术治疗仅对早期NSCLC患者具有较好疗效,而放疗和化疗则会产生严重的毒副作用。因此,亟待开发治疗NSCLC的新策略。
色素上皮衍生因子(PEDF)是一种分子量为50 kD的外分泌糖蛋白,属于丝氨酸蛋白酶抑制因子超家族成员,最初由Tombran-Tink等在胎儿视网膜色素上皮细胞中分离出来,后发现其广泛表达于胚胎和成体组织中。由于PEDF选择性抑制新生血管,而对已形成的血管则无太大影响,使其作为一个有吸引力的抗肿瘤血管生成候选因子而受到关注[3,4]。间充质干细胞(mesenchymal stem cells,MSCs)是具有自我更新和多向分化潜能的非造血系成体干细胞,目前研究发现其具有较低的免疫原性,并可向损伤组织及肿瘤组织靶向迁移。因此,MSCs作为基因和药物的细胞载体显示出巨大的应用前景,并越来越多地运用在肿瘤的基因治疗中[5,6]。
本实验室前期已成功将重组色素上皮源性因子腺病毒(Ad-PEDF)转染MSCs,并在体外采用Western Blot检测到细胞培养上清液中的PEDF表达,ELISA检测培养上清中PEDF浓度为(78.8±4.8)ng/ml。 HUVECs成管抑制实验和迁移抑制实验显示,MSCs-PEDF分泌至培养液上清中的PEDF可显著抑制HUVECs形成小管及向生长因子迁移,证明其分泌的是具有生物活性的PEDF蛋白。相关实验方法及结论已形成论著发表于《西部医学》[7],在此基础上,本研究建立小鼠Lewis肺癌(LL/2)皮下瘤模型,观察携带PEDF基因的MSCs(MSCs-PEDF)在体内对肿瘤生长的抑制作用及小鼠生存期的影响,为肿瘤的靶向治疗提供一种新的治疗策略。
1 材料与方法
1.1 小鼠LL/2肺癌细胞的培养
小鼠Lewis肺癌细胞株(LL/2)及HEK293细胞株均购于美国模式培养物储藏所(American type culture collection,ATCC)。
将LL/2细胞置于含有10%胎牛血清及100 U/ml阿米卡星的DMEM培养基中,在37 ℃、5%CO2、95%湿度条件下的孵箱中培养,以0.25%胰蛋白酶消化并传代, 2-3 d传代1次。
1.2 藻酸盐包裹肿瘤细胞实验
将藻酸钠溶于无菌生理盐水,使其终浓度为1.5%。收集对数生长期的LL/2细胞,将其用1.5%藻酸钠溶液重悬。将该细胞悬液用100 μl加样器缓慢滴入磁力搅拌的250 mmol/L氯化钙溶液中,形成乳白色的藻酸盐小珠,每粒小珠含有LL/2细胞约1×105个。8周龄的C57BL/6小鼠用10%水合氯醛腹腔注射麻醉,消毒并切开背部的皮肤,皮下植入2粒藻酸盐小珠,缝合皮肤,外敷手术胶膜。次日小鼠随机分为4组(3只/组),每组小鼠分别予以尾静脉注射100 μl PBS、1×108PFU Ad-PEDF、5×105MSCs-LacZ或5×105MSCs-PEDF。第12天,每只小鼠经尾静脉注射100 μl FITC标记的葡聚糖(FITC-Dextran,100 mg/kg)。麻醉小鼠后解剖暴露出藻酸盐颗粒(附带部分皮肤),在解剖显微镜下观察并照相。注射FITC-Dextran 20 min后处死小鼠,取出藻酸盐颗粒,加入2 ml生理盐水后捣碎颗粒并混匀标本,室温静置1 h。1 500 r/min离心5 min,取上清液,用荧光酶标仪检测。用不同浓度的FITC-Dextran制备标准曲线。
1.3 小鼠LL/2肺癌皮下瘤模型的建立
6-8周龄C57BL/6雌性小鼠,清洁动物,购自四川大学华西动物实验中心。收集对数生长期的LL/2细胞,1 500 r/min离心3 min,细胞沉淀以无血清培养基洗涤3次,用血球计数板计数细胞数量后调整细胞密度为5×106/ml,无菌条件下送到动物室。在C57BL/6小鼠一侧背部皮下接种LL/2细胞100 μl(5×105个细胞/只)。接种后7-8 d,肿瘤最大径达到3-5 mm,小鼠肿瘤模型即建立成功。
1.4 小鼠分组及治疗
将荷瘤小鼠随机分为4组,每组8只。Ⅰ组:100 μl PBS;Ⅱ组:100 μl 1×108PFU Ad-PEDF病毒液;Ⅲ组:100 μl 5×105MSCs-LacZ;Ⅳ组:100 μl 5×105MSCs-PEDF。分别给予尾静脉注射,每4 d注射1次,共给予2次治疗。
我父亲在省医院看过,不过大医院人多,几百人排队挂号、取药。他可能意识到自己的病没救了,整个人无精打采的,打完针就去睡觉,不愿和人说话。对于我来说,父母亲这么大年纪,去大医院我们不放心,但在莫多寺曼巴照顾得十分周到,我心里特别感谢。在莫多寺看病,活佛让他一边服药,一边鼓励他参加寺院的开示和法会。可能是受活佛的教化,他完全放开了,感觉他有精神了,人也开朗了,有时还和我母亲开开玩笑。[注]访谈人:欧阳丽婷;访谈对象:云丹;访谈时间:2015年9月15日;访谈地点:青海省兴海县莫多寺。
1.5 观察指标
每隔3 d用游标卡尺测量肿瘤长、宽径及小鼠体重,并观察荷瘤小鼠的行动、对外界刺激的反应及饮食情况等。计算肿瘤体积并绘制肿瘤的生长曲线。肿瘤体积计算公式:体积(mm3)=0.52×长2×宽2。在接种后第30天采用断颈法处死小鼠,取心、肝、脾、肺、肾浸泡于4%多聚甲醛固定。每个肿瘤组织取一部分置于-80 ℃冻存,其余部分浸泡于4%多聚甲醛。
1.6 生存分析
为进一步了解PEDF基因修饰的间充质干细胞对LL/2荷瘤小鼠生存期的影响,取40只LL/2皮下瘤模型小鼠随机分为四组,每组10只,分别为PBS组、Ad-PEDF组、MSC-LacZ组、MSC-PEDF组,具体给药及治疗方案完全同皮下瘤的疗效研究。记录每只小鼠的死亡时间。
1.7 统计学分析
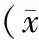
2 结果
2.1 藻酸盐包裹肿瘤细胞实验
通过藻酸盐包裹肿瘤细胞实验观察MSCs-PEDF在体内对肿瘤新生血管形成的抑制作用,结果显示,PBS、Ad-PEDF及MSCs-LacZ组藻酸盐珠表面有较多微血管生成,而MSCs-PEDF组则微血管明显减少(见图1)。FITC-Dextran摄入量检测显示,MSCs-PEDF组较其余3组 FITC-Dextran摄入明显减少(P<0.01)。以上结果说明,MSCs-PEDF可抑制肿瘤细胞诱导的新生血管形成。
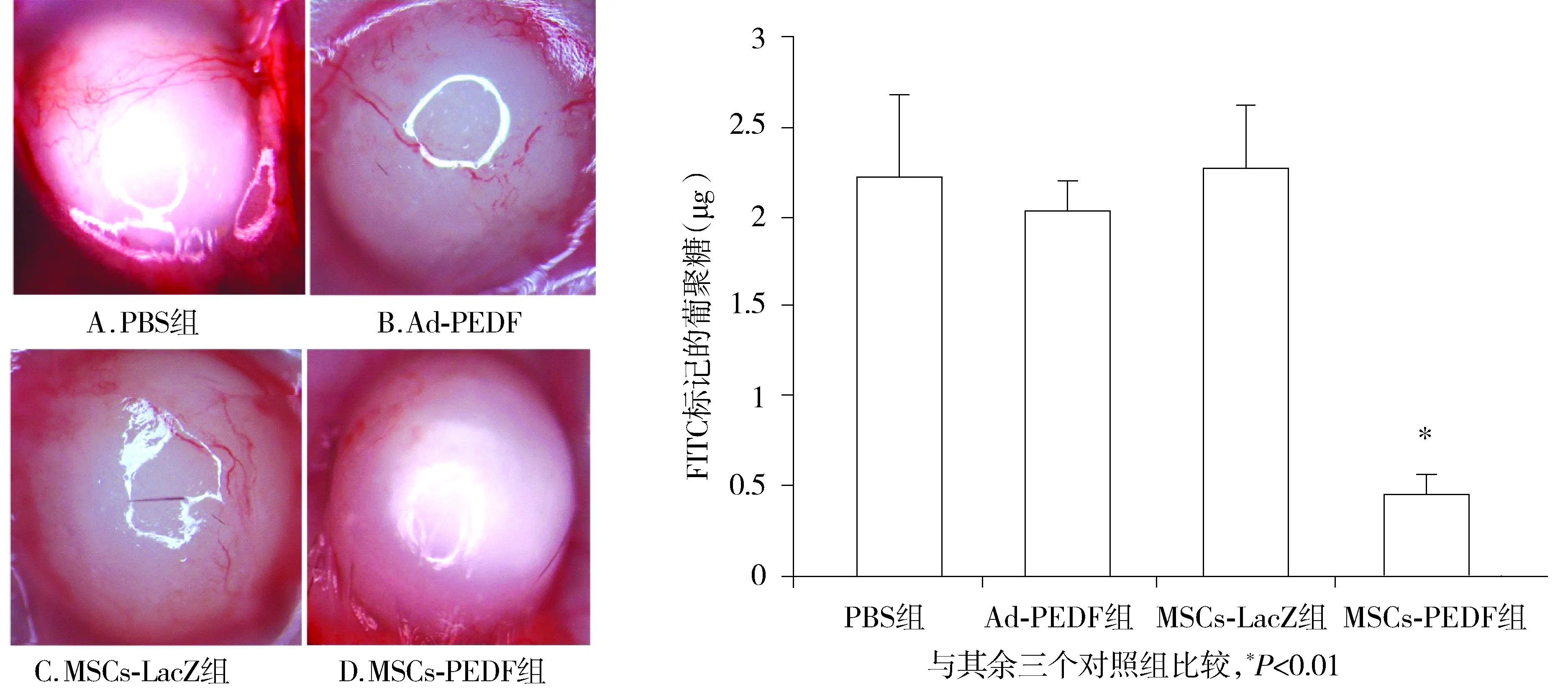
图1 藻酸盐包裹实验观察MSCs-PEDF抑制肿瘤诱导的新生血管形成Figure 1 The antiangiogenic activity of MSCs-PEDF by alginate-encapsulated tumor cell assay
2.2 MSCs-PEDF抑制小鼠LL/2皮下瘤生长
如图2所示,MSCs-PEDF治疗组与其余各组相比,可显著抑制肿瘤生长(P<0.01),MSCs-LacZ治疗组与PBS组相比无显著差异(P>0.05)。而Ad-PEDF组与PBS组比较,仅在给药后短期内对肿瘤稍有抑制作用,而到后期则与PBS组差异不明显(P>0.05)
2.3 MSCs-PEDF对肿瘤肺转移的抑制作用
处死LL/2荷瘤小鼠后, 摘取各组小鼠的肺脏计算肺表面的肿瘤转移结节数,结果显示,MSCs-PEDF治疗明显抑制了肺转移,与其他三组比较差异有统计学意义(P<0.05,见图3)。Ad-PEDF组与PBS组无明显差异(P>0.05)。
2.4 MSCs-PEDF延长LL/2荷瘤小鼠生存期
PBS治疗组于接种后第42 天全部死亡,而对生存期进行Log-Rank(Mantel-Cox)分析显示,MSCs-PEDF治疗组与其余各组相比生存期明显延长,差异有统计学意义(P<0.01,见图4)。
2.5 观察毒副反应
每3d测量1次小鼠体重,作为毒性反应的评估指标。在实验过程中,MSCs-PEDF治疗组与PBS组比较,荷瘤小鼠的体重变化无明显差异(P>0.05,见图5)。同时,各组小鼠的皮毛、食欲、行为等也无特殊改变。表明MSCs-PEDF对小鼠并不产生明显的毒副作用。
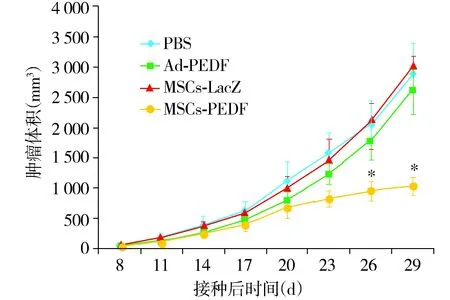
与其余三个对照组比较,*P<0.01图2 MSCs-PEDF对LL/2皮下瘤模型的生长抑制作用Figure 2 MSCs-PEDF inhibited growth in LL/2 subcutaneous tumor model
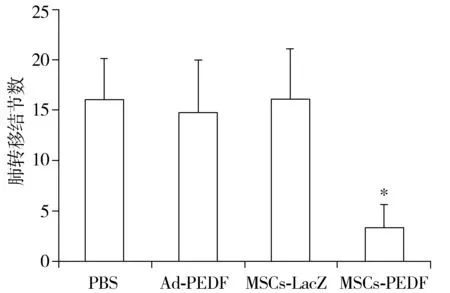
与其余三个对照组比较,*P<0.05图3 不同处理后LL/2皮下瘤肺转移结节计数Figure 3 Lung metastasis nodules number in the LL/2 subcutaneous tumor model in different groups
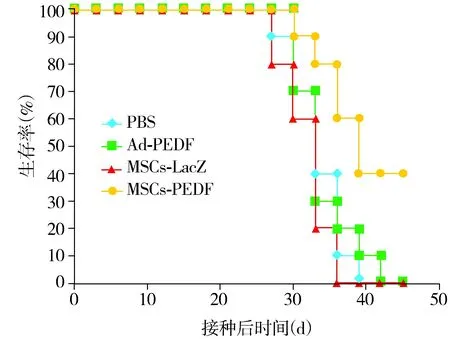
图4 LL/2荷瘤小鼠生存分析Figure 4 Survival analysis of LL/2 tumor bearing mice
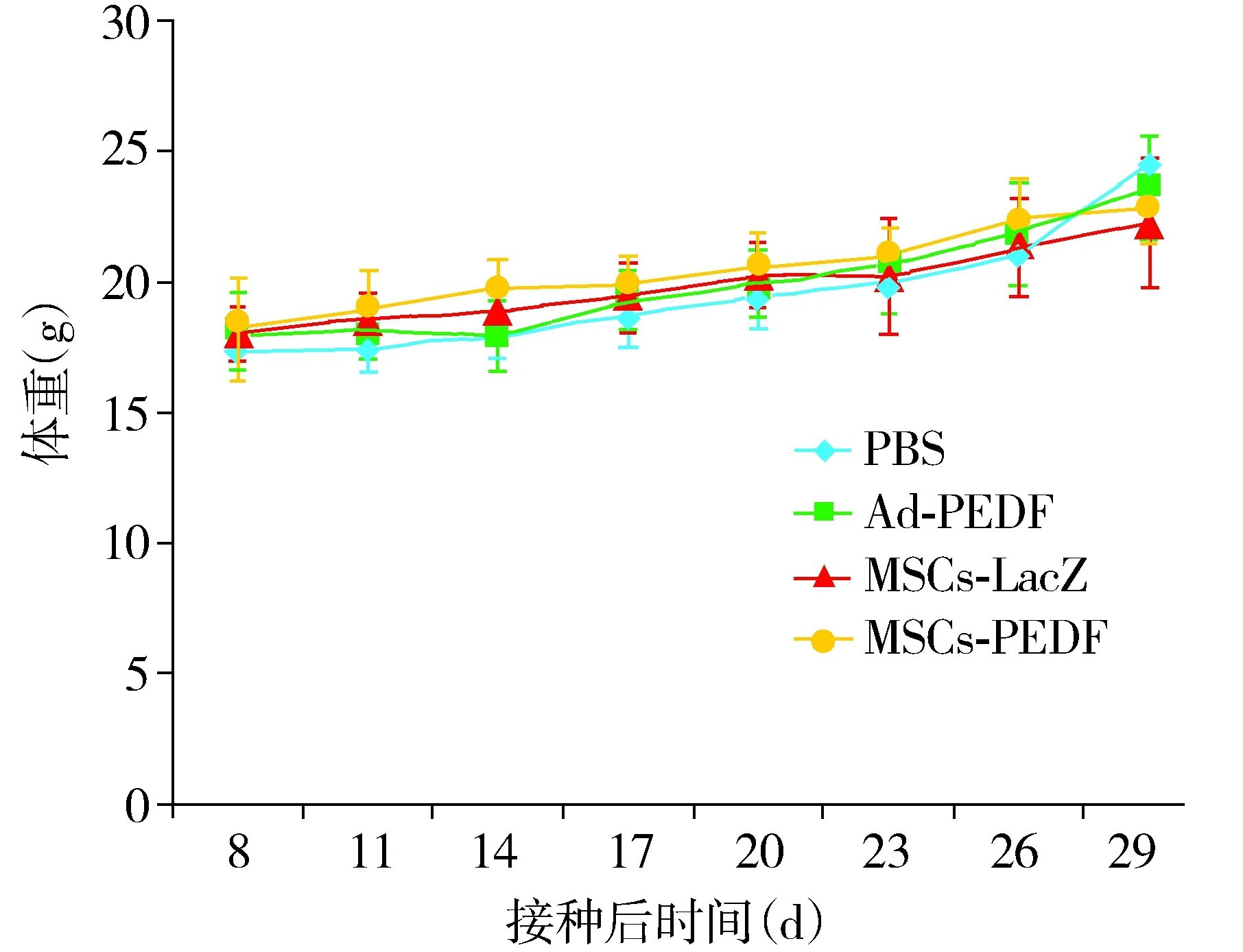
图5 荷瘤小鼠体重改变情况Figure 5 Changes of body weight of tumor bearing mice
3 讨论
肿瘤进展依赖于新的血管网的生成以供给其营养。非小细胞肺癌(NSCLC)是血管依赖性疾病,肿瘤血管生成在NSCLC的发生、发展及转移过程中都发挥着重要作用。如果能有效地阻止NSCLC的血管生成,就有望控制手术或放、化疗治疗后肿瘤的复发和转移[8,9]。
PEDF具有强有力的抗血管生成活性,并且还可通过促进肿瘤细胞凋亡以及诱导肿瘤细胞分化等多种途径来抑制肿瘤细胞的生长和转移。以上的生理特性,奠定了PEDF应用于肿瘤治疗的基础[3]。目前,已有大量的实验研究显示,PEDF在包括NSCLC在内多种肿瘤模型中取得了良好的效果,可显著抑制肿瘤的生长和转移[10]。在本研究中,携带PEDF基因的腺病毒(AD-PEDF)在LL/2皮下瘤的生长及转移中相对于PBS组均表现出了强有力的抑制作用,证实了PEDF在NSCLC中具有抑瘤作用。然而,病毒或非病毒为载体的基因治疗,由于缺乏靶向性,不能渗透脉管壁难以穿透至肿瘤组织。而纯化的重组蛋白在体内易于降解,需要长期、反复给药,并且因蛋白的制备、纯化困难,价格较为昂贵。这些缺点大大降低了它们潜在的治疗效果和应用价值[10,11]。因此,如何将PEDF基因有效地运送到肿瘤部位,并使其在局部持续表达是本实验的研究重点。
近年来,间充质干细胞(MSCs)作为一种理想的细胞载体而被广泛应用于肿瘤的基因治疗。首先,MSCs的低免疫原性可使其在宿主体内存活数百天以上并长效表达外源基因,对慢性疾病可活的更好的治疗效应;其次,MSCs具有向肿瘤组织归巢的特性,因此,它们可以使抗肿瘤药物在肿瘤局部达到较高的浓度,并可降低这些药物对机体正常组织器官的副作用;最后,MSCs易于在体外分离、培养、扩增以及基因修饰,为以后的临床应用提供了便利并且花费相对低廉[12]。已有研究证实稳定转染并表达IFN-β的MSCs在体内对黑色素的治疗效应,这是MSCs在体内作为细胞载体的第一个报道[13]。后续的大量研究也证实了MSCs与不同的治疗策略相结合在抗肿瘤治疗中的巨大潜力[14-16]。在本研究中,MSCs-PEDF与Ad-PEDF相比对LL/2皮下瘤具有更强的抑制作用,并且能更好地抑制肿瘤转移,使荷瘤小鼠获得更长的生存期。因此,MSCs是一个相对完美的运输载体,它们可以保护PEDF基因在循环系统中不被清除,并且也不会因为在血液中浓度过高而对其他组织造成影响,同时还可促进PEDF的治疗作用。MSCs-PEDF可定向迁移到肿瘤部位,而Ad-PEDF却没有这种能力。
本研究证实MSCs-PEDF可通过抑制肿瘤细胞诱导的新生血管形成,从而抑制LL/2肿瘤的生长和转移,并可延长荷瘤小鼠的生存期。这些结果预示着用MSCs作为基因载体是一个很有前景的肿瘤治疗策略,它改变了腺病毒载体本身固有的一些缺陷,为将来的临床应用研究打下了基础。本实验研究为进展性肿瘤的靶向治疗提供了一个新的策略。
[1] Ferlay J,Autier P,Boniol M,etal.Estimates of the cancer incidence and mortality in Europe in 2006[J].Ann Oncol,2007,18(3):581-592.
[2] Parkin DM,Bray F,Ferlay J,etal.Global cancer statistics,2002[J].CA Cancer J Clin,2005,55(2):74-108.
[3] Becerra SP,Notario V.The effects of PEDF on cancer biology:mechanisms of action and therapeutic[J].Nat Rev Cancer,2013,13(4):258-71.
[4] Belkacemi L,Zhang SX.Anti-tumor effects of pigment epithelium derived factor(PEDF):implication for cancer therapy.A mini-review[J].J Exp Clin Cancer Res,2016,35:4.
[5] Roorda BD,ter Elst A,Kamps WA,etal.Bone marrow-derived cells and tumor growth:contribution of bone marrow-derived cells to tumor micro-environments with special focus on mesenchymal stem cells[J].Crit Rev Oncol Hematol,2009,69(3):187-198.
[6] Ullah I,Subbarao RB,Rho GJ.Human mesenchymal stem cells-current trends and future prospective[J].Biosci Rep,2015,35(2):e00191.
[7] 陈巧玲,别俊,白亦光,等.骨髓间充质干细胞作为携带PEDF基因载体的可行性研究[J].西部医学,2015,27(10):1464-1471.
[8] Dass CR,Tran TM,Choong PF,etal.Angiogenesis inhibitors and the need for anti-angiogenic therapeutics[J].J Dent Res,2007,86(10):927-936.
[9] Kim TE,Murren JR.Angiogenesis in non-small cell lung cancer.A new target for therapy[J].Am J Respir Med,2002,1(5):325-338.
[10] Wang L,Schmitz V,Perez-Mediavilla A,etal.Suppression of angiogenesis and tumor growth by adenoviral-mediated gene transfer of pigment epithelium-derived factor[J].Mol Ther,2003,8(1):72-79.
[11] Doll JA,Stellmach VM,Bouck NP,etal.Pigment epithelium-derived factor regulates the vasculature and mass of the prostate and pancreas[J].Nat Med,2003,9(6):774-780.
[12] Chen X,Lin X,Zhao J,etal.A tumor-selective biotherapy with prolonged impact on established metastases based on cytokine gene-engineered MSCs[J].Mol Ther,2008,16(4):749-756.
[13] Harati MD,Amiri F,Jaleh F,etal.Targeting delivery of lipocalin 2-engineered mesenchymal stem cells to colon cancer in order to inhibit liver metastasis in nude mice[J].Tumour Biol,2015,36(8):6011-6018.
[14] Xin H,Kanehira M,Mizuguchi H,etal.Targeted delivery of CX3CL1 to multiple lung tumors by mesenchymal stem cells[J].Stem Cells,2007,25(7):1618-1626.
[15] Zhu Y,Cheng M,Yang Z,etal.Mesenchymal stem cell-based NK4 gene therapy in nude mice bearing gastric cancer xenografts[J].Drug Des Devel Ther,2014,8:2449-2462.
[16] Zhang X,Yao S,Liu C,etal.Tumor tropic delivery of doxorubicin-polymer conjugates using mesenchymal stem cells for glioma therapy[J].Biomaterials,2015,39:269-281.
Inhibitory effect of bone marrow-derived mesenchymal stem cells carrying PEDF gene on Lewis lung carcinoma in mice
CHEN Qiaoling1, BAI Yiguang2, XIAO Dongqin3, LIU Kang3, FENG Gang3*
(1DepartmentofOncology,NanchongCentralHospital,SecondClinicalCollegeofNorthSichuanMedicalCollege,Nanchong637000,China;2OrthopaedicDepartment,NanchongCentralHospital,SecondClinicalCollegeofNorthSichuanMedicalCollege;3ResearchInstituteofTissueEngineeringandStemCell,NanchongCentralHospital,SecondClinicalCollegeofNorthSichuanMedicalCollege;*Correspondingauthor,E-mail:lssmd18@gmail.com)
ObjectiveTo investigate the inhibitory effect of bone marrow-derived mesenchymal stem cells(MSCs) transfected with recombinant adenovirus encoding pigment epithelium-derived factor(Ad-PEDF) on the growth and metastasis of Lewis lung carcinoma in mice.MethodsAn alginate-encapsulated tumor cell assay was conducted to evaluate the inhibition of MSCs-PEDF on angiogenesis induced by Lewis lung carcinoma cells(LL/2).C57BL/6 mice were inoculated subcutaneously in the right flank with LL/2 cells. At 7 d after inoculation, the mice were divided into four groups(n=18 in each group). Mice were administered with 100 μl PBS, 1×108PFU Ad-PEDF, 5×105MSCs-LacZ or 5×105MSCs-PEDF in four groups by tail vein injection, respectively. Tumors were monitored every 3 d with caliper. Eight mice from each group were sacrificed at 30 d after inoculation to observe the pulmonary metastases nodules, and the rest ten mice in each group were monitored for observing the long-term survival.ResultsAlginate-encapsulated tumor cell assay exhibited that capillary network of alginate beads was apparently reduced and FITC-dextran uptake was decreased in MSCs-PEDF-treated mice compared with that in controls. The volume of subcutaneous tumors was significantly smaller in MSCs-PEDF group than in PBS group, Ad-PEDF group or MSCs-LacZ group [(1 038.8±139.0)mm3vs(2 897.7±274.9)mm3,(2 622.8±359.1)mm3, (3019.2±360.9)mm3,P<0.01). The number of pulmonary metastases nodules in MSCs-PEDF group was also less than in PBS group, Ad-PEDF group or MSCs-LacZ group(3.2±2.4vs16.0±4.0, 14.6±5.3,16.1±4.9,P<0.05), and the survival time of mice in MSCs-PEDF group was prolonged compared to the other control groups(P<0.01). Furthermore, the body weight of mice had no significant difference between MSCs-PEDF group and PBS group(P>0.05).ConclusionMSCs-PEDF may inhibit the growth and metastasis of LL/2 subcutaneous tumors, and promote the survival of tumor-bearing mice, which suggesting that MSCs engineered to secrete PEDF by adenoviral transfection may be a novel therapeutic approach for lung carcinoma.
mesenchymal stem cells; pigment epithelium-derived factor; non-small cell lung carcinoma; gene therapy
国家自然科学基金资助项目(30872614);四川省教育厅理科重点资助项目(15ZA0216,15ZB0201);南充市科技局科技支撑项目(14A0017,14A0022);川北医学院科研发展计划项目(CBY14-A-ZD02,CBY15-A-ZD02);四川省卫计委科研基金资助项目(16PJ202)
陈巧玲,女,1983-03生,博士,主治医师,E-mail:cql166@163.com
2016-10-27
R734.2
A
1007-6611(2017)01-0011-05
10.13753/j.issn.1007-6611.2017.01.003
