茶树牻牛儿基牻牛儿基焦磷酸合成酶基因CsGGDPS的克隆及表达分析
2017-02-22姚雪倩岳川杨国一陈丹张冬桃陈桂信叶乃兴
姚雪倩,岳川,杨国一,陈丹,张冬桃,陈桂信,叶乃兴
茶树牻牛儿基牻牛儿基焦磷酸合成酶基因的克隆及表达分析
姚雪倩,岳川,杨国一,陈丹,张冬桃,陈桂信*,叶乃兴*
福建农林大学园艺学院中国乌龙茶协同创新中心,福建福州 350002
以铁观音芽叶为材料,验证从茶树转录组数据库中筛选到的1条牻牛儿基牻牛儿基焦磷酸合成酶(GGDPS)的编码全长序列cDNA。该cDNA全长1 661 bp,含有1个1 137 bp完整的开放阅读框,命名为。该基因编码378个氨基酸,氨基酸序列具有类异戊二烯合成酶家族的5个保守域和2个特征功能域;序列分析显示,该cDNA与其他植物GGDPS高度保守,与三七()的亲缘关系最近。CsGGDPS属于不稳定、亲水蛋白,可能定位到叶绿体中,不存在跨膜结构,无信号肽,发生磷酸化的位点可能有20个;二级结构主要由α-螺旋构成,三级结构与拟南芥GGPPS11匹配度最高。实时荧光定量PCR结果表明,在茶树发育过程和不同叶位的表达量随芽叶成熟度的增加呈上升趋势,随着做青过程的进行,的表达量逐渐升高;在父本黄旦、母本铁观音和子一代金观音中均有表达,但表达量存在差异。
茶树;牻牛儿基牻牛儿基焦磷酸合成酶;茶叶香气;基因表达
茶树((L.) O. Kuntze)是多年生常绿木本植物。茶树品种、茶园生态及茶叶加工工艺等是影响茶叶香气的重要因素。萜烯类化合物作为茶叶香气的重要组分之一,其含量占春季茶鲜叶总挥发油的51.26%,主要包含芳樟醇、香叶醇、橙花叔醇、法尼烯、萜品烯、杜松烯等物质[1-2]。植物中萜烯类化合物合成途径复杂,由多种酶参与其合成调控。其中,牻牛儿基牻牛儿基焦磷酸合成酶(Geranylgeranyl diphosphate synthase, GGDPS),是植物萜类物质合成途径中的关键酶之一[3-4]。植物萜类化合物合成途径的第一阶段经甲羟戊酸途径(Mevalonic acid, MVA)和甲基赤鲜糖醇磷酸途径(Methyl- erythritol-phosph-ate, MEP)生成的终产物——异戊烯基焦磷酸(Isopenteny pyrophosphate, IPP)和其双键异构体二甲烯丙基焦磷酸酯(Dimethylallyl diphosphate, DMAPP),是合成牻牛儿基牻牛儿基焦磷酸(Geranylgeranyl diphosphate, GGDP)的关键底物。第二阶段中,GGDPS能够以3分子IPP与1分子DMAPP、1分子IPP和1分子法尼基焦磷酸(Famesyl pyrophosphate, FPP)或者2分子IPP和1分子牻牛儿基焦磷酸(Geranyl diphosphate, GPP)为底物,分别催化缩合生成GGDP[5-6]。GGDP是一种类异戊二烯化合物,该通用前体物在多步不同酶促反应下参与叶绿素、类胡萝卜素、赤霉素、脱落酸、独脚金内酯、辅酶Q、维生素K、维生素E、多酚和多萜醇等的生物合成,同时还能调控植物代谢中“碳流”的方向和催化蛋白的异戊二烯化等[7-10]。因此,GGDPS被认为是植物体内合成二萜、四萜和多萜类化合物等重要初级和次级代谢途径中的关键酶,在植物生长、发育、繁殖和防御中扮演重要角色。尽管茶树中萜烯类合成途径中的多种关键酶基因已有报道,如乙酰辅酶A酰基转移酶(Acetyl-CoA C-acetyltransferase, AACT)[11]、l-脱氧-D-木酮糖-5-磷酸还原异构酶(1-deoxy- D- xylulose-5- phosphate reductoisomerase, DXR)和3-羟基-3-甲基戊二酰辅酶A还原酶(3-hydroxy-3- methylglutaryl coenzyme A reductase, HMGR)[12]等,但GGDPS基因及其在茶叶香气形成中的作用未见报道。
本研究以茶树芽叶为材料,克隆并验证从茶树转录组中筛选到的全长cDNA序列。对该基因的生物信息学特征进行了全面的分析;采用实时荧光定量PCR技术研究该基因在铁观音茶树芽叶发育过程、不同叶位,以及做青过程不同阶段的动态表达模式,并分析了该基因在父母本和子一代间的表达量变化,为揭示乌龙茶萜烯类香气形成的分子机制和香气相关基因在茶树亲子代间的差异表达模式提供参考。
1 材料与方法
1.1 试验材料及试剂
供试材料:2016年3月中旬至5月中旬于福建农林大学南区教学茶场采集以下4种样品:(1)从3月中旬开始,对铁观音茶树进行挂牌,每隔1 d对铁观音春梢芽叶发育过程进行观察,摘取各生育期长势一致的芽头、第一叶、第二叶、第三叶和第四叶,用于研究在茶树芽叶发育过程不同阶段的表达模式变化;(2)以铁观音(母本)、黄旦(父本)和金观音(杂交子一代)品种的一芽二叶为供试材料,用于研究在父母本和子一代中的表达量变化;(3)采摘铁观音春梢中小开面时期的第一叶、第二叶、第三叶和第四叶,研究在不同叶位的表达模式;(4)以铁观音中小开面二三叶为鲜叶原料,按闽南乌龙茶做青工艺进行做青[13],并对鲜叶、晒青叶以及一摇后、二摇后、三摇后、杀青前各阶段进行取样。采集的样品用锡箔纸包裹并标记,液氮速冻后移入—80℃冰箱保存备用,每个样品3次重复。
试剂:RNAprep Pure Plant Kit(Polysaccharides & Polyphenolics-rich)和Universal DNA Purification Kit购自天根生化科技有限公司;SuperScriptTMII Reverse Transcriptase购自Invitrogen公司;KlenTaq LA Polymerase Mix和DL2000 DNA Marker购自Clontech公司;DNA Polymerase High Fidelity (HiFi)、-T1 Simple Cloning Kit和-T1 Phage Resistant Chemically Competent Cell、One-Step gDNA Removal and cDNA Synthesis SuperMix购自北京全式金公司;2×PCR StarMix with Loading Dye购自普洛斯生物科技有限公司;琼脂糖Agarose为西班牙进口试剂;50×TAE电泳缓冲液和DEPC处理水购自北京索莱宝公司;引物合成和测序由上海铂尚生物技术有限公司完成。
1.2 试验方法
1.2.1 供试材料总RNA的提取
取适量供试样品,液氮研磨后,按照天根植物多糖多酚提取试剂盒的操作步骤提取茶树总RNA。提取的总RNA用1%的琼脂糖凝胶电泳检测其完整性,用NanoDrop 2000超微量分光光度计测定RNA的浓度和纯度,合格的RNA样品于—80℃保存。
1.2.2 cDNA的合成
以铁观音一芽二叶为材料,以提取的总RNA为模板,参照SMARTTMcDNA Library Construction Kit说明书,采用SMART两步逆转录法合成cDNA第一链,采用抑制LA-PCR合成cDNA第二链,即制备好普通RT-PCR模板。按照全式金的One-Step gDNA Removal and cDNA Synthesis SuperMix试剂盒方法合成的cDNA作为荧光定量PCR的模板。
1.2.3的全长验证
在茶树高通量全转录组(SRX1676258)数据库中找到1个GGDPS基因全长序列,利用该序列设计全长引物-fl-F、-fl-R(表1),以铁观音一芽二叶总RNA的反转录第二链cDNA为模板,进行RT-PCR扩增。PCR反应体系:10×HiFi Buffer Ⅱ2.5 μL,2.5 mmol·L-1dNTPs 2 μL,-fl-F和-fl-R(10 μmol·L-1)各0.5 μL,HiFi Polymerase 0.125 μL,Template DNA 1 μL,DEPC处理水补至25 μL。程序:95℃预变性5 min,95℃变性30 s,55℃退火90 s,72℃延伸2 min,35个循环;72℃延伸10 min,最后保持4℃。扩增产物经1%琼脂糖凝胶电泳检测,在紫外灯下切割目的片段大小的条带,并用DNA凝胶回收试剂盒进行回收纯化。新鲜PCR产物与-T1载体连接,将重组质粒转入-T1化学感受态细胞,37℃培养过夜。通过蓝白斑筛选与菌落PCR鉴定得到阳性克隆,挑选3个阳性菌液送至上海铂尚生物技术有限公司测序。
1.2.4 CsGGDPS的生物信息学特征分析
对所得全长cDNA序列,利用NCBI网站在线查找ORF和同源性检索等;利用protparam、protscale、TMHMM-2.0、NetPhos、SignalP、TargetP软件分别对保守区所编码的蛋白质进行理化性质、亲疏水性、跨膜结构、磷酸化位点、信号肽预测分析和亚细胞定位;利用predictprotein和swissmodel两个软件预测分析蛋白质的二级结构和三级结构;利用DNAMAN软件进行CsGGDPS氨基酸多序列比对;利用MEGA5.0软件构建茶树GGDPS与其他物种GGDPS的系统进化树。
1.2.5 CsGGDPS实时荧光定量PCR表达分析
根据全长cDNA序列设计荧光定量PCR引物-QPCR-F、-QPCR-R(表1)。以茶树为内参基因,检测在铁观音芽叶发育过程、不同叶位、做青过程,以及亲本与子代间的相对表达量变化。数据结果采用Excel 2003和2–ΔΔT法进行定量分析。

表1 引物序列
2 结果与分析
2.1 茶树CsGGDPS全长cDNA序列的验证及序列分析
从茶树转录组中获得的1 597 bp的序列,NCBI BLASTx比对显示它具有完整的开放阅读框(ORF)。设计引物扩增验证其全长ORF,PCR结果显示扩增出的条带大小与预期目的片段大小基本一致,约1 500 bp(图1)。测序结果拼接后,获得全长序列。BLASTn分析表明,它与公布的茶树基因(登录号:KU892076)的同源性达到99%。在铁观音中扩增出GGDPS基因,命名为。该序列全长1 661 bp,含有200 bp 5′非编码区(UTR)、1 137 bp ORF(201~1 337 bp),324 bp 3′非编码区(UTR)。

图1 铁观音CsGGDPS扩增产物电泳图
2.2 茶树CsGGDPS的生物信息学分析
2.2.1 蛋白质理化性质预测
在线软件预测该蛋白质相对分子质量为41.12 kDa,理论等电点为6.37,由378个氨基酸组成,半衰期为30 h。该蛋白不稳定系数为41.26,整个多肽链中分值最低(-3.333)的氨基酸亲水性最强;分值最高(2.433)的氨基酸疏水性最强(图2),总平均亲水性为-0.072,推测该蛋白为不稳定、亲水性蛋白。
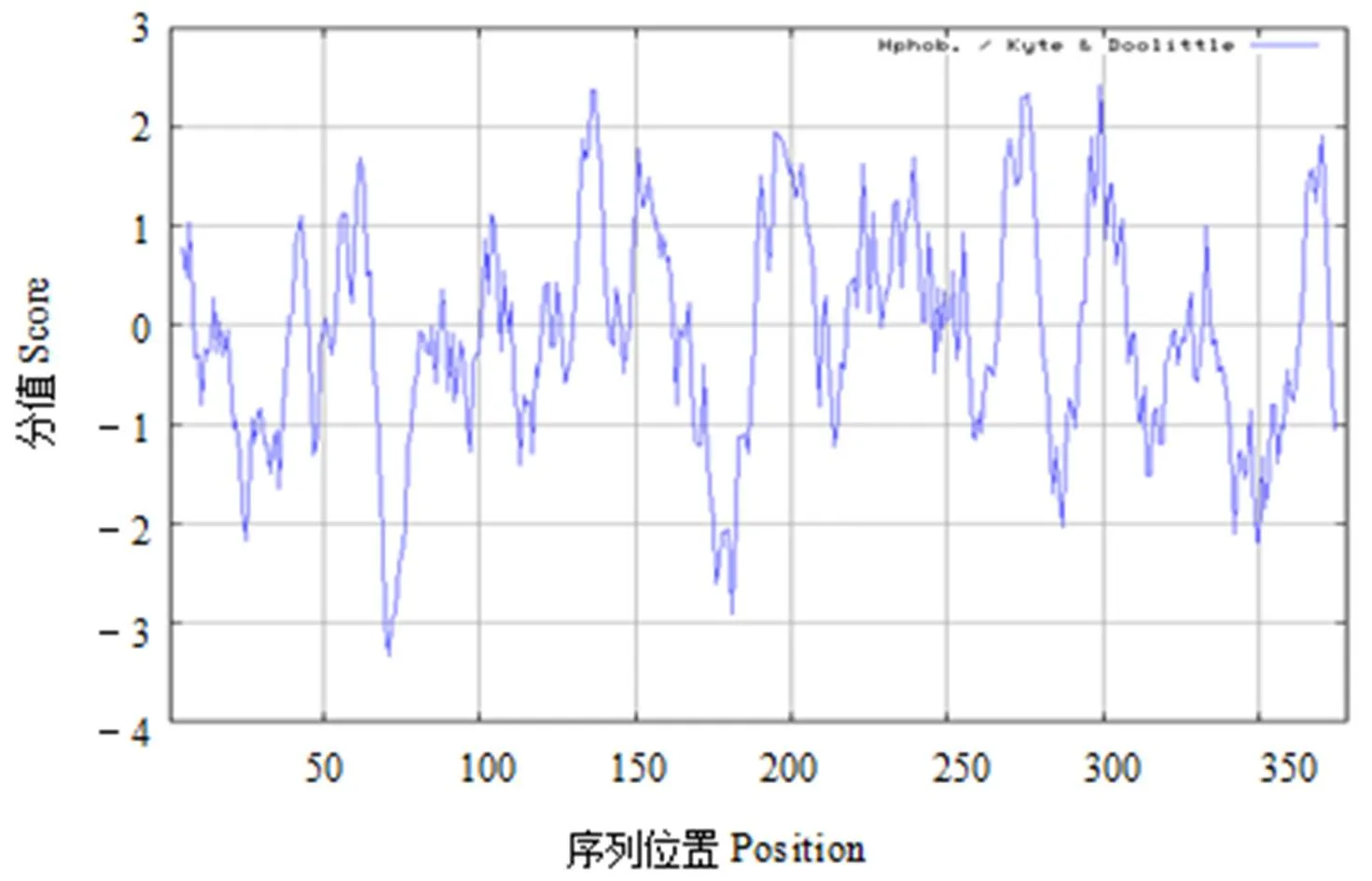
图2 CsGGDPS蛋白亲/疏水性分析
2.2.2 跨膜结构、信号肽和亚细胞定位预测
跨膜区域显示(图3)整条肽链位于膜外,故CsGGDPS不存在跨膜结构,非膜蛋白,可能是在游离核糖体上合成蛋白多肽。TargetP1.1 Server在线分析含有信号肽(Signal peptide, SP)的可能性分值为0.007,说明CsGGDPS不具有信号肽,属于非分泌蛋白,该结果与SignalP-HMM预测结果一致。亚细胞定位预测显示,全氨基酸序列中叶绿体运输肽(Chloroplast transit peptide, cTP)的可能性分值最高为0.764,线粒体靶向肽(Mitochondrial targeting peptide, mTP)的可能性分值为0.247,其他可能性分值为0.051,可靠等级值为3,由此推断CsGGDPS蛋白定位到叶绿体上。在细胞质中合成GGDPS,再在叶绿体转运肽的协助下进入叶绿体,于叶绿体基质中与底物结合催化合成GGDP。

图3 CsGGDPS蛋白跨膜区域分析
2.2.3 CsGGDPS蛋白的二级结构和三级结构预测
CsGGDPS蛋白的二级结构主要由α-螺旋构成,占47.62%,其次为不规则卷曲,占30.42%,N端含有较多不规则卷曲,可能存在活性位点,延伸链和β-转角同样分布于整个肽链中,分别占15.08%和6.88%。CsGGDPS的三级结构建模与二级结构预测类似(图4),预测结果评估显示GMQE分值为0.71,说明构建的CsGGDPS蛋白三级结构可信度高。建模结果显示,CsGGDPS为同源二聚体蛋白,与拟南芥的GGPPS11(5e8l.1.B)匹配度最高(79.39%),因此借助模式植物拟南芥该基因的表达情况可为深入研究奠定基础。
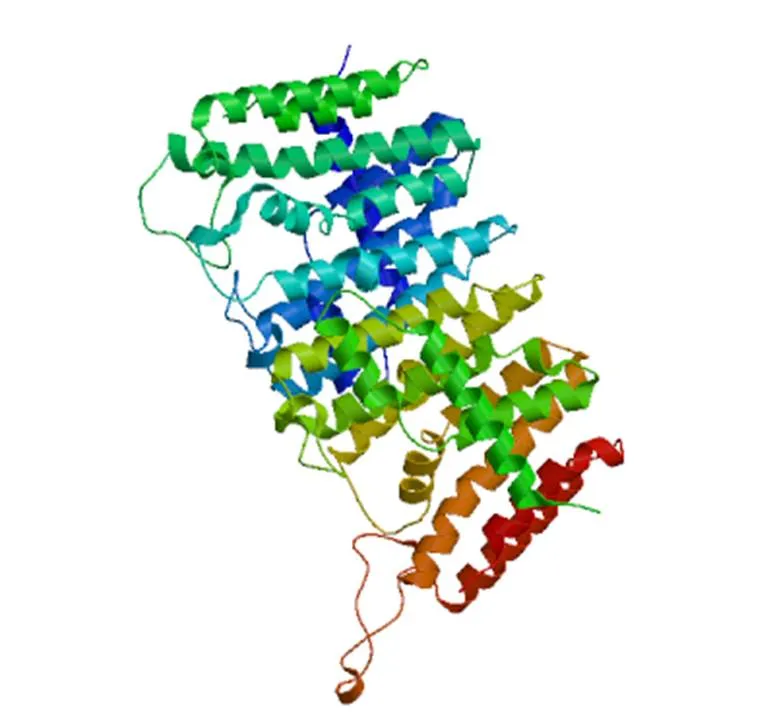
图4 CsGGDPS蛋白三级结构分析
2.2.4 磷酸化位点预测
通过NetPhos 2.0 Serve对CsGGDPS进行磷酸化结构的预测。结果表明,丝氨酸的磷酸化位点可能有14个,位于多肽链的第23、25、60、97、107、215、216、229、244、249、282、313、340、356位氨基酸,其中第107、215、216、313、356位氨基酸的预测值均达到0.980以上,说明这些位点的丝氨酸发生磷酸化的可能性较高。苏氨酸可能的磷酸化位点有6个,分别为第26、48、66、76、211、264位氨基酸。
2.2.5 同源性比对和分子系统进化树分析
将CsGGDPS的氨基酸序列进行BLASTp比对,结果显示(图5),该氨基酸序列属于类异戊二烯家族,含有底物结合袋(Substrate binding pocket)、底物-Mg2+结合位点(Substrate-Mg2+binding site)、链长决定区(Chain length determination region)、催化残基的活性位点,以及3个特异结构域“Trans_ IPPS_HT”、“IspA”和“Polypreny_synt”等。CsGGDPS与多个物种中的GGDPS具有较高的相似性,相似性均在70%以上,其中与三七()、长春花()、芝麻()、米团花()、葡萄()的相似度分别为77%、75%、74%、73%、71%;将它与8个物种GGDPS氨基酸序列进行多重序列比对,结合功能结构域分析,结果显示(图6),这些植物的GGDPS基因都包含聚异戊二烯合成酶的5个特征性功能结构域(ⅠⅤ),同时含有2个几乎所有萜类合成酶共有的保守区天冬氨酸富集基序DDXXXXD和DDXXD(X可为任意氨基酸)。CsGGDPS在5′端前86个氨基酸位点保守性较低,从第87位开始到之后的位点氨基酸保守性较高。
将19个物种的GGDPS氨基酸序列采用邻近连接法(Neighbor-Joining, NJ)构建系统进化树(图7)。GGDPS在分子进化树上被分为两大类,其中CsGGDPS与三七()的聚在一起,亲缘关系最近,同时与长春花()和龙胆()的亲缘关系也较近;而与木本植物,如苹果、白梨、胡杨等的关系较远。
2.3 CsGGDPS相对荧光定量PCR表达分析
采用实时荧光定量PCR技术,检测在铁观音芽叶发育过程不同阶段、不同叶位和做青过程的表达量变化。结果显示,在发育过程中,的表达量总体呈上升趋势,以芽头为对照,一叶时表达量约为芽头的2倍,从二叶到四叶过程中,的表达量呈明显上升趋势,四叶期的表达量最高,约为芽头的4倍(图8-A)。在不同叶位中,从第一叶到第四叶,的表达量呈上升趋势,其中第三叶的表达量达到最高,约为第一叶的2倍,第四叶中仍保持较高的表达量水平(图8-B)。在做青过程中,从鲜叶到晒青叶,的表达量较低且增长缓慢;一摇后表达量增加,与鲜叶相比,二者相差近6倍;随着做青过程的进行,从二摇后到杀青前,的表达量显著升高,杀青前的表达量达到最高,约为鲜叶的20倍(图8-C)。
研究检测了在铁观音母本(♀)、黄旦父本(♂)及它们的杂交子一代金观音3个品种间的表达水平。结果显示(图9),在亲本黄旦、铁观音和子一代金观音中均有表达,属于基因差异表达模式中的共同表达型。然而,在铁观音中的表达量显著高于黄旦,它们的杂交后代金观音中的表达水平介于父母本之间,呈现偏低亲的杂种表达量现象,这可能与3个品种间香气差异有关。

图9 茶树亲本与子一代间CsGGDPS表达分析
3 讨论
茶树中芳香物质代谢包括不饱和脂肪族醇、芳香族醇和萜烯类化合物3个方面的生物合成与转化[14]。本研究克隆了铁观音中CsGGDPS基因,该基因编码蛋白是植物萜烯类化合物合成途径中的关键酶之一。CsGGDPS基因cDNA全长1 661 bp,与其他植物的具有较高的相似性,氨基酸多重序列比对显示该序列含5个保守结构域以及GGDPS的特异功能域——FARM(the first aspartate-rich motif)和SARM(the second aspartate-rich motif),这2个基序是GGDPS关键的催化活性位点,对Mg2+桥与底物分子二磷酸基团的结合至关重要[15-16]。
本研究结果表明,在铁观音芽叶发育过程和不同叶位的相对表达量总体随芽叶成熟度的增加而呈上升的趋势,与刘晶晶等[17]研究萜类化合物在茶树发育阶段的合成与释放大体表现为幼叶中多、老叶中少的结果一致。张冬桃[18]分析了萜类代谢途径的关键基因,如等在铁观音发育过程和不同叶位的表达量情况,结果表明这些基因的表达均随芽叶成熟进程呈上升趋势。从CsGGDPS的分子系统进化树可以看出,它与三七聚为一类。闵丹丹[4]研究发现,三七可能与三七叶绿素、类胡萝卜素等二萜物质的合成代谢及叶绿体的发育有关,由此可推测可能与三七的功能相近,伴随芽叶成熟度的增加,茶树体内不断合成叶绿素和类胡萝卜素等供茶树生长发育必需的物质,萜类前体物质也逐步积累[19],最终导致定位于叶绿体中的萜类合成酶的表达量上升。这与乌龙茶生产加工需采摘一定成熟度芽叶的理论相吻合。虽然前人有研究表明,未受损伤的茶树鲜叶基本无味或味轻微[20],但以中小开面为标准采摘的乌龙茶鲜叶中能检测到更多微量的游离态萜类香气物质,为乌龙茶制茶过程中香气品质的形成与转化提供物质基础。做青是乌龙茶独特香气形成的关键工序,其中的摇青工序使茶鲜叶破损,细胞组织机械损伤,加速萜烯糖苷的水解。β-葡萄糖苷酶在水解萜烯类香气前驱体中发挥重要作用[21]。张秀云等[22]研究发现,β-葡萄糖苷酶在做青过程中呈峰型变化,做青结束前2 h活性达到最高,糖苷键合态香气物质水解为游离态的能力最强,促使己烯酯类、芳樟醇氧化物、倍半萜烯类、顺-茉莉酮、茉莉内酯和苯乙醛等芳香物质大量形成[23]。做青过程中茶鲜叶内部氧气、水分、膜透性发生变化,摇青使脂肪酸氧化裂解生成的青叶醇和青叶醛大部分挥发,留下少量具有清香的反式青叶醇[24]。乌龙茶做青过程中还伴随胡萝卜素类的氧化降解产物生成,如β-紫罗酮、二氢海葵内酯、茶螺烯酮等香气物质[25]。乌龙茶品质特征主要形成于三摇或其后阶段,橙花叔醇、香叶醇、芳樟醇及其氧化物、吲哚、α-法尼烯、顺-茉莉酮等香气组分在一定摇青强度范围内不断积累[26-29]。本研究发现,在铁观音做青过程中表达量显著增加,杀青前其表达量最高可达到鲜叶的20倍。由前面的研究结果分析,3次摇青静置后的做青叶,具有典型的兰花香,对乌龙茶品质具有重要的影响。因此,由在铁观音芽叶发育过程、不同叶位和做青过程的表达结果推测,该基因与乌龙茶萜烯类香气品质的形成密切相关。
在母本铁观音、父本黄旦和子一代金观音中的表达差异较大。金观音中的表达量接近父本而显著低于母本,属于基因表达量差异中的偏低亲表达模式,也称作非加性表达[30]。这与Li等[31]提出的关于双亲中不同表达量的基因比相同表达量的基因更易呈现非加性表达模式的观点相近,如苜蓿中这一比值为3∶1。郭吉春等[32]对金观音的选育研究认为,金观音的遗传性状趋向母本,该观点与本实验在金观音和铁观音中表达量有明显差异的结果不一致。因此推测,双亲和子一代中表达的差异既有可能受顺式作用元件、反式作用元件或二者共同作用的影响,也有可能与它们的基因表达调控、表观遗传机制有关。铁观音和黄旦作为重要的乌龙茶育种材料,通过杂交选育了一批优良的茶树品种,丰富了乌龙茶品种资源,对乌龙茶的发展产生了深远的影响。但由于茶树是异花授粉的遗传杂合体,亲本与F1代间在一定程度上存在遗传差异[33],所以铁观音和黄旦杂交后基因的遗传规律还有待后续研究。茶叶香气这一品质性状属于数量性状,数量性状从微效多基因控制过渡到主基因-多基因混合控制形成植物杂种优势[34]。因此,萜类合成酶相关基因在杂种和亲本中的遗传趋势有待进一步研究验证,以期为杂种的早期选择、杂种优势形成理论和乌龙茶加工过程中萜烯类香气形成等的解析提供理论依据。
[1] 张正竹, 施兆鹏, 宛晓春. 萜类物质与茶叶香气(综述)[J]. 安徽农业大学学报, 2000, 27 (1): 51-54.
[2] 吴勇. 萜烯类化合物与茶叶香气[J]. 化学工程与装备, 2009, 32(11): 123-125.
[3] 魏攀, 孟利军, 陈千思, 等. 烟草牻牛儿基牻牛儿基焦磷酸合成酶基因的克隆和功能分析[J]. 烟草科技, 2016, 49(4): 8-15.
[4] 闵丹丹, 唐美琼, 李刚, 等. 三七香叶基香叶基焦磷酸合酶基因的克隆及表达分析[J]. 中国中药杂志, 2015, 40(11): 2090-2095.
[5] 杨滢. 植物萜类代谢途径关键酶的比较及其在丹参中的表达分析[D]. 西安: 陕西师范大学, 2012: 1-2.
[6] Beck G, Coman D, Herren E, et al. Characterization of thesynthase gene family in[J]. Plant Molecular Biology, 2013, 82(4): 393-416.
[7] Yamamura Y, Mizuguchi Y, Taura F, et al. Transcriptional activation of a geranylgeranyl diphosphate synthase gene,,isolated fromby treatment with methyl jasmonate and yeast extract [J]. Journal of Natural Medicines, 2014, 68(4): 748-753.
[8] 李泽锋, 魏攀, 夏玉珍, 等. 烟草牻牛儿基牻牛儿基焦磷酸合成酶基因家族的全基因组鉴定[J]. 烟草科技, 2015, 48(6): 1-8.
[9] 张萌, 苏平, 刘雨佳, 等. 雷公藤牻牛儿基牻牛儿基焦磷酸合酶基因全长cDNA的获得及生物信息学分析[J]. 中国中药杂志, 2015, 40(6): 1066-1070.
[10] 韩立敏. 菘蓝牦牛儿基牦牛儿基焦磷酸合成酶基因() 的克隆及其表达特性分析[J]. 基因组学与应用生物学, 2015, 34( 6): 1172-1178.
[11] Wei X, Yan X, Fu M W, et al. In silico analysis and feeding assays of some genes in the early steps of terpenoid biosynthetic pathway in[J]. Journal of Tea, 2013, 39(4): 191-198.
[12] 徐燕. 茶树萜类合成途径关键基因克隆及表达研究[D]. 杭州: 浙江大学, 2013: 12.
[13] 温立香, 郭雅玲, 黄寿辉. 乌龙茶做青技术的研究进展[J]. 安徽农业科学, 2015, 43(24): 215-217.
[14] 宛晓春. 茶叶生物化学[M]. 3版. 北京: 中国农业出版社, 2003: 119-120.
[15] HEMMI H, NOIKE M, NAKAYAMA T, et al. An alternative mechanism of product chain-length determination in type III granylgeranyl diphosphate synthase [J]. Eur J Biochem, 2003, 270(10): 2186-2194.
[16] Song L, Poulter C D. Yeast farnesyl-diphosphate synthase: site-directed mutagenesis of residues in highly conserved prenyltransferase domainsⅠand Ⅱ[J]. Proc Natl Acad Sci USA, 1994, 91(8): 3044-3048.
[17] 刘晶晶, 王富民, 刘国峰, 等. 茶树萜类香气物质代谢谱与相关基因表达谱时空变化的关系[J]. 园艺学报, 2014, 41(10): 2094-2106.
[18] 张冬桃. 乌龙茶做青过程香气形成相关基因的分离与表达[D]. 福州: 福建农林大学, 2016: 54.
[19] Dudareva N, Pichersky E. Biology of floral scent[M]. Boca Raton: CRC Press, 2006: 55-78.
[20] 许宁, 陈宗懋, 游小清. 引诱茶尺蠖天敌寄生蜂的茶树挥发物的分离与鉴定[J]. 昆虫学报, 1999, 42(2): 126-131.
[21] 吴颖, 戴永峰, 张凌云. 做青工艺对乌龙茶品质影响研究进展[J]. 广东茶业, 2013, 31(5): 8-11.
[22] 张秀云, 方世辉, 夏涛. 乌龙茶萎凋做青中β-葡萄糖苷酶活性变化研究[J]. 安徽农业大学学报, 2000, 27(2): 164-166.
[23] 杨意成, 梁月荣. 乌龙茶花香形成机理的研究[J]. 茶叶, 2008, 34(1): 10-14.
[24] 梁晓岚, 陈春林. 乌龙茶香气形成机理初探[J]. 广东农业科学, 1996, 23(4): 23-25.
[25] Yang Z Y, Baldermann S, Watanabe N. Recent studies of the volatile compounds in tea [J]. Food Research International, 2013, 53(2): 585-599.
[26] 黄福平, 陈荣冰, 梁月荣, 等. 乌龙茶做青过程中香气组成的动态变化及其与品质的关系[J]. 茶叶科学, 2003, 23(1): 31-37.
[27] 陈林, 陈键, 陈泉宾, 等. 做青工艺对乌龙茶香气组成化学模式的影响[J]. 茶叶科学, 2014, 34(4): 387-395.
[28] 王日为, 张丽霞, 杨伟丽, 等. 乌龙茶做青过程中香气的动态变化规律[J]. 湖南农业大学学报, 1999, 25(3): 194-199.
[29] Lin J, Zhang P, Pan Z Q, et al. Discrimination of Oolong tea () varieties based on feature extraction and selection from aromatic profiles analysed by HS-SPME/ GC-MS [J]. Food Chemistry, 2013, 141(1): 259-265.
[30] 许晨璐, 孙晓梅, 张守攻. 基因差异表达与杂种优势形成机制探讨[J]. 遗传, 2013, 35(6): 714-726.
[31] Li X H, Wei Y L, Nettleton D, et al. Comparative gene expression profiles between heterotic and non-heterotic hybrids of tetraploid[J]. BMC Plant Biol, 2009, 9(1): 107-115.
[32] 郭吉春, 叶乃兴, 杨如兴, 等. 茶树杂交种金观音、黄观音的选育与应用[J]. 福建茶叶, 2008, 31(1): 11-14.
[33] 王让剑, 杨军, 孔祥瑞, 等. 福建15个茶树品种SSR遗传差异分析与指纹图谱建立[J]. 福建农业学报, 2014, 29(10): 970-975.
[34] 盖钧镒, 章元明, 王建康. 植物数量性状遗传体系[M]. 北京: 科学出版社, 2003: 145-156.
Cloning and Expression Analysis of Geranylgeranyl Diphosphate Synthase Genein Tea Plant ()
YAO Xueqian, YUE Chuan, YANG Guoyi, CHEN Dan, ZHANG Dongtao, CHEN Guixin*, YE Naixing*
College of Horticulture, Fujian Agriculture and Forestry University, Collaborative Innovation Center of Chinese Oolong Tea Industry, Fuzhou 350002, China
A full-length cDNA sequence encoding geranylgeranyl diphosphate synthase (GGDPS) was isolated from transcriptome database of tea plant, cloned fromTieguanyin and named as. The cDNA length ofwas 1 661 bp, with an open reading frame (ORF) of 1 137 bp and deduced protein of 378 amino acids. The protein was deduced to contain 5 conserved domains with 2 functional domains of Isoprenoid-Biosyn-C1 superfamily. The sequence analysis showed that CsGGDPS was highly conserved and had the closest genetic relationship with. CsGGDPS was an instability and hydrophilic protein, which was predicted to be located in chloroplast but with no transmembrane structure and signal peptide. There were 20 phosphorylation sites within the polypeptide chain. Alpha helix was predicted to be the major secondary structure of CsGGDPS. The three-dimension structure of CsGGDPS was highly similar to GGPPS11 from. The quantitative real-time PCR showed thatexpression was increased during the developmental process and increased with the age of tea leaves. Meanwhile, its expression was also enhanced during the Zuoqing procedure.was ubiquitously expressed in theHuangdan,Tieguanyin and their first filial generationJinguanyin, but with different expression levels.
, GGDPS, tea aroma, gene expression
S571.1;Q946.5
A
1000-369X(2017)01-086-11
2016-08-01
2016-08-23
国家自然科学基金(31600555)、福建省“2011协同创新中心”中国乌龙茶产业协同创新中心专项(闽教科〔2015〕75号)、福建茶产业农技推广服务试点建设(KNJ-151001)。
姚雪倩,女,硕士研究生,主要从事茶树栽培育种与生物技术研究。
