盐度对未驯化微生物活性的影响
2017-02-22郭姿璇佘宗莲中国海洋大学环境科学与工程学院海洋环境与生态教育部重点实验室山东青岛266100
郭姿璇,王 群,佘宗莲(中国海洋大学环境科学与工程学院,海洋环境与生态教育部重点实验室,山东 青岛266100)
盐度对未驯化微生物活性的影响
郭姿璇,王 群,佘宗莲*(中国海洋大学环境科学与工程学院,海洋环境与生态教育部重点实验室,山东 青岛266100)
取序批式活性污泥反应器(SBR)中未经驯化的污泥通过间歇实验测定含盐条件下的微生物活性,对比分析盐度对硝化菌和反硝化菌的影响.活性测定包括比氨氧化速率(SAOR:0~30gNaCl/L)、比亚硝酸盐氧化速率(SNIOR:0~15gNaCl/L)、比亚硝酸盐反硝化速率(SNIDR:0~35gNaCl/L)、比硝酸盐反硝化速率(SNADR:0~40gNaCl/L)、内源比亚硝酸盐反硝化速率(E-SNIDR:0~25gNaCl/L)、内源比硝酸盐反硝化速率(E-SNADR:0~5gNaCl/L)、比耗氧速率(SOUR:0~30gNaCl/L)和脱氢酶活性(DHA:0~80gNaCl/L),结果表明,盐度为5gNaCl/L时,能够提高SNIDR和SOUR; 15gNaCl/L时,SAOR和SNIOR的活性系数(AC)分别下降至46%和1%,亚硝酸盐氧化菌比氨氧化菌更容易受到盐度的影响;当盐度高于10gNaCl/L时(含10gNaCl/L),SNIDR和SNADR的AC比SAOR及SNIOR高,反硝化菌比硝化菌对盐度的耐受性更强;NaCl浓度高达80g/L时仍能检测出DHA,说明微生物仍具有催化氧化还原反应的能力.
SBR;盐度;微生物活性;硝化;反硝化
淡水资源紧缺已成为全球性的环境问题,为缓解淡水资源日益紧张的局面,许多沿海国家和地区都在加快海水的利用[1],例如青岛、大连等沿海城市已启动海水冲厕示范工程,这将导致大量含盐废水排放,而盐浓度过高会导致微生物活性降低甚至失活[2-4].当前城市污水处理系统中的微生物均未经盐驯化,含盐废水直接排放会给市政污水处理带来挑战,因此研究盐度对未经盐驯化微生物脱氮的影响对含盐废水的处理及污水处理系统的实际运行具有重大意义.
目前,国内外关于盐对脱氮影响的研究主要集中在各类反应器运行的整体效果[5-7],鲜有关于硝化、反硝化各个反应阶段受盐影响的对比分析.本文通过测定未经盐驯化的微生物在含盐条件下的比氨氧化速率、比亚硝酸盐氧化速率、比亚硝酸盐反硝化速率、比硝酸盐反硝化速率、内源比亚硝酸盐反硝化速率、内源比硝酸盐反硝化速率、比耗氧速率以及脱氢酶活性,对比分析盐度对微生物硝化活性、反硝化活性的影响.
1 材料与方法
1.1 SBR系统及运行方式
SBR为圆柱体结构,有效容积22.67L.曝气阶段采用微孔曝气器向SBR中充入空气,利用转子流量计控制曝气量为 0.5L/h,使用潜水泵进行搅拌使混合液保持均匀.反应器内安装带有温控装置的加热棒,将温度控制在30℃左右. SBR在无盐条件下运行,一个运行周期为 8h,按照进水(23min)-曝气(380min)-沉淀(60min)-排水(10min)-闲置(7min)的程序运行,一个运行周期的进出水量为 9.1L.接种污泥取自青岛市李村河污水处理厂,本研究期间通过定期排泥使反应器内MLSS维持在3000mg/L左右.
1.2 活性测定实验
1.2.1 底物转化速率测定 采用间歇实验测定活性污泥微生物的比氨氧化速率(SAOR)、比亚硝酸盐氧化速率(SNIOR)、比亚硝酸盐反硝化速率(SNIDR)、比硝酸盐反硝化速率(SNADR)、内源比亚硝酸盐反硝化速率(E-SNIDR)、内源比硝酸盐反硝化速率(E-SNADR)和比耗氧速率(SOUR),测定方法参照王建龙等[8]和 Gong等[9]的研究.污泥取自 SBR曝气阶段末期,将污泥用蒸馏水冲洗3次,洗去残余的有机物、NH4+-N、NO2--N、NO3--N等物质.实验盐度从0gNaCl/L开始,以 5gNaCl/L的幅度递增,直至底物转化速率降到无盐条件下的 5%以下,不再提高盐度,但E-SNADR的测定除外(内源条件下硝酸盐反硝化速率很低,盐度为5gNaCl/L时E-SNADR仅为0.04mg/(h⋅VSS),已接近零,虽然此盐度下硝酸盐转化速率为无盐条件下的 34%;因此本研究E-SNADR测定的最大盐度定为5gNaCl/L).每个活性实验重复测定3次.
SAOR、SNIOR、SNIDR、SNADR、E-SNIDR、E-SNADR的测定在SHY-2A型水浴恒温振荡器中进行,控制温度为 30 ,℃转速为150r/min.每隔 15min取样,测定离心液的目标底物浓度.
SAOR和SNIOR在好氧条件下测定.将污泥与培养液混合(初始条件见表 1),倒入锥形瓶中,调节初始pH为7.6,反应液总体积200mL.实验期间采用微孔曝气方式对混合液进行曝气,维持DO为3~4mg/L.
SNIDR、SNADR、E-SNIDR、E-SNADR的测定在无氧条件下进行.首先向受试污泥和培养液中分别充入氮气 5min,达到无氧状态,然后将两者加入血清瓶中混合,用橡皮塞密封后放入水浴恒温振荡器中进行反应.SNIDR和SNADR测定时外加碳源;E-SNIDR和E-SNADR用于表征内源反硝化活性,测定时不外加碳源.

表1 活性实验的初始条件Table 1 The initial experimental conditions of activity tests
SOUR的测定.将活性污泥与培养液混合,曝气至溶解氧浓度达到饱和,加入锥形瓶内至充满,用装有溶解氧探头的橡胶塞密封,放置于磁力搅拌器上进行反应,温度控制在 30℃.定时读取溶解氧浓度.
比底物转化速率由式(1)计算[10]:

式中:dt[底物]/dt表示底物转化速率;VSS表示样品中挥发性污泥浓度,g/L.
活性系数(AC)由公式(2)计算:

式中:A表示各盐度条件下的微生物活性;A0表示无盐条件下的微生物活性.
1.2.2 脱氢酶活性测定 取 5mL洗净污泥加入50mL离心管中,加入4mLTris-HCl缓冲液、4mL含盐溶液以及 1mL 2,3,5-氯化三苯基四氮唑,使混合后 NaCl浓度分别为 0,5,10,15,20,25, 30,35,40,45,50,60,70,80g/L.放置于水浴恒温振荡器中(37℃)避光振荡2h后加入1mL浓H2SO4终止反应,然后加入4mL丙酮和5mL石油醚,避光振荡10min,在4000r/min离心4min,提取有机溶剂层进行比色[11].每个盐浓度进行3次平行测定.
2.3 分析方法
NH4+-N、NO2--N、NO3--N、COD、MLSS、MLVSS采用国家标准方法测定[12].用 WTWOxi-330i型氧自动测定仪测定 DO和温度,pH的测定采用雷磁E-201-C型pH复合电极,氧化还原电位(ORP)采用501型ORP复合电极进行测定.
2 结果与讨论
2.1 SBR的运行效果
本研究旨在利用SBR培养可实现同步硝化反硝化的活性污泥,为活性测定实验提供未经驯化的微生物,因此SBR进水中没有外加NaCl.经过81d的培养,SBR达到高效稳定的同步硝化反硝化脱氮性能,稳定状态下SBR的去除效果见表2.COD、NH4+-N和TN的平均去除率分别达到90.0%、94.5%和 83.2%,曝气阶段同步硝化反硝化效率(ESND)达到79.2%;出水NO2--N和NO3--N浓度分别为0.4和4.5mg/L,基本没有NO2--N的积累.本研究SBR进水C/N约为10,反应温度控制在30℃,这些条件有利于同步硝化反硝化的实现[13-14].Chiu等[13]通过试验表明,在SBR反应器中将C/N控制11.1时, ESND能够达98.75%,且出水中未检测出COD.Liu等[15]通过Carrousel氧化沟中试试验发现,较高的C/N和较短的水力停留时间(HRT)有利于提高ESND.
2.2 盐度对污泥活性的影响
2.2.1 盐度对硝化活性的影响 SAOR 和 SNIOR分别反映污泥的氨氧化活性和亚硝酸盐氧化活性,测定的盐度范围分别为 0~30gNaCl/L和0~15gNaCl/L.从图1(a)和(b)中可看出,随着盐度升高,氨氧化活性和亚硝酸盐氧化活性均受到抑制而逐渐下降.无盐条件下,SNIOR约为SAOR的2倍,说明SBR中污泥的亚硝酸盐氧化活性高于氨氧化活性[16].盐度为5gNaCl/L时, SAOR和SNIOR活性系数(AC)分别降至75%和55%(表3),说明亚硝酸盐氧化活性比氨氧化活性受到更为严重的影响.盐度提高到15gNaCl/L时,SNIOR的AC下降至1%, SAOR的AC相对较高,为46%.实验结果表明,亚硝化菌比氨氧化菌对盐度刺激更加敏感,Dincer等[17]和 Cortés- Lorenzo等[18]在实验中也发现了同样的结果.当 NaCl浓度提高到30g/L时,NH4+-N的转化速率很慢,AC降为3%,氨氧化活性几乎被完全抑制.张宇坤等[19]也发现,SAOR在0gNaCl/L时最大,SAOR随NaCl浓度升高而下降,当NaCl/L为30g/L时,SAOR的AC下降至15%.
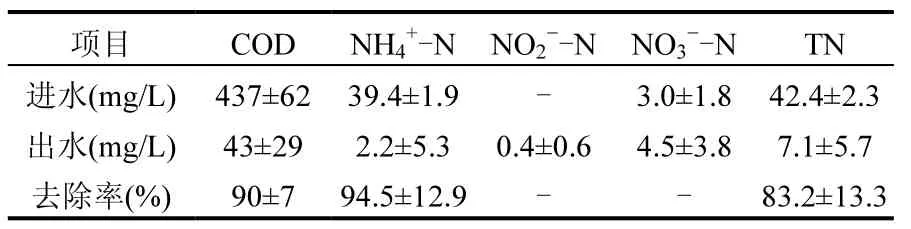
表2 SBR有机物和氮的去除率及进出水水质Table 2 Removal efficiencies of organic matter, nitrogen and characteristics of influent and effluent in SBR
2.2.2 盐度对反硝化活性的影响 亚硝酸盐及硝酸盐均可作为反硝化反应的电子受体,本研究表明亚硝酸盐型反硝化和硝酸盐型反硝化对盐的耐受性不同.不加盐条件下测得 SNIDR和SNADR分别为22.41,14.36mg/(h⋅VSS),反硝化活性高于硝化活性(不加盐条件下SAOR和SNIOR分别为 2.16,4.59mg/(h⋅VSS)).NaCl含量为 5g/L时,SNIDR为24.38mg/(h⋅VSS),比无盐条件下略有升高,这可能是因为受低盐度刺激时,微生物通过调节自身渗透压来适应环境,此时盐可以看成是促进微生物活动的刺激性物质, Hamoda等[20]也发现低浓度盐能够促进未经驯化微生物的活性.盐度提高到 10gNaCl/L时,亚硝酸盐型反硝化活性受到抑制而下降.硝酸盐型反硝化对盐度显现出较强的耐受能力,盐度为 15gNaCl/L时,活性系数仍高达 74%,而亚硝酸盐型反硝化的活性系数下降至57%.SNIDR和SNADR的AC分别在NaCl浓度为35和40g/L时下降到5%以下.实验结果表明,低盐度时亚硝酸盐型反硝化能够较好的适应盐度,而高盐度时硝酸盐型反硝化对盐的耐受性更好,这与Zhao等[3]的研究结果不一致,他们的研究表明硝酸盐型反硝化活性受盐度影响较大,这有可能是由于接种污泥、运行条件、盐度等测定条件的不同所致.
测定E-SNIDR和E-SNADR时,分别以亚硝酸盐和硝酸盐作为电子受体,不外加碳源,研究内源条件下反硝化受盐度的影响.在 0~25gNaCl/L的盐度测定范围内, E-SNIDR随测定盐度的上升持续下降,盐度为5,10,15,20,25gNaCl/L时,AC分别为48%,42%, 40%,14%和2%.E-SNADR只在0和5gNaCl /L盐度条件下进行了测定, 降解速率分别为0.13和0.04mg/(h⋅VSS).结果可以看出,内源反硝化的反应速率较低,这说明要实现快速反硝化需要外加碳源.
2.2.3 盐度对比耗氧速率的影响 SOUR可以综合反映内源呼吸、好氧异养菌、碳氧化菌、氨氧化菌和亚硝酸盐氧化菌的活性[21-22],本研究测定 SOUR的盐度范围为 0~30gNaCl/L.盐度为5gNaCl/L时,微生物活动受到盐的有利刺激,耗氧速率加快.SOUR能够反映微生物的新陈代谢活性,有研究显示[23],在盐度较低的条件下,微生物会加快新陈代谢作用来克服增大的渗透压,以维持细胞质内水分的平衡.之后随盐度的升高,耗氧速率逐渐降低,盐度达到30gNaCl/L时,耗氧微生物受到严重抑制,SOUR活性系数仅有4%.

表3 盐度变化对未经驯化微生物AC的影响Table 3 Effects of salinity on AC of non-acclimated microbes
2.2.4 盐度对脱氢酶活性的影响 污水生物处理的实质是利用微生物酶催化降解污染物质,脱氢酶是一种主要的氧化还原酶,脱氢酶的活性(DHA)直接影响到微生物进行氧化还原反应的能力,DHA能够反映活性微生物量和有机物代谢能力,因此 DHA是有效表征污泥活性的指标[24]. 本研究结果显示,DHA 随盐度的升高持续下降[见图 1(h)].盐度为 5g NaCl/L时的DHA比无盐条件时略有降低;盐度提高到20gNaCl/L时,活性系数下降至30%;盐度在50~80gNaCl/L范围内时,DHA很低但变化不大,活性系数为8%~10%,这说明虽然高盐度条件下脱氢酶活性受到严重抑制,但并未完全丧失.
2.2.5 微生物活性的半抑制浓度(IC50) 微生物活性的 NaCl半抑制浓度由大到小的顺序为: SNADR(20.2g/L)>SNIDR(16.5g/L)>SOUR(15.1g/L)>SAOR(11.3g/L)>DHA(10.9g/L)>SNIOR(6.0g/L)>E-SNIDR(4.7g/L)>E-SNADR(3.0g/L),可以看出,反硝化活性对盐的耐受能力较强,硝化活性更容易受到盐的抑制,因此硝化反应会成为含盐废水除氮的限制条件. SOUR的 IC50比 SAOR和SNIOR高,说明其他耗氧菌对盐的耐受能力高于氨氧化菌和亚硝酸盐氧化菌.
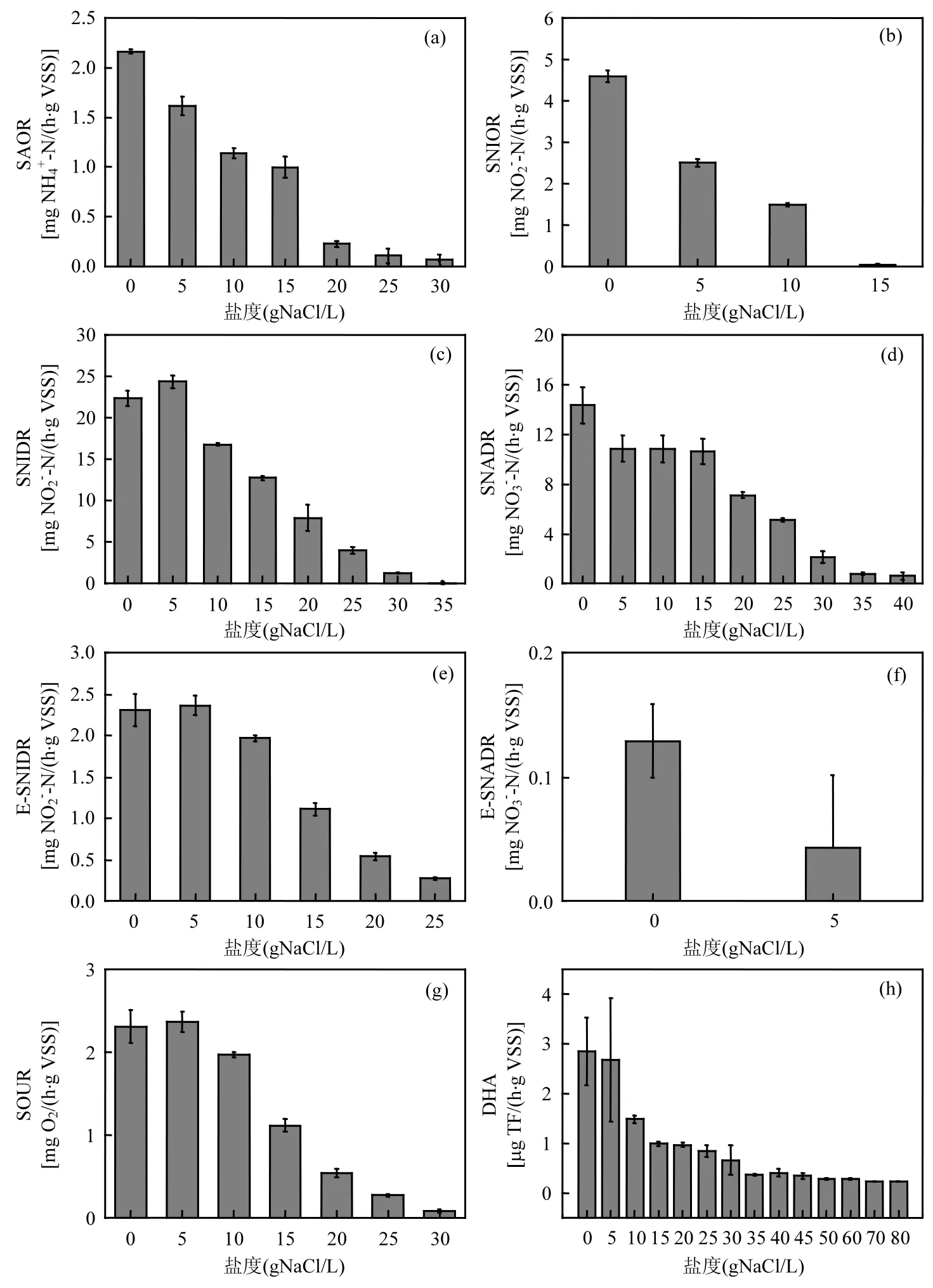
图1 盐度对微生物活性的影响Fig1 Effects of salinity on microbial activity
海水的盐度大约为 3.5%,从实验结果看,各活性指标的 IC50均低于海水盐度,在盐度为35gNaCl/L时,除SNADR和DHA外,其余微生物活性指标的AC均低于5%,表明未经驯化的微生物不具有处理海水及以上盐度污水的能力.但一般情况
下,冲厕用水约占城市生活用水的 30%[25],若冲厕水全部采用海水,城市污水处理系统中污水含盐量一般不会超过1.05%,在此盐度范围内,未经驯化的微生物仍具有较高的硝化、反硝化活性.
3 结论
3.1 SAOR、SNIOR、SNADR、E-SNIDR、E-SNADR和DHA的总体趋势都是随着盐度的升高逐渐降低;但SNIDR和SOUR在5gNaCl/L时比无盐条件下略有升高,说明低盐条件对微生物活性有促进作用.
3.2 盐度为5gNaCl/L时,SAOR和SNIOR的AC分别降至75%和55%,亚硝酸盐氧化活性比氨氧化活性更容易受到盐的抑制;在 0和 5gNaCl/L时,SNIDR的 AC高于 SNADR,当盐度达到15gNaCl/L后,SNADR的AC高于SNIDR,表明低盐度对硝酸盐型反硝化活性的抑制作用大于亚硝酸盐型反硝化活性,高盐度条件下结果相反;盐度达10gNaCl/L后,SNIDR和SNADR的AC在各盐度条件下均比SAOR及SNIOR高,说明反硝化活性对盐的承受能力比硝化活性更强.
3.3 SAOR、SNIOR、SNIDR、SNADR、ESNIDR、E-SNADR、SOUR、DHA的IC50分别为11.3,6.0,16.5,20.2,4.7,3.0,15.1,10.9gNaCl/L.
[1] 崔有为,张国辉,计立平,等.海水冲厕污水生物处理可行性研究[J]. 工业水处理, 2003,23(12):33-36.
[2] Mosquera-Corral A, Gonzalez F, Campos J L, et al. Partial nitrification in a SHARON reactor in the presence of salts and organic carbon compounds [J]. Process Biochemistry, 2005,40(9): 3109-3118.
[3] Zhao W, Wang Y, Liu S, et al. Denitrification activities and N2O production under salt stress with varying COD/N ratios and terminal electron acceptors [J]. Chemical Engineering Journal, 2013,215:252-260.
[4] Moussa M S, Sumanasekera D U, Ibrahim S H, et al. Long term effects of salt on activity, population structure and floc characteristics in enriched bacterial cultures of nitrifiers [J]. Water research, 2006,40(7):1377-1388.
[5] She Z L, Zhao L L, Zhang X L, et al. Partial nitrification and denitrification in a sequencing batch reactor treating high-salinity wastewater [J]. Chemical Engineering Journal, 2016,288: 207—215.
[6] Uygur A, Kargı F. Salt inhibition on biological nutrient removal from saline wastewater in a sequencing batch reactor [J]. Enzyme & Microbial Technology, 2004,34(3):313-318.
[7] 齐泮晴,于德爽,李 津,等.盐度对厌氧氨氧化工艺处理含海水污水脱氮特性的影响 [J]. 中国环境科学, 2016,36(5):1392-1399.
[8] 王建龙,吴立波,齐 星,等.用氧吸收速率(OUR)表征活性污泥硝化活性的研究 [J]. 环境科学学报, 1999,19(3):225-229.
[9] Gong L X, Li J, Yang Q, et al. Biomass characteristics and simultaneous nitrification-denitrification under long sludge retention time in an integrated reactor treating rural domestic sewage [J]. Bioresource Technology, 2012,119(9):277-284.
[10] Chu L B, Wang J L. Nitrogen removal using biodegradable polymers as carbon source and biofilm carriers in a moving bed biofilm reactor [J]. Chemical Engineering Journal, 2011,170(1): 220-225.
[11] Klapwuk A, Drent J, Steenvoorden J H A M. A modified procedure for the TTC-dehydrogenase test in activated-sludge [J]. Water Research, 1974,8(2):121-125.
[12] 国家环境保护总局,水和废水监测分析方法编委会.水和废水监测分析方法 [M]. 北京:中国环境科学出版社, 2002:261-282.
[13] Chiu Y C, Lee L L, Chang C N, et al. Control of carbon and ammonium ratio for simultaneous nitrification and denitrification in a sequencing batch bioreactor [J]. International biodeterioration & biodegradation, 2007,59(1):1-7.
[14] Zhang K F, Ling Z Y, Zhang L Q, et al. Effect of Temperature on Simultaneous Nitrification and Denitrification via Nitrite in Sequencing Batch Biofilm Reactor [J]. Bioprocess & Biosystems Engineering, 2009,32(2):175-182.
[15] Liu Y, Shi H, Xia L, et al. Study of operational conditions of simultaneous nitrification and denitrification in a Carrousel oxidation ditch for domestic wastewater treatment [J]. Bioresource technology, 2010,101(3):901-906.
[16] Peng Y Z, Zhu G B. Biological nitrogen removal with nitrification and denitrification via nitrite pathway [J]. Applied Microbiology & Biotechnology, 2006,73(1):15-26.
[17] Dincer A R, Kargi F. Salt inhibition of nitrification and denitrification in saline wastewater [J]. Environmental Technology, 1999,20(11):1147-1153.
[18] Cortés-Lorenzo C, Rodríguez-Díaz M, Sipkema D, et al. Effect of salinity on nitrification efficiency and structure of ammoniaoxidizing bacterial communities in a submerged fixed bed bioreactor [J]. Chemical Engineering Journal, 2015,266:233-240.
[19] 张宇坤,王淑莹,董怡君,等. NaCl盐度对氨氧化细菌活性的影响及动力学特性 [J]. 中国环境科学, 2015,35(2):465-470.
[20] Hamoda M F, Al-Attar I M S. Effects of high sodium chloride concentrations on activated sludge treatment [J]. Water Science and Technology, 1995,31(9):61-72.
[21] Sibag M, Choi B G, Suh C, et al. Inhibition of total oxygen uptake by silica nanoparticles in activated sludge [J]. Journal of Hazardous Materials, 2015,283:841-846.
[22] 荣宏伟,李健中,张可方.铜对活性污泥微生物活性影响研究 [J].环境工程学报, 2010,4(8):1709-1713.
[23] Panswad T, Anan C. Impact of high chloride wastewater on an anaerobic/anoxic/aerobic process with and without inoculation of chloride acclimated seeds [J]. Water Research, 1999,33:1165—1172.
[24] Kumar S, Chaudhuri S, Maiti S K. Soil dehydrogenase enzyme activity in natural and mine soil—a review [J]. Middle-East J Sci Res, 2013,13(7):898-906.
[25] 于德爽,彭永臻,宋学起,等.含海水污水的短程硝化反硝化 [J].环境科学, 2003,24(3):50-55.
Effects of salinity on the activity of non-acclimated biomass.
GUO Zi-xuan, WANG Qun, SHE Zong-lian*
(Key Laboratory of Marine Environmental Science and Ecology, Ministry of Education, School of Environmental Science and Technology, Ocean University of China, Qingdao 266100, China). China Environmental Science, 2017,37(1):181~187
Microbial activities of the sludge taken from the sequencing batch reactor (SBR) were measured by batch experiments under salinity stress, and the impacts of salinity on nitrifying bacteria and denitrifying bacteria were analysed. The special ammonia oxidation rate (SAOR:0~30gNaCl/L), special nitrite oxidation rate (SNIOR:0~15gNaCl/L), special nitrite denitrication rate (SNIDR:0~35gNaCl/L), special nitrate denitrification rate (SNADR:0~40gNaCl/L), endogenesis special nitrite denitrification rate (E-SNIDR:0~25gNaCl/L), endogenesis special nitrate denitrification rate (E-SNADR: 0~5gNaCl/L), special oxygen uptake rate (SOUR: 0~30gNaCl/L) and dehydrogenase activity (DHA: 0~80gNaCl/L) were conducted for activities analysis in this study. The results indicated that when salinity was 5gNaCl/L, salt stress could enhance SNIDR and SOUR. The activity cofficients (AC) of SAOR and SNIOR were decreased to 46% and 1% under salinity of 15gNaCl/L, respectively, so compared with ammonia oxidizing bacteria, nitrite oxidizing bacteria was more easily inhibited by salt stress. The ACs of SNIDR and SNADR were higher than SAOR and SNIOR when salinity higher than 10gNaCl/L (included 10gNaCl/L) showed that denitrifying bacteria had more salt tolerance than nitrifying bacteria. DHA could still be detected at NaCl concentration as high as 80g/L, indicating that microorganisms still had the ability of catalyze redox reaction.
SBR;salinity;microbial activity;nitrification;denitrification
X703
A
1000-6923(2017)01-0181-07
郭姿璇(1992-),女,湖南株洲人,中国海洋大学环境科学与工程学院硕士研究生,主要从事水污染控制研究.
2016-03-29
国家水体污染控制与治理科技重大专项(2014ZX07203-008)
* 责任作者, 教授, szlszl@ouc.edu.cn
