茵栀黄口服液联合清蛋白治疗新生儿病理性黄疸疗效及安全性研究
2017-02-21徐睿霞王甫琴吴亚臻
徐睿霞,王甫琴, 吴亚臻
(1.青海大学附属医院儿科,西宁 810000;2.新疆五家渠市103团医院儿科,新疆五家渠 831304)
·经验交流· doi:10.3969/j.issn.1671-8348.2017.04.035
茵栀黄口服液联合清蛋白治疗新生儿病理性黄疸疗效及安全性研究
徐睿霞1,王甫琴2, 吴亚臻1
(1.青海大学附属医院儿科,西宁 810000;2.新疆五家渠市103团医院儿科,新疆五家渠 831304)
[摘要] 目的 探讨茵栀黄口服液联合清蛋白治疗新生儿病理性黄疸疗效、安全性及可能机制。方法 收集150例新生儿病理性黄疸患儿,分为对照组75例和观察组75例。常规治疗基础上,对照组给予清蛋白,而观察组则联合给予茵栀黄口服液治疗。比较对照组和观察组患儿临床疗效、血清胆红素水平、胆红素下降速度、血清超敏C反应蛋白(hs-CRP)、甲胎蛋白(AFP)、转铁蛋白(TRF)水平及不良反应发生情况。结果 疗效评价显示,观察组患儿治疗总有效率明显高于对照组(96.0%vs.86.7%,P<0.05)。治疗后,与对照组相比,观察组患儿血清胆红素水平显著降低(110.2±17.1)μmol/Lvs. (148.8±19.1)μmol/L,胆红素日均下降程度更明显[(45.1±4.5)μmol·L-1·d-1vs.(28.3±5.2)μmol·L-1·d-1],退黄时间明显缩短[(5.1±1.8 )dvs. (7.6±1.6)d],血清hs-CRP、AFP水平明显降低[(7.3±1.6)mg/Lvs.(13.7±2.2 )mg/L,(13.2±2.1)mg/Lvs.(18.1±2.5)mg/L],TRF水平明显升高(1.97±0.28) g/Lvs.(1.64±0.24)g/L,组间比较差异均有统计学意义(均P<0.05)。治疗期间,两组患儿均未出现严重不良反应病例,观察组不良反应发生率明显低于对照组(8.0%vs.20.0%,P<0.05)。结论 茵栀黄口服液联合清蛋白治疗新生儿病理性黄疸疗效可靠,能够显著提高临床疗效,临床上值得进一步研究。
茵栀黄口服液;清蛋白;黄疸, 新生儿;C反应蛋白;甲胎蛋白类;转铁蛋白
病理性黄疸是临床上常见的新生儿疾病,发病率高,以皮肤、巩膜、黏膜黄染为临床表现。新生儿的血脑屏障尚未发育成熟,当患儿体内胆红素不能迅速恢复至正常水平,疾病进展时,胆红素可以通过血脑屏障,损伤神经系统,轻者遗留神经系统后遗症,严重者甚至导致患儿死亡[1-2]。多项研究表明,蓝光照射与药物联合作用疗效优于单独蓝光治疗,然而联用药物的选择与方案却尚无统一共识。清蛋白可以迅速结合水溶性胆红素,增加血清胆红素清除率[3],茵栀黄口服液可以增加胆管收缩功能,从而使胆汁排出增加,起到利胆退黄作用[4]。在蓝光照射基础上联用清蛋白和茵栀黄口服液可能以不同机制协同提高治疗新生儿病理性黄疸疗效,然而目前尚无相关报道。本研究旨在探讨茵栀黄口服液联合清蛋白治疗新生儿病理性黄疸疗效、安全性及可能的机制,以期为该疾病的治疗提供一定参考依据。
1 资料与方法
1.1 一般资料 收集2015年1-10月于青海大学附属医院接受治疗的150例符合纳入标准的新生儿病理性黄疸患儿作为研究对象,分为对照组75例和观察组75例。所有患儿均符合新生儿病理性黄疸的相关诊断标准[5],且不需要换血治疗,并排除核黄疸、阻塞性黄疸、心肺肝肾功能不全、感染性疾病等患儿。所有入选患儿家属对具体治疗方案知情同意,自愿参与本研究,并签订知情同意书。其中对照组患儿男40例,女35例,日龄(12.6±4.1)d;胎龄(38.7±4.2)周;出生体质量(3.4±0.8)kg。观察组患儿男42例,女33例,日龄(11.8±3.7)d;胎龄(38.2±4.4)周;出生体质量(3.2±0.6)kg。对照组和观察组患儿一般资料比较差异无统计学意义(均P>0.05),具有可比性。
1.2 方法 患儿入选后,均给予保暖,改善缺氧,抗感染,纠正水电解质、酸碱平衡紊乱,营养支持等一般治疗及蓝光照射治疗。在此基础上,对照组患儿给予清蛋白(上海新兴医药股份有限公司,国药准字S20033048)治疗,剂量:1 g/kg静脉滴注,1次/d。而观察组患儿在对照组基础上联合给予茵栀黄口服液(北京华润高科技天然药物有限公司,国药准字Z11020607)治疗,给药剂量:5 mL/次,口服,2次/d。疗程均为1周。
1.3 疗效评价及观察指标 1个疗程结束后,评价新生儿病理性黄疸疗效,标准如下,痊愈:经过治疗,患儿皮肤、巩膜及黏膜黄染完全消退,复查血清胆红素水平恢复正常水平;有效:经过治疗,患儿黄染症状部分消退,复查血清胆红素较治疗前有所下降,但仍未恢复至正常水平;无效:经过治疗,患儿黄染消退不明显甚至加重,血清胆红素下降不明显甚至升高。 痊愈及有效病例均为治疗有效。治疗前后,抽取患儿静脉血,检测组间血清超敏C反应蛋白(hs-CRP)、甲胎蛋白(AFP)、转铁蛋白(TRF)水平,其中hs-CRP、AFP采用酶联免疫吸附试验(ELISA)法检测,TRF采用全自动生化分析仪检测。
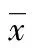
2 结 果
2.1 临床疗效比较 疗效评价显示,对照组患儿和观察组患儿治疗总有效率分别为86.7%和96.0%。统计学显示,观察组患儿总有效率明显高于对照组,差异有统计学意义(χ2=4.13,P<0.05)。见表1。

表1 两组临床疗效比较[n(%)]
2.2 胆红素水平比较 治疗前,对照组和观察组患者血清胆红素水平比较差异无统计学意义(P>0.05)。治疗后,与对照组相比,观察组患者血清胆红素水平明显降低,胆红素日均下降程度更明显,且退黄时间显著缩短,组间比较差异均有统计学意义(P<0.05)。见表2。

表2 两组胆红素水平比较 ±s)
2.3 hs-CRP、AFP、TRF水平比较 治疗前,对照组和观察组患儿血清hs-CRP、AFP、TRF水平比较差异无统计学意义(P>0.05)。治疗后,两组患儿上述指标均有一定程度改善(P<0.05)。与对照组相比,观察组患儿治疗后血清hs-CRP、AFP水平均明显降低,TRF水平明显升高,组间比较差异均有统计学意义(P<0.05)。见表3。
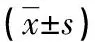
表3 两组患儿治疗前后hs-CRP、AFP、TRF水平比较
a:P<0.05,与同组治疗前比较;b:P<0.05,与对照组比较。
2.4 不良反应发生情况 治疗期间,对照组和观察组患儿均未出现严重不良反应。其中对照组患儿腹泻7例,皮疹6例,发热2例,不良反应发生率为20.0%(15/75);观察组患儿腹泻3例,皮疹2例,发热1例,不良反应发生率为8.0%(6/75)。统计分析后显示,观察组患儿不良反应发生率明显低于对照组患儿(χ2=4.48,P=0.03)。
3 讨 论
病理性黄疸是常见的新生儿疾病,患儿体内未结合胆红素水平异常升高,导致皮肤、巩膜等黄染,与胆红素生成过多、肝脏等器官胆红素结合能力降低、胆红素排泄障碍等因素有关[6-7]。当治疗不及时,未结合胆红素将通过血脑屏障损伤中枢神经系统,严重威胁患儿健康及生命[8]。治疗上,不管病因如何,迅速清除高水平的胆红素是该疾病的治疗关键。
蓝光照射是新生儿病理性黄疸的常用治疗手段,可以将胆红素由脂溶性转变为水溶性,使其从胆汁及尿液中排出达到治疗目的,操作简单,疗效确切[9]。但是,蓝光照射治疗会损伤皮肤及降低患儿的免疫功能,容易出现发热、腹泻、皮疹等不良反应,不利于治疗[10]。为了提高疗效,降低不良反应,在蓝光照射基础上多种治疗方案可应用到该疾病的治疗中。研究表明,蓝光照射治疗时脂溶性胆红素转化为水溶血胆红素是一个可逆反应,此时应用清蛋白可以迅速结合水溶性胆红素,促进该反应的进行,使未结合胆红素水平迅速降低,提高疗效[11]。茵栀黄口服液是一种复方中药制剂,主要有效成分为茵陈、黄芩、栀子、金银花,其中茵陈具有清热利湿、退黄疸功效,黄芩可以清热燥湿、泻火解毒,栀子能够清热利湿,金银花则可以清热解毒,诸药合用,可以加速胆红素分解及排泄,达到退黄目的[12]。但目前关于茵栀黄口服液联合清蛋白治疗新生儿病理性黄疸的研究较少。本研究中,在一般治疗及蓝光照射治疗基础上,与单独应用清蛋白组相比,联合茵栀黄口服液组患儿黄疸的治疗总有效率提高,治疗后血清胆红素水平降低,胆红素日均下降程度更明显,且不良反应发生率降低,结果表明该联合方案能够发挥协同作用,加速排出血清胆红素,提高治疗疗效,而不良反应减少可能与茵栀黄口服液改善患儿免疫功能有关[13]。
新生儿病理性黄疸是一种病理过程,血清多种指标水平会发生改变,可以作为该疾病严重程度判断及疗效评价指标。其中C反应蛋白(CRP)是机体在应激状态下产生的急性时相蛋白,其水平在新生儿病理性黄疸患儿中显著升高,与黄疸的发生关系密切[14]。AFP是由肝脏、胃肠道等多种器官合成分泌的一种糖蛋白,在高胆红素血症中大量表达[15]。而TRF是由肝细胞合成的具有转运铁功能的一种β球蛋白,其水平在黄疸患儿中有所下降,且随着黄疸的加重而进一步降低[16]。本研究中,与单独应用清蛋白组相比,联合茵栀黄口服液组患儿治疗后hs-CRP、AFP水平降低,TRF水平升高,组间比较差异均有统计学意义(P<0.05),表明联合茵栀黄口服液治疗后反映黄疸严重程度及疗效的评价指标hs-CRP、AFP、TRF改善更明显,这也从侧面表明该联合方案能够提高新生儿病理性黄疸的治疗效果。
综上所述,茵栀黄口服液联合清蛋白治疗新生儿病理性黄疸疗效可靠,能够显著提高临床疗效,迅速降低血清胆红素水平,改善血清hs-CRP、AFP、TRF水平,并降低不良反应发生率,临床上值得进一步研究。
[1]Harpavat S,Devaraj S,Finegold MJ.An infant with persistent jaundice and a normal newborn direct bilirubin measurement[J].Clin Chem,2015,61(2):330-333.
[2]Pettit KE,Tran SH,Lee E,et al.The association of antenatal corticosteroids with neonatal hypoglycemia and hyperbilirubinemia[J].J Matern Fetal Neonatal Med,2014,27(7):683-686.
[3]Christensen RD,Yaish HM,Lemons RS.Neonatal hemolytic jaundice:morphologic features of erythrocytes that will help you diagnose the underlying condition[J].Neonatology,2014,105(4):243-249.
[4]李国苍.间断蓝光照射联合妈咪爱、茵栀黄治疗新生儿黄疸48例[J].中国药业,2014,23(4):89.
[5]魏克伦,王玉山.关于新生儿病理性黄疸诊断标准的讨论[J].中华儿科杂志,2009,47(1):17.
[6]Sebbe PF,Villaverde AB.Characterization of an optical device with an array of blue light emitting diodes LEDS for treatment of neonatal jaundice[J].AIP Conf Proc,2008,992(1):606-610.
[7]Chang YS,Hwang JH,Kwon HN,et al.In vitro and in vivo efficacy of new blue light emitting diode phototherapy compared to conventional halogen quartz phototherapy for neonatal jaundice[J].J Korean Med Sci,2005,20(1):61-64.
[8]刘阳.茵栀黄联合双歧杆菌配合蓝光治疗病理性黄疸的疗效分析[J].海南医学,2013,24(23):3476-3478.
[9]路军.茵栀黄口服液联合蓝光照射治疗新生儿病理性黄疸的临床疗效研究[J].中医药学报,2014,42(5):132-134.
[10]唐红装,梁丽清,谢映梅.短时多次蓝光疗法在新生儿黄疸治疗中的效果观察与护理[J].广东医学,2010,31(23):3154-3155.
[11]张伟忠,陈能.新生儿病理性黄疸经清蛋白联合光疗治疗后临床效果观察[J].河北医药,2013,35(15):2297-2298.
[12]李举,郝晓广.蓝光联合茵栀黄颗粒治疗新生儿病理性黄疸临床疗效分析[J].中国生化药物杂志,2014,34(1):121-122.
[13]张文旻.茵栀黄联合微生态制剂治疗新生儿黄疸的临床效果及对免疫功能的影响[J].实用临床医学,2013,14(10):86-87,93.
[14]朱小冰.C反应蛋白和甲胎蛋白在新生儿黄疸中的表达意义[J].重庆医学,2015,44(14):1968-1970.
[15]Kuzdan C,Coban AC,Ince Z,et al.The umbilical cord alpha-fetoprotein levels for predicting hyperbilirubinemia in term neonates[J].J Matern Fetal Neonatal Med,2014,27(3):265-269.
[16]田晓曦,张敏.腺苷蛋氨酸辅助治疗对新生儿黄疸患儿血清转铁蛋白、心肌酶谱及血清胆红素的影响[J].中国生化药物杂志,2015,35(8):66-68.
徐睿霞(1976-),本科,主治医师,主要从事新生儿疾病方面的治疗工作。
R722.17
B
1671-8348(2017)04-0530-03
2016-09-30
2016-10-28)
