Egr-1通过上调NDRG1诱导骨髓间充质干细胞成骨分化
2017-02-21史素琴
史素琴,潘 研,岳 新,陈 妍,赵 璐△
(1.河南中医药大学第一附属医院内分泌科,郑州 450000;2.河南中医药大学第三附属医院内分泌科,郑州 450000)
论著·基础研究 doi:10.3969/j.issn.1671-8348.2017.04.004
Egr-1通过上调NDRG1诱导骨髓间充质干细胞成骨分化
史素琴1,潘 研1,岳 新1,陈 妍2,赵 璐2△
(1.河南中医药大学第一附属医院内分泌科,郑州 450000;2.河南中医药大学第三附属医院内分泌科,郑州 450000)
[摘要] 目的 探究早期生长因子1(Egr-1)对骨髓间充质干细胞(BMSCs)增殖和成骨分化的影响。方法 采集成年男性骨髓组织,分离培养原代BMSCs并在显微镜下观察其形态,流式细胞术鉴定BMSCs表面标志物;pcDNA3.1/Egr-1转染BMSCs,MTT检测BMSCs的增殖,茜素红钙染色试剂盒检测细胞基质内钙结节的形成,ALP活性测定试剂盒检测细胞内ALP的活性,实时定量qPCR和 Western blot分别检测细胞内Egr-1、Runx2、NDRG1 mRNA和蛋白表达;Egr-1 siRNA转染BMSCs,检测细胞内ALP活性、Egr-1、Runx2和NDRG1 mRNA及蛋白表达。结果 离体培养的BMSCs高表达CD90和CD29,而CD34和CD45呈阴性表达;pcDNA3.1/Egr-1转染对BMSCs增殖无明显作用,却能促进细胞基质内钙结节的形成,上调ALP活性和Egr-1、Runx2、NDRG1的表达,而Egr-1 siRNA则作用相反。结论 Egr-1通过上调NDRG1诱导BMSCs的成骨分化。
骨质疏松;骨髓间充质干细胞;成骨细胞;早期生长因子1;N-myc下游调节基因1
[Abstract] Objective To explore the effects of early growth response gene-1 (Egr-1) on bone marrow mesenchymal stem cells (BMSC) proliferation and osteogenic differentiation,which is aimed at providing new molecular targets for the treatment of osteoporosis.Methods Bone marrow was collected from adult men and the BMSCs were cultured primarily and observed by microscope.Meanwhile,flow cytometry was used for BMSCs phenotypic identification;After transfection of pcDNA3.1/Egr-1 into BMSCs,the level of BMSCs proliferation was determined by MTT respectively on the 2 d,4 d and 6 d;On the 7 d after transfection,the ALP activity assay was used for testing the ALP activity in BMSCs.And then,alizarin red S-calcium kit was used for measuring the calcified knots respectively on the 7 d,14 d and 21 d;On the 21 d after transfection,real-time qPCR and Western blotting were used respectively for measuring the expression of mRNA and protein of Egr-1,Runx2 and NDRG1;Further,BMSCs were transfected with Egr-1 siRNA,and the content of calcium nodules,ALP activity,the expression of Egr-1,Runx2 and NDRG1 were detected as above methods.Results The cells cultured in vitro showed high level of CD90 and CD29 and very low level of CD34 and CD45,which is accorded with the characteristic of BMSCs.The pcDNA3.1/Egr-1 transfection for BMSCs had no effect on cells proliferation.However,the calcified knots,ALP activity and the expression of Egr-1,Runx2 and NDRG1 were increased after transfection of pcDNA3.1/Egr-1 for BMSCs.In addition,Egr-1 siRNA showed the opposite effect with pcDNA3.1/Egr-1 transfection for BMSCs.Conclusion Egr-1 induces osteogenic differentiation of BMSCs by promoting NDRG1 but has no effects on proliferation of BMSCs.
原发性骨质疏松症常见于中老年人和绝经后妇女,主要表现为骨量减少、骨组织微结构的改变等。成骨细胞功能和数量的退化对骨质疏松症的发生发展有重要作用[1],而骨髓间充质干细胞(bone marrow mesenchymal stem cells,BMSCs)经定向诱导可分化为成骨细胞,成为防治骨质疏松症的重要手段[2-3]。
N-myc下游调节基因(N-myc downstream regulated gene,NDRG)是一个与细胞分化相关的基因,能转录调控多种蛋白的表达,也对骨肉瘤等多种肿瘤细胞的生长和分化有调控作用[4]。之前有研究发现,NDRG2能通过上调成骨标志基因(runt-related transcription factor 2,Runx2)和碱性磷酸酶(Alkaline phosphatase,ALP)活性促进BMSCs成骨分化,而NDRG1与NDRG2在结构和功能上具有相似性[5]。最近的一项研究证明,NDRG1在腰椎到骶椎体节过渡区域特化过程中起一定作用[6]。而且,NDRG1可被早期生长因子1(early growth response gene-1,Egr-1)上调。Egr-1又是重要的核转录因子,能通过介导细胞内信号级联反应的偶联过程调控诸多下游长期反应基因的表达,进而调控细胞的纤维化和分化[7]。也有研究发现,Egr-1介导了小鼠软骨细胞的凋亡过程[8],但它对BMSCs的增殖和分化作用尚未见报道。本文检测了Egr-1对BMSCs增殖、成骨分化及NDRG1表达的影响,旨在为骨质疏松症的治疗寻找新的分子靶点。
1 资料与方法
1.1 一般资料 研究对象来自2014年3月至2015年1月在河南中医药大学第一附属医院择期手术的4例脊柱侧弯16~20岁的男性自愿手术患者。术中收集4例骨髓组织,每例约8 mL。本研究经河南中医药大学第一附属医院伦理学委员会批准。所有患者均被告知风险,经患者知情同意后签署书面同意书。
1.2 方法
1.2.1 BMSCs 的分离与培养 在收集的骨髓组织中加入10 mL DMEM(Invitrogen,USA)培养基后摇匀,离心,去上清。加细胞重悬液重悬洗涤后加4 mL D-Hanks(Invitrogen)溶液和4 mL细胞分离液(0.56∶0.44),离心后收集单核细胞层,用含10% 胎牛血清的DMEM培养基洗涤。将BMSCs接种到25 mL培养瓶中(5×105/cm2),于37 ℃、5% CO2的培养箱内培养,3 d后换液,以后每2天换液1 次。待细胞融合达70%~80%后,用2.5 g/L胰酶消化,以1×104/cm2将细胞传代培养。倒置相差显微镜下观察细胞形态。
1.2.2 流式细胞术鉴定BMSCs 在生长状态良好的BMSCs中加入胰酶消化液,离心。然后分别加入购自英国Abcam公司的PE-CD34、FITC-CD29、FITC-CD45和FITC-CD90抗体,4 ℃孵育30 min。PBS冲洗后在流式细胞仪上检测。
1.2.3 细胞转染 构建正义Egr-1质粒并合成,经感受态转化,质粒提取试剂盒(Invitrogen,Carlsbad,CA,USA)提取后转染到空载体pcDNA3.1中,命名为pcDNA3.1/Egr-1。待细胞融合达80%后,分别配置pcDNA3.1、pcDNA3.1/Egr-1、siRNA、Egr-1 siRNA与脂质体复合物,用Lipofectamine 2000转染BMSCs细胞。转染的BMSCs细胞在荧光显微镜下观察到点状绿光则表明转染成功。本实验转染用的Egr-1 siRNA引物序列均由广州锐博生物科技有限公司设计并合成。
1.2.4 噻唑蓝(MTT)法检测BMSCs细胞增殖 BMSCs经胰酶消化后,以1×104个/cm2接种于96 孔板。经pcDNA3.1/Egr-1转染后分别培养2、4、6 d,加入20 μL MTT,37 ℃孵育4 h。吸弃孔内MTT,加二甲基亚砜后避光振荡10 min,酶标仪测定各孔490 nm,吸光度(A)490 nm值。
1.2.5 茜素红钙结节染色 BMSCs如1.2.4接种后,pcDNA3.1/Egr-1转染细胞并用成骨培养基培养,各组细胞于转染第7、14、21天分别按照茜素红钙结节染色试剂盒(上海杰美基因医药有限公司)对样本进行固定、染色和澄清,倒置显微镜下观察。
1.2.6 ALP活性检测 转染诱导分化7 d后,ALP活性测定试剂盒(南京建成公司)检测各组细胞内ALP活性,酶标仪上测定各孔A520 nm值。
1.2.7 实时定量 PCR TRIzol法提取细胞内总RNA,在核酸定量仪上测得浓度,ReverTra Ace qPCR RT Master Mix试剂盒(K1621,Formentas)用于总RNA的反转录,荧光定量试剂盒(K0241,Fermentas)检测Egr-1 Runx2和NDRG1的表达。各基因引物见表1。反应条件为:95 ℃ 10 min,95 ℃ 15 s,60 ℃ 30 s,72 ℃ 30 s,共40 个循环。
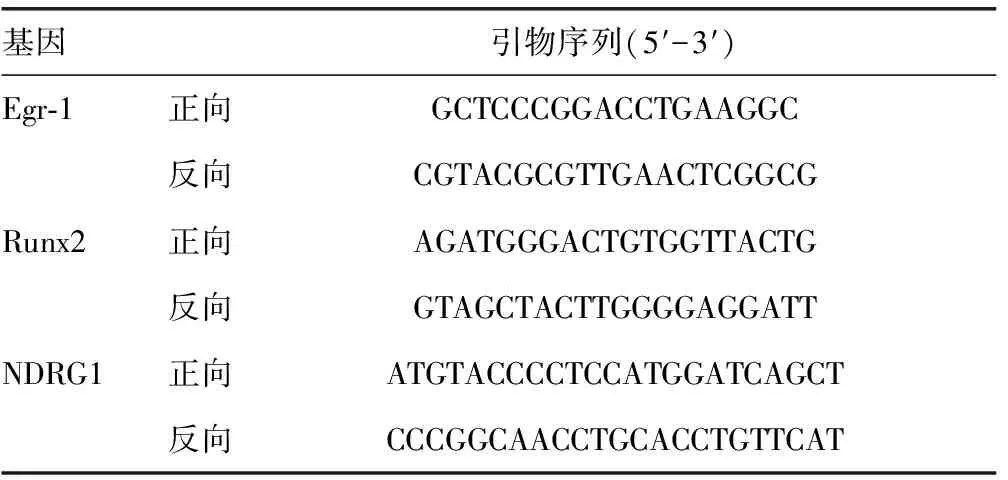
表1 基因引物
1.2.8 Western blot RIPA裂解细胞,用总蛋白提取试剂盒(Millipore,USA)提取细胞蛋白质,测定浓度。吸取50 μg蛋白上样于10%聚丙烯酰胺凝胶孔,80 V恒压电泳,然后恒流转移至聚偏氟乙烯(PVDF)膜。用含脱脂奶粉的Tris缓冲液于室温封闭1 h,分别加入Runx2、NDRG1一抗(Abcam,UK)4 ℃过夜。经TBST洗膜、FITC标记的二抗(Abcam,UK)室温孵育1 h。蛋白质发光试剂盒(Millipore,USA)化学发光显影后用凝胶成像分析系统分析。
2 结 果
2.1 BMSCs的鉴定 接种BMSCs后于显微镜下观察,发现2 d后细胞贴壁,呈集落样生长,细胞形态清晰可见,呈多突、梭形,部分伸出伪足呈短棒状(图1A)。7 d 后BMSCs围绕集落中心迅速生长和增殖,此时的细胞相对形态均一,排列紧密,细胞胞体略大,多呈长梭形,集落周围能观察到许多放射状或旋涡状的贴壁细胞(图1B)。 通过流式细胞仪检测BMSCs表面标志物CD29、CD34、CD45、CD90的表达(图1C),结果发现实验培养的细胞高表达CD90和CD29,其阳性率值分别为99.2%和99.5%,极少表达CD34和CD45,阳性率值分别为0.2%和0.8%,这些结果符合BMSCs 表型特征。
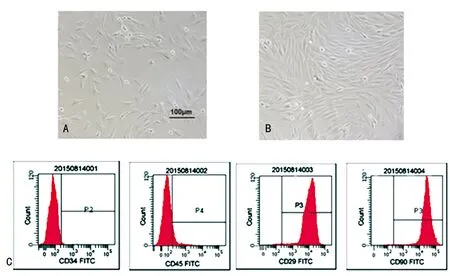
A:接种第2 天;B:接种第10天;C:BMSCs表面标志物CD29、CD34、CD45、CD90的表达。
2.2 Egr-1对BMSCs增殖无明显作用 为了探究Egr-1对BMSCs增殖的作用,笔者采用pcDNA3.1和pcDNA3.1/Egr-1分别转染BMSCs。表2是转染后细胞分别培养2、4、6 d的MTT检测结果,与对照组相比,pcDNA3.1和pcDNA3.1/Egr-1转染对BMSCs的增殖过程无明显作用(P>0.05)。
表2 Egr-1 对人BMSCs增殖的影响
2.3 Egr-1促进钙结节的形成 为了探究Egr-1能否诱导BMSCs向成骨细胞分化,分别于pcDNA3.1和pcDNA3.1/Egr-1转染BMSCs后第7、14、21天用茜素红钙结节染色试剂盒对细胞基质内钙结节染色。结果显示,pcDNA3.1/Egr-1组细胞基质内钙结节的数量和密度在转染后7、14、21 d逐渐增加,且明显高于对照组和pcDNA3.1组(P<0.05);pcDNA3.1组细胞基质内钙结节的数量和密度与对照组相比差异无统计学意义(P>0.05),见图2。
2.4 Egr-1促进BMSCs内ALP活性及Egr-1、Runx2、NDRG1表达 为了探讨Egr-1是否通过NDRG1促进BMSCs向成骨细胞分化,笔者检测了pcDNA3.1/Egr-1转染后第7天细胞内ALP活性和第21天细胞内Runx2、NDRG1的表达。结果表明,pcDNA3.1/Egr-1组细胞内ALP活性(图3A)明显高于对照组和pcDNA3.1组(P<0.05);Egr-1 mRNA(图3B)和蛋白(图3C)的表达在pcDNA3.1/Egr-1组明显高于对照组和pcDNA3.1组(P<0.01);Runx2和NDRG1 mRNA(图3B)和蛋白(图3C)的表达在pcDNA3.1/Egr-1组也都明显高于对照组和pcDNA3.1组(P<0.05)。
2.5 Egr-1 siRNA转染抑制BMSCs向成骨细胞的分化 为了进一步探讨Egr-1在BMSCs成骨细胞分化中的作用,笔者接下来采用Egr-1 siRNA转染BMSCs,于第7天检测细胞内ALP活性,第21天检测细胞内Runx2、NDRG1的表达。结果发现,Egr-1 siRNA转染组细胞内ALP活性(图4A)明显低于对照组和siRNA组(P<0.01);Egr-1 mRNA(图4B)和蛋白(图4C)的表达在Egr-1 siRNA组明显低于对照组和siRNA组(P<0.01);Runx2和NDRG1 mRNA(图4B)和蛋白(图4C)的表达在Egr-1 siRNA组也都低于对照组和siRNA组(均P<0.05)。表明Egr-1通过上调NDRG1的表达来诱导BMSCs向成骨细胞分化。
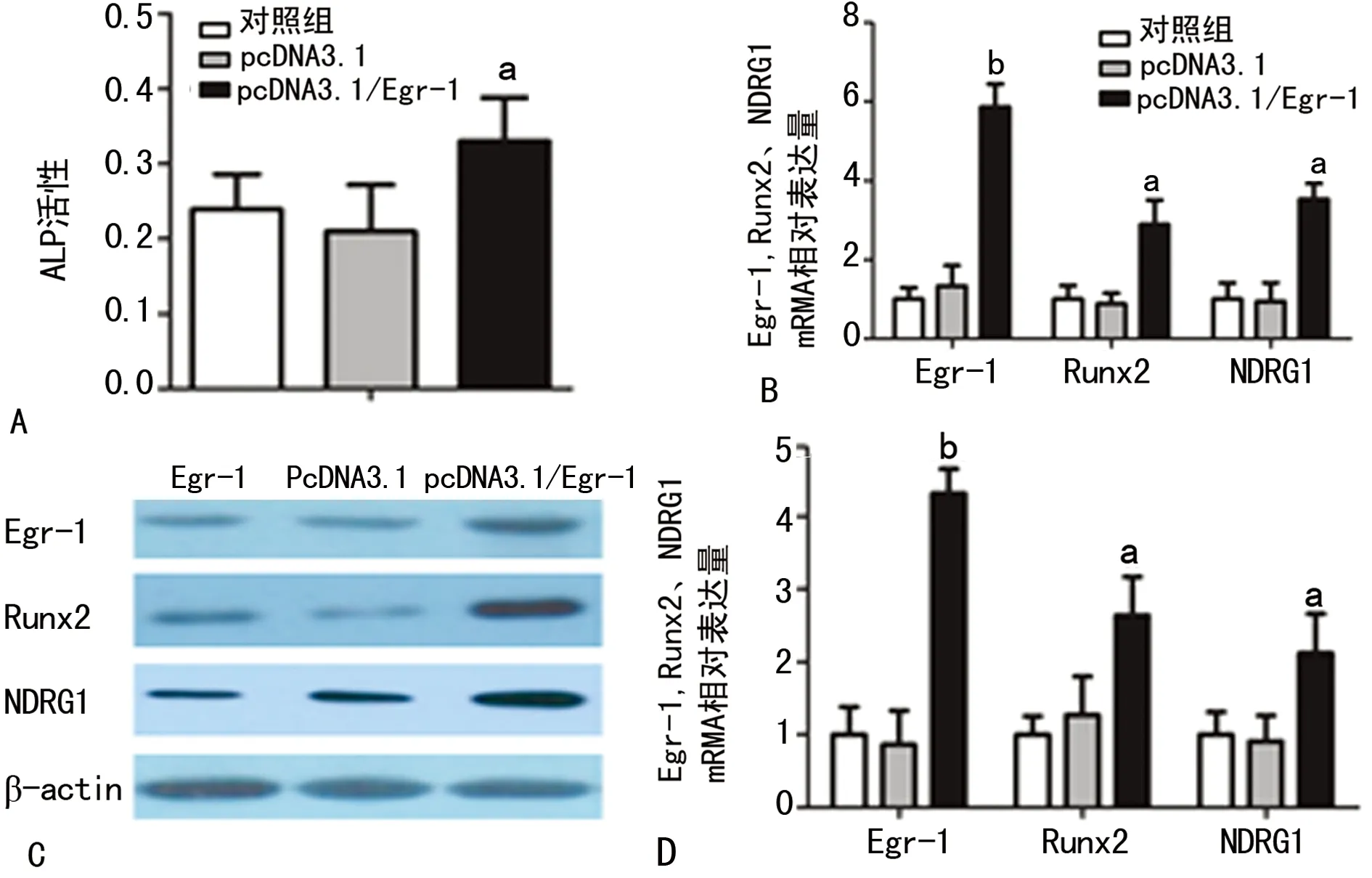
A:ALP活性分析图; B:Egr-1、Runx2、NDRG1 mRNA表达分析图;C:Westerm blot图;D:Westerm blot分析图。a:P<0.05,b:P<0.01,与对照组比较。
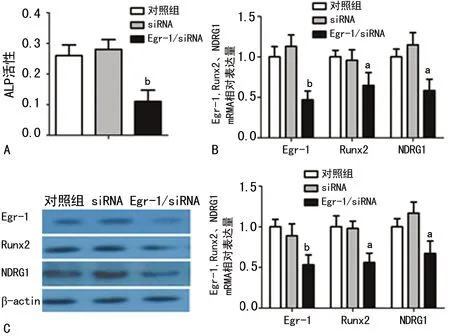
A:ALP活性分析图;B:Egr-1、Runx2、NDRG1 mRNA表达分析图;C:Egr-1、Runx2、NDRG1 蛋白表达及分析图。a:P<0.05,b:P<0.01,与对照组比较。
3 讨 论
BMSCs的数量和功能一直是维持骨骼正常生理机能的关键因素,当机体发生骨质疏松时,骨髓中BMSCs的成骨能力降低。因此,BMSCs向成骨细胞分化相关的研究是近年来骨质疏松症关注的焦点。NDRG1是一个在体内广泛表达的细胞质蛋白,之前关于NDRG1的研究大都集中在对癌细胞分化,包括肝癌、食管癌、结肠癌、乳腺癌、宫颈癌和前列腺癌等[9-10]。近年来,King等[11]发现NDRG1能促进髓鞘细胞的形成和分化。在NDRG1基因敲除鼠中,NDRG1具有调控腰椎和胸椎过渡区域椎体同源转换的作用[6]。甚至有人认为NDRG1参与了骨肉瘤中成骨细胞的分化,可作为成骨分化的候选标志基因[12]。又考虑到NDRG2能通过上调Runx2表达和ALP活性促进BMSCs成骨分化,不难发现NDRG1能促进成骨细胞的形成。本研究结果也发现在ALP活性和Runx2表达越高、钙结节形成越多的BMSCs中,即骨化程度越高的细胞内,NDRG1表达也越高,进一步证实NDRG1与成骨细胞的形成相关。
Egr-1是即刻早期反应基因家族的成员之一,在细胞的生长分化过程中能检测到其活性表达,对多种类型细胞的增殖分化都有调控作用。Egr-1基因的过表达不仅能促进肾小管上皮细胞转分化和肾间质纤维化的发生发展[13],也能通过上调转化生长因子-β1(transforming growth factor-β,TGF-β1)诱导肺泡上皮细胞向肌成纤维细胞分化[14]。在骨关节炎患者的软骨组织中,Egr-1的表达比健康人要低,而且Egr-1能促进软骨细胞的增殖和分化过程[15]。反之,在大骨节病患者的软骨组织中,其表层细胞内Egr-1的表达也明显高于健康人[16]。与此同时,TGF-β已被报道能诱导BMSCs向成骨细胞分化,而Egr-1又是TGF-β的上游基因,这也进一步间接暗示Egr-1或许参与了BMSCs成骨分化。本研究的结果与之前研究的结论相一致,发现Egr-1能促进BMSCs基质中钙结节的形成及ALP活性,进而促进BMSCs向成骨细胞分化。另外,由于NDRG1作为Egr-1的下游靶点之一,又在BMSCs成骨分化过程中高表达,因此,笔者认为Egr-1通过上调NDRG1的表达诱导BMSCs向成骨细胞分化。
由此看来,Egr-1能促进BMSCs向成骨细胞方向分化,这将有助于骨的形成,也为临床治疗骨质疏松提供新的理论依据。但是,BMSCs 增殖和分化的机制较为复杂,可能有多种信号分子参与,Egr-1在该过程中也可能存在更多潜在的作用靶点。而且,Egr-1究竟能否用于骨质疏松的治疗,这都需要进一步构建相关的动物模型,并结合细胞水平的实验来加以评价。
[1]Pernow Y,Granberg B,Sääf M,et al.Osteoblast dysfunction in male idiopathic osteoporosis [J].Calcif Tissue Int,2006,78(2):90-97.
[2]Sun J,Zhang T,Zhang P,et al.Overexpression of the PLAP-1 gene inhibits the differentiation of BMSCs into osteoblast-like cells[J].J Mol Histol,2014,45(5):599-608.
[3]Jia M,Nie Y,Cao DP,et al.Potential antiosteoporotic agents from plants:a comprehensive review[J].Evid Based Complement Alternat Med,2012,2012(8):277-293.
[4]Hua Y,Jia X,Sun M,et al.Plasma membrane proteomic analysis of human osteosarcoma and osteoblastic cells:revealing NDRG1 as a marker for osteosarcoma[J].Tumour Biol,2011,32(5):1013-1021.
[5]杲丽.NDRG2调节骨髓间充干细胞成骨成脂分化机制的研究[D].上海:第四军医大学,2013.
[6]陈慧慧,朱煌,郭熙志.N drg1 基因缺失对腰椎到骶椎结构转换的影响[J].国际骨科学杂志,2015,36(3):202-206.
[7]Marie-Justine G,Benjamin C,Geoffroy N,et al.Transcription factor EGR1 directs tendon differentiation and promotes tendon repair [J].J Clin Invest,2013,123(8):3564-3576.
[8]叶志强,张荣凯,陈郁鲜,等.Egr-1介导了IL-1β诱导的小鼠软骨细胞凋亡[J].中国病理生理杂志,2012,8(28):1482-1487.
[9]Li D,Mei H,Pu J,et al.Intelectin 1 suppresses the growth,invasion and metastasis of neuroblastoma cells through up-regulation of N-myc downstream regulated gene 2[J].Mol Cancer,2015,14(1):1-15.
[10]Han LL,Hou L,Zhou MJ,et al.Aberrant NDRG1 methylation associated with its decreased expression and clinicopathological significance in breast cancer[J].J Biomed Sci,2013,20(196):52.
[11]King RHM,David C,Sash L,et al.Ndrg1 in development and maintenance of the myelin sheath[J].Neurobiol Dis,2011,42(3):368-380.
[12]Matsugaki T,Zenmyo M,Hiraoka K,et al.Role of NDRG1/Cap43 in osteogenic differentiation[J].Bone,2009,44(2):321.
[13]翟英,孙世仁,杜锐,等.早期生长反应因子1过表达促进肾小管上皮细胞转分化[J].肾脏病与透析肾移植杂志,2009,18(6):537-541.
[14]Lee CG,Cho SJ,Kang MJ,et al.Early growth response gene 1-mediated apoptosis is essential for transforming growth factor beta1-induced pulmonary fibrosis[J].J Exp Med,2004,200(3):377-389.
[15]Wang FL,Connor JR,Dodds RA,et al.Differential expression of Egr-1 in osteoarthritic compared to normal adult human articular cartilage[J].Osteoarthritis Cartilage,2000,8(3):161-169.
[16]武世勋,郭雄,张峰,等.大骨节病与骨关节病软骨组织死亡相关因子表达的比较 [J].南方医科大学学报,2014,34 (12):1-7.
《重庆医学》对临床研究论文医学伦理学要求
凡投本刊的临床研究论文(主体是以人为研究对象),作者应说明其遵循的程序是否符合伦理委员会(单位性的、地区性的或国家性的)所制订的伦理学标准,并提供(上传)该委员会的批准文件复印件及受试对象或其亲属的知情同意书复印件。
《重庆医学》编辑部
Egr-1 induces osteogenic differentiation of BMSCs by promoting NDRG1
ShiSuqin1,PanYan1,YueXin1,ChenYan2,ZhaoLu2△
(1.DepartmentofEndocrinology,theFirstAffiliatedHospitalofHenanUniversityofTraditionalChineseMedicine,Zhengzhou,Henan450000,China;2.DepartmentofEndocrinology,theThirdAffiliatedHospitalofHenanUniversityofTraditionalChineseMedicine,Zhengzhou,Henan450000,China)
osteoporosis;bone marrow mesenchymal stem cells;osteoblast;early growth response gene-1;N-myc downstream regulated gene 1
史素琴(1977-),主治医师,博士,主要从事骨质疏松研究。△
,E-mail:zhaolu.cn@163.com。
R335
A
1671-8348(2017)04-0442-04
2016-09-29
2016-10-17)
