转GGCX基因治疗兔骨性关节炎的体外实验研究*
2017-02-21汪文玉付晓玲陈伟高吴建雄
汪文玉,付晓玲,陈 睿,陈伟高,吴建雄
(南昌大学第二附属医院骨科 330006)
·论 著· doi:10.3969/j.issn.1671-8348.2017.04.002
转GGCX基因治疗兔骨性关节炎的体外实验研究*
汪文玉,付晓玲△,陈 睿,陈伟高,吴建雄
(南昌大学第二附属医院骨科 330006)
[摘要] 目的 探索GGCX基因对兔骨性关节炎软骨细胞MMP13的影响及其在兔骨性关节炎软骨退变中的作用。方法 取体质量(2.0±0.2)kg日本大耳兔6只,随机分为3组,每组设立一只对照兔,分别在2、4、6周使用膝前交叉韧带切断术构建模型,6周后模型兔构建成功,分离关节软骨,经消化分离后将软骨细胞接种到6孔细胞培养板,将软骨细胞分为空白组、阴性对照组(转染不含GGCX基因慢病毒)、转染组(转染含GGCX基因慢病毒)3组。转染组则均以LipofectamineTM2000 为转染媒介。用PCR法及蛋白免疫印迹法(Western blot)检测GGCX和MMP13的表达。结果 转染组GGCX有较高的表达水平;转染组MMP13的表达水平降低,且二者与空白组及阴性对照组比较,差异均有统计学意义(P<0.05)。结论 GGCX基因过表达可明显降低其软骨细胞MMP13的表达,为将基因治疗运用于体外骨性关节炎提供实验基础。
软骨,关节;骨关节炎;GGCX基因;基质金属蛋白酶13
骨关节炎(osteoarthritis,OA)是最为常见的关节炎之一,尤以中老年发病最多[1]。骨关节炎的核心是关节面软骨的退行性改变,会造成相应的关节骨质、关节囊、滑膜及关节的其他结构的累及,为慢性、无菌性、进行性侵犯关节的疾病,目前国内外仍未见满意的治疗方法[2]。目前基因转移技术已较为成熟,能作用于靶细胞使其表达软骨生长调控因子,使之能够有效促进软骨生长及基质的合成[3]。近些年来,国内外开始出现用基因来进行基因治疗的新方法,但使用γ-谷氨酰基羧化酶(GGCX)转基因治疗OA的实验研究并未见报道。本研究即通过观察GGCX基因转染的兔骨性关节炎软骨细胞中MMP13的表达及其在OA治疗中的作用,为OA基因治疗方面提供新的思路及对策。
1 材料与方法
1.1 实验动物 3个月龄大小的健康雄性日本大耳白兔6只,体质量约(2.0±0.2)kg,南昌龙平兔业有限公司提供。
1.2 主要材料与仪器 建立该模型手术所需的器械、药品及材料均由南昌大学医学院实验室提供,MMP13一抗抗体、免疫组织化学染色试剂盒均购自南昌中洪博元生物技术有限公司,免疫组织化学技术所需的设备与材料由南昌大学第二附属医院实验室提供,GGCX慢病毒由上海市诺辰生物公司包装并生产。
1.3 方法
1.3.1 模型动物制备 将兔随机分为3组,每组2只,每组设立一只对照兔,不切断前交叉韧带,实验组剪除兔右膝毛,经耳缘静脉麻醉后清洗暴露出右膝皮肤,消毒行右膝前交叉韧带切断术,生理盐水冲洗后给予切口缝合。实验肢体不固定,术后给予抗菌药物预防感染,24~29 ℃环境下分别喂养2、4、6周后处死,观察模型构建情况。
1.3.2 软骨细胞的培养 兔骨性关节炎模型构建成功后,将实验兔子处死,对双膝进行消毒并将其完全离断,用乙醇浸泡后将膝关节放入含有双抗的二氨基联苯胺(PBS)中;在超净台内将关节软骨面进行分离并切取下软骨,将软骨剪碎成1 mm2大小,放入盛有消化酶的试管内进行消化;37 ℃恒温水浴伴震荡。45 min后取上清,离心收集细胞,重复4次;将细胞重悬于DMEM完全培养基中,按一定密度接种于培养瓶中,置于5% CO2,37 ℃培养箱培养,隔天换液;倒置显微镜观察软骨细胞融合成片,长满大部分培养瓶壁后,进行消化后传代扩增培养。实验中发现软骨细胞从第3代开始出现去分化、纤维化现象,因此,在本次研究中,均选用培养的第一代骨性关节炎软骨细胞进行试验。
1.3.3 产生慢病毒颗粒 将GGCX-pSIH1-H1-copGFP质粒与pPACKH1TM Lentivector Packaging 试剂盒按比例混合,应用LipofectamineTM2000试剂共转染293T细胞。收集细胞上清液,按比例稀释再感染新的293T细胞,检测慢病毒的滴度。
1.3.4 慢病毒感染软骨细胞 首先分为3组,空白组:不进行转染;阴性对照组:转染不含GGCX的慢病毒;转染组:转染含有GGCX的慢病毒。将待转染的软骨细胞用含双抗液(1×10 U/L)的D-hanks液漂洗,酶两步消化法分离原代人关节软骨细胞,然后接种于25 cm培养瓶内(5 mL/瓶),置于37 ℃,5% CO2培养箱培养,待细胞贴壁达85%~90%后加入0.25%胰蛋白酶和0.02%EDTA(1∶1)的消化液进行传代培养。接种处于对数生成长期的细胞到96孔细胞培养板,每孔2×103个细胞,使用F-12+10%胎牛血清(FBS)的完全培养基,添加病毒液,37 ℃ 5% CO2的条件下正常培养。转染1 d后运用显微镜对其进行观察,以判定转染效率。转染效率达90%之后进行后续实验。
1.3.5 PCR分析GGCX和MMP13 mRNA的表达 引物序列信息如表1。

表1 各基因PCR引物序列
将培养细胞消化、离心、弃上清,下层细胞加入生理盐水后破碎,提取总 RNA,按逆转录试剂盒说明配制逆转录反应体系20 μL,逆转录反应的条件:37 ℃ 1 h;95 ℃ 5 mim;灭活鼠白血病病毒(MMLV)。将逆转录的cDNA进行PCR扩增,运用自带软件ABI Prism 7500 SDS Software分析得到的结果。
1.3.6 Western blot 提取总蛋白,进行蛋白定量,制备PAGE胶,进行上样及电泳,将胶缓慢移进缓冲液,剪大小相同的硝酸纤维素膜(NC),甲醇浸泡2 min,水洗3 min,最后用缓冲液平衡12 min。在恒流350 mA条件下,转膜40 min。膜封闭,一、二抗孵育,最后进行显色检测目的蛋白GGCX和MMP13的表达。
2 结 果
2.1 兔OA模型构建 实验兔6周后造模成功,如图1可见兔膝关节滑膜增生,前交叉韧带断裂,关节间隙变窄,关节面变得毛糙,关节软骨面有不同程度磨损。

A:转染组切断前交叉韧带图片;B:6周后兔OA模型图片。
2.2 实时定量RT-PCR结果 转染组GGCX表达水平较空白组、阴性对照组明显升高;MMP13在转染组中的表达水平较空白组及阴性对照组明显降低,差异有统计学意义(P<0.05),空白组和阴性对照组比较差异无统计学意义(P>0.05)。见表2。
表2 各组中GGCX、MMP13 mRNA相对表达量
2.3 Western blot检测结果 Western blot方法检测各组中GGCX、MMP13的水平,运用单因素方差分析法,结果显示:转染组中GGCX水平明显高于空白组及阴性对照组,差异有统计学意义(P<0.05)。空白组和阴性对照组相比较差异无统计学意义(P>0.05)。转染组中的MMP13水平与空白组及阴性对照组相比较低,差异有统计学意义(P<0.05);空白组和阴性对照组之间比较差异无统计学意义(P>0.05),见图2。各个组蛋白的表达结果与mRNA的表达水平相一致。
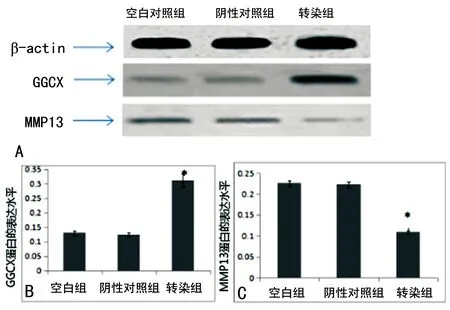
A:各组中不同蛋白的表达情况;B:GGCX在各组中的表达分析图;C:MMP13在各组中的表达分析图。
3 讨 论
目前应用病毒载体能够成功地把基因转染到细胞中,慢病毒载体有转染率高、可转染不分裂细胞、基因可长期表达等优势[4],而且国外已有以慢病毒为载体的基因治疗报道[5]。可获得较高的效率, 从而缩短了临床应用的距离 。
羟化的基质GLA蛋白(cMGP)是软骨组织中钙化的强烈抑制蛋白,能够调节软骨的钙化和动脉的钙化,GGCX为MGP羧基化过程中的关键酶,它的缺失能使cMGP减少,从而使之减弱对钙离子晶体形成的抑制作用[6]。研究发现正常膝关节和原发性膝关节OA的软骨中均有GGCX表达,但骨性关节炎中GGCX明显降低;而且GGCX的表达与关节软骨的退变程度有关,随着退变程度的加重,GGCX表达逐渐降低[7],因此GGCX可以抑制OA的发生发展,本研究与文献报道相符。
MMP 家族(MMPs)为一种重要酶类,在细胞外基质的生理性和病理性降解过程中起重要作用[8];MMP13为MMPs一员,可对各种胶原进行有效降解,可分解胶原三螺旋结构[9]。软骨的退变主要由Ⅱ型胶原纤维降解引起,而MMP13也称胶原酶13,其降解Ⅱ型胶原的能力是其他胶原酶的10~30倍[10],并且其他许多MMPs亚型对Ⅱ型胶原的降解也需要通过它们起作用。并且Hamamura等[11]、Kneer等[12]研究发现MMP13在OA关节软骨损害中起一定的作用,通过免疫组织化学方法检测到MMP13在OA组织中存在高表达现象,且MMP13表达水平与OA的严重程度正相关。因此,MMP13具有促进骨性关节炎发生发展的作用。
但GGCX与MMP13之间是否具有相关性,其是否通过调节MMP13的表达来对OA的发生发展进行调节国内外未见相关文献报道,本实验研究通过免疫组组织化学检测转染后兔软骨细胞中GGCX及MMP13表达水平,发现转染组中GGCX高表达,而转染组MMP13出现低表达,与空白组及阴性对照组比较差异有统计学意义,表明GGCX基因成功转染且转GGCX基因的兔OA软骨细胞中GGCX的高表达导致了MMP13的低表达。
综上所述, 转GGCX基因可明显降低其软骨细胞MMP-13的表达,且具有降低炎性因子的作用。达到治疗兔OA的作用。为将基因治疗运用于体外OA提供了良好的实验基础。
[1]肖巍,杜晓红,李曙波,等.膝骨关节炎发病机制及腔内治疗概述[J].中国民族民间医药,2013,22(3):47-48.
[2]张平,蔡道章,刘斌,等,转IL-1Ra和TGF-β1基因治疗兔骨性关节炎的体外实验研究[J].中华关节外科杂志,2011,5(3):335-342.
[3]邓尚,陈竹.关节软骨退行性变基因治疗研究进展[J].西部医学,2015,27(6):958-960.
[4]张阳.慢病毒载体的研究进展[J].福建医科大学学报,2014(6):407-410.
[5]Alcaraz MJ,Megías J,García-Arnandis I,et al.New molecular targets for the treatment of osteoarthritis[J].Biochem Pharmacol,2010,80(1):13-21.
[6]Jiang Q,Li Q,Grandpierre AE,et al.Administration of vitamin K does not counteract the ectopic mineralization of connective tissues in Abcc6 (-/-) mice,a model for pseudoxanthoma elasticum[J].Cell Cycle,2011,10(4):701-707.
[7]厉亚男.慢病毒介导IL-1Ra基因对人滑膜细胞体外转染的研究[D].青岛:青岛大学,2014.
[8]Reddi Ah.Aging,osteoarthritis and transforming gronsthfactor-beta algnaling in cartlage[J].Arthritis Res Ther,2006,8(1):101.
[9]付晓玲.GGCX在原发性膝关节骨性关节炎软骨中的表达及其意义[D].长沙:中南大学,2013.
[10]长峰,杨开舜.MMP-13、TIMP-1在兔骨关节炎模型的表达及其意义[J].中国现代医生,2009,47(3):39-41.
[11]Hamamura K,Zhang P,Zhao L,et al.Knee loading reduces MMP13 activity in the mouse cartilage[J].BMC Musculoskelet Disord,2013,14(1):312.
[12]Kneer W,Rother M,Mazgareanu S,et al.A 12-week randomized study of topical therapy with three dosages of ketoprofen in Transfersomegel (IDEA-033) compared with the ketoprofen-free vehicle (TDT 064),in patients with osteoarthritis of the knee[J].J Pain Res,2013,6:743-753.
An in vitro study on rabbit osteoarthritis gene therapy with GGCX gene*
WangWenyu,FuXiaoling△,ChenRui,ChenWeigao,WuJianxiong
(DepartmentofOrthopaedics,theSecondAffiliatedHospitalofNanchangUniversity,Nanchang,Jiangxi330006,China)
[Abstract] Objective To research the effect of GGCX gene on MMP13 in rabbit osteoarthritis cartilage cells and investigate its effect on osteoarthritis cartilage degeneration.Methods Six Japanese big ear rabbits weighted (2.0±0.2)kg were randomly divided into three groups,each group seted a rabbit as control. Anterior cruciate ligament transection method was used to build osteoarthritis cartilage degeneration model at second, forth,sixth week. Articular cartilage was separated successfully after the model were built,cartilage cells were divided from articular cartilage and cultured in 6-well cell culture plate. Cartilage cells were divided into blank group, negative control group and transfection group.PCR method and Western blot were conducted to detect GGCX and MMP13 expressed at the level of mRNA and protein.Results Compare with blank group and negative control group, the expressin level of GGCX incresed,while the MMP13 expression level dcresed(P<0.05).Conclusion Over expression of GGCX gene can obviously decrease the expression of MMP13,it provide experimental basis for osteoarthritis of the in vitro gene therapy.
cartilage,articular;osteoarthritis;GGCX gene;matrix metalloproteininases 13
国家自然基金资助项目(81301561)。 作者简介:汪文玉(1987-),住院医师,硕士,主要从事骨与关节疾病的研究。△
,E-mail:417603614@qq.com。
R332
A
1671-8348(2017)04-0436-03
2016-09-18
2016-10-20)
