水稻胚乳组织的结构观察
2017-02-20郑彦坤曾德二魏和平许远顾蕴洁王忠
郑彦坤曾德二魏和平许远顾蕴洁王忠
(1安庆师范大学生命科学学院,安徽安庆246133;2扬州大学生物科学与技术学院,江苏扬州225009;∗通讯联系人,E-mail: zhengyanun1985@163.com)
水稻胚乳组织的结构观察
郑彦坤1,∗曾德二1魏和平1许远1顾蕴洁2王忠2
(1安庆师范大学生命科学学院,安徽安庆246133;2扬州大学生物科学与技术学院,江苏扬州225009;∗通讯联系人,E-mail: zhengyanun1985@163.com)
【目的】阐明水稻糊粉层细胞、亚糊粉层细胞与中心胚乳贮藏细胞的结构特性。【方法】采用光镜、透射电镜与扫描电镜对水稻胚乳组织进行观察研究。【结果】糊粉层细胞分化过程中,大液泡变成小体积蛋白贮存液泡,蛋白贮存液泡又转变成糊粉粒。颖果背部比腹部有更多层糊粉层,但背部糊粉层细胞内糊粉粒的形成与积累速度却较慢。亚糊粉层细胞起初含有一些脂质体,后来脂质体消失,而其内部淀粉体与蛋白体逐渐增多。中心胚乳贮藏细胞含有淀粉体与蛋白体,蛋白体以液泡型蛋白体为主,它们可以相互融合而变大。中心胚乳贮藏细胞内的淀粉积累速度明显快于亚糊粉层细胞内的。成熟颖果的中心胚乳贮藏细胞内淀粉体最为密集,背部和侧部的亚糊粉层细胞内淀粉体排列较疏松,腹部的亚糊粉层细胞内淀粉体最为稀疏。【结论】水稻颖果背部与腹部的糊粉层细胞和亚糊粉层细胞的结构差异可能与养分吸收与转运有关;中心胚乳贮藏细胞内淀粉体发育速度快于亚糊粉层细胞。
水稻;胚乳;糊粉层细胞;亚糊粉层细胞;中心胚乳贮藏细胞
水稻是我国的主要粮食作物之一,其颖果被广泛用于人类食物、禽畜饲料和工业原料。胚乳是水稻颖果内重要的养分运输与贮藏系统,胚乳的发育和充实状况决定着颖果的产量和品质。因此,有关水稻胚乳结构与功能的研究一直受到科研工作者们的重视。
水稻胚乳按位置可大致分为胚乳表层与内胚乳两部分[1]。Royo等[2]指出,与玉米、小麦等谷物不同,水稻胚乳表层仅分化为糊粉层细胞。水稻内胚乳主要分化为亚糊粉层细胞和中心胚乳贮藏细胞[3]。糊粉层细胞具有一定的养分贮存功能,能够积累蛋白质、矿物质和脂质[4-5]。Ogawa等[6]通过X射线微分析器发现糊粉层细胞富集磷、镁、钾等矿质元素。另外,水稻糊粉层具有养分运输功能。王忠等[1]曾对水稻胚乳与颖果养分运输的关系进行过详细研究,指出背部主维管束卸载的灌浆物质首先进入质外体,糊粉层从质外体中吸收养分并将其转运进胚乳。中心胚乳贮藏细胞是胚乳内淀粉与蛋白质的积累主体;亚糊粉层细胞是介于糊粉层细胞与中心胚乳贮藏细胞之间的胚乳组织,可以积累淀粉、蛋白质和一定量的脂质[7]。糊粉层所吸收的养分只有经过亚糊粉层才能进入中心胚乳贮藏细胞。不同颖果位置的胚乳内养分积累情况存在较大差异,王忠等[8]在扫描电镜下观察到颖果背部胚乳内淀粉体充实程度比颖果腹部胚乳内的高。尽管水稻胚乳组织的结构与功能方面已有所研究,但仍存在一些问题尚未完全阐明。例如,与其他糊粉层细胞相比,靠近维管束的糊粉层有哪些更适应养分吸收与转运的结构特点?糊粉层细胞、亚糊粉层细胞和中心胚乳贮藏细胞的分化机制是什么?
针对以上这些问题,本研究以水稻品种日本晴为实验材料,通过光镜、透射电镜与扫描电镜观察的研究方式进一步探明水稻胚乳组织的结构与功能特性,并讨论其分化机制。
1 材料与方法
研究材料为水稻品种日本晴,在实验田按常规方式种植。我们采用记号笔点开花颖花与植株上挂牌相结合的方式对授粉时间进行标记,并取授粉后不同天数的颖果进行实验。
1.1 样品的光镜与透射电镜观察
将颖果横切,取所要观察的部位,先用2.5%戊二醛前固定3 h,然后以0.1 mol/L(p H 7.2)的磷酸缓冲液清洗3次,再用0.5%锇酸后固定3 h。用0.1 mol/L(p H 7.2)的磷酸缓冲液清洗后,乙醇梯度脱水,环氧丙烷置换,用低黏性的Spurr树脂浸透与包埋。先切1μm半薄切片,用0.5%甲苯胺蓝-O (TBO)染色,在光镜(Leica DMLS)下观察显微结构。在光镜观察的基础上,制作60 nm超薄切片。用醋酸双氧铀和柠檬酸铅进行双重染色,在透射电镜(Philips Tecnai 12)下观察切片的超微结构。
1.2 样品的扫描电镜观察
将颖果用液氮处理后横向断裂,取所要观察的部位,用2.5%戊二醛低温固定3 h后,以0.1 mol/L (p H 7.2)的磷酸缓冲液清洗3次。乙醇梯度脱水,醋酸异戊酯置换,CO2临界点干燥。最后经过离子溅射镀金制样后,在扫描电镜(Philips XL-30 ESEM)下观察。
2 结果与分析
从水稻颖果横切面来看,有维管束的为颖果背部,而与之相对的是颖果腹部(图1-A)。
花后2 d,胚乳已进入细胞化期,但仅有1~2层胚乳表层细胞形成,细胞质较浓,细胞核明显,细胞内有许多体积大小不一的液泡(图1-B~D)。颖果背部胚乳有2层细胞(图1-B),而颖果腹部与侧部胚乳仅有1层细胞(图1-C,D)。因此,细胞化初期,颖果背部胚乳的细胞化速度快于颖果其他部位胚乳。花后3 d,胚乳内已初步分化出糊粉层细胞、亚糊粉层细胞和中心胚乳贮藏细胞(图1-E,F)。在颖果背部胚乳中,约有2层糊粉层细胞形成,细胞内细胞核明显,仍有数个体积较大的液泡,液泡周围有一些脂质体分布;中心胚乳贮藏细胞体积大,液泡化程度极高,液泡几乎占据了除细胞核外的所有空间,有一些体积极小的的淀粉体附着于细胞核周围;亚糊粉层细胞内,淀粉体数目比中心胚乳贮藏细胞少,脂质体数目比糊粉层细胞少(图1-E)。颖果腹部胚乳中,约有1层糊粉层细胞形成(图1-F)。
花后5 d,颖果背部胚乳中,糊粉层细胞大约有3层,平周方向排列较为疏松,细胞内部有稀疏的小体积蛋白贮藏液泡与脂质体;亚糊粉层细胞内部有数目很少的小体积淀粉体以及蛋白贮藏液泡和脂质体(图2-A)。颖果腹部胚乳中,糊粉层细胞有1~2层,排列紧密,细胞内部含有较为密集的蛋白贮藏液泡和脂质体;亚糊粉层细胞内有稀疏的小体积淀粉体(图2-B)。在透射电镜下,可以看到糊粉层细胞内,大小不一的脂质体围绕着小体积蛋白贮藏液泡(图3-D);亚糊粉层细胞的外侧细胞壁附近有许多线粒体,这可能与活跃的物质交换有关(图3-C)。中心胚乳贮藏细胞内的淀粉体数目与体积增长更为明显(图2-C)。在透射电镜下,可以看到中心胚乳贮藏细胞内已出现内质网衍生型蛋白体与液泡型蛋白体,内质网衍生型蛋白体铅铀染色效果浅,含量少(图3-A);液泡型蛋白体铅铀染色效果深,含量较多,液泡型蛋白体会相互融合而增大(图3-B)。花后9d,颖果背部胚乳中,糊粉层细胞内的蛋白贮藏液泡和脂质体密度增大,亚糊粉层内的淀粉体仍然稀少且体积小(图2-D)。颖果腹部胚乳中,糊粉层细胞进一步分化,糊粉粒初步形成,亚糊粉层内的淀粉体也稀少且体积小(图2-E)。中心胚乳贮藏细胞内,淀粉体体积与密度都有所增加,而且蛋白体体积与数目也有所增长(图2-F)。
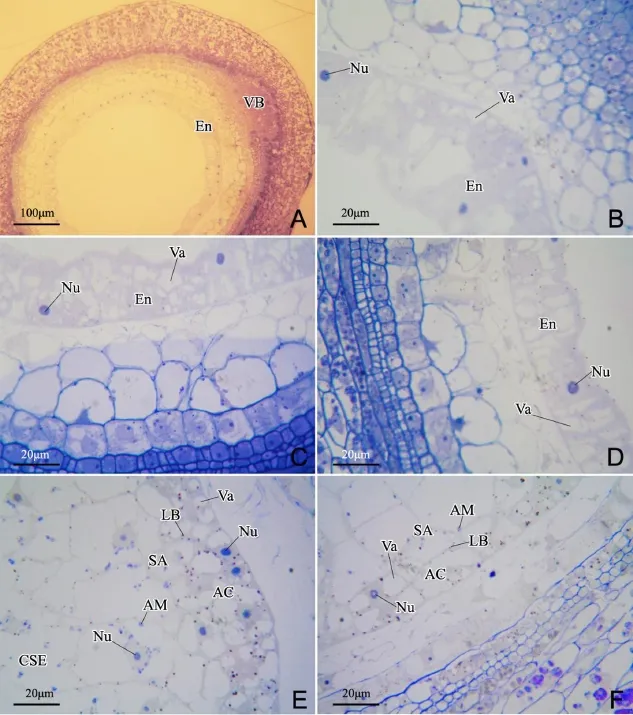
图1 花后2 d(A~D)与3 d(E,F)水稻胚乳组织Fig.1.Rice endosperm tissues at 2(A~D)and 3(E,F)days after pollination.
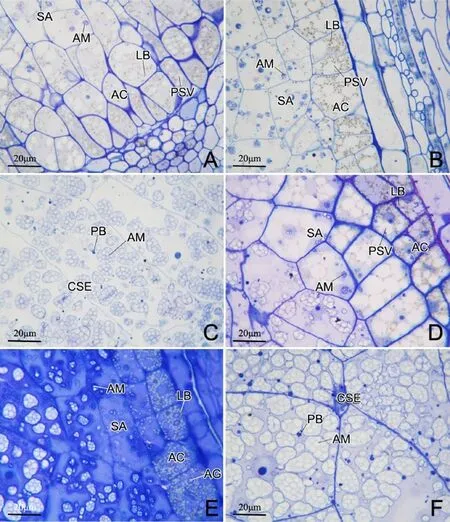
图2 花后5 d(A~C)与9 d(D~F)水稻胚乳组织Fig.2.Rice endosperm tissues at 5(A~C)and 9(D~F)days after pollination.
花后12 d,颖果背部胚乳中,糊粉层细胞仍约有3层,细胞壁明显增厚,蛋白贮藏液泡已转变成糊粉粒;亚糊粉层细胞几乎被淀粉体充满,蛋白体留存于淀粉体之间的小缝隙里,脂质体已消失(图4-A)。与颖果背部胚乳相比,颖果腹部胚乳中,糊粉层细胞有1~2层,细胞壁也明显增厚,但糊粉粒的数目要多一些;亚糊粉层细胞内含有大量蛋白体和一些体积较小的淀粉体,脂质体已消失(图4-B)。中心胚乳贮藏细胞内近乎充满密集的淀粉体,受挤压的蛋白体残留于淀粉体间隙里(图4-C)。花后18 d,中心胚乳贮藏细胞内淀粉进一步积累充实,密集的淀粉体相互挤压,几乎连成一体(图4-D)。
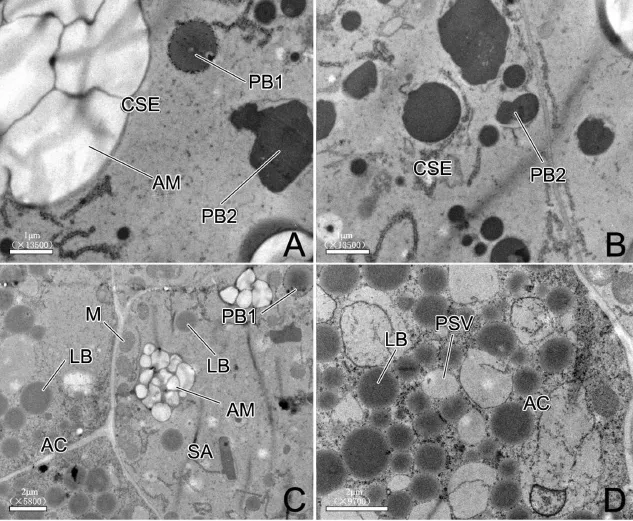
图3 花后5 d水稻胚乳组织超微结构Fig.3.Ultra-structures of rice endosperm tissues at 5 days after pollination.
成熟颖果糊粉层细胞内部已被糊粉粒所充实(图5-A)。颖果的中心胚乳贮藏细胞内的淀粉体非常密集(图5-C),颖果背部和侧部的亚糊粉层细胞内的淀粉体较稀疏(图5-A,B),而颖果腹部亚糊粉层细胞内的淀粉体最疏松,淀粉体间隙明显(图5-D)。
通过以上所述可知:1)糊粉层细胞发育过程中,大液泡逐渐转化成小的蛋白贮存液泡,蛋白贮存液泡充实蛋白质和矿物质后转化成糊粉粒,糊粉粒逐渐增多直至充满糊粉层细胞;与颖果腹部糊粉层相比,颖果背部糊粉层层数多,但细胞内糊粉粒的形成与积累速度却慢一些;2)亚糊粉层细胞起初积累一定量的脂质体,但后来脂质体消失,而淀粉体与蛋白体逐渐增多;亚糊粉层细胞内淀粉积累速度明显慢于中心胚乳贮藏细胞;3)中心胚乳贮藏细胞内主要积累液泡型蛋白体,液泡型蛋白体可以相互融合而变大。
3 讨论
3.1 水稻胚乳组织的形成与分化
因为位置效应和基因控制等因素,谷物胚乳分化成不同组织[3,5],使胚乳的养分运输与积累等功能得以有效发挥。水稻胚乳主要分化产生糊粉层细胞、亚糊粉层细胞和中心胚乳贮藏细胞这三类组织。
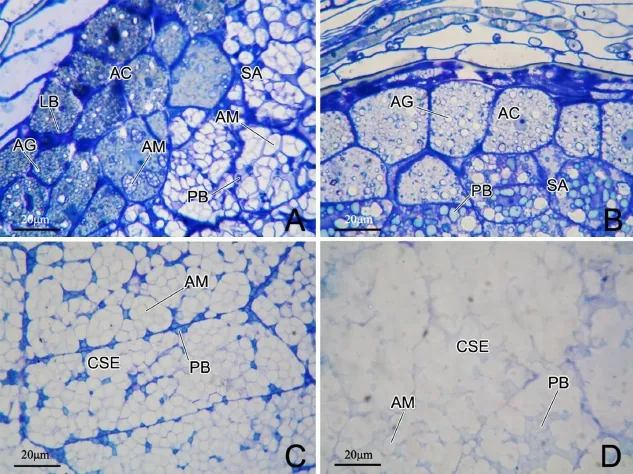
图4 花后12 d(A~C)与18 d(D)水稻胚乳组织Fig.4.Rice endosperm tissues at 12(A—C)and 18(D)days after pollination.
胚乳表层细胞是胚乳在细胞化期通过平周分裂最先形成的细胞[9]。颖果母体组织(果皮和种皮)与子代组织(胚与胚乳)之间没有胞间连丝相连[8],因而颖果维管束卸载的物质进入质外体后只有通过胚乳表层才能进入胚乳。这些来自母体组织的物质中,有诱导糊粉层细胞分化的信号分子,胚乳表层细胞受体接受信号分子后向糊粉层细胞转化[5]。本研究结果显示,靠近维管束的颖果背部糊粉层的层数明显多于远离维管束的颖果腹部糊粉层的层数。这可能是因为越靠近维管束,胚乳表层所接收的糊粉层细胞诱导信号就越多造成的。玉米、小麦和高粱的糊粉层一般为一层[5],而水稻糊粉层出现数层,这可能也与糊粉层细胞诱导信号的传递存在差异有关。
亚糊粉层细胞和中心胚乳贮藏细胞与糊粉层细胞同源,都是由受精极核分裂分化而来,但是亚糊粉层细胞和中心胚乳贮藏细胞在细胞化期产生晚,经历核内复制,分化期积累淀粉与蛋白质,且细胞核发生消亡。与核内复制、碳代谢以及淀粉酶合成相关的基因影响着亚糊粉层细胞和中心胚乳贮藏细胞的形成、分化和养分积累[7]。亚糊粉层细胞和中心胚乳贮藏细胞中存在抑制糊粉层细胞诱导信号传递的物质,使得诱导信号由外至内越来越弱[5]。于是,从胚乳表层向内层,糊粉层细胞特征越来越不明显。糊粉层细胞吸收与转运灌浆物质时,矿质元素、部分氨基酸以及脂肪酸等滞留在糊粉层细胞中参与糊粉粒和脂质体的形成,而可溶性糖和大部分氨基酸运入亚糊粉层细胞和中心胚乳贮藏细胞供合成淀粉与蛋白质用[1]。
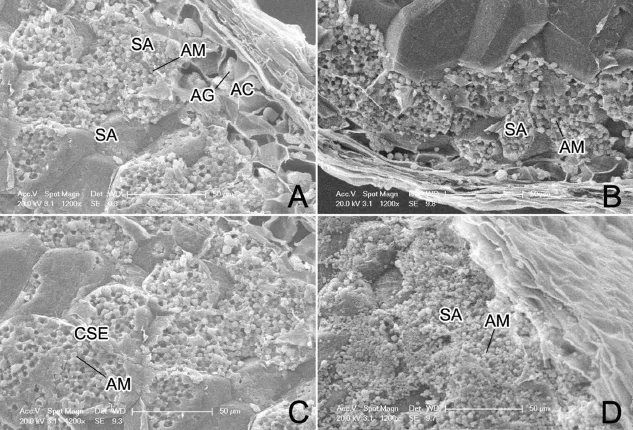
图5 成熟水稻颖果不同部位胚乳组织的扫描电镜观察Fig.5.Endosperm tissues in different parts of mature rice caryopsis under a scanning electron microscope.
3.2 水稻胚乳组织的功能
水稻糊粉层细胞的脂质体内积累脂质,糊粉粒内积累蛋白质和矿物质。除了养分贮存功能外,水稻糊粉层还具有养分运输功能,糊粉层从质外体中吸收养分,经过亚糊粉层进入中心胚乳贮藏细胞。本研究发现,亚糊粉层细胞外侧的细胞壁附近有许多线粒体,这可能与活跃的物质交换有关。与颖果腹部糊粉层相比,颖果背部糊粉层离维管束近且层数多,但细胞内糊粉粒的形成与积累速率却慢一些。糊粉层层数多有利于提高养分吸收能力,糊粉粒形成与积累速度慢是为了减少养分运输阻力。除了直接从质外体吸收养分,糊粉层细胞之间也可以传输养分。糊粉层细胞之间存在胞间连丝连接,颖果腹部糊粉层可以将吸收的养分通过胞间连丝向腹部糊粉层运输。颖果腹部糊粉层内糊粉粒最先形成与积累,而背部糊粉层内糊粉粒较晚形成与积累,这样可以保证糊粉层间养分输送途径的顺畅。小麦中,靠近维管束的是具有壁内突的“变型糊粉层”,壁内突增加质膜表面积,有利于养分吸收与转运[10];变型糊粉层与其他部分糊粉层相比,细胞壁成分差异很大,也有利于养分吸收和转运[11]。水稻中,靠近维管束的糊粉层没有形成壁内突结构,具体原因尚不清楚,但其细胞壁成分可能与其他部分糊粉层细胞的也不同,因为这样才有利于将维管束卸载的养分转运进胚乳。
亚糊粉层细胞是中心胚乳贮藏细胞和糊粉层细胞之间的中间类型细胞。水稻亚糊粉层细胞内起初积累少量的的脂质体和很少的小淀粉体,随后脂质体逐渐消失,但淀粉体逐渐增多增大,蛋白体也逐渐增多。Olsen认为,至胚乳发育后期,亚糊粉层细胞与中心胚乳贮藏细胞之间的养分积累差距会逐渐缩小[3]。本研究发现,亚糊粉层细胞内淀粉积累速度明显慢于中心胚乳贮藏细胞,这是为了减少糊粉层吸收的养分向中心胚乳贮藏细胞转运的阻力。正因为亚糊粉层在整个胚乳发育过程中都承担着一定的养分运输作用,所以成熟颖果亚糊粉层细胞内的淀粉体充实情况比中心胚乳贮藏细胞内的淀粉体充实情况要差。而腹部亚糊粉层细胞内的淀粉体充实情况最差,还因为距离维管束最远,养分运输阻力大。中心胚乳贮藏细胞是胚乳养分积累主体,胚乳发育后期,中心胚乳贮藏细胞内部淀粉体密度非常大,受挤压的蛋白体残留于淀粉体间隙里。Lousser
等认为胚乳蛋白体在胚乳发育后期不再以蛋白体的形式存在,而是融合成蛋白质基质,留存在淀粉体间隙内[12]。在水稻胚乳中,内质网衍生型蛋白体积累醇溶蛋白[13];液泡型蛋白体积累谷蛋白,谷蛋白占据胚乳总蛋白的80%[14]。本研究也发现,水稻中心胚乳贮藏细胞主要积累液泡型蛋白体,且液泡型蛋白体会相互融合,但不像小麦胚乳内液泡型蛋白体那样融合成体积很大的蛋白体[7]。
[1] 王忠,顾蕴洁,郑彦坤,王慧慧.水稻胚乳细胞发育的结构观察及其矿质元素分析.中国水稻科学,2012,26(6):693-705.Wang Z,Gu Y J,Zheng Y K,Wang H H.Structure observation of rice endosperm cell development and its mineral element analysis.Chin J Rice Sci,2012,26:189-196.(in Chinese with English abstract)
[2] Royo J,Gómez E,Hueros G.Transfer cells//Plant Cell.Olsen OA,Monographs.Berlin Heidelberg:Springer-Verlag, Monogr,2007.
[3] OlsenO A.Nuclear endosperm development in cereals and Arabidopsis thaliana.Plant Cell(Suppl),2004,16:S214-S227.
[4] Zheng Y K,Wang Z.Protein accumulation in aleurone cells, sub-aleurone cells and the center starch endosperm of cereals. Plant Cell Rep,2014,33:1607-1615.
[5] Zheng Y K,Wang Z.Differentiation mechanism and function of the cereal aleurone cells and hormone effects on them.Plant Cell Rep,2014,33:1779-1787.
[6] Ogawa M,Tanaka K,Kasai Z.Accumulation of phosphorus, magnesium and potassium in developing rice grains:Followed by electron microprobe X-ray analysis focusing on the aleurone layer.Plant Cell Physiol,1979,20:19-27.
[7] Zheng Y K,Wang Z.The cereal starch endosperm development and its relationship with other endosperm tissues and embryo.Protoplasma,2015,252:33-40.
[8] 王忠,顾蕴洁,王敏,郑彦坤,刘智,王慧慧.关于水稻胚乳淀粉体发育的研究.中国科技论文在线精品论文,2012,5(17): 1601-1614.Wang Z,Gu Y J,Wang M,Zheng Y K,Liu Z,Wang H H.Investigation of amyloplast development in rice endosperm.Highlights of Sciencepaper Online,2012,5(17):1601-1614.(in Chinese with English abstract)
[9] Becraft P W.Cell fate specification in the cereal endosperm.Semin Cell Dev Biol,2001,12:387-394.
[10]Zheng Y K,Wang Z.Contrast observation and investigation of wheat endosperm transfer cells and nucellar projection transfer cells.Plant Cell Rep,2011,30:1281-1288.
[11]Robert P,Jamme F,Barron C,Bouchet B,Saulnier L,Dumas P,Guillon F.Change in wall composition of transfer and aleurone cells during wheat grain development.Planta,2011, 233:393-406.
[12]Loussert C,Popineau Y,Mangavel C.Protein bodies ontogeny and localization of prolamin components in the developing endosperm of wheat caryopses.J Cereal Sci,2008,47:445-456.
[13]Saito Y,Kashida K,Takata K,Takahashi H,Shimada T, Tanaka K,Morita S,Satoh S,Masumura T.A green fluorescent protein fused to rice prolamin forms protein body-like structures in transgenic rice.J Ex p Bot,2009,60:615-627.
[14]Yamagata H,Sugimoto T,Tanaka K,Kasal Z.Biosynthesis of storage proteins in developing rice seeds.Plant Physiol, 1982,70:1094-1100.
Structure Observation of Rice Endosperm Tissues
ZHENG Yankun1,∗,ZENG De’er1,WEI Heping1,XU Yuan1,GU Yunjie2,WANG Zhong2
(1 School of Life Sciences,Anqing Normal University,Anqing 246133,China;2College of Bioscience and Biotechnology,Yangzhou University,Yangzhou 225009,China;∗Corresponding author,E-mail:zhengyanun1985@163.com)
【Objective】The objective of this research was to clarify structural characteristics of aleurone cells, sub-aleurone cells and central starchy endosperm cells.【Method】We observed and investigated rice endosperm using a light microscopy,a transmission electron microscopy and a scanning electron microscopy.【Result】During the differentiation process of aleurone cells,the large vacuoles were transformed into protein storage vacuoles of small volume and protein storage vacuoles were transformed into aleurone granules.There were more layers of aleurone cells in the dorsal part than in the ventral part of caryopses.However,the formation and accumulation rate of aleurone granules was slower in aleurone cells of the dorsal part of caryopses.Sub-aleurone cells initially included some lipid bodies,and later lipid bodies disappeared and amyloplasts and protein bodies in them increased gradually.Central starchy endosperm cells included amyloplasts and protein bodies.Vacuolar protein bodies occupied the major part of total protein bodies and they could fused with one another to be larger.Starch accumulation rate of central starchy endosperm cells was evidently quicker than that of sub-aleurone cells.In mature caryopses,amyloplasts were very dense in central starchy endosperm cells,amyloplasts were sparser in sub-aleurone cells of dorsal and lateral parts of caryopses and amyloplasts were sparsest in sub-aleurone cells of the ventral part of caryopses.【Conclusion】Structural differences of aleurone cells and sub-aleurone cells in dorsal and ventral parts of rice caryopses might be related to nutrient absorption and translocation.Developmental rate of amyloplasts in central starchy endosperm cells was quicker than that in sub-aleurone cells.
rice;endosperm;aleurone cells;sub-aleurone cells;central starchy endosperm cells
Q944.46;S511.01
A
1001-7216(2017)01-0091-08
2016-04-12;修改稿收到日期:2016-10-08。
安徽省教育厅重点项目(KJ2015A168);安徽省高等学校省级优秀青年人才基金重点项目(2013SQRL060ZD;国家自然科学基金资助项目(31270228)。
