乳酸菌中移动基因元件的预测与分析
2017-02-20
(东北农业大学,乳品科学教育部重点实验室,哈尔滨150030)
乳酸菌中移动基因元件的预测与分析
李婉,于上富,丁秀云,杜金城,徐敏,霍贵成
(东北农业大学,乳品科学教育部重点实验室,哈尔滨150030)
CR ISPR-Cas系统作为获得性免疫系统能够保护乳酸菌免受噬菌体等外源基因元件的入侵,旨在对乳酸菌中CR ISPR-Cas系统的活性与近期发生水平基因转移的程度是否呈负相关进行检验。预测了乳酸菌中的CR ISPR-Cas系统、前噬菌体及基因岛,并分别分析乳酸菌中CR ISPR与前噬菌体及与基因岛在数量上的相关性。研究发现CRISPR序列的长度(能反映该免疫系统的活性)与预测的近期发生的水平基因转移事件的数目之间没有明显的相关性。结果表明乳酸菌中的CRISPR-Cas系统并不抑制水平基因转移事件的发生。
乳酸菌,移动基因元件,CRISPR-Cas系统,水平基因转移,间隔序列
0 引言
CR ISPR(clustered regu larly interspaced short pal⁃indro mic repeats)-Cas(CR ISPR-associated genes)系统能够为细菌和古细菌提供可获得、可遗传的免疫,使其免受病毒[1,2]和质粒[3-4]的侵染。CR ISPR-Cas系统在绝大多数的古细菌及大多数细菌中普遍存在[5,6],这使得CR ISPR-Cas系统成为近年来学者研究的焦点。CR ISPR-Cas基因座包含一系列短的、部分回文的重复序列,这些重复序列又被间隔序列穿插[7]。
水平基因转移(ho rizontal gene transfer,HGT),是指在差异生物个体之间,或单个细胞内部细胞器之间所进行的遗传物质的交流。水平基因转移能使原核生物获得新的而分子功能,并提供选择性的进化优势。有研究指出CR ISPR-Cas系统活性可能会造成水平基因转移缩减,阻止宿主从细菌中获得新基因[8-9]。因此,验证乳酸菌中CR ISPR-Cas系统是否抑制水平基因转移对于后期CR ISPR-Cas系统的应用具有重要意义。
1 实验
1.1 材料
本研究所包含的菌株有NCBI上已测序的9株嗜热链球菌、4株徳氏乳杆菌保加利亚亚种、7株瑞士乳杆菌、5株乳酸乳球菌、7株植物乳杆菌及3株嗜酸乳杆菌,共35株乳酸菌。
1.2 CR ISPR-Cas系统活性的预测
在NCBI上查找并下载已测序的植物乳杆菌、嗜酸乳杆菌及乳酸乳球菌的全基因组序列,利用CR IS⁃PR Finder[10](http://crispr.u-psud.fr/Server/)对CR IS⁃PR序列进行查找,统计各CR ISPR所含间隔序列的数目。
1.3 前噬菌体预测
利用PHAST(http://phast.w ishartlab.com/)网站在线预测乳酸菌基因组中所含前噬菌体,统计各乳酸菌中所含前噬菌体的数目及噬菌体蛋白的数目。
1.4 基因岛预测
利用IslandView er 3[11](http://w ww.pathogenom⁃ics.sfu.ca/islandviewer/)对实验菌株的基因岛进行预测,推定的基因岛需大于8个基因或者大于8 kb。统计基因岛的数目并计算基因岛中所含基因占基因组的百分比。

表1 课题使用乳酸菌信息
1.5 相关性分析
利用O rigin 9软件制作条形图,分别分析乳酸菌中CR ISPR与前噬菌体及与基因岛在数量上的相关性。
2 结果和分析
2.1 乳酸菌中CR ISPR序列概况
利用CR ISPR Finder预测得到乳酸菌中所含CR ISPR序列的情况如表2所示。表2中,仅确定的CR ISPR序列被列出,可疑的CR ISPR序列未列出,不含CR ISPR序列的菌株未列出。9株嗜热链球菌及4株德氏乳杆菌均含CR ISPR序列,5株乳酸乳球菌均不含CR ISPR序列。
2.2 乳酸菌中前噬菌体概况
经PHAST预测得到乳酸菌中前噬菌体情况如表3所示。表3中,不含前噬菌体的菌株未列出。其中,徳氏乳杆菌仅ND 02含有1个前噬菌体,其余3株均不含前噬菌体,瑞士乳杆菌除H 9和DPC 4571外均含不同数目的前噬菌体。
35株乳酸菌中,13株无间隔序列的乳酸菌所含前噬菌体蛋白的平均值为156,1株含6个间隔序列的乳酸菌所含前噬菌体蛋白数目为182,2株间隔序列数目在7到21之间的乳酸菌其平均前噬菌体蛋白数目为19个,有12株乳酸菌的间隔序列数目在22个到42个之间,它们的前噬菌体蛋白数目平均为45个,有7株乳酸菌的间隔序列数目在43个到76个之间,它们的前噬菌体蛋白数目平均为20个。由此可见,基因组中前噬菌体蛋白数目与间隔序列数目并不呈负相关。
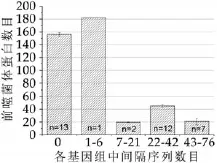
图1 前噬菌体蛋白与间隔序列之间的数量关系
2.3 基因岛预测
利用IslandViewer 3预测得到乳酸菌中所含的基因岛,其中大于8个基因或大于8 kb的基因岛被统计,每个基因组中所含基因岛的大小占基因组的比例如表4所示。
基因组中基因岛所占比例与间隔序列数目之间的关系如图2,13株不含间隔序列的乳酸菌其基因组中基因岛所占比例的平均值为1.03%,间隔序列数目在1到6个之间的乳酸菌其基因岛所占比例为0.33%,间隔序列数目在7到21个之间的乳酸菌其基因岛所占比例为1.51%,间隔序列数目在22到42个之间的乳酸菌其基因岛所占比例为1.19%,而间隔序列数目在43到76个之间的乳酸菌其基因岛所占比例为1.76%。基因组中基因岛占基因组的比例与间隔序列数目亦不呈负相关。
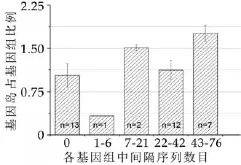
图2 基因岛占基因组的比例与间隔序列数目之间的关系
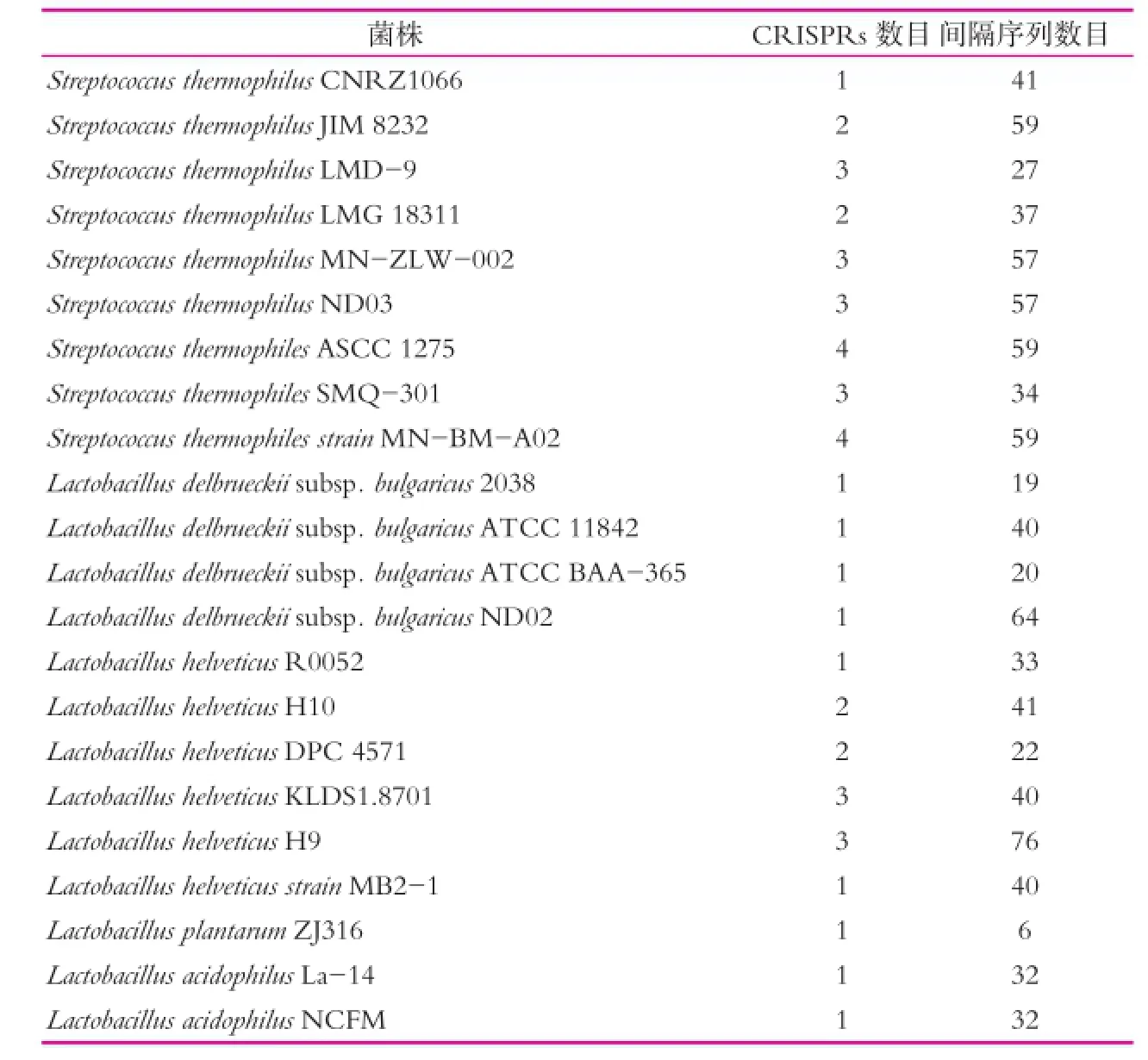
表2 乳酸菌中CR ISPR序列概况

表3 乳酸菌中前噬菌体概况
3 讨 论
移动基因元件如前噬菌体、基因岛等能通过水平基因转移机制被细菌基因组获得或失去。比较基因组学研究表明移动基因元件的水平基因转移是一个主要的进化步骤,能够增加基因和表型的多样性,使得细菌能够适应多变的环境。然而,有研究表明在葡萄球菌中CR ISPR干扰限制了水平基因转移,并因此限制了抗生素抗性在致病菌中的传播[3]。的确,临床分离的多药耐药性肠球菌与敏感菌相比缺乏CR IS⁃PR-Cas系统,这可能是由于敏感菌所含的CR ISPR-Cas系统阻碍了抗性质粒的获得[12]。因此看来,在活跃的获得性免疫与通过水平基因转移获得新基因或者新功能之间有一个权衡。
目前,利用间隔序列数目来反映CR ISPR系统活性被认为是最佳的计算方法。现已证明一个有活性的CR ISPR-Cas系统能够连续获得间隔序列,使得CR IS⁃PR序列不断增长[19]。相反,在缺乏选择压力的情况下,为了维持CR ISPR-Cas系统的活性,间隔序列则会被快速删除[7,13,14]。因此,无活性的CR ISPR序列应趋向于缩短,而有活性的CR ISPR序列则将扩大或者至少保持一个相对稳定的大小。此外,尽管一个CR IS⁃PR-Cas系统近期在某个基因组中没有活性,但该基因组仍携带一个大的CR ISPR序列,这似乎更适合观察CR ISPR-Cas系统影响其近期的进化历史。
由于CR ISPR-Cas系统能够阻止质粒接合、前噬菌体整合以及裸DNA的转化,因此该免疫系统被认为是阻碍水平基因转移的栅栏[15]。观察人类的病原菌[12]并结合实验和模型[16],证实了当宿主在选择压力下获得基因(当暴露在抗生素环境下时,获得抗性便是存活或复制的关键)时,CR IS⁃PR-Cas系统往往是失活的或者丢失的。然而,在有效地抵抗外源基因元件与无法获得新基因之间存在一个权衡。本研究检验了水平基因转移与CR ISPR-Cas系统活性之间的关系,结果并不支持权衡假说。事实上,细菌中CR ISPR-Cas系统的活性与水平转移基因的比例并不呈负相关。
本研究中CR ISPR-Cas系统的活性与通过水平转移基因获得的基因之间不存在负相关,这归因于一些不相互排斥的进化机制。最简单的解释是CR ISPR-Cas系统经常自发地移动,因此它们在任何基因组中的存在与否并不能表明其仍具有长期的影响。其次,在某些环境下,当微生物面临较高的移动基因元件入侵的风险时,CR ISPR-Cas系统的作用是微不足道的[17]。因此,大的CR ISPR序列表明基因组积极地整合新的间隔序列,并且由于其遭受一连串的外源DNA元件的入侵,CR ISPR序列需要选择性地维持自身活性。此外,近期研究表明一些CR ISPR-Cas系统需要转录外源DNA序列用于干扰,以允许溶源作用,防止烈性感染[18]。第三,细菌和古细菌中间隔序列的获得并非随机的,而是优先从含有匹配已经存在的间隔序列的基因组中获得。

表4 乳酸菌中基因岛概况
本研究检验了CR ISPR-Cas系统活性与水平基因转移事件之间的关系,结果乳酸菌中CR ISPR-Cas系统的活性与所含前噬菌体蛋白数目及基因岛所占基因组的比例均不呈负相关,证明了CR ISPR-Cas系统并不抑制前噬菌体、基因岛等移动基因元件的水平转移,表明在进化的时间尺度上CR ISPR-Cas系统对水平基因转移事件没有抑制作用。
[1]BARRANGOU R,FREMAUX C,DEVEAU H,et al.CR ISPR provides acquired resistance against viruses in prokaryotes[J].Science, 2007,315(5819):1709-1712.
[2]MAN ICA A,ZEBEC Z,TEICHMANN D,et al.In vivo activity of CRISPR-mediated virus defence in a hyperthermophilic archaeon[J]. Molecular Microbiology,2011,80(2):481-491.
[3]MARRAFFIN I L,SONTHEIMER E.CR ISPR interference li mits horizontal gene transfer in staphylococci by targeting DNA[J].Sci⁃ence,2008,322(5909):1843-1845.
[4]SOLEY G,LING D,ZHENGJUN C,et al.Dynamic properties of the Sulfolobus CR ISPR/Casand CRISPR/C mr systemswhen chal⁃lenged w ith vector-borne viraland plas mid genesand protospacers[J]. Molecular Microbiology,2011,79(1):35-49.
[5]ANDERSON R,BRAZELTON W,BAROSS J.Using CR ISPRsas ametageno mic tool to identifymicrobialhostsof a diffuse flow hydro⁃thermalvent viralassemblage[J].FemsMicrobiology Ecology,2011,77 (1):120-133.
[6]W EINBERGER A,WOLF Y,LOBKOVSKY A,et al.Viral diversity threshold for adaptive immunity in prokaryotes[J].Mbio,2012,3(6): 17.
[7]HORVATH P,ROMERO D,COÛTƔ-MONVO ISIN A,etal.Di⁃versity,activity,and evolution of CR ISPR loci in streptococcus ther⁃mophilus[J].Journalof bacteriology,2008,190(4):1401-1412.
[8]MARRAFFIN I L.CR ISPR-Cas immunity against phages:its effects on the evolution and survivalof bacterial pathogens[J].Plos Pathogens, 2013,9(12):1831-1836.
[9]HATOUM-ASLAN A,MARRAFFIN IL.I mpact of CRISPR im⁃munity on the emergence and virulence of bacterial pathogens[J]. CurrentO pinion in Microbiology,2014,17(3):82-90.
[10]GR ISSA I,VERGNAUD G,POURCEL C.CR ISPRFinder:aweb tool to identify clustered regularly interspaced short palindromic re⁃peats[J].Nucleic acids research,2007,35(suppl2):W 52-W 57.
[11]DH ILLON B,LAIRD M,SHAY J,etal.IslandViewer3:more flexi⁃ble,interactive genomic island discovery,visualization and analysis[J]. Nucleic AcidsR esearch,2015,43(W 1):104-108.
[12]PALMER K,GILMORE M.Multidrug-resistant enterococci lack CRISPR-cas[J].Mbio,2010,1(4):516-524.
[13]TYSON G,BANFIELD J.Rapidly evolving CRISPRsimplicated in acquired resistance of microorganisms to viruses[J].Environmentalmi⁃crobiology,2008,10(1):200-207.
[14]DEVEAU H,BARRANGOU R,GARNEAU J,et al.Phage re⁃sponse to CRISPR-encoded resistance in streptococcus thermophilus [J].Journalofbacteriology,2008,190(4):1390-1400.
[15]ROTEME,UDIQ.The Escherichia coli CRISPR syste mprotects fromλ lysogenization,lysogens,and prophage induction[J].Journal of Bacteriology,2010,192(23):6291-6294.
[16]WENYAN J,INBALM,FAWAZ A,et al.Dealingw ith the evolu⁃tionary downside of CR ISPR immunity:bacteria and beneficial plas⁃mids[J].PlosGenetics,2013,9(9):119-129.
[17]GOPHNA U,KRISTENSEN D,WOLF Y,et al.No evidence of inhibition ofhorizontalgene transfer by CR ISPR-Cason evolution⁃ary ti mescales[J].Isme Journal,2015,9(9).
[18]GOLDBERG G,WENYAN J,DAVID B,et al.Conditional toler⁃ance of temperate phages via transcription-dependent CR ISPR-Cas targeting[J].Nature,2014,514(7524):633-637.
Prediction and analysis of mobile genetic ele ments in Lacticacid bacteria
LIW an,YU Shangfu,DING Xiuyun,DU Jincheng,XU Min,HUO Guicheng
(Key Laborato ry o f Dairy Science,Ministry o f Education,No rtheast Agricu ltu ral University,H arbin 150030,China)
W e aimed to test thatwhether the activity of CRISPR–Cas in microbes isnegatively correlated w ith the extent of recent HGT or not.W e predict the CRISPR–Cassystems,prophagesand geno mic islands to analysis the correlations between CRISPR spacer count and HGT measures.We found no significant dependence between the length of CRISPR arrays,which reflects the activity of the immune system,and the estimated number of recent HGT events.No evidence of inhibition of horizontal gene transfer by CRISPR–Cason evolu⁃tionary timescales.
Lacticacid bacteria;mobilegenetic elements;CRISPR-Cassystem;horizontalgene transfer;spacers
Q 933
A
1001-2230(2017)01-0004-04
2016-06-12
国家自然科学基金(31171717);国家“863计划”(2012AA022 108)。
李婉(1990–),女,硕士研究生,研究方向为乳酸菌生物技术。
霍贵成
