壳聚糖凝胶球对Cu(Ⅱ)和Cr(Ⅵ)吸附行为的对比
2017-02-17张艺钟刘珊刘志文吴文成邓东阳鞠勇明
张艺钟,刘珊,刘志文,吴文成,邓东阳,鞠勇明
(1长安大学环境科学与工程学院旱区地下水文与生态效应教育部重点实验室,陕西 西安 710064;2环境保护部华南环境科学研究所,广东 广州 510655;3广东工业大学环境科学与工程学院,广东 广州 510006)
壳聚糖凝胶球对Cu(Ⅱ)和Cr(Ⅵ)吸附行为的对比
张艺钟1,2,刘珊1,刘志文2,3,吴文成2,邓东阳2,鞠勇明2
(1长安大学环境科学与工程学院旱区地下水文与生态效应教育部重点实验室,陕西 西安 710064;2环境保护部华南环境科学研究所,广东 广州 510655;3广东工业大学环境科学与工程学院,广东 广州 510006)
为使壳聚糖粉末吸附后易于固液分离,采用溶胶-凝胶-冷冻干燥法制备毫米级(2.8~3mm)壳聚糖凝胶球,比较了Cu(Ⅱ)和Cr(Ⅵ)吸附行为。结果表明,壳聚糖凝胶球对Cu(Ⅱ)和Cr(Ⅵ)吸附行为不同:Cu(Ⅱ)和Cr(Ⅵ)最佳吸附pH分别为5.5和3.0;达到吸附平衡Cu(Ⅱ)和Cr(Ⅵ)分别需要25h和2h;Cu(Ⅱ)的吸附反应是自发、吸热、熵增过程,而Cr(Ⅵ)吸附反应为自发、放热、熵减过程;吸附Cu(Ⅱ)后的壳聚糖凝胶球不易脱附,而吸附Cr(Ⅵ)后凝胶球脱附率相对较高。借助红外表征及Langmuir、Freundlich等温模型、拟一级、拟二级动力学、颗粒内扩散模型对吸附过程拟合表明,Cu(Ⅱ)吸附机理为单层化学吸附,而Cr(Ⅵ)是单层化学吸附与多层物理吸附共同作用的吸附-还原过程。壳聚糖凝胶球对Cu(Ⅱ)和Cr(Ⅵ)的最大吸附量分别为155.67mg/g和185.08mg/g,说明冷冻干燥法可以强化壳聚糖的吸附量,同时毫米级的壳聚糖凝胶球改善了壳聚糖粉体吸附剂难分离的问题。
壳聚糖凝胶球;冷冻干燥;Cu(Ⅱ)和Cr(Ⅵ);吸附;还原;动力学模型
重金属广泛存在于自然环境中,具有高毒性、难生物降解性、生物富集性及环境持久性等特点,对人类健康和生态安全有重要影响[1-2]。目前,化学沉淀法、离子交换法、膜滤法、电化学法、反渗透法、溶剂萃取法、吸附法等技术已经用于处理水体重金属污染。吸附法具有成本低、效率高等显著优势,被广泛用于水体重金属污染治理。各种吸附剂中,生物吸附剂具有易获得、价格低廉、环境友好等优势引起很多研究学者的重视[2-5]。
壳聚糖主要由虾蟹废料改性制得,是一种无毒、可生物降解的生物高分子材料。壳聚糖分子骨架上有许多氨基(—NH2)和羟基(—OH),这使其成为优良的重金属生物吸附剂[4-6]。然而,壳聚糖粉末直接用于重金属吸附存在吸附剂固液分离困难等难题。溶胶-凝胶成球法通过调控壳聚糖粉末物理结构,制备出微球改性吸附剂的研究引起了广泛关注[7-11]。另外,MI等[12]分别采用冷冻干燥法和热烘干法处理离子交联后的壳聚糖-草酸吸附剂,研究发现,冷冻干燥后的壳聚糖-草酸吸附剂比热烘干法处理的该吸附剂的吸附量提高了30%。
因此,首先采用溶胶-凝胶法制备毫米级壳聚糖凝胶球并通过冷冻干燥处理。其次,选择天然水体中Cu(Ⅱ)和Cr(Ⅵ)等阳离子和阴离子开展壳聚糖凝胶球吸附研究,对比壳聚糖凝胶球对Cu(Ⅱ)和Cr(Ⅵ)的吸附行为。
1 材料与方法
1.1 实验试剂
壳聚糖[(C6H11NO4)n,分子量70万~80万,脱乙酰度≥90.0%];盐酸(HCl,分析纯);硫酸(H2SO4,分析纯);硝酸(HNO3,分析纯);柠檬酸(C6H8O7·H2O,分析纯);乙二胺四乙酸二钠(EDTA-2Na, C10H16N2Na2O8,分析纯);氢氧化钠(NaOH,分析纯);硝酸铜[Cu(NO3)2·3H2O,分析纯];重铬酸钾(K2Cr2O7,分析纯)。
1.2 实验仪器
六联同步搅拌器(LB-6H,金坛市朗博仪器制造有限公司);恒温磁力搅拌器(JB-3,上海雷磁创益仪器仪表有限公司);滴定管(50mL,滴定口内径为0.8~1.0mm);冷冻干燥仪(EYELA FDU-2100),pH计(梅特勒特利多FE20);水浴恒温振荡器(SHA-BH,金坛市宏华仪器厂);原子吸收分光光度计(AA-6300C,岛津公司);NICOLET型红外光谱仪(Licolet 公司);实验用水为超纯水(比电阻18.3MΩ·cm,Milli-Q超纯水系统)。
1.3 壳聚糖凝胶球的制备
壳聚糖凝胶球的制备包括以下三步。
(1)壳聚糖水溶胶的制备 称取3.0g壳聚糖,倒入100mL稀盐酸(体积分数1%)溶液中,过夜搅拌,滤出未溶物,得到均一分散的水溶胶,见图1(a)。
(2)壳聚糖凝胶球的制备 如图1(b)所示,将上述水溶胶倒入滴定管中,再将水溶胶逐滴缓慢滴入到500mL的NaOH(1mol/L)溶液中,获得乳白色壳聚糖凝胶球。滴加完毕后,壳聚糖凝胶球在碱溶液中继续搅拌2h,过滤并用蒸馏水将壳聚糖凝胶球洗涤至中性。
(3)冷冻干燥凝胶球 将上述湿凝胶球放在冷冻干燥仪中(–80℃,24h),得到冷冻干燥壳聚糖凝胶球(2.8~3.0mm),见图1(c)。吸附重金属后的壳聚糖凝胶球见图1(d)。
1.4 吸附试验
取25.0mg壳聚糖凝胶球分别加入到Cu(Ⅱ)和Cr(Ⅵ)溶液中(初始浓度为100mg/L,体积25.0mL),在25℃±1℃、160r/min恒温振荡器振荡25~30h后,取上清液稀释一定倍数,用原子吸收分光光度计测定吸附后金属离子浓度。用0.1mol/L的氢氧化钠或0.1mol/L稀盐酸调节金属离子溶液初始pH。吸附等温学实验中Cu(Ⅱ)和Cr(Ⅵ)初始浓度为10~650mg/L;吸附动力学实验中Cu(Ⅱ)和Cr(Ⅵ)初始浓度为50mg/L、100mg/L、200mg/L,吸附液体积为250mL;吸附热力学实验中吸附温度为25℃、35℃、45℃、55℃。
1.5 材料表征
将壳聚糖凝胶球、吸附后的壳聚糖凝胶球-Cu(Ⅱ)和-Cr(Ⅵ)材料干燥后处理为粉末经溴化钾压片用红外光谱仪进行红外光谱分析。其中,吸附后的壳聚糖凝胶球-Cu(Ⅱ)和-Cr(Ⅵ)材料的制备条件为:初始浓度均为100mg/L,初始pH分别为5.5和3.0。

图1 冷冻干燥壳聚糖凝胶球制备过程及吸附应用
2 结果与讨论
2.1 溶液pH对Cu(Ⅱ)及Cr(Ⅵ)吸附的影响
在吸附过程中,溶液pH不仅影响吸附剂的表面特性,还影响吸附质在溶液中的存在形态[13]。例如:壳聚糖在酸性介质下不稳定,较低pH时会发生明显溶解[6];当pH>5.5时,Cu(Ⅱ)在溶液中会发生沉淀[5]。本研究中,Cu(Ⅱ)和Cr(Ⅵ)吸附实验的pH范围分别设定为3.0~5.5和3.0~10.0。
如图2所示,酸性介质有利于Cr(Ⅵ)的吸附,而pH升高到中性范围,有利于Cu(Ⅱ)的吸附。因此,5.5±0.1和3.0±0.1是Cu(Ⅱ) 和Cr(Ⅵ)的最佳吸附pH并用于下面实验。从反应机理而言,壳聚糖C2-NH2上N原子的孤对电子在酸性环境下易质子化为C2-NH3+[8],与Cu2+产生静电排斥并降低吸附量;当pH增大到中性范围时,壳聚糖上-NH2质子化程度变弱,Cu2+离子较容易接近-NH2发生配位反应,吸附量增大[6]。然而,在酸性环境下(pH=3.0左右)Cr(Ⅵ)主要以HCrO4–的形态存在[14],容易受-NH3+静电吸引靠近壳聚糖凝胶球,部分Cr(Ⅵ)被壳聚糖上具有还原性的—NH2和—OH还原为Cr(Ⅲ)[8,15];当pH升高(pH>6.8),—NH2质子化变弱,HCrO4–转化为CrO42–,静电作用变弱导致对Cr(Ⅵ)吸附能力下降[2,13]。此外,H+与Cu2+以及OH–与CrO42–竞争活性点位也是降低吸附量的一个重要原因[6,16]。
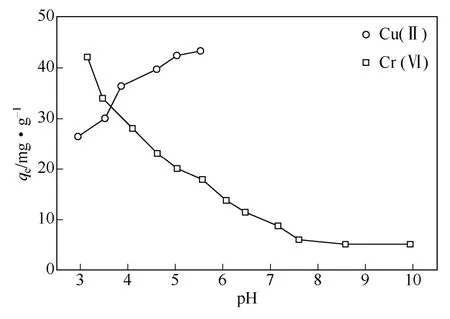
图2 pH对Cu(Ⅱ)和Cr(Ⅵ)吸附的影响
2.2 吸附动力学
如图3(a)和(b),在反应初始阶段,壳聚糖凝胶球对Cu(Ⅱ)和Cr(Ⅵ) 吸附速率较快,随后吸附变慢直至平衡。吸附量均随着初始浓度增加不断增加,这是因为增加吸附质浓度会增加传质推动力,容易克服溶质从液相到固相的传质阻力,因而吸附剂与吸附质碰撞机会增加从而强化了吸附[8]。另外,在5min内,Cr(Ⅵ)至少完成了平衡吸附量的50%,2h后达到吸附平衡;而在120min内,Cu(Ⅱ)达到50%平衡吸附量,25h后吸附平衡。这可能因为Cr(Ⅵ)的吸附主要通过静电作用,而Cu(Ⅱ)的吸附主要发生化学配位反应,吸附较慢。分别用拟一级和拟二级吸附动力学模型对吸附过程进行拟合,见式(1)和式(2)[11]。

式中,k1为拟一级速率常数,min–1;k2为拟二级速率常数,g/(mg·min);qt为t时刻的吸附容量,mg/g。用式(1)和式(2)对实验数据进行非线性拟合可得到k1、k2及qe。吸附动力学相关参数见表1。
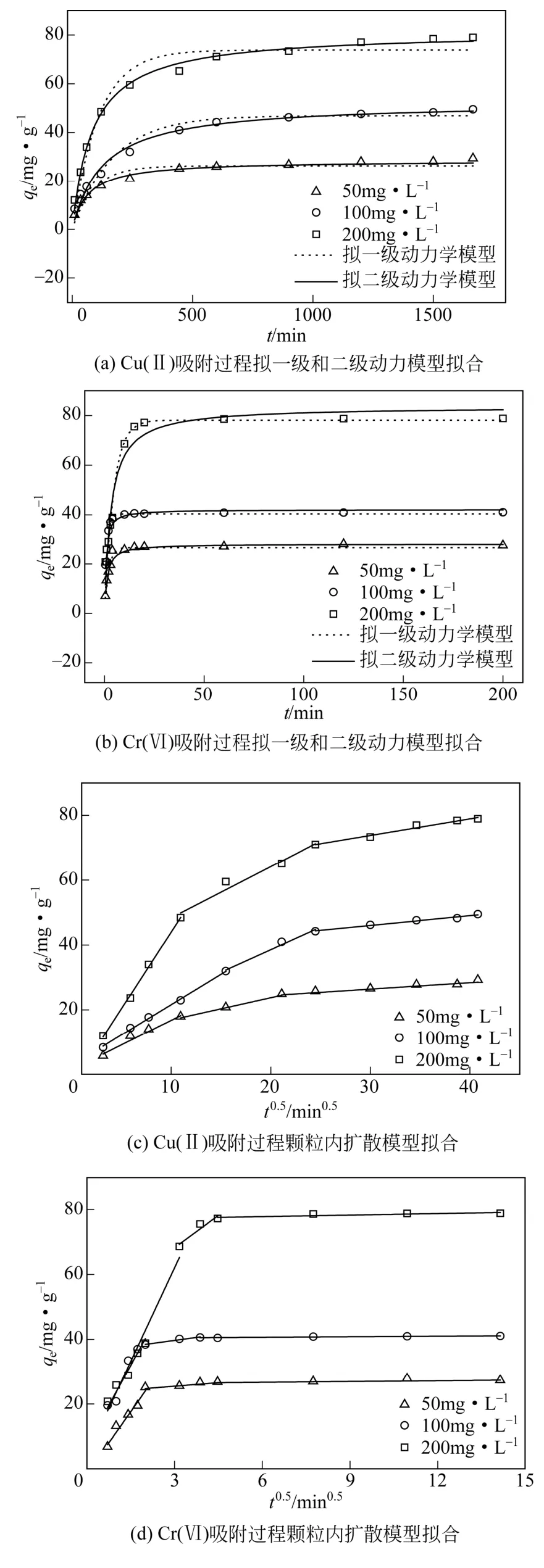
图3 Cu(Ⅱ)和Cr(Ⅵ)吸附动力学
由表1可知,两模型拟合下的吸附速率常数kCr(Ⅵ)>kCu(Ⅱ),这与Cr(Ⅵ)快吸附过程相符。另外,拟二级模型能够更好地用于描述壳聚糖凝胶球对Cu(Ⅱ)吸附过程,说明Cu(Ⅱ)的吸附主要受化学吸附控制。对Cr(Ⅵ)而言,拟一级模型的R2均稍高于拟二级模型,但是两者R2很接近,表明物理作用(静电吸引)和化学作用[Cr(Ⅵ)的部分还原]可能共同参与Cr(Ⅵ)的吸附过程[17]。冷冻干燥后的壳聚糖凝胶球其内部形成了互相联通的孔道[12],吸附过程可能存在吸附质在孔道扩散现象,颗粒内扩散模型用以判断颗粒孔内扩散是否为限制速率的一步,表达式如式(3)[13,18]。

式中,kp为颗粒内扩散速率常数,mg/(g·min0.5);C为与边界层厚度有关的常数,mg/g。式(3)中qt对t0.5作图所得到的斜率和截距即为kp和C(见表1)。
如果颗粒内扩散是整个吸附过程速率控制的一步,则qt对t0.5作图是一条过原点的直线[18]。如图3(c)和(d),qt对t0.5为三段线性图,说明在整个吸附过程中有3步不同的吸附过程控制着吸附速率:首先,金属离子在溶液中通过本体扩散到壳聚糖凝胶球的外表面;然后,外表面上的吸附质通过颗粒内扩散进入壳聚糖凝胶球的孔道内并到达各吸附点位;最后随着溶液中金属离子浓度的大幅下降,颗粒内扩散减慢至吸附平衡。第二步为颗粒内扩散过程,通过该步R2可知,颗粒内扩散不是Cr(Ⅵ)限制速率的一步(R2<0.90),而对于Cu(Ⅱ)吸附过程,尽管R2>0.95,但直线未过原点,说明颗粒内扩散不是限制速率的唯一一步,还包括化学吸附[8,18]。
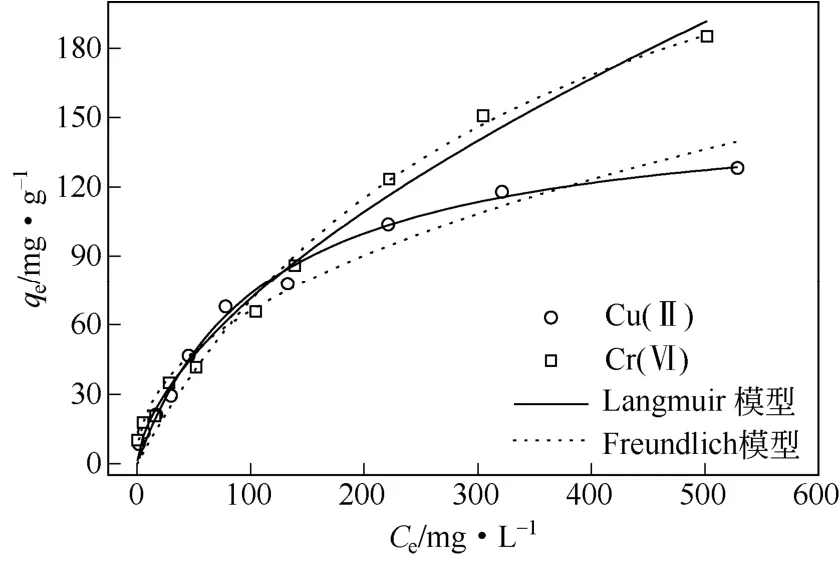
图4 壳聚糖凝胶球吸附Cu(Ⅱ) 和Cr(Ⅵ)的吸附等温线
2.3 吸附等温线及热力学
如图4所示,在低浓度范围内,随着平衡浓度增大,Cu(Ⅱ)和Cr(Ⅵ)的吸附容量均快速增加。当初始浓度超过200mg/L时,壳聚糖凝胶球对Cr(Ⅵ)的吸附容量则显著大于Cu(Ⅱ)。分别采用Langmuir和Freundlich模型分析吸附剂和吸附质之间的相互作用,如式(4)、式(5)[10-11,15]。
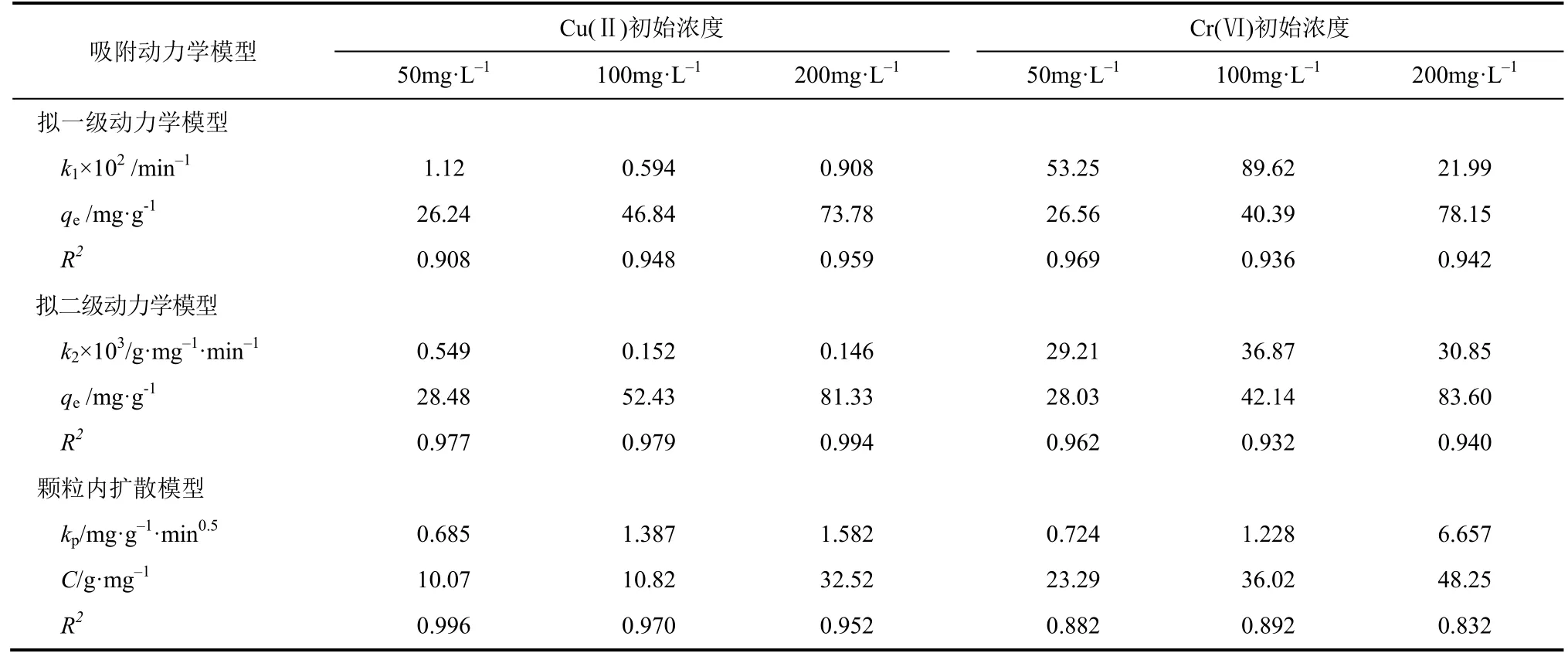
表1 Cu(Ⅱ)和Cr(Ⅵ)吸附动力学参数

式中,qe为平衡吸附量,mg/g;qm为最大饱和吸附量,mg/g;KL为Langmuir吸附平衡常数,与吸附亲和力或吸附能有关,L/mg;Ce是吸附质的平衡浓度,mg/L;KF为Freundlich等温常数,L/mg,代表了吸附量的相对值;n可以评价吸附亲和力,n越大亲和力越大。用式(4)和式(5)对实验数据非线性拟合得到KL和qm,KF和n,相关参数详见表2。
比较相关系数R2发现,Langmuir等温模型可以较好地拟合吸附Cu(Ⅱ)的实验数据,这说明壳聚糖凝胶球吸附Cu(Ⅱ)为单层吸附。Freundlich模型既可用于单层化学吸附也可以用于多层物理吸附[10],对Cr(Ⅵ)而言,虽然Freundlich等温模型拟合优于Langmuir模型(0.986>0.982),但两者相关系数很接近,这表明吸附剂对Cr(Ⅵ)的吸附过程可能既涉及单层吸附又涉及多层吸附。拟合得到壳聚糖凝胶球对Cu(Ⅱ)的最大吸附量可达155.67mg/g,Cr(Ⅵ)在实验浓度范围内最大吸附量为185.08mg/g,优于文献报道的壳聚糖基改性吸剂[5,9,12,16,19-21],详见表3。
为了进一步分析吸附过程,引入一个量纲为1常数RL,用于描述Langmuir模型的基本特性,表达式如式(6)[5,20]。

式中,C0为吸附质的初始浓度,mg/g;当RL=0,说明吸附是不可逆的;当0<RL<1,对吸附有利;当RL=1时,线性吸附;当RL>1,不利于吸附。RL的值越小说明吸附剂对吸附质的亲和力就越大。由于KL>0,因此0<RL<1,说明吸附过程均有利于Cu(Ⅱ)和Cr(Ⅵ)吸附。由表1可知,Langmuir吸附常数,故,这表明壳聚糖凝胶球吸附Cu(Ⅱ)的亲和力比Cr(Ⅵ)大。通过Freundlich等温模型nCu(Ⅱ)>nCr(Ⅵ)也可以印证这一点[10]。
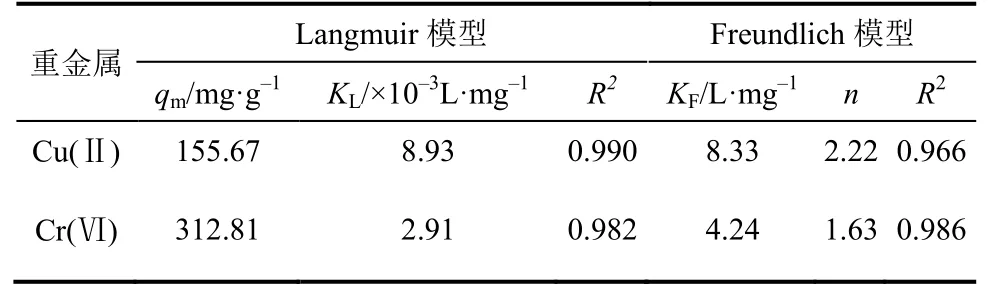
表2 吸附Cu(Ⅱ)和Cr(Ⅵ)的Langmuir和 Freundlich等温模型相关参数
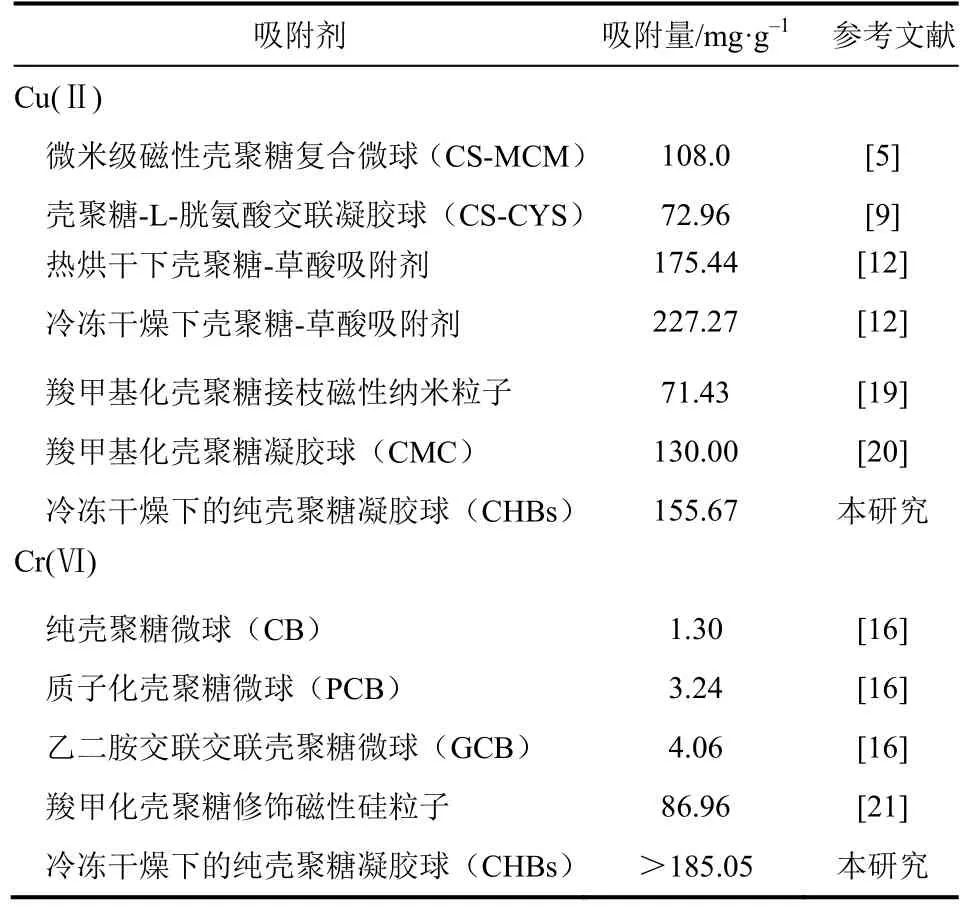
表3 对比不同壳聚糖基吸附剂对Cu(Ⅱ)和Cr(Ⅵ)的吸附容量
此外,为了研究壳聚糖凝胶球吸附Cu(Ⅱ)和Cr(Ⅵ)的热力学过程,热力学参数详见式(7)和式(8)[13]。

式中,Kc为不同温度下的吸附平衡常数,L/mol,由qe/Ce得到;ΔG为吉布斯自由能变,J/(mol·K);ΔH为焓变,kJ/mol;ΔS为熵变,kJ/mol;R为气体常数,8.314J/(mol·K)。ΔH和ΔS通过ΔG对T作图的截距和斜率推出。吸附热力学参数见表4。
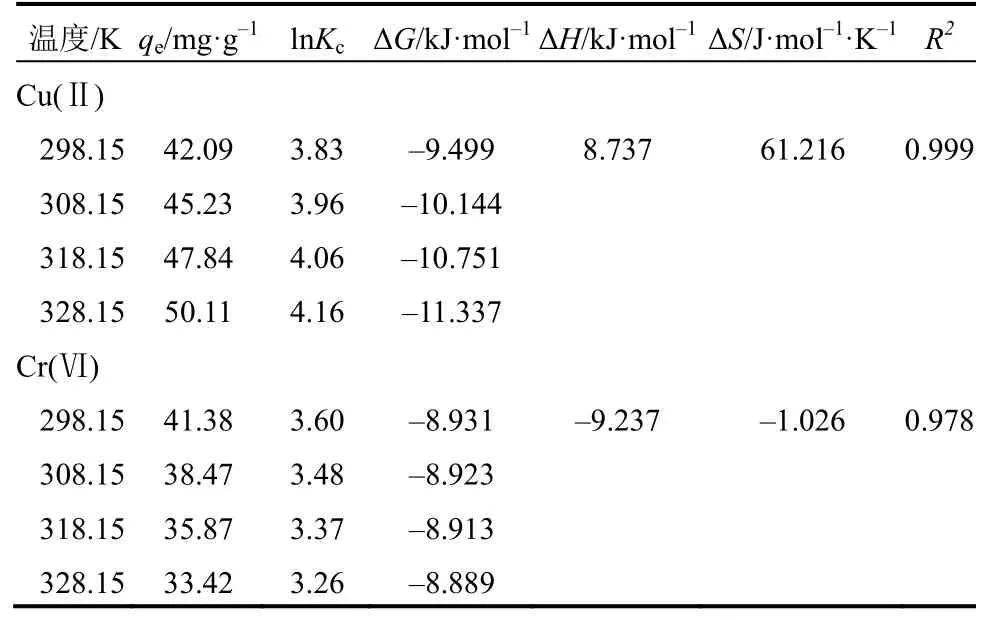
表4 壳聚糖凝胶球吸附Cu(Ⅱ)和Cr(Ⅵ)的热力学参数
从表4可以看出,Cu(Ⅱ)和Cr(Ⅵ)的吸附过程ΔG<0,说明Cu(Ⅱ)和Cr(Ⅵ)的吸附过程均是自发、可行的过程。Cu(Ⅱ)的ΔG的绝对值随着温度上升而增大,表明升温有利于Cu(Ⅱ)吸附的进行,而对Cr(Ⅵ)吸附却恰恰相反。Cu(Ⅱ)吸附的ΔH>0,而Cr(Ⅵ)的ΔH<0,这说明吸附Cu(Ⅱ)为吸热过程,而Cr(Ⅵ)的吸附是放热过程,这与实测的吸附量随温度变化趋势一致(见表4)。Cu(Ⅱ)吸附的ΔS>0,这说明Cu(Ⅱ)吸附在壳聚糖凝胶球固液界面上的混乱度是增强的[12]。Cr(Ⅵ)吸附的ΔS<0,说明Cr(Ⅵ)在界面上的混乱度是减弱的,这与文献报道一致[8,13]。
2.4 吸附机理对比分析
如图5所示,吸附前在3419cm–1的峰归属于壳聚糖凝胶球中N—H和O—H的重叠伸缩振动,1657cm–1和1601cm–1分别为NHCOCH3基团中C=O的伸缩振动和—NH2中N—H的弯曲振动,1326cm–1、1080cm–1、1024cm–1分别对应于—CN、C3—OH、C6—OH伸缩振动[8,22-23]。这说明,溶胶-凝胶-冷冻干燥过程并未破坏壳聚糖官能团,—OH和—NH2仍存在于壳聚糖分子骨架内。当吸附Cu(Ⅱ)后,O—H和N—H重叠伸缩振动峰偏移到3423cm–1;1601cm–1处N—H弯曲振动峰移动到1608cm–1;C3—OH和C6—OH吸附峰1080cm–1和1024cm–1的均向低波数偏移,同时1326cm–1处—CN峰变弱以至完全消失。Cr(Ⅵ)吸附后,除了与—OH和—NH2相关谱带发生位移外,在940cm–1和806cm–1处出现了两个新峰,属于Cr(Ⅵ)—O和Cr(Ⅲ)—O吸收峰,证实了吸附剂表面上的Cr(Ⅵ)部分被还原成了Cr(Ⅲ)[8]。因而,壳聚糖凝胶球上的—NH2和—OH基团参与了Cu(Ⅱ)和Cr(Ⅵ)化学吸附过程。
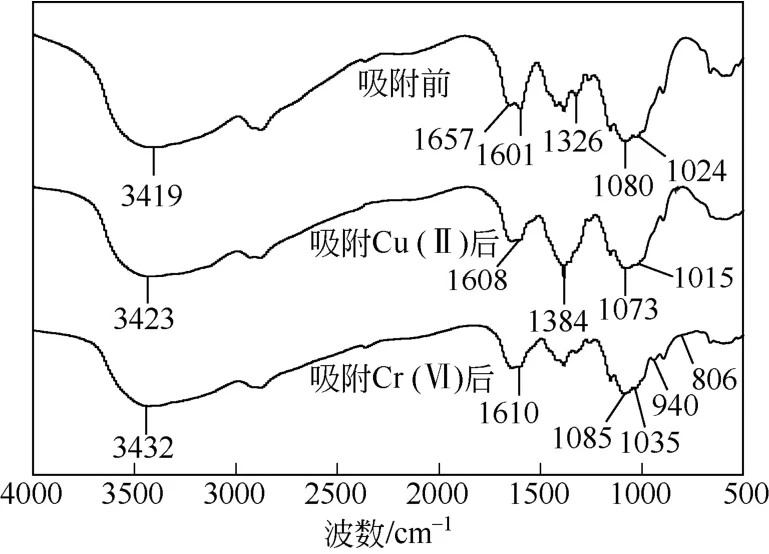
图5 壳聚糖凝胶球吸附前后FTIR谱图
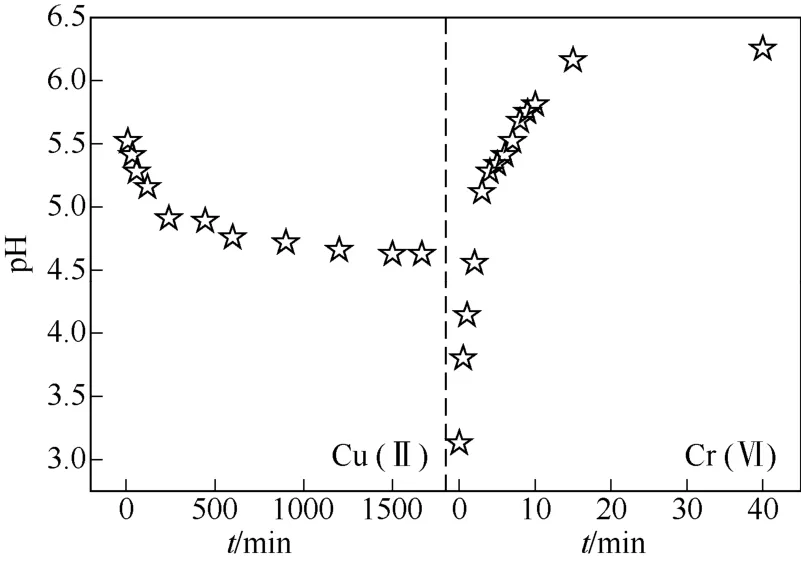
图6 Cu(Ⅱ)和Cr(Ⅵ)吸附过程中溶液pH变化
壳聚糖吸附铜的机理主要有两种:①4mol—NH2螯合1mol Cu(Ⅱ);②2mol —NH2和2mol—OH结合1mol Cu(Ⅱ)[24]。如图6所示,在Cu(Ⅱ)吸附过程中,溶液pH随吸附时间推移逐渐下降并至平衡,这可能归因于壳聚糖凝胶球上部分—OH与Cu(Ⅱ)发生配位脱去质子后释放到溶液中。而Cr(Ⅵ)在酸性条件下(存在形态主要为HCrO4–)首先通过静电引力预吸附在吸附剂表面上,然后—NH2和—OH作为电子供体将电子传递给Cr(Ⅵ),在H+存在的情况下,Cr(Ⅵ)部分还原成Cr(Ⅲ)[式(9)],随着—NH2质子化和Cr(Ⅵ)还原过程消耗质子,pH快速上升(图6),当pH>6时,一部分Cr(Ⅲ)以沉淀的形式吸附在凝胶球的表面上[8,15]。综上,壳聚糖凝胶球吸附Cu(Ⅱ)的机理主要以单层化学吸附作用,而吸附Cr(Ⅵ)是单层化学吸附和多层物理吸附共同作用的吸附-还原过程。
此外,如图7所示,选用盐酸、硫酸、硝酸、柠檬酸等对吸附Cu(Ⅱ)后的壳聚糖凝胶球进行24h脱附发现,Cu(Ⅱ)在pH为4.0的脱附剂稀溶液的脱附率低于pH为3.0的脱附剂稀溶液的脱附率;硝酸的脱附效果最好,脱附率仅为33%,进一步采用络合剂乙二胺四乙酸二钠(EDTA-2Na)脱附研究发现,随着脱附剂浓度从2.0mmol/L增加到3.5mmol/L,脱附率从35%提高到65%,然而EDTA-2Na浓度超过2.5mmol会造成吸附Cu(Ⅱ)饱和的壳聚糖凝胶球发生少量溶解。吸附Cr(Ⅵ)的壳聚糖凝胶球在0.1mol/L的NaOH连续5次/每次5h脱附率分别从90%下降到71%。因而,壳聚糖凝胶球脱附Cr(Ⅵ)的效果显然优于Cu(Ⅱ)。但是,壳聚糖凝胶球的吸附容量随着循环利用次数的增加而显著下降,可能是因为Cr(Ⅵ) 在吸附剂表面上部分还原为Cr(Ⅲ)占用吸附点位且无法再生。上述对Cu(Ⅱ)和Cr(Ⅵ)不同的脱附结果也暗示了Cu(Ⅱ)和Cr(Ⅵ)的不同吸附机理:吸附质与吸附剂间的物理作用[Cr(Ⅵ)]通常比化学配位反应[Cu(Ⅱ)]更容易脱附。
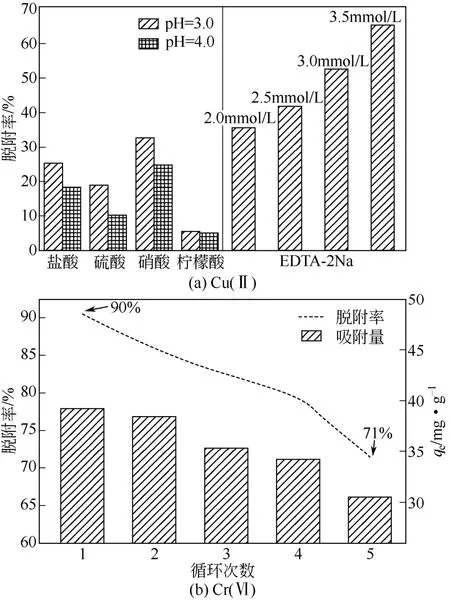
图7 壳聚糖凝胶球吸附Cu(Ⅱ)和Cr(Ⅵ)后材料脱附对比
3 结论
(1)采用溶胶-凝胶-冷冻干燥法制备出毫米级壳聚糖凝胶球,吸附实验发现壳聚糖凝胶球对Cu(Ⅱ)和Cr(Ⅵ)的吸附行为不同:Cu(Ⅱ)和Cr(Ⅵ)的最佳吸附pH分别为5.5和3.0;吸附过程中,Cr(Ⅵ)在2h达到吸附平衡,而Cu(Ⅱ)吸附平衡则需25h;Cu(Ⅱ)和Cr(Ⅵ)的吸附过程均为自发过程,Cu(Ⅱ)的吸附反应为吸热、熵增过程,而Cr(Ⅵ)的吸附反应为放热、熵减过程;吸附Cu(Ⅱ)后的壳聚糖凝胶球较难脱附,而吸附Cr(Ⅵ)后的凝胶球脱附时间短、脱附率相对较高。
(2)FTIR谱图研究证实—NH2和—OH是壳聚糖凝胶球吸附Cu(Ⅱ)和Cr(Ⅵ)的主要吸附活性位点,Cr(Ⅵ)在吸附过程发生了部分还原反应。通过Langmuir、Freundlich等温模型,拟一级、拟二级动力学、颗粒内扩散模型对吸附过程拟合表明:Cu(Ⅱ)的吸附过程主要为单层化学吸附,而Cr(Ⅵ)是单层化学吸附与多层物理吸附共同作用的吸附-还原过程。
壳聚糖凝胶球对Cu(Ⅱ)和Cr(Ⅵ)的最大吸附量分别为155.67mg/g和185.08mg/g,这说明通过溶胶-凝胶-冷冻干燥法制备的壳聚糖凝胶球强化了吸附量,同时毫米粒径的凝胶球利于吸附后固液分离,改善了粉体吸附剂难分离的问题。
符号说明
C——与边界层厚度有关的常数,mg/g
C0,Ce——分别为吸附质初始浓度和平衡浓度,mg/L
Kc——不同温度下的吸附平衡常数,L/mol
KF——Freundlich等温常数,L/mg
KL——Langmuir吸附平衡常数,L/mg
k1——拟一级速率常数,min-1
k2——拟二级速率常数,g/(mg·min)
kp——颗粒内扩散速率常数,mg/(g·min0.5)
n——评价吸附亲和力
qe,qt,qm—— 分别为平衡吸附量、t时的吸附量及最大饱和吸附量,mg/g
R—— 气体常数,8.314J/(mol·K)
RL—— 量纲为1常数
ΔG—— 吉布斯自由能变,J/(mol·K)
ΔH—— 焓变,kJ/mol
ΔS—— 熵变,kJ/mol
[1] ZHAO F P,REPO E,YIN D,et al.EDTA-cross-linked β-cyclodextrin:an environmentally friendly bifunctional adsorbent for simultaneous adsorption of metals and cationic dyes[J].Environmental Science & Technology,2015,49(17):10570-10580.
[2] LI H,BI S D,LIU L,et al.Separation and accumulation of Cu(Ⅱ),Zn(Ⅱ) and Cr(Ⅳ) from aqueous solution by magnetic chitosan modified with diethylenetriamine[J].Desalination,2011,278(1/2/3):397-404.
[3] JIANG W,WANG W F,PAN B C,et al.Facile fabrication of magnetic chitosan beads of fast kinetics and high capacity for copper removal[J].ACS Applied Materials & Interfaces,2014,6(5):3421-3426.
[4] WEN Y Z,MA J Q,CHEN J,et al.Carbonaceous sulfur-containing chitosan-Fe(Ⅲ):a novel adsorbent for efficient removal of copper(Ⅱ) from water[J].Chemical Engineering Journal,2015,259:372-380.
[5] YAN H,YANG L Y,YANG Z,et al.Preparation of chitosan/poly(acrylic acid) magnetic composite microspheres and applications in the removal of copper(Ⅱ) ions from aqueous solutions[J].Journal of Hazardous Materials,2012,229/230:371-380.
[6] KYZAS G Z,KOSTOGLOU M,LAZARIDIS N K.Copper and chromium(Ⅵ) removal by chitosan derivatives-equilibrium and kinetic studies[J].Chemical Engineering Journal,2009,152(2/3):440-448.
[7] MILLER S M,ZIMMERMAN J B.Novel,bio-based,photoactive arsenic sorbent:TiO2-impregnated chitosan bead[J].Water Research,2010,44(19):5722-5729.
[8] JIANG Y J,YU X Y,LUO T,et al.γ-Fe2O3nanoparticles encapsulated millimeter-sized magnetic chitosan beads for removal of Cr(Ⅵ) from water: thermodynamics,kinetics,regeneration,and uptake mechanisms[J].Journal of Chemical & Engineering Data,2013,58(11):3142-3149.
[9] 王思思,英晓光,张卫英,等.L-胱氨酸交联球形壳聚糖凝胶的制备Cu2+吸附性能[J].化工学报,2013,64(9):3437-3445.WANG S S,YING X G,ZHANG W Y,et al.Preparation and properties of spherical chitosan hydrogel crosslinked with L-cystine for Cu2+adsorption[J].CIESC Journal,2013,64(9):3437-3445.
[10] SIKDER M T,MIHARA Y,ISLAM M S,et al.Preparationand characterization of chitosan-caboxymethyl-β-cyclodextrin entrapped nanozero-valent iron composite for Cu(Ⅱ) and Cr(Ⅵ) removal from wastewater[J].Chemical Engineering Journal,2014,236:378-387.
[11] QI J Y,ZHANG G S,LI H N.Efficient removal of arsenic from water using a granular adsorbent:Fe-Mn binary oxide impregnated chitosan bead[J].Bioresource Technology,2015,193:243-249.
[12] MI F L,WU S J,LIN F M.Adsorption of copper(Ⅱ) ions by a chitosan-oxalate complex biosorbent[J]. International Journal of Biological Macromolecules,2015,72:136-144.
[13] GHEJU M,BALCU I,MOSOARCA G.Removal of Cr(Ⅵ) from aqueous solutions by adsorption on MnO2[J].Journal of Hazardous Materials,2016,310:270-277.
[14] LI Y J,GAO B Y,WU T,et al.Hexavalent chromium removal from aqueous solution by adsorption on aluminum magnesium mixed hydroxide[J].Water Research,2009,43(12):3067-3075.
[15] HUANG X X,LIU Y G,LIU S B,et al.Effective removal of Cr(Ⅵ) usingβ-cyclodextrin-chitosan modified biochars with adsorption/reduction bifuctional roles[J].RSC Advances,2016,6(1):94-104.
[16] KOUSALYA G N,GANDHI M R,MEENAKSHI S.Sorption of chromium(Ⅵ) using modified forms of chitosan beads[J].International Journal of Biological Macromolecules,2010,47(2):308-315.
[17] DAI J,YANG H,YAN H,et al.Phosphate adsorption from aqueous solutions by disused adsorbents:chitosan hydrogel beads after the removal of copper(Ⅱ)[J].Chemical Engineering Journal,2011,166(3):970-977.
[18] WANG T,ZHANG L Y,LI C F,et al.Synthesis of core-shell magnetic Fe3O4@poly(m-phenylenediamine) particles for chromium reduction and adsorption[J].Environmental Science & Technology,2015,49(9):5654-5662.
[19] 程昌敬,左芳,吴莉莉.羧甲基化壳聚糖修饰磁性Fe3O4纳米粒子去除Cu(Ⅱ)离子[J].化工进展,2011,30(11):2549-2553.CHENG C G,ZUO F,WU L L.Removal of Cu(Ⅱ) ions by carboxymethylated-chitosan modified magnetic Fe3O4nanoparticles[J].Chemical Industry and Engineering Progress,2011,30(11):2549-2553.
[20] YAN H,DAI J,YANG Z,et al.Enhanced and selective adsorption of copper(Ⅱ) ions on surface carboxymethylated chitosan hydrogel beads[J].Chemical Engineering Journal,2011,174(2):586-594.
[21] 程昌敬,刘东,张嫦.羧甲基化壳聚糖修饰磁性硅粒子去除Cr(Ⅵ)离子[J].化工进展, 2012,31(1):227-232.CHENG C J,LIU D,ZHANG C.Adsorptive removal of Cr(Ⅵ) ions by carboxymethylated-chitosan modified magnetic silica particles[J]. Chemical Industry and Engineering Progress,2012,31(1):227-232.
[22] ZHANG S,ZHOU Y F,NIE W Y,et al.Preparation of Fe3O4/chitosan/poly(acrylic acid) composite particles and its application in adsorbing copper ion(Ⅱ)[J].Cellulose,2012,19(6):2081-2091.
[23] BORSAGLI F G L M,MANSUR A A P,CHANGS P,et al.O-carboxymethyl functionalization of chitosan:Complexation and adsorption of Cd(Ⅱ) and Cr(Ⅵ) as heavy metal pollutant ions[J].Reactive and Functional Polymers,2015,97:37-47.
[24] ZHAO F,YU B Y,YUE Z R,et al.Preparation of porous chitosan gel beads for copper(Ⅱ) ion adsorption[J].Journal of Hazardous Materials,2007,147(1/2):67-73.
Comparison for Cu(Ⅱ) and Cr(Ⅵ) adsorption behavior onto chitosan hydrogel beads
ZHANG Yizhong1,2,LIU Shan1,LIU Zhiwen2,3,WU Wencheng2,DENG Dongyang2,JU Yongming2
(1Key Laboratory of Subsurface Hydrology and Ecological Effects in Arid Region,Ministry of Education,School of Environmental Science and Engineering,Chang’an University,Xi’an 710064,Shaanxi,China;2South China Institute of Environmental Science,Ministry of Environmental Protection,Guangzhou 510655,Guangdong,China;3School of Environmental Science and Engineering,Guangdong University of Technology,Guangzhou 510006,Guangdong,China)
To facilitate the separation of chitosan powder after adsorption process,we adopted the sol-gel and freeze-drying method for the synthesis of millimeter-scale chitosan hydrogel beads(2.8 to 3mm),and further revealed the different adsorption behavior for Cu(Ⅱ) and Cr(Ⅵ) ions. Results showed that the optimum pH value for the adsorption of Cr(Ⅵ) and Cu(Ⅱ) ions was 3.0 and 5.5,respectively;The adsorption equilibrium achieved in 2h for Cr(Ⅵ) and 25h for Cu(Ⅱ) ions;The adsorption process for Cu(Ⅱ) ions was spontaneous and endothermic reactions with the increase of entropy. In a contrary,the adsorption process for Cr(Ⅵ) ions was spontaneous and exothermic reactions with the decrease of entropy;Desorption efficiency for Cu(II)-loaded CHBs(Cu-CHBs) was relatively low,while the desorption of Cr(Ⅵ)-loaded CHBs(Cr-CHBs) was conducted easily. Additionally,based on the results of FTIR and five models,including Langmuir isotherm,Freundlich isotherm,pseudo-first order kinetics,pseudo-second order kinetics,and intra-particle diffusion model.the adsorption process onto CHBs was monolayer chemisorptions for Cu(Ⅱ) ions and adsorption-reduction process for Cr(Ⅵ) ions mainly including monolayer chemisorptions together with multilayer physisorptions. The maximal adsorption capacities for Cu(Ⅱ) ions and Cr(Ⅵ) ions were 155.67mg/g and 185.08mg/g,respectively. This indicates that freeze-drying medthod enhanced adsorption capacity of CHBs are promising to solve the separation of chitosan powders.
chitosan hydrogel beads(CHBs);freeze-drying;Cu(Ⅱ) and Cr(Ⅵ) ions;adsorption;reduction;kinetic modeling
X703
:A
:1000–6613(2017)02–0712–08
10.16085/j.issn.1000-6613.2017.02.043
2016-06-20;修改稿日期:2016-09-19。
广东省科技计划(2016A020221017)及环境保护部百人工程项目。
张艺钟(1991—),男,硕士研究生。E-mail:yizhongyizhong @yeah.net。联系人:鞠勇明,高级工程师,主要从事功能材料开发及应用。E-mail:juyongming@scies.org。
