D-二聚体胶体金免疫层析定量检测方法的初步建立
2017-02-17崔宁明亮王云龙刘红春王万海李玉林王继创
崔宁 明亮 王云龙,2 刘红春 王万海 李玉林 王继创
(1.郑州大学第一附属医院 河南 郑州 450052; 2.郑州职业技术学院 河南 郑州 450121;3.河南省生物工程技术研究中心 河南 郑州 450001)
·论 著·
D-二聚体胶体金免疫层析定量检测方法的初步建立
崔宁1明亮1王云龙1,2刘红春1王万海1李玉林3王继创3
(1.郑州大学第一附属医院 河南 郑州 450052; 2.郑州职业技术学院 河南 郑州 450121;3.河南省生物工程技术研究中心 河南 郑州 450001)
目的 建立一种检测D-二聚体的胶体金免疫层析定量检测方法,为临床检测D-二聚体提供一种简便、快速、准确的检测方法。方法 根据免疫学中双抗体夹心和免疫层析的原理,研制定量检测样本中D-二聚体的胶体金试纸条,在金标定量仪上建立标准曲线,从灵敏度、特异性、线性、精密性、稳定性和方法学对比等方面对该方法进行评价。结果 本试纸条的线性范围为0.156 25~10 μg/ml,回归方程Y=92.907X+307.88,R2=0.982 68;批内变异系数(CV)为3.78%和2.81%,批间变异系数(CV)为4.95%和4.07%;与纤维蛋白原无交叉反应性;在37 ℃条件下保存1周;与IL公司ACL-TOP700检测系统免疫比浊法的相关性良好,回归方程Y=0.959 64X+0.026 45,相关系数R2=0.985 93。结论 本研究初步建立了检测D-二聚体的胶体金免疫层析定量检测方法,为临床检测D-二聚体提供了一种新的技术和方法。
D-二聚体;胶体金免疫层析;定量
D-二聚体是交联纤维蛋白(Fb)经纤溶酶作用后的特异降解产物,可作为体内高凝状态和纤溶亢进的分子标志物[1],是唯一反映凝血和纤溶的理想指标。D-二聚体正常参考值范围为0~243 ng/ml,临床上一般以0.5 μg/ml作为判断D-二聚体是否增高的临界值[2-4]。随着现代生活节奏的加快及人们饮食结构的改变,近年来血栓及肺栓塞性疾病、DIC、心脑血管疾病及恶性肿瘤等疾病发病率有逐年增高的趋势。研究表明,在这些疾病中,均会有凝血及纤溶系统的异常,进而导致体内D-二聚体水平的升高,其升高程度与病情进展程度密切相关[4-7]。因此,检测样本血浆中D-二聚体的含量可以辅助诊断以上疾病的发生发展,尤其在肺栓塞和深静脉血栓的排除诊断中,D-二聚体具有极其重要的临床排除诊断价值[3,8]。此外,也有研究表明,D-二聚体的升高与急性胰腺炎、糖尿病血管性病变及急慢性荨麻疹等疾病的发生发展和预后有极其密切的联系[9]。因此,检测样本血浆中D-二聚体的含量具有极其重要的临床应用价值。
随着方法学的不断进步,D-二聚体的检测方法日趋完善[6,10],目前临床上应用最多的是免疫比浊法。免疫比浊法虽有定量准确、灵敏度高、试剂重复性好、稳定性好等优点,但不能实现快速检测,需要大型的特殊仪器设备,这使其不能在基层和社区医院普及。胶体金免疫层析法具有快速、操作简便、设备简单等优点,弥补了免疫比浊法的不足。随着胶体金免疫层析法的不断发展和成熟,其已从定性发展为定量,既能定性,又能定量,并越来越广泛地应用于多种物质的检测。在D-二聚体的定量检测中,一直缺少一种简便快速的检测方法,这使得胶体金免疫层析定量检测方法以其独特的优势有望应用于D-二聚体的定量检测中。本课题就D-二聚体的胶体金定量检测方法的建立进行了相对深入全面的研究,初步建立了D-二聚体胶体金免疫层析定量检测方法。
1 材料和方法
1.1 主要仪器与试剂
1.1.1 仪器 金标定量仪购自天根生物科技有限公司;HM3030型三维平面点膜喷金仪购自上海金标生物科技有限公司;CT300型截条机购自上海金标生物科技有限公司;TG16-W微量高速离心机购自长沙湘仪离心机仪器有限公司。
1.1.2 试剂 抗D-二聚体单克隆抗体(包被用和标记用)、羊抗鼠IgG均由河南省生物工程中心提供。
1.2 材料 硝酸纤维素膜(型号:CN140):赛多利斯(sartorius Stedim);玻璃纤维棉购自上海良信生物科技有限公司;吸水纸由上海金标生物科技有限公司提供。
1.3 标本
1.3.1 样本 正常人全血标本(乙肝、丙肝、梅毒及人类免疫缺陷病毒均为阴性,且无脂血、溶血)和D-二聚体全血样本均取自郑州大学第一附属医院。
1.3.2 室内参考品 由河南省生物工程技术研究中心提供。
1.4 方法[8-11]
1.4.1 免疫金垫的制备
1.4.1.1 胶体金溶液的制备 采用柠檬酸三钠还原氯金酸法制备胶体金,氯金酸溶液与柠檬酸钠溶液的体积比为100 μl∶150 μl。
1.4.1.2 最佳标记pH的确定 将制备好的胶体金溶液用1.5 ml的离心管分装8管,每管1.0 ml。用0.02 mol/L的K2CO3溶液调节pH分别至5.0、6.0、6.5、7.0、7.5、8.0、8.5、9.0,每管加入6 μl标记用D-二聚体单克隆抗体,混匀。30 min后,在上述各管中加入0.1 ml质量分数为10%的NaCl溶液,观察各管颜色变化。以溶液颜色不再变化的最小碳酸钾量为最佳碳酸钾量,其所对应的pH为最佳pH。
1.4.1.3 最适标记浓度的确定 设置以下5个浓度的最佳量标记蛋白:0.5 mg/ml、1.0 mg/ml、1.5 mg/ml、2.0 mg/ml、2.5 mg/ml,按照本课题D-二聚体金标工艺制备成5种试纸条,用D-二聚体室内参考品检测以上5种试纸条的线性,线性最优的标记浓度即胶体金标记的最佳标记蛋白浓度。
1.4.1.4 免疫金的制备 取1.5 ml离心管若干支,每管加入1 ml胶体金溶液;每管加入最佳量的0.02 mol/L K2CO3,混匀;再向每管加入6 μl最佳浓度D-二聚体标记抗体,混匀,室温静置5 min;每管中加入质量为数为10% BSA 15 μl,混匀,室温静置10 min;12 000 r/min离心10 min,弃上清;向每管中加入1 ml洗液使沉淀充分溶解,混匀,12 000 r/min离心10 min,弃上清;向每管中加入200 μl金标保护液,使沉淀充分溶解,混匀,即得到实验所需免疫金。
用以下两种方法对免疫金进行鉴定:①用紫外分光光度计测定免疫金的吸光度值,并与未标记胶体金溶液的吸光度值进行比较,以吸光度值是否增加判断是否标记成功;②用此免疫金按照本课题D-二聚体金标工艺制备D-二聚体试纸条,用D-二聚体阳性标本和生理盐水在试纸条上检测,以试纸条显色与否判断是否标记成功。
1.4.1.5 免疫金垫的制备 打开三维平面点膜喷金仪,取合适长度10 mm宽的玻璃纤维棉,按照40 μl/cm的喷金量将制备的免疫金均匀喷于玻璃纤维棉上,置于37 ℃烘箱内干燥4 h,备用。
1.4.2 包被
1.4.2.1 最佳硝酸纤维素(NC)膜的选择 选取赛多利斯(Sartorius Stedim)公司CN140、CN95、JN90 3种硝酸纤维素膜,用D-二聚体参考品分别检测由以上3种NC膜制备而成的试纸条,以爬行速度、显色背景、有无非特异性反应及线性为考察标准,以爬行速度最快、背景最清晰、无非特异性反应且线性最优的NC膜为最佳NC膜。
1.4.2.2 最适包被浓度的确定 设置以下5种浓度的D-二聚体包被抗体:0.5、1.0、1.5、2.0、2.5 mg/ml。按照本课题D-二聚体胶体金试纸条制备工艺制备出此5个包被浓度的试纸条,用D-二聚体参考品检测此5种试纸条的线性,线性最优的包被浓度即为试纸条检测线的最佳包被浓度。
1.4.2.3 包被 用0.02 mol/L pH 7.8的磷酸盐缓冲液将包被用D-二聚体单克隆抗体稀释至最适浓度,将羊抗鼠IgG多克隆抗体稀释至1.0 mg/ml,分别作为检测线(T线)和质控线(C线)。用三维平面点膜喷金仪以1 μl/cm的速度将稀释好的抗体包被在硝酸纤维素膜(NC膜)上,置于37 ℃干燥4 h后备用。
1.4.3 标准曲线的建立
1.4.3.1 参考品的稀释 用生理盐水对40 μg/ml的D-二聚体参考品做倍比稀释,得到以下浓度的一系列室内参考品:40、20、10、5、2.5、1.25、0.625、0.312 5、0.156 25、0.078 μg/ml,现用现稀释。
1.4.3.2 标准曲线的建立 用各个实验条件的最优结果制备D-二聚体试纸条,用此试纸条和一系列参考品在金标定量仪上测定,每个浓度的参考品检测3次,取其平均值。以平均值为横坐标,以金标定量仪上的参数area为纵坐标建立曲线。将偏离线性的高值和低值剔除,直至出现最宽的线性和最大的R2值,并保证曲线所覆盖的浓度值至少为6个。线性范围的低值不小于0.312 5 μg/ml,同时R2值达到0.98以上的曲线为最终的标准曲线。
1.4.4 试纸条性能评价
1.4.4.1 特异性评价 将浓度大于10 mg/ml的纤维蛋白溶液、浓度大于5.63 mmol/L的甘油三酯溶液和浓度大于343 μmol/L的胆红素溶液各取75 μl滴加到试纸条上,15 min内观察显色情况。
1.4.4.2 精密性评价 用5 μg/ml和2.5 μg/ml这两个浓度的参考品分别对试纸条进行批内精密性和批间精密性检测。①批内精密性:抽取同一批试纸条20条,用上述两个浓度的参考品进行检测,每种参考品测10条,分别计算每个浓度参考品测量结果的平均值M和标准差SD,根据公式:CV=SD/M×100%计算出变异系数(CV)。结果应达到CV≤15%。②批间精密性:连续制备3批试纸条,每批抽取20条,用上述两个浓度的参考品进行测定,每个浓度的参考品每批测10条,每个浓度的参考品共测30条,分别计算每个浓度参考品的测量结果的平均值M和标准差SD,根据公式CV=SD/M×100%计算变异系数(CV)。结果应达到CV≤15%。
1.4.4.3 稳定性评价 用各个最优实验条件制备一批试纸条,从中抽取100条置于37 ℃存放1周,选取0.156 25、2.5、10 μg/ml 3个浓度参考品进行检测,每间隔1 d检测1次,考察试纸条的线性、特异性和精密性是否符合要求。
1.4.5 方法学对比 用本课题建立的检测方法对已用美国IL公司ACL-TOP700检测系统(免疫比浊法)定值的55份临床标本中的D-二聚体含量进行测定,将检测结果与IL公司的检测结果进行比对,计算两种检测结果的相关系数R2值,比较其相关性。
2 结果与方法学对比
2.1 最佳标记pH的确定 pH为7.5、8.0、8.5、9.0(对应K2CO3量依次为12、15、20、25 μl)时胶体金溶液颜色未发生改变,选取最小K2CO3量(12 μl)对应的pH为最佳标记pH。见图1。

图1 不同pH条件下胶体金的稳定性
2.2 最适标记浓度的确定 标记浓度在1.5 mg/ml时线性最优,故选取1.5 mg/ml为最佳标记蛋白浓度。见表1。
2.3 免疫金鉴定结果 胶体金溶液标记后比标记前吸光度值增大,见图2。D-二聚体阳性标本和生理盐水的检测结果中,阳性标本质控线和检测线均显色,阴性标本质控线显色,见图3。以上均说明标记成功。
图2 标记前后胶体金溶液吸光度变化

图3 标记后阴阳性标本检测
2.4 最佳硝酸纤维素(NC)膜的选择 3种NC膜中,CN140的显色速度最快,显色背景最清晰,线性范围最宽,R2最大且无非特异性反应,故选取NC膜CN140为D-二聚体胶体金定量试纸条的最佳NC膜。见表2。
2.5 最适包被浓度的确定 包被浓度为 1.5 mg/ml时,试纸条的线性范围最宽、R2最大,故选取1.5 mg/ml为D-二聚体胶体金定量试纸条检测线的最佳包被浓度。见表3。
2.6 标准曲线的建立 10个浓度参考品的检测信号值见表4。原始曲线见图4。调整后的最终标准曲线,线性范围为0.156 25~10 μg/ml,回归方程Y=92.907X+307.88,R2=0.982 68,见图5。
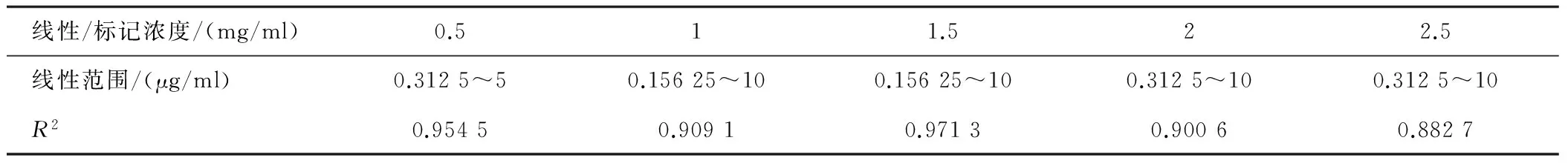
表1 5种标记蛋白浓度线性检测结果
2.7 试纸条性能评价
2.7.1 特异性评价 将浓度大于10 mg/ml的纤维蛋白溶液、浓度大于5.63 mmol/L的甘油三酯溶液及浓度大于343 μmol/L的胆红素溶液滴加到试纸条的样品垫上后,结果均为阴性,均无交叉反应,说明该试纸条特异性强。见图6。
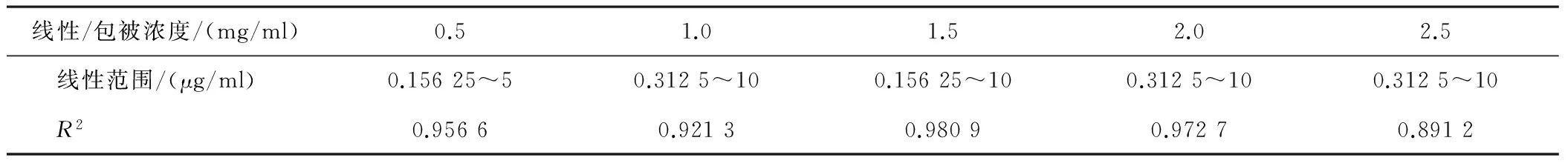
表3 5种不同包被浓度检测结果
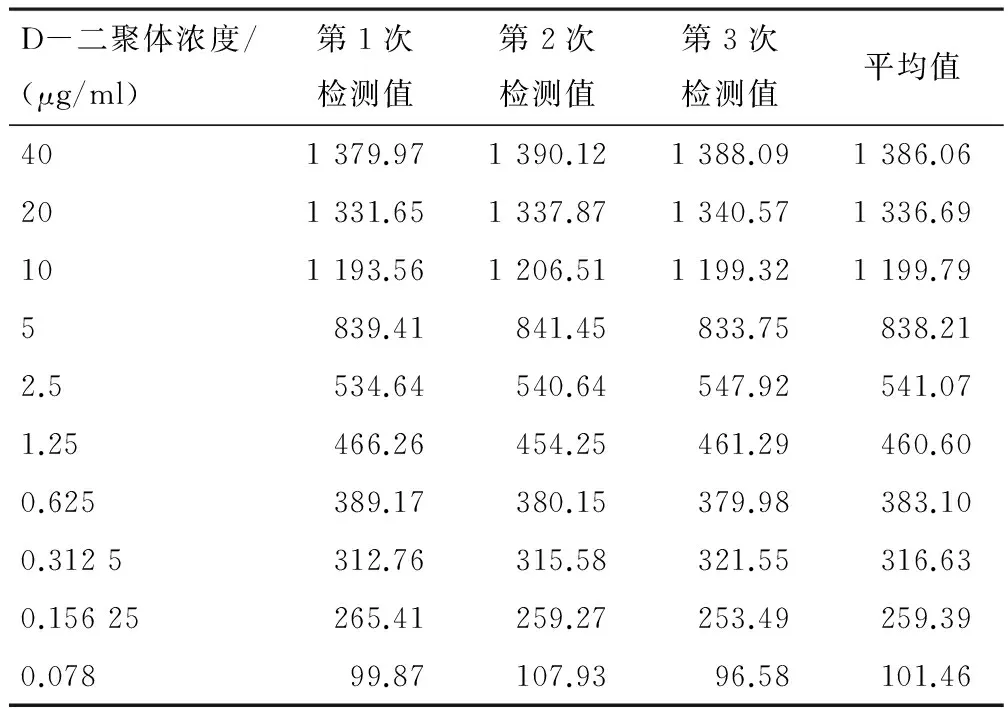
表4 10个浓度参考品测定信号值Area(mm·mV)
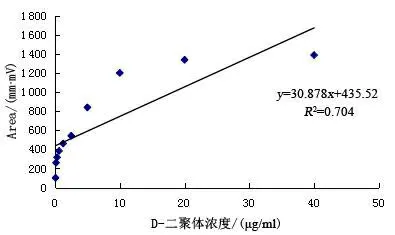
图4 D-二聚体胶体金免疫层析法定量检测原始曲线
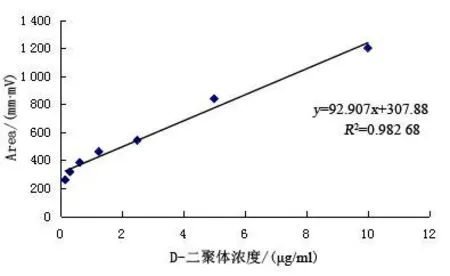
图5 D-二聚体胶体金免疫层析法定量检测标准曲线

1:纤维蛋白; 2:甘油三酯;3:胆红素。
2.7.2 精密性评价 批内和批间精密性均达到了满足批内CV%<15%、批间CV%<15%的要求。见表5。
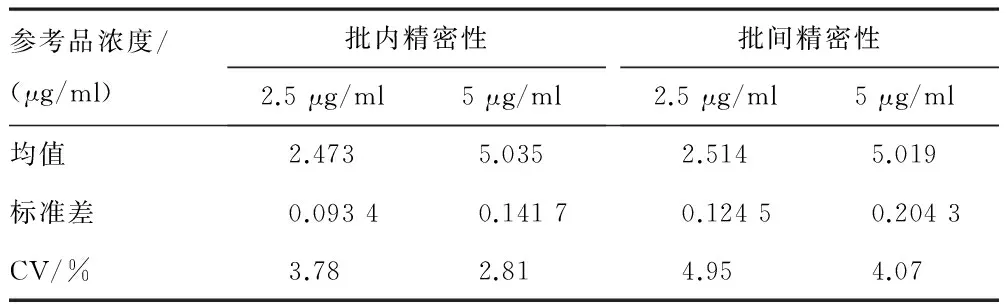
表5 D-二聚体试纸条精密性检测结果
2.7.3 稳定性评价 本课题研制的D-二聚体试纸条在37 ℃条件下存放7 d,线性、特异性和精密性均在可接受范围内。见表6。
2.8 方法学对比 本课题建立的检测方法与美国IL公司的ACL-TOP700检测系统免疫比浊法相比,两者相关性良好,回归方程:Y=0.959 64X+0.026 45,R2=0.985 93。见图7。
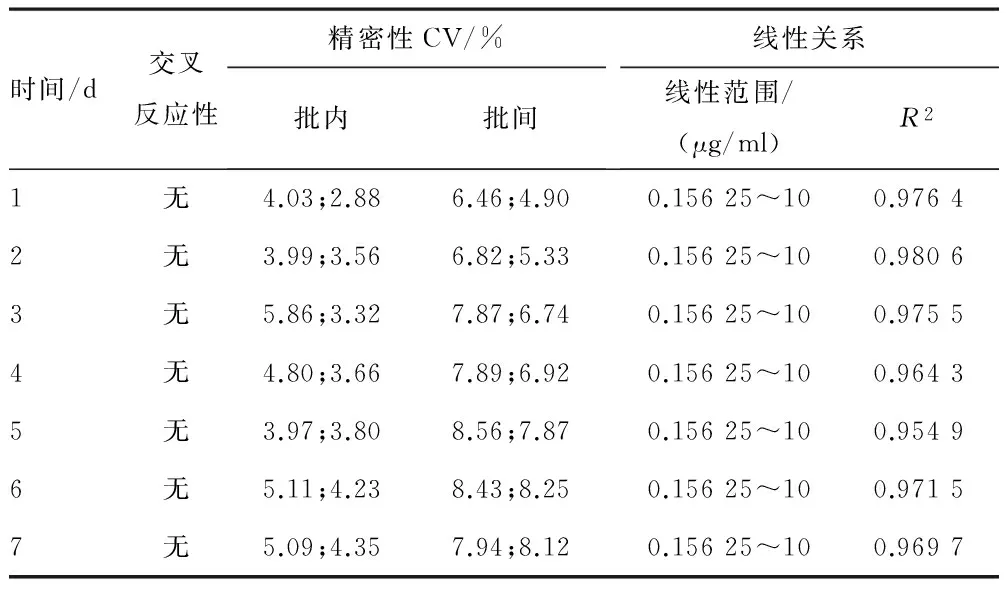
表6 37 ℃条件下稳定性检测结果
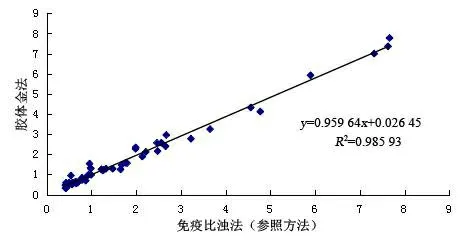
图7 D-二聚体试纸条与免疫比浊法相关性比较
3 讨论
3.1 金标定量仪上3个参数的选择 本课题使用的金标定量仪中,可反映检测线和质控线信号强弱的有3个参数:Intensity、Height和Area。Intensity指曲线中峰的峰谷距离X轴的距离,与待测物质的含量成负相关;Height指整个峰高的高度,与待测物质含量成正相关;Area指整个峰所占的面积值,也与待测物质含量成正相关。本研究进行了一系列实验用以比较这3个参数在反映线性方面的优劣性及科学性。结果显示,在3个参数中,每条标准曲线都是以Area为参数时的线性最好(同等条件下线性范围最宽,R2最大),也最能反映信号强度的最大值,故本课题选取Area为纵轴建立标准曲线。
3.2 最佳检测时间的确定 加样完毕距离开始检测的时间也是影响检测结果准确性的重要因素。最佳的检测时间最能反映质控线和检测线的最大信号值,因此需要实验探索本检测方法的最佳检测时间。本课题研究,运用了两种方法,检测出了最佳检测时间。具体方法如下:①用同一个试纸条加样后将其放置于金标定量仪相应位置,5~20 min内每间隔1 min检测1次,将此16个信号值和时间做曲线,结果显示信号值在加样后的5~13 min内已达到最大、最稳定,随后逐渐下降。②另取10个浓度室内参考品和5组(每组10条)试纸条在金标定量仪上检测。分别在加样后的3、5、10、13、15 min后检测,计算并比较这5个检测时间点的线性。结果显示在加样后5 min和10 min的线性最优。由此说明,在加样后5~10 min检测最佳。为使所建立试剂盒实现快速测定,选择在加样后5 min测定。
3.3 线性范围的确定 目前,业内公认为较权威的美国IL公司ACL-TOP700检测系统免疫比浊法的参考区间0~243 ng/ml为D-二聚体的健康人群参考区间。本课题建立的检测方法线性范围的确定就是以此为依据,故线性范围的最低值至少不能高于243 ng/ml。本课题建立的检测方法的线性范围的最低值为0.156 25 μg/ml,符合要求。
从结果分析看,D-二聚体定量检测试纸的灵敏度、特异性、精密性、稳定性和线性等指标均满足临床要求,且与美国IL公司的ACL-TOP700检测系统(免疫比浊法)相关系数R2=0.985 9,两者相关性良好。此外,本课题建立的D-二聚体定量检测方法的线性范围比已有的研究[11-12]宽,且检测速度更快(5 min),这使临床上可以及时、快速检测出更宽浓度范围的D-二聚体,为临床提供更高的参考价值。
本研究初步建立了D-二聚体胶体金免疫层析定量检测方法,为进一步研制D-二聚体试剂盒奠定了基础。然而,本课题仅对55份临床样本进行了测定,如进行新药报批和临床应用,需进行大量标本的临床实验研究。
[1] 李玮,王缚鲲,安黎云.D-二聚体检测方法及临床应用进展[J].解放军医药杂志,2013,25(5):80-83.
[2] 高丽枫.D-二聚体检测的临床作用及展望[J].赤峰学院学报(自然科学版),2015,31(1):17-18.
[3] 马婉蓉,宋艳丽,吴先正.急性肺栓塞诊断及预后生物标记物的研究进展[J].中华临床医师杂志(电子版),2015,9(10):1911-1915.
[4] 尤立蕊.D-二聚体的临床应用价值[J].医学综述,2015,21(16):2965-2967.
[5] 余祖辉.D-二聚体的检测及临床应用进展[J].中国医疗前沿,2011,6(12):12.
[6] 曾白华,吕连华,刘利华,等.D-二聚体的检测方法及其临床应用进展[J].现代医学,2013,41(3):216-219.
[7] 张金彪,代荣琴.D-二聚体检测的研究进展及其临床价值[J].国际检验医学杂志,2014,35(9):1152-1153.
[8] 董怀平.D-二聚体的研究进展[J].国际检验医学杂志,2006,27(12):1134-1135.
[9] 罗莉.D-二聚体检测及临床应用研究进展[J].四川医学,2010,31(10):1562-1563.
[10]蔡玉琳.D-二聚体检测方法及临床应用研究进展[J].基层医学论坛,2014,18(13):1742-1744.
[11]周静,孙家瑜,孙加冠,等.五种D-二聚体检测方法用于排除可疑静脉血栓栓塞症的临床评价[J].四川大学学报(医学版),2009,40(6):1078-1081.
[12]刘会芹.免疫法检测D-二聚体的研究[D].青岛:青岛科技大学,2010.
Establishment of the quantitative detection method of colloidal gold immunochromatography for D-Dimer
Cui Ning1, Ming Liang1, Wang Yunlong1,2, Liu Hongchun1, Wang Wanhai1, LI Yulin3, Wang Jichuang3
(1.TheFirstAffiliatedHospitalofZhengzhouUniversity,Zhengzhou450052,China; 2.ZhengzhouVocationalandTechnicalCollege,Zhengzhou450121,China; 3.Henanbioengineeringtechnologyresearchcenter,Zhengzhou450001,China)
Objective To establish a quantitative detection method based on the principle of immune chromatography, which provides a new detection method for detecting D-Dimer that is fast,accurate,simple and convenient. Methods According to the principle of double antibody sandwich and immune chromatography in immunology, a quantitative detection of the colloidal gold test strip of D-Dimer was created. And standard curve on gold standard quantitative instrument have been established. Besides, the method was evaluated by the sensitivity, specificity, linearity, precision, stability and methodology comparison. Results The linear range was 0.156 25~10 μg/ml, and the regression equation wasY=92.907X+307.88,R2=0.982 68. The intra-group variation coefficients were 3.78% and 2.81%, and the inter-group variation coefficients were 4.95% and 4.07%. Otherwise, the test strip had no cross reactivity with fibrinogen and the stability. The test strips could be stored for 144 h at 37 ℃. The correlation between the method we have established and the immunoturbidimetry of IL company was good, and the regression equation wasY=0.959 64X+0.026 45,R2=0.985 93. Conclusion In this study, we have initially and successfully established the colloidal gold immune chromatography assay for the quantitative detection of D-Dimer. We provide a new technique and method for clinical detection of D-Dimer.
D-Dimer; colloidal gold immune chromatography; quantitative ness
王云龙,E-mail:biowyl@126.com。
R-331
10.3969/j.issn.1004-437X.2017.02.001
2016-05-26)
