S100A9蛋白表达与宫颈鳞癌细胞侵袭、转移的关系研究
2017-02-17陈苗苗张文文王颖朱雪琼
陈苗苗 张文文 王颖 朱雪琼
S100A9蛋白表达与宫颈鳞癌细胞侵袭、转移的关系研究
陈苗苗 张文文 王颖 朱雪琼
目的 探讨S100A9蛋白表达与宫颈鳞癌细胞侵袭、转移的关系。方法采用S100A9重组腺病毒转染人宫颈鳞癌C-33A细胞,S100A9 siRNA转染人宫颈鳞癌Caski细胞;应用Western blot检测转染前后2种细胞中S100A9蛋白的表达,Transwell检测细胞侵袭与转移能力的变化。结果转染S100A9重组腺病毒后C-33A细胞中S100A9蛋白的表达明显增强;与未转染组、阴性对照组相比,转染组C-33A细胞的穿膜细胞数、穿过小室的细胞数均明显增多(均P<0.05)。转染S100A9 siRNA后Caski细胞中S100A9蛋白的表达明显降低;siRNA组Caski细胞的穿膜细胞数、穿过小室的细胞数均明显少于阴性对照组(均P<0.05)。结论S100A9与宫颈鳞癌细胞的侵袭、转移相关。上调S100A9的蛋白表达,可促进C-33A细胞侵袭与转移的能力;下调S100A9的蛋白表达,可抑制Caski细胞侵袭与转移的能力。
S100A9 宫颈鳞癌 侵袭 转移
S100A9是钙结合蛋白家族的成员之一,其在细胞的分化、增殖、凋亡和迁移中发挥着重要作用[1]。目前有相关研究结果显示S100A9在细胞恶性转化中亦具有重要作用,它在多种恶性肿瘤如乳腺癌[2]、卵巢癌[3]、膀胱癌[4]和未分化的甲状腺癌[5]中表达增高,并参与肿瘤的发生、发展。我们的前期研究发现S100A9在正常宫颈组织、宫颈上皮内瘤变(CIN)、宫颈癌中的表达逐渐升高[6],但对宫颈癌细胞生物学行为的影响尚不明确。此外,本课题组还发现在宫颈鳞癌细胞系SiHa、C-33A、Caski和MS751中,无论是mRNA水平还是蛋白水平,S100A9在Caski细胞中的表达最高,在C-33A细胞中的表达最低(待发表)。故本研究采用转染S100A9重组腺病毒上调宫颈鳞癌C-33A细胞S100A9的表达,利用RNA干扰技术下调宫颈癌Caski细胞中S100A9的表达,以研究S100A9蛋白表达的改变对宫颈癌细胞侵袭、转移的影响,为宫颈鳞癌的治疗提供新的思路。
1 材料和方法
1.1 材料 人宫颈鳞癌细胞系C-33A和Caski均购于中国科学院上海细胞研究所细胞库。DMEM、RPMI-1640培养基购于美国Gibco公司;胎牛血清购于浙江天杭生物科技有限公司;S100A9抗体购于美国Abcam公司;S100A9 siRNA和对照siRNA购于上海吉玛制药技术有限公司;脂质体Lipofectamine 2000购于美国Invitrogen公司;Matrigel购于美国BD公司。
1.2 方法
1.2.1 细胞培养 将Caski细胞加入RPMI-1640培养基,C-33A细胞加入DMEM培养基,置于37℃、5%CO2的培养箱中进行培养。2~3d换1次培养液。
1.2.2 C-33A细胞的病毒转染 C-33A细胞以3×105/ml接种于6孔板,分为未转染组、阴性对照组和转染组。培养24h后,细胞融合至50%~60%,转染组加入重组腺病毒Ad-S100A9,阴性对照组加入空载体Ad-RFP,孵育12h后,换普通培养液继续培养36h,收集细胞进行后续实验。未转染组未予特殊处理。
1.2.3 Caski细胞的siRNA转染 Caski细胞以2×105/ml接种于6孔板,培养24h后,细胞融合至30%~50%,换成无血清的培养基。将稀释好的S100A9 siRNA(5′-CCUUGAACUCUAUCGACGUCUA-3′)与脂质体Lipofectamine 2000轻轻混匀,在室温下放置20min。加入6孔板孵育6h后,换成完全培养基,转染48h后收集细胞进行后续实验,以阴性序列作为阴性对照。
1.2.4 Western blot检测细胞S100A9蛋白的表达 收集各组细胞,用裂解液裂解、超声处理后,采用二喹啉甲酸(BCA)法测定。经12%SDS-PAGE凝胶电泳后转膜。4℃摇床上一抗(S100A9,1∶1 000,Tubulin,1∶2 000)孵育过夜,TBST洗膜10min×3次;在辣根过氧化物酶标记的IgG二抗中室温孵育2h,TBST洗膜10min×3次;均匀滴加曝光液于膜上后,采用Bio-Rad公司的图像摄取系统曝光并保存图像,测得吸光度值,即细胞S100A9蛋白的表达。
1.2.5 Transwell检测细胞迁移能力 各组细胞用无血清培养基重悬后,加入Transwell上室;下室加入含10%血清的完全培养基。孵育24h后取出上室,轻轻擦去上层未穿透的细胞,多聚甲醛固定及结晶紫染色后拍照,计数穿过小孔的细胞数。
1.2.6 Transwell检测细胞侵袭能力 将Matrigel胶稀释后铺于上室,其余步骤同迁移实验。
1.3 统计学处理 应用SPSS17.0统计软件。计量资料呈正态分布,用表示,多组间比较采用单因素方差分析,两组比较采用独立样本t检验。
2 结果
2.1 转染重组腺病毒后C-33A细胞中S100A9蛋白的表达 Western blot结果显示,与未转染组、阴性对照组相比,转染 S100A9重组腺病毒后C-33A细胞中S100A9蛋白的表达明显增强,见图1。

图1 转染S100A9重组腺病毒后C-33A细胞中S100A9蛋白表达的电泳图
2.2 转染S100A9重组腺病毒后C-33A细胞侵袭和迁移能力的变化
2.2.1 C-33A细胞侵袭能力的变化 Transwell检测结果显示,未转染组、阴性对照组和转染组的穿膜细胞数分别为(46.40±3.65)、(46.40±2.70)和(70.40±3.85)个;与未转染组、阴性对照组相比,转染组穿膜细胞数明显增多(均P<0.05);而未转染组与阴性对照组比较差异无统计学意义(P>0.05),见图2。
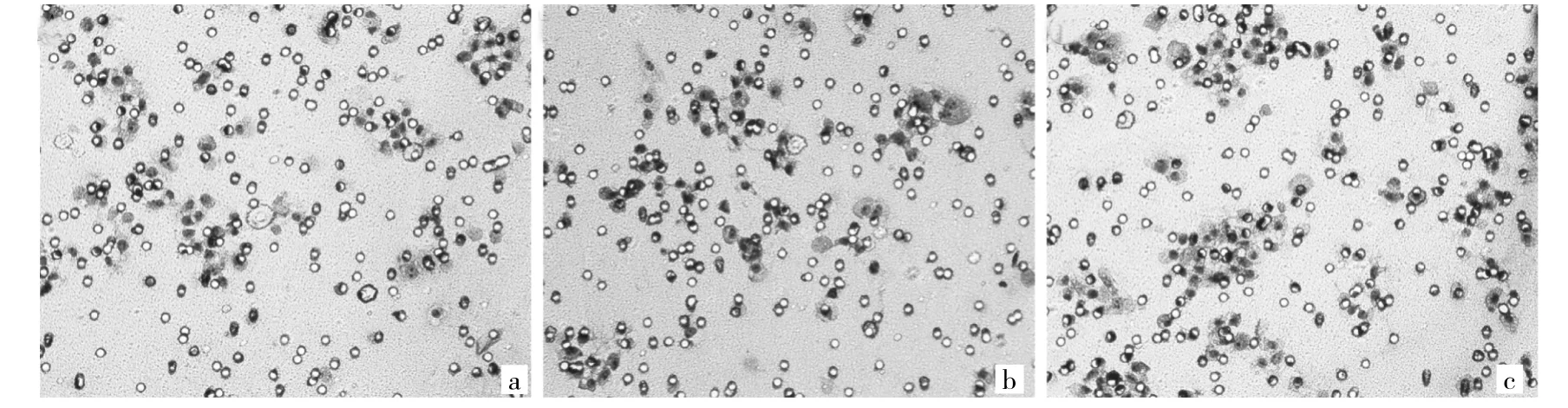
图2 转染S100A9重组腺病毒后C-33A细胞侵袭能力的变化(a:未转染组;b:阴性对照组;c:转染组;×400)
2.2.2 C-33A细胞迁移能力的变化 Transwell检测结果显示,未转染组、阴性对照组和转染组穿过Transwell小室的细胞数分别为(44.40±3.78)、(46.60±3.21)和(70.80±3.70)个,与未转染组、阴性对照组相比,转染组穿过Transwell小室的细胞数明显增多(均P<0.05);而未转染组与阴性对照组比较差异无统计学意义(P>0.05)。
2.3 转染S100A9 siRNA后Caski细胞中S100A9蛋白的表达 Western blot结果显示,与阴性对照组相比,转染S100A9 siRNA后Caski细胞中S100A9蛋白的表达明显降低,见图3。
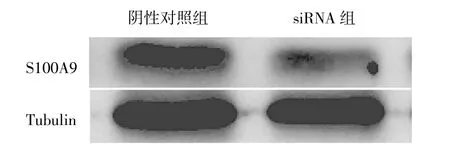
图3 转染S100A9 siRNA后Caski细胞中S100A9蛋白表达的电泳图
2.4 转染S100A9 siRNA后Caski细胞侵袭和迁移能力的变化
2.4.1 Caski细胞侵袭能力的变化 Transwell检测结果显示,siRNA组的穿膜细胞数为(40.20±3.27)个,明显低于阴性对照组的(55.80±4.81)个(P<0.05),见图4。

图4 转染S100A9 siRNA后Caski细胞侵袭能力的变化(a:阴性对照组;b:siRNA组;×400)
2.4.2 Caski细胞迁移能力的变化 Transwell检测结果显示,siRNA组穿过Transwell小室的细胞数为(35.60± 6.80)个,明显低于阴性对照组的(45.60±3.57)个(P<0.05)。
3 讨论
S100A9是一类只存在于脊椎动物中的小分子酸性蛋白[7]。人S100A9位于染色体lq21,此区域稳定性差,容易发生缺失、异位和重叠等,并参与多种恶性肿瘤的发生、发展[8-9]。有文献报道S100A9可抑制胃癌细胞的侵袭与转移[10],但多数研究发现S100A9可促进多种恶性肿瘤的侵袭与转移。Kwon等[11]发现S100A9可通过激活p38 MAPK/NF-κB信号通路,进而促进细胞的侵袭与迁移能力;在前列腺癌[12]、肝细胞癌[13]中,外源性增加S100A9的表达,可激活p38 MAPK/NF-κB信号通路,从而促进细胞的迁移。在宫颈癌中,Zhao等[14]采用基质辅助激光解吸电离飞行时间质谱发现有26个蛋白在正常宫颈组织、CIN和宫颈鳞癌中逐渐升高,其中包括S100A9蛋白。本课题组前期研究亦发现,在正常宫颈组织、CIN、宫颈癌中S100A9的表达逐渐升高[6]。但是,目前关于S100A9对宫颈鳞癌细胞生物学行为的影响尚未明确。
本研究发现转染S100A9重组腺病毒能明显提高C-33A细胞中 S100A9蛋白的表达,转染 S100A9 siRNA能抑制Caski细胞中S100A9蛋白的表达。本实验通过上述方法改变宫颈鳞癌细胞中S100A9的表达,并观察其对细胞侵袭和转移能力的改变。宫颈鳞癌C-33A细胞转染S100A9重组腺病毒,可促进细胞侵袭与转移的能力;宫颈鳞癌Caski细胞转染S100A9 siRNA,可抑制细胞侵袭与转移的能力。以上结果提示S100A9与宫颈鳞癌细胞的侵袭、转移相关,但具体机制和通路有待进一步研究。
[1]Basso D,Bozzato D,Padoan A,et al.Inflammation and pancreatic cancer:molecularand functionalinteractions between S100A8,S100A9,NT-S100A8andTGFβ1[J].CellCommunSignal, 2014,12:20.
[2]Gunaldi M,Okuturlar Y,Gedikbasi A,et al.Diagnostic importance of S100A9 and S100A12 in breast cancer[J].Biomed Pharmacother,2015,76:52-56.
[3]Nepomuceno A I,Shao H,Jing K,et al.In-depth LC-MS/MS analysis ofthe chicken ovarian cancerproteome reveals conserved and novel differentially regulated proteins in humans [J].Anal Bioanal Chem,2015,407(22):6851-6863.
[4]Ebbing J,Mathia S,Seibert F S,et al.Urinary calprotectin:a new diagnostic marker in urothelial carcinoma of the bladder[J].World J Urol,2014,32(6):1485-1492.
[5]Reeb A N,Li W,Sewell W,et al.S100A8 is a novel therapeutic target for anaplastic thyroid carcinoma[J].J Clin Endocrinol Metab,2015,100(2):E232-242.
[6]Zhu X,Jin L,Zou S,et al.Immunohistochemical expression of RAGE and its ligand(S100A9)in cervical lesions[J].Cell Biochem Biophys,2013,66(3):843-850.
[7]Leanderson T,Liberg D,Ivars F.S100A9 as a Pharmacological target molecule in inflammation and cancer[J].Endocr Metab Immune Disord Drug Targets,2015,15(2):97-104.
[8]Srikrishna G.S100A8 and S100A9:new insights into their roles in malignancy[J].J Innate Immun,2012,4(1):31-40.
[9]Lim M Y,Thomas P S.Biomarkers in exhaled breath condensate and serum ofchronicobstructivepulmonarydiseaseandnon-small-cell lung cance[J].International Journal of Chronic Diseases,2013,2013(11suppl):578613.
[10]Choi J H,Shin N R,Moon H J,et al.Identification of S100A8 and S100A9 as negative regulators for lymph node metastasis of gastric adenocarcinoma[J].Histol Histopathol,2012,27(11): 1439-1448.
[11]Kwon C H,Moon H J,Park H J,et al.S100A8 and S100A9 promotes invasion and migration through p38 mitogen-activated protein kinase-dependent NF-κB activation in gastric cancer cells[J].Mol Cells,2013,35(3):226-234.
[12]Hermani A,De Servi B,Medunjanin S,et al.S100A8 and S100A9 activate MAP kinase and NF-kappaB signaling pathways and trigger translocation of RAGE in human prostate cancer cells[J]. Exp Cell Res,2006,312(2):184-197.
[13]Wu R,Duan L,Ye L,et al.S100A9 promotes the proliferation and invasion ofHepG2 hepatocellularcarcinoma cells via the activation of the MAPK signaling pathway[J].Int J Oncol,2013, 42(3):1001-1010.
[14]Zhao Q,He Y,Wang X L,et al.Differentially expressed proteins among normal cervix,cervical intraepithelial neoplasia and cervical squamous cell carcinoma[J].Clin Transl Oncol,2015,17 (8):620-631.
Relationship between S100A9 expression and invasive/metastatic ability of squamous cervical cancer cells
ObjectiveTo investigate the relationship between S100A9 expression and invasive/metastatic ability of squamous cervical cancer cells.MethodsHuman squamous cervical cancer C-33A cells were transfected with S100A9 adenoviral vectors and Caski cells were transfected with S100A9 siRNA.The expression of S100A9 protein was measured by Western blot and the ability of cell invasion and migration was evaluated by Transwell cell assays.ResultsCompared with control groups,S100A9 protein was significantly increased in C-33A cells after transfected with S100A9 adenoviral vectors.The invasion and migration assay showed that the number of cells migrating through the Transwell membrane and chamber were significantly increased after C-33A cells were transfected with S100A9 adenoviral vectors (P<0.05).Compared with control group,the expression of S100A9 was significantly decreased in Caski cells transfected with S100A9 siRNA.In Transwell cell assays,the number of cells migrating through the Transwell membrane and chamber were significantly lower in 100A9 siRNA-transfected Caski cells compared with control group(P<0.05).ConclusionS100A9 may play its role in the invasion and migration of squamous cervical cancer cells.Upregulation of S100A9 promoted invasion and migration of squamous cervical cancer cells,and downregulation of S100A9 reduced invasion and migration of squamous cervical cancer cells.
S100A9 Squamous cervical cancerInvasion Migration
2016-10-05)
(本文编辑:陈丹)
国家自然科学基金资助项目(81372381);浙江省医药卫生平台重点资助计划(2013ZDA016)
325027 温州医科大学附属第二医院妇产科
朱雪琼,E-mail:zjwzzxq@163.com
