高岭土磁性复合材料表面印迹聚合物选择性吸附分离环丙沙星
2017-02-16毛艳丽罗世田吴俊峰康海彦刘彪潘建明霍鹏伟
毛艳丽罗世田吴俊峰康海彦刘彪潘建明霍鹏伟
(1河南城建学院市政与环境工程学院,平顶山467036)
(2平顶山市建设工程质量监督站,平顶山467036)
(3江苏大学化学化工学院,镇江430074)
高岭土磁性复合材料表面印迹聚合物选择性吸附分离环丙沙星
毛艳丽*,1罗世田2吴俊峰1康海彦1刘彪1潘建明3霍鹏伟3
(1河南城建学院市政与环境工程学院,平顶山467036)
(2平顶山市建设工程质量监督站,平顶山467036)
(3江苏大学化学化工学院,镇江430074)
以氨基改性的磁性高岭土为基质材料,利用电子转移产生催化剂的原子转移自由基聚合法制备磁性高岭土表面印迹聚合物(MMIPs)。通过FTIR、TEM、TGA、XRD和VSM等方法对其物理化学性质进行表征,其比表面积112m2·g-1,且具有较好的热稳定性、超顺磁性(Ms=13.365emu·g-1)。吸附性能研究表明,准二级动力学模型能较好地描述MMIPs对环丙沙星(CIP)吸附动力学行为,Langmuir等温模型能较好地拟合MMIPs对CIP的吸附平衡数据,25℃时MMIPs的单分子层吸附容量为89.36mg·g-1。选择性实验研究表明,MMIPs对CIP具有较好地选择识别性。结合高效液相色谱分析技术,MMIPs已成功应用于鲜鱼样品中痕量CIP的分离、富集和回收,CIP的回收率为92.15%。
磁性高岭土;磁性分子印迹材料;环丙沙星;特异性吸附
0 引言
环丙沙星是一种人工合成的新型杀菌性抗菌药物,被广泛用于人类医疗和畜牧养殖业。但目前残留在环境中的抗生素已经成为潜在新型污染物[1]。国内外已有关于在环境和食品样品中检测到不同浓度抗生素的报道[2-4]。残留在环境中的抗生素由于具有较强的生物反应活性、持久性及难生物降解性等特点,对人类和水生、陆生生物产生潜在危害[5]。因此,从复杂的环境基质中有效识别和分离痕量抗生素是一个亟待解决的问题[6]。
表面分子印迹技术通过把分子识别位点建立在基质材料的表面,很好的解决了传统本体聚合高度交联导致的模板分子不能完全去除、结合能力小和质量转移慢、活性位点包埋过深,吸附-脱附的动力学性能不佳等缺点[7]。潘建明等以凹凸棒土[8]、埃洛石纳米管[9]等天然硅基材料作为印迹载体制备表面印迹聚合物,并将其应用于环境中痕量农药、雌激素等污染物的选择性分离/富集。本课题组已经以改性高岭土为基质制备表面分子印迹材料,并将其应用于环境中BPA的分离、富集[10]。天然硅基材料的种类有很多,包括高岭土、凹凸棒土、蒙脱土、和埃洛石纳米管等。高岭土是一种由硅氧四面体、铝氧八面体组成的常见无机层状硅酸盐矿物。具有化学稳定性强、比表面积大、资源丰富、价格低廉等优点[11-13]。本研究以高岭土和磁性纳米粒子耦合得到的磁性复合材料为载体,利用电子转移产生催化剂的原子转移自由基聚合法制备磁性高岭土表面印迹聚合物(MMIPs),用于环境中环丙沙星的选择性识别与分离。
1 实验部分
1.1 试剂
环丙沙星(CIP)、磺胺嘧啶(SD)、四环素(TC)、磺胺二甲嘧啶(SMZ)、甲苯、3-氨丙基三乙氧基硅烷、二氯甲烷、三乙胺、溴代异丁酰溴(2-BIB)、甲基丙烯酸(MAA)、N,N′-亚甲基双丙烯酰胺(MBAA)、苯甲醚、N,N,N′,N″,N″-五甲基二乙烯三胺(PMDETA)、氯化铜(CuCl2)均为分析纯,由阿拉丁试剂有限公司提供。丙酮、乙醇、甲醇等药品为分析纯,由国药集团化学试剂有限公司提供。浓硝酸、乙酸、氯化铜、抗坏血酸(AsAc)是从河南省金硕化学试剂有限公司购买。高岭土由河南省平顶山高岭土矿物有限公司提供。其它化学试剂均为分析纯。
1.2 主要仪器设备
傅立叶变换红外光谱仪(FTIR,NEXUS-470);透射电子显微镜(Transmission Electron Microscopy,TEM),日本产JEOL IEM-200CX型;热重分析仪(Thermogavimetric analyzer,TGA),德国产Netzsch STA 449C型,温度范围为25~800℃,升温速率为5.0℃·min-1;X射线衍射仪(X-ray Diffraction,XRD),德国产Bruker-AXSr D8Advance(Super speed)型,Cu Kα(λ=0.154nm,管压40kV,电流30mA,扫描范围为2θ=20°~80°;样品振动磁强计,VSM 7300, Lakeshore;比表面与空隙度分析仪,美国产NDVA-2000e型;粒度粒型测试仪,荷兰产CIS-100型;原子吸收分光光度计(Atomic Absorption Spectrophotometer,AAS),中国产TBS-990型;紫外可见分光光度计,日本产Shimadzu UV-2450型;高效液相色谱仪,德国产Agilent 1200LC型,20μL注射器,流动相为甲醇和去离子水(25∶75,V/V),流动相速度1.0mL·min-1,温度25℃。
1.3 材料的制备
1.3.1 磁性高岭土复合材料的制备
参照文献[14]采用溶剂热法制备磁性高岭土:称取0.6g六水合氯化铁和5.0g醋酸钠溶解在200mL乙二醇中,随后将3.0g酸活化高岭土加入到乙二醇的混合溶液中,氮气保护下超声分散2.0h。将0.8g聚乙二醇加入到上述分散液。然后把上述分散液倒入100mL高压反应釜中,200℃反应14h,产物用Nd-Fe-B永久磁铁收集,无水乙醇多次洗涤,60℃真空干燥,得到磁性高岭土。
1.3.2 磁性高岭土表面印迹聚合物的制备
称取3.0g磁性高岭土和6.0g 3-氨丙基三乙氧基硅烷(APTES)溶解在200mL甲苯中,90℃下300r·min-1机械搅拌24h,产物用甲苯洗涤后,干燥得到磁性高岭土-NH2。将2.0g磁性高岭土-NH2、30mL二氯甲烷和1.0mL三乙胺依次加入100mL三口烧瓶中。在冰水浴下反应混合物振荡并通氮气30~60min,然后逐滴加入1.0mL 2-BIB,氮气保护下反应12h。得到的产物依次用二氯甲烷、蒸馏水洗涤数次后,在60℃下真空干燥至恒重,得到磁性高岭土@Br。
将1.0g CIP、15mL MAA和150mL MBAA加入到120mL苯甲醚中,随后向上述混合液中迅速依次加入2.0g磁性高岭土@Br、80μL PMDETA、30mg CuCl2和100mg AsAc,上述混合物在氮气保护下,50℃反应24h。所得产物MMIPs用Nd-Fe-B永久磁铁收集,用乙醇和去离子水多次洗涤。最后用甲醇和乙酸为9∶1(V/V)的混合液索氏提取24h,直到洗脱液中检测不到模板分子,60℃真空干燥。非印迹聚合物(MNIPs)只是在合成过程中不加模板分子CIP,其余步骤与上述相同。

图1 磁性高岭土表面印迹聚合物制备流程图Fig.1Preparation diagram of MMIPs
1.4 吸附实验
用1.0mol·L-1HCl和1.0mol·L-1NaOH调节溶液pH值为2.0~11.0,考察pH值对吸附过程的影响。将10mg吸附材料(MMIPs或MNIPs)分散在20mL不同初始浓度(5~400mg·L-1)的CIP溶液中,在25℃恒温水浴静置吸附12h,考察吸附材料的等温吸附;20mL初始浓度为100mg·L-1的CIP水溶液与10mg吸附材料(MMIPs或MNIPs)反应,在25℃恒温静置至所需时间(5.0~120min),考察吸附材料的吸附动力学;上述溶液中MMIPs或MNIPs用Nd-Fe-B分离,取上清液于吸收波长276nm处测定吸光度。吸附率(α)与吸附容量(qe,mg·g-1)根据下式计算。

C0(mg·L-1)和Ce(mg·L-1)分别为CIP的初始浓度和平衡浓度,V(L)和W(g)分别为溶液体积和吸附剂的质量。
实验中获得的动力学数据采用准一级和准二级吸附动力学方程进行拟合[15-16]。准一级吸附动力学方程的线性形式为:

准二级吸附动力学方程的线性形式为:

其中,qe(mg·g-1)和qt(mg·g-1)分别是吸附平衡时和时间t(min)时的吸附容量。k1(min-1)和k2(g·mg-1·min-1)分别为一级和二级速率常数,其相应值可由ln(qeqt)对t及t/qt对t作图所得直线的截距和斜率分别求得。
吸附平衡数据采用Langmuir和Freundlich等温模型进行拟合[17-18]。

式中qe的含义同式4,qm为饱和吸附容量(mg·g-1),Ce为被吸附物质的平衡浓度(mg·L-1),KL为与吸附能有关的常数(L·mg-1)。Kf为与吸附能力有关的常数(g·L-1),n为与温度有关的常数,当n在2~10之间时易于吸附。
1.5 选择性识别研究
将CIP与结构类似的抗生素化合物(如SD、TC和SMZ)配制成混合溶液并作为竞争吸附实验的测试溶液,其中每种抗生素的浓度均为50mg·L-1。在竞争吸附实验中,于10mL配制的抗生素化合物混合溶液中加入10mg MMIPs或MNIPs,调节溶液pH值为6.0,25℃恒温静置4.0h后,MMIPs或MNIPs用Nd-Fe-B永久磁铁分离,吸附后溶液中残留的每种抗生素类化合物的浓度用HPLC测定,并用于计算分配系数Kd(L·g-1)、选择性系数k和相对选择性系数k′。
Kd、k、k′的计算公式分别为:

其中,qe(mg·g-1)和Ce(mg·L-1)分别为抗生素的吸附容量和平衡浓度;Kd(T)和Kd(X)分别为模板分子和竞争性抗生素的分配系数;kMM和kMN分别为MMIPs和MNIPs的选择性系数。
1.6 漏磁实验
将50mg MMIPs分别加入到pH值为2.0~8.0的10mL蒸馏水中,室温静置24h后,用Nd-Fe-B永久磁铁将MMIPs从溶液中分离,用FAAS法测定溶液中铁离子含量。
1.7 实际样品分析
取5.0g鲜鱼样品搅碎成均一样品,然后加入一定量15%(V/V)的三氯乙酸溶液,高速搅拌混合均匀,离心,过滤。上述滤液用CIP溶液定标到50μg· L-1。称取5.0mg MMIPs或MNIPs分散到10mL定标液中,搅拌8.0h。用Nd-Fe-B永久磁铁分离。将捕获CIP的MMIPs(或MNIPs)用3.0mL乙腈除去非特异性吸附,随后用10mL 20%(V/V)甲醇和醋酸的混合液洗涤,并在298K、氮气氛围下干燥。然后残留物用1.0mL甲醇和醋酸混合液溶解,0.45μm滤膜过滤,用于HPLC测定其中CIP的浓度。
2 结果与讨论
2.1 材料的理化性能表征
2.1.1 红外分析
从图2(a)中可知,在1025和985cm-1处的吸收峰分别为高岭土Si-O伸缩振动和Si-O-Si键的伸缩振动[19];在3680和1632cm-1处的吸收峰为高岭土内表面羟基伸缩振动和内层水形变振动的特征峰;从图2(b)中可知,高岭土-NH2在1720cm-1的特征峰表明氨基成功接枝于磁性高岭土,532cm-1处出现了Fe3O4纳米粒子的Fe-O键特征吸收峰[20];从图2(c)中可知,在1725、1265和1160cm-1处出现的较强吸收峰可以分别归为MAA中的碳酰基的伸缩振动、EGDMA酯基中C-O键的对称和不对称伸缩振动[21-22]。
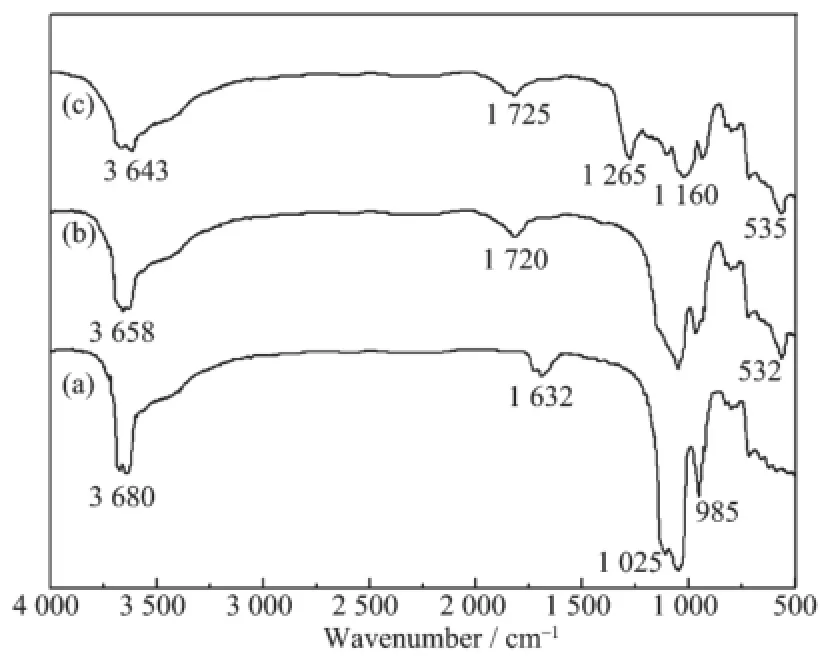
图2 高岭土(a)、磁性高岭土-NH2(b)和MMIPs(c)的红外光谱图Fig.2FTIR spectra of the kaolinite(a),magnetic kaolinite-MPS(b)and MMIPs(c)
2.1.2 TEM和氮气吸附-脱附分析
通过透射电镜从图3a可以看出,所制备的磁性高岭土颗粒分散性良好,呈均匀的球形结构,尺寸在60~170nm之间。图3b为表面印迹聚合物(MMIPs)的透射电镜图。从图中可以看出表面聚合物层的厚度为30~80nm。因此,可以推断出MAA、MBAA能够在氯化铜和配体PMDETA组成的催化体系中发生聚合反应且能够获得比较均一的聚合物层。

图3 磁性高岭土(a)和MMIPs(b)的透射电镜图Fig.3Micrographs from transmission electron microscope of magnetic kaolinite(a)and MMIPs(b)
从表1中可以看出,MMIPs比MNIPs拥有更大的比表面积、孔容和平均孔尺寸。较大的比表面积、孔容和平均孔尺寸将有利于MMIPs对目标物的吸附。
2.1.3 TGA分析
图4分别为磁性高岭土(a)、MMIPs(b)和MNIPs (c)的热重分析图。在初始的200℃内,磁性高岭土、MMIPs和MNIPs热稳定性较好,对应的失重率分别为4.36%、14.77%和17.20%,主要是由于游离水的失重[23]。当温度升至650℃时,MMIPs和MNIPs出现了较大的失重,失重率分别为63.78%和69.28%,这归因于表面印迹聚合层的分解,MMIPs的总损失比MNIPs少了0.84%,可能是MMIPs表面有印迹部分的原因,这与文献[24]结论是一致的。700℃时MMIPs和MNIPs残留的物质主要是热阻性的Fe3O4磁性纳米粒子和少量的碳或石墨。

表1 MMIPs和MNIPs的氮气吸附-脱附分析比较Table 1Comparison of MMIPsand MNIPs from nitrogen adsorption-desorption analysis

图4 磁性高岭土(a)、MMIPs(b)和MNIPs(c)的热重分析图Fig.4Thermogravimetric analysis of magnetic kaolinite (a),MMIPs(b)and MNIPs(c)
2.1.4 XRD分析
在2θ=20°~70°范围内,磁性高岭土、MMIPs和MNIPs均出现了6个分别位于30.78°、35.38°、43.76°、53.82°、57.48°和62.32°处的Fe3O4特征衍射峰。这些峰值分别归属于Fe3O4在(220)、(311)、(400)、(422)、(511)和(440)处的特征峰(PDF No.72-2303)。图中MMIPs与MNIPs的XRD图相似,说明它们具有相似的管壁结构和晶面间距。从图5可以看出,磁性高岭土、MMIPs和MNIPs中均有Fe3O4存在,磁性高岭土(a)的峰尖而高,表明磁性高岭土中Fe3O4拥有最好的晶型。与磁性高岭土比较,MMIPs和MNIPs的XRD图中Fe3O4的峰强发生了不同程度的下降,其原因可能是MMIPs和MNIPs中Fe3O4晶型和含量发生了不同程度的改变。
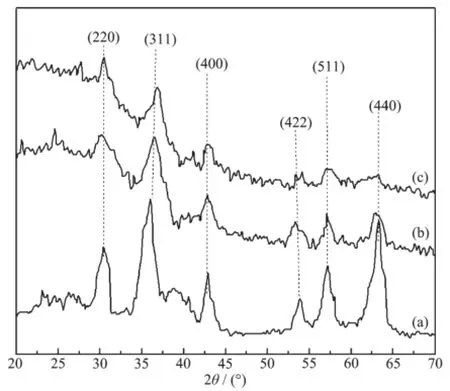
图5 磁性高岭土(a)、MMIPs(b)和MNIPs(c)的XRD图Fig.5XRD patterns of magnetic kaolinite(a),MMIPs(b) and MNIPs(c)
2.1.5 磁性能分析
磁性高岭土和MMIPs的磁性能分析如图6所示。从图6(a)可以看出2条曲线的形状和变化趋势类似,且都是关于原点对称,表明磁性高岭土和MMIPs都具有超顺磁性[25]。室温下磁性高岭土和MMIPs的饱和磁化强度(Ms)分别为13.365emu·g-1和7.533emu·g-1。由6(b)可以看出,MMIPs在水中有良好的分散性和磁分离效能。由图6(c)可知,在pH值为4.0~8.0的范围内,MMIPs中几乎没有铁离子泄漏出来。在pH=2.0时,MMIPs的漏磁量最大,每50mg MMIPs中约有9.156μg铁离子泄漏。
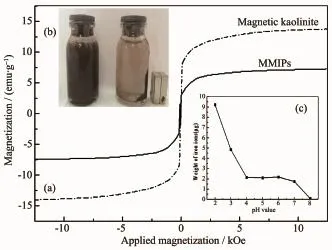
图6 (a)磁性高岭土和MMIPs在室温时的磁滞回线; (b)悬浮在水中(左边)和在外加磁场作用下(右边)MMIPs的照片;(c)pH值对MMIPs磁稳定性的影响Fig.6(a)Magnetization curves of magnetic kaolinite and MMIPs at room temperature;(b)Photograph of MMIPs suspended in water(left)and separated by an external magnet(right);(c)Effect of pH value on the magnetic stability of MMIPs
2.2 pH值对吸附性能的影响
从图7可以看出,当pH值为6时,MMIPs和MNIPs对CIP的吸附容量达到最大,分别为41.45mg·g-1和84.25mg·g-1,这与吸附材料和CIP在不同pH值条件下的表面电荷和分子形态密切相关。CIP分子中含有-NH和-COOH(pKa1=6.18,pKa2=8.76)[26],当pH<pKa1时,CIP的-NH与溶液中H+结合而呈CIPH2+形态,当pH>pKa2时,CIP的-COOH与OH结合而主要以CIP-形态存在。当5<pH<pKa1,MMIPs和MNIP表面带有负电荷有利于吸附CIP,故吸附容量较高;当pH<5.0时,MMIPs和MNIPs对CIP的吸附容量减少,可能与过多的H+与CIP会竞争吸附点位有关;当pH>pKa2时,由于此时CIP在水溶液中主要以CIP-形态存在,二者吸附容量减少。综上,本研究选用pH=6为吸附实验的pH值。

图7 pH值对吸附CIP的影响Fig.7Effect of pH value on adsorption of CIP
2.3 吸附动力学和吸附等温线
图8为MMIPs和MNIPs对CIP的吸附动力学情况(图8(a))及准二级动力学线性拟合曲线(图8(b))。在初始40min内,MMIPs和MNIPs对CIP的吸附率快速增加。60min后,吸附率逐渐趋于动态平衡,在相同吸附时间下,MMIPs对CIP的吸附率高于MNIPs,说明MMIPs具有特殊的结合位点,对模板分子CIP具有吸附特异性。将吸附动力学数据用准一级动力学方程(方程3)和准二级动力学方程(方程4)进行拟合,结果如表2所示。可以看出,MMIPs和MNIPs对CIP的吸附动力学更符合准二级动力学模型。
由图9可以看出,MMIPs和MNIPs对CIP的平衡吸附容量随着CIP平衡浓度的增加,先是迅速增加然后缓慢增加。在同等条件下,MMIPs对CIP的吸附容量明显大于MNIPs,这可能归因于MMIPs比MNIPs拥有更大的比表面积、孔容以及MMIPs具有对模板分子的结合位点[27]。
图9中吸附平衡数据分别用方程式5和6拟合所得参数见表3。从表3可以看出,Langmuir等温模型能较好的拟合MMIPs和MNIPs对CIP的吸附平衡数据,可以推断MMIPs对CIP的吸附是单分子层吸附,最大单分子层吸附容量89.36mg·g-1。

图8 (a)MMIPs和MNIPs吸附动力学数据;(b)准二级动力学模型线性回归拟合Fig.8(a)Adsorption kinetic curves of MMIPs and MNIPs;(b)Pseudo-second-order rate equation for CIP adsorption on MMIPs and MNIPs using linear regression

图9 MMIPs和MNIPs对CIP的吸附等温线Fig.9Adsorption isotherms for CIP adsorption on MMIPs and MNIPs
2.4 选择性研究
由表4数据表明,与MNIPs相比MMIPs的Kd、k值显著增加,这是因为印迹材料表面有具有识别能力的专一性结合位点,使MMIPs对CIP具有选择识别能力。k′值表明,MMIPs对CIP的选择能力是MNIPs的7.728~11.568倍。

表2 MMIPs和MNIPs的动力学常数Table 2Kinetic constants for MMIPs和MNIPs

表3 MMIPs和MNIPs吸附CIP的等温吸附常数Table 3Adsorption isotherm constants for CIP adsorption onto MMIPs和MNIPs
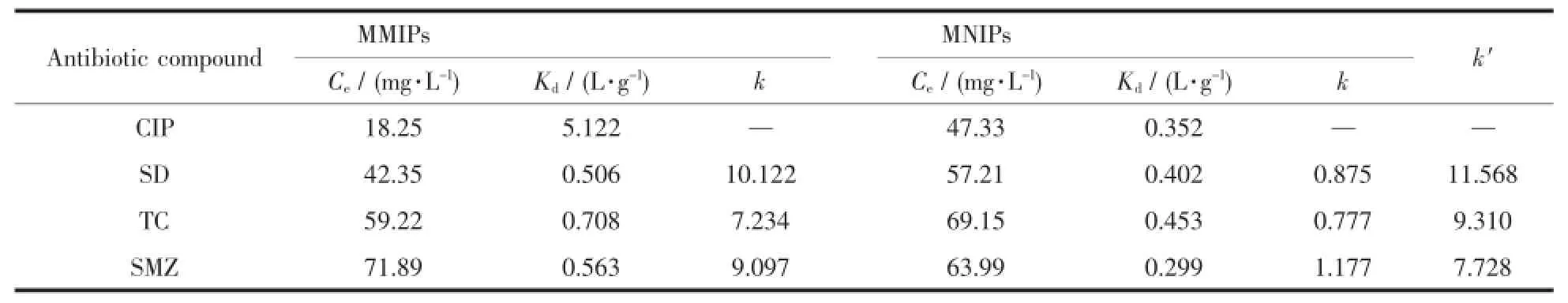
表4 分配系数、选择性系数和相对选择性系数数据Table 4Distribution coefficients and selectivity coefficients,relative selectivity coefficients
2.5 实际样品分析
图10给出了加标鲜鱼样品(a)、MMIPs(b)和MNIPs(c)提取样品后溶液的高效液相色谱图。如图10(a)所示,加标的鲜鱼样品中,由于目标分子CIP浓度较低,没有被检测出。经过MMIPs和MNIPs分离富集,富集倍数为28.5。如图10(b)和(c)所示,5.6min处均有CIP色谱峰,MMIPs检测出的CIP峰值明显高于MNIPs,主要是由于MMIPs对模板分子的特殊识别性。鲜鱼样品中的CIP的加标回收率为92.15%。结果表明,本实验所制备的MMIPs能够有效分离富集环境样品中痕量CIP。

图10 定标鲜鱼样品溶液(a)、用MNIPs提取后的样品溶液(b)、用MMIPs提取后的样品溶液(c)的高效液相色谱图Fig.10HPLC-UV chromatograms of CIP obtained from spiked fish samples(a),extraction with MNIPs(b) and extraction with MMIPs(c)
3 结论
以氨基改性的磁性高岭土为基质材料,CIP为模板分子,MAA为功能单体,MBAA为交联剂,催化剂CuCl2和配体PMDETA为催化体系,AsAc为还原剂,利用电子转移产生催化剂的原子转移自由基聚合法制备磁性高岭土表面印迹聚合物(MMIPs)。该材料具有良好的热稳定性、超顺磁性和磁稳定性,对CIP具有较好的选择识别性能,实验范围内对CIP单分子层吸附容量为89.36mg·g-1。所制备的材料已经成功应用于环境样品中痕量CIP的分离、富集与检测。
[1]Sarmah A K,Meyer M T,Boxall A B A.Chemosphere,2006, 65(5):725-759
[2]Li W H,Shi Y L,Gao L H,et al.Chemosphere,2012,89(11): 1307-1315
[3]Reemtsma T,Weiss S,Müller J,et al.Environ.Sci.Technol., 2006,40(17):5451-5458
[4]Kumar R R,Lee J T,Cho J Y.J.Korean Soc.Appl.Biol.Chem.,2012,55(6):701-709
[5]GAN Xiu-Mei(甘秀梅),YAN Qing(严清),GAO Xu(高旭), et al.Environ.Sci.(环境科学),2014,35(5):1817-1823
[6]Fernández F,Pinacho D G,Gratacós-Cubarsí M,et al.Food Chem.,2014,157C:221-228
[7]Gao B J,Wang J,An F Q,et al.Polymer,2008,49(5):1230-1238
[8]Pan J M,Wang B,Dai J D,et al.J.Mater.Chem.,2012,22(8):3360-3369
[9]Pan J M,Yao H,Xu L C,et al.J.Phys.Chem.C,2011,115(13):5440-5449
[10]Mao Y L,Kang H Y,Guo Y F.Desalin.Water Treat.,2016, 57(9):3947-3956
[11]Alagha L,Wang S Q,Yan L J,et al.Langmuir,2013,29:3989-3998
[12]Turhan Y,Dogˇan M,Alkan M.Ind.Eng.Chem.Res.,2010, 49:1503-1513
[13]Karaogˇlu M H,Dogˇan M,Alkan M.Ind.Eng.Chem.Res., 2010,49:1534-1540
[14]Deng H,Li X,Peng Q,et al.Angew.Chem.Int.Ed.,2005, 44(18):2782-2785
[15]Dai J D,Zhou Z P,Zhao C Y,et al.Ind.Eng.Chem.Res., 2014,53(17):7157-7166
[16]LIU Jing-Liang(刘景亮),ZONG En-Ming(宗恩敏),CHEN Huan(陈欢),et al.Chinese J.Inorg.Chem.(无机化学学报),2015,31(6):1105-1111
[17]Anbia M,Haqshenas M.Int.J.Environ.Sci.Technol.,2015, 12:2649-2664
[18]ZHENG Guang-Wei(郑广伟),DU Yu-Cheng(杜玉成),HOU Rui-Qin(侯瑞琴),et al.Chinese J.Inorg.Chem.(无机化学学报),2015,31(5):930-938
[19]YAO Chao(姚超),ZENG Yong-Bin(曾永斌),CAO Yan-Yuan (曹燕媛),et al.J.Chin.Ceram.Soc.(硅酸盐学报),2010,38(4):671-677
[20]Zhu H Y,Jiang R,Xiao L,et al.J.Hazard.Mater.,2010, 179(1/2/3):251-257
[21]Zou X H,Pan J M,Ou H X,et al.Chem.Eng.J.,2011,167(1):112-121
[22]Yoshimatsu K,Reimhult K,Krozer A,et al.Anal.Chim. Acta,2007,584(1):112-121
[23]Feng B,Hong R Y,Wang L S,et al.Colloids Surf.A,2008, 328(1/2/3):52-59
[24]Ren Y M,Ma W Q,Ma J,et al.J.Colloid Interface Sci., 2012,367(1):355-361
[25]Wang X,Wang L Y,He X W,et al.Talanta,2009,78(2): 327-332
[26]Vasudevan D,Bruland G L,Torrance B S,et al.Geoderma, 2009,151(3/4):68-76
[27]Li X X,Pan J M,Dai J D,et al.Chem.Eng.J.,2012,198-199:503-511
Selective Adsorption and Separation of Ciprofloxacin by Molecularly Imprinted Polymers Based on Magnetic Kaolinite Composites
MAO Yan-Li*,1LUO Shi-Tian2WU Jun-Feng1KANG Hai-Yan1LIU Biao1PAN Jian-Ming3HUO Peng-Wei3
(1School of Municipal and Environmental Engineering,Henan University of Urban Construction,Pingdingshan,Henan 467036,China)
(2Construction Engineering Quality Supervise Station of Pingdingshan Construction Commmittee,Pingdingshan,Henan 467036,China)
(3School of Chemistry and Chemical Engineering,Jiangsu University,Zhenjiang,Jiangsu 212013,China)
Based on the magnetic kaolinite-MPS,magnetic molecularly imprinted particles(MMIPs)were further synthesized via activators regenerated by electron transfer atom transfer radical polymerization(AGET ATRP). The as-prepared MMIPs were charcterized by FTIR,TEM,XRD,TGA and VSM,which indicated that the MMIPs exhibited magnetic sensitivity(Ms=13.365emu·g-1),thermal stability and the larger specific surface area (112m2·g-1).The results of batch adsorption experiments suggested that pH value of 6.0in testing solution was the optimal adsorption condition.The kinetic properties of MMIPs were well described by the pseudo-secondorder model.The Langmuir isotherm model was fitted to the equilibrium data,and the monolayer adsorption capacity of MMIPs at 25℃was 89.36mg·g-1.The selective recognition experiments demonstrated high affinity and selectivity of MMIPs towards ciprofloxacin(CIP)over competitive antibiotics.Combined with high performance liquid chromatographic analysis technology,the prepared MMIPs were successfully applied to extract trace CIP in fish samples,and the recoveries of CIP was 92.15%.
magnetic kaolinite;magnetic molecularly imprinted particles;ciprofloxacin;specific adsorption
TB333
A
1001-4861(2017)01-0081-08
10.11862/CJIC.2017.007
2016-07-10。收修改稿日期:2016-11-11。
国家自然科学基金(No.51509083)、中国博士后青年基金(No.2011M500870)、河南省科技攻关项目(No.152102210094)和河南省高等学校重点科研项目(No.16A610005)资助。
*通信联系人。E-mail:myanliao@163.com;Tel:13721877188
