苹果异三聚体G蛋白α亚基基因MdGPA1的克隆及功能鉴定
2017-02-16李睿安建平由春香王小非郝玉金
李睿,安建平,由春香,王小非,郝玉金
(山东农业大学园艺科学与工程学院/作物生物学国家重点实验室/农业部黄淮地区园艺作物生物学与种质创制重点实验室,山东泰安 271018)
苹果异三聚体G蛋白α亚基基因MdGPA1的克隆及功能鉴定
李睿,安建平,由春香,王小非,郝玉金
(山东农业大学园艺科学与工程学院/作物生物学国家重点实验室/农业部黄淮地区园艺作物生物学与种质创制重点实验室,山东泰安 271018)
【目的】异三聚体G蛋白(Heterotrimeric G protein)作为植物生物体内重要的信号转导分子,在感受外界环境刺激、参与植物抗逆反应和跨膜信号转导等方面发挥着重要作用。克隆异三聚体G蛋白α亚基基因MdGPA1,并在烟草中过量表达MdGPA1,对其进行生物学功能鉴定和生理指标分析,为多年生木本植物响应环境因子信号转导过程中的分子机理研究提供参考。【方法】本研究以‘嘎拉’苹果(Malus × domestica ‘Royal Gala’)为研究试材,利用同源序列比对和PCR技术,克隆获得MdGPA1。使用MEGA5.0构建GPA1物种间系统进化树;利用qRT-PCR方法检测该基因在苹果受非生物胁迫诱导表达及组织特异性表达情况。构建MdGPA1植物过表达载体,通过农杆菌介导法转化烟草叶片,比较干旱胁迫条件下野生型和转基因株系的表型与生理指标,验证MdGPA1在植物干旱胁迫条件下的生物学功能。【结果】克隆得到苹果异三聚体G蛋白α亚基基因MdGPA1(基因序列号:MDP0000881842),该基因长为1 173 bp,编码390个氨基酸。进化树分析表明MdGPA1与白梨PbGPA1亲缘关系最近,同源性最高。基因表达分析显示MdGPA1主要在叶片中表达,在根系中的表达量次之,在茎和果实中的表达量较低。定量分析表明,该基因参与干旱、低温和盐等非生物逆境胁迫响应,在150 mmol·L-1NaCl、150 mmol·L-1甘露醇、10% PEG和4℃胁迫条件下表达量明显下调,在5% H2O2胁迫处理下表达量明显上调。在烟草中过量表达MdGPA1,发现MdGPA1转基因烟草表现出对干旱敏感的表型特征,其叶片鲜重、叶绿素含量以及脯氨酸含量明显低于野生型烟草。在地下部,MdGPA1转基因烟草同样表现出对干旱敏感的表型特征;其根系形态相比于野生型较小,干重也明显低于野生型。【结论】MdGPA1参与了植物感受外界环境刺激的过程,对干旱、低温和盐等非生物逆境胁迫都存在着不同程度的响应。在烟草中异源表达MdGPA1后,提高了烟草对干旱的敏感性,转基因烟草表现出不耐干旱的表型,受干旱胁迫比野生型烟草更为严重,说明MdGPA1在响应植物抗旱胁迫中起着负调控作用。
苹果;异三聚体G蛋白;MdGPA1;表达分析;功能鉴定
0 引言
【研究意义】异三聚体 GTP结合蛋白(Heterotrimeric GTP binding proteins),又名G蛋白,是细胞质膜信号传递组分中重要的组成部分,在跨膜信号转导途径起着非常重要的作用[1]。因此,研究G蛋白有助于了解植物响应外界环境的分子机制,为果树基因工程遗传改良、获得抗逆新品种提供参考。【前人研究进展】G蛋白由Gα、Gβ、Gγ三个亚基构成[2],其中 G蛋白 α亚基在信号转导过程中发挥主导作用,且G蛋白α亚基基因GPA1最先在拟南芥中被克隆[3]。在植物中,G蛋白参与的跨膜信号转导途径是一种保守且常见的作用机制[4]。G蛋白的主要作用是转导胞外信号并产生第二信使激活下游的效应器,形成跨质膜的胞内信使系统[5]。研究表明,G蛋白可以影响K+通道和ABA信号。WANG等[6]发现野生型拟南芥中常见的由ABA抑制K+内流的效应在Gα亚基基因缺失突变体GPA1中消失,表明K+通道可能与有活性的G蛋白相关联。PANDEY等[7]用免疫共沉淀技术发现Gα与GCR1可以在体外结合,提示Gα和GCR1的结合可能参与了ABA调控气孔运动的信号传递过程。进一步研究表明 G蛋白参与了植物体内许多信号转导过程,包括调节根系发育[8],影响气孔运动[9],参与植物光信号反应[10],调控细胞周期[11],参与激素应答等[12]。这些都对植物的生长、发育、分化和抗逆等方面起着重要作用。此外,植物 G蛋白信号转导的基本模式也已经被发现,与哺乳动物类似,都是通过调节与Gα亚基结合的鸟苷酸分子的状态来调节G蛋白的活性[13]。相关研究表明,Gα几乎在植物所有组织中都有表达,只是在不同组织或发育阶段有所差异[14]。Gα在导管和筛管中大量表达,这表明Gα有可能参与了物质摄取过程的信号转导。进一步说明了 G蛋白在植物生长发育中具有十分广泛的功能。有关G蛋白的研究开始较早,在G蛋白结构、受体及其效应器之间的作用机制等方面取得了许多研究结果。但是由于植物细胞中广泛存在信号之间的串扰,使得专一研究 G蛋白系统信号转导过程变得较为困难[15]。所以,植物 G蛋白信号转导的一般规律仍需进一步研究。【本研究切入点】虽然目前关于 G蛋白已有大量研究,但主要集中在拟南芥、水稻[16]、番茄等植物。在多年生木本果树中的相关研究鲜有报道。【拟解决的关键问题】以‘嘎啦’苹果(Malus×domestica‘Royal Gala’)为材料,通过基因克隆获得苹果异三聚体 G蛋白 α亚基基因MdGPA1,并对其进行生物信息学和转基因分析,运用分子生物学手段验证MdGPA1在苹果响应环境因子过程中的重要作用。
1 材料与方法
试验于2015—2016年在山东农业大学园艺科学与工程学院进行。
1.1 材料收集与处理
本试验所用到的植物材料有嘎拉(Malus× domestica‘Royal Gala’),野生型烟草NC89(Nicotiana tabaccum L. cv. ‘NC89’)。10年生‘嘎啦’苹果种植在山东果树科学研究所的果树试验田(山东泰安)。2015年4月开始,分别对‘嘎啦’苹果当年新生长的根、幼茎、新生叶、初花时的花和花后30 d的幼果取样,取样后用液氮速冻保存。分别用低温(4℃)、NaCl(150 mmol·L-1)、甘露醇(150 mmol·L-1)、10% PEG、5% H2O2处理生长两周、长势一致的‘嘎啦’组培苗,以正常生长的‘嘎啦’组培苗作为对照,6 h后取样,用液氮冷冻备用。
1.2 MdGPA1的克隆与同源性分析
根据在苹果基因组数据库中检索到的序列设计引物(表1),以‘嘎拉’组培苗的cDNA为模板进行PCR扩增。PCR扩增反应条件:95℃预变性10 min,95℃变性40 s,56℃退火40 s,72℃延伸2 min,34次循环,72℃后延伸2 min。PCR产物用1.5%的琼脂糖凝胶进行电泳并回收目的条带,连接到 pMD18-T克隆载体进行测序。根据扩增到的DNA序列,从NCBI数据库(http://www.ncbi. nlm. nih. gov/)中检索并下载对应的其他物种的核酸和蛋白序列。通过MEGA5.0软件构建Neighbor-Joining系统进化树。
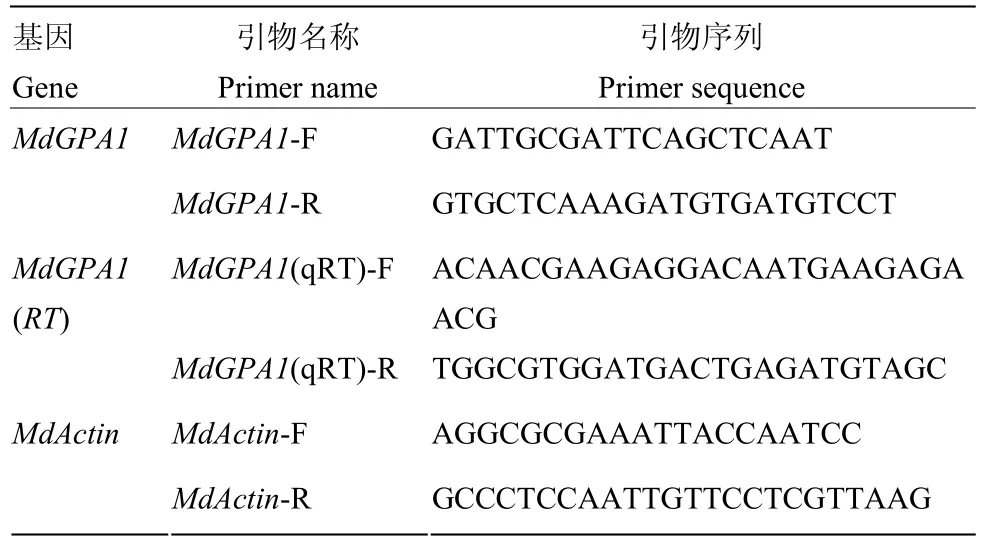
表1 本研究中所用的引物Table 1 Primers used in this study
1.3 总RNA的提取以及实时荧光定量PCR分析
苹果各组织的RNA以及转基因烟草的RNA提取采用康为世纪科技有限公司的全能型植物 RNA提取试剂盒(DNase I)。以提取的总RNA为模板,利用Clontech SMARTTM Library反转录试剂盒合成cDNA第 1链。选取 MdActin(GenBank accession number CN938024)为内参基因。用Ultra SYBR Mixture(with ROX)试剂盒(康为世纪)进行实时荧光定量 PCR分析。荧光定量PCR使用的仪器为BIO-RAD IQ5,所有PCR反应都设3次重复。PCR反应体系为:2× UltraSYBR Mixture 10.0 μL,上游引物(10 μmol·L-1)1.0 μL,下游引物(10 μmol·L-1)1.0 μL,cDNA 1.0 μL。加去离子水至20 μL。PCR反应程序为:94℃预变性10 min,94℃变性15 s,56℃退火15 s,65℃延伸10 s,40个循环;每次循环第2步进行荧光采集。最后采用2-ΔΔCT法进行定量数据分析。
1.4 载体构建及烟草转化和鉴定
转基因烟草通过侵染烟草叶片的方法获得。将野生型烟草切成小块,放置在预培养培养基(MS培养基+3 mg·L-16-BA+0.2 mg·L-1NAA)上培养1—2 d。通过农杆菌介导的遗传转化侵染烟草叶片;随后,将叶片转移至筛选培养基(MS培养基+3 mg·L-16-BA+0.2 mg·L-1NAA+100 mg·L-1潮霉素+500 mg·L-1头孢霉素)。PCR检测获得阳性转基因植株,收取种子,播种后选择长势一致的植株进行表型观察。
1.5 转基因烟草干旱处理及生理指标测定
1.5.1 转基因烟草干旱处理与表型观察 选择 3周左右、生长状态一致的野生型和MdGPA1转基因烟草进行干旱处理。连续干旱处理20 d后,观察植株生长状态,复水3 d后,观察植株生长状况并拍照。
1.5.2 转基因烟草生理指标测定
1.5.2.1 烟草叶片叶绿体色素提取 称取剪碎的烟草叶片,放入研钵中,加少量石英砂和碳酸钙粉及2—3 mL 96%乙醇研成匀浆。用滤纸过滤匀浆到棕色容量瓶中,并用乙醇定容。以96%乙醇为空白,在波长652 nm下测定提取液光密度。利用公式计算叶绿体色素含量。
叶绿素总量浓度CT=(D625×1000)/34.5
叶绿体色素含量=(CT×提取液体积×稀释倍数)/样品鲜重
1.5.2.2 烟草叶片脯氨酸含量测定 脯氨酸含量测定采用横基水杨酸比色法:取50—100 mg剪碎的烟草叶片,置于10 mL EP管中,加入5 mL 3%磺基水杨酸溶液,沸水浴10 min。冷却至室温后吸取上清液2 mL,加入2 mL冰乙酸,3 mL 2.5%酸性茚三酮溶液显色液(冰乙酸和6 mol·L-1磷酸以3﹕2比例配制,两日内有效)。振荡均匀后沸水浴40 min,加入5 mL甲苯萃取红色物质,测定520 nm波长处的吸光度。将吸光度代入标准曲线,即可计算样品提取液中的脯氨酸浓度。利用公式计算样品中脯氨酸含量百分数。
脯氨酸(μg·g-1FW)=提取液中脯氨酸浓度×提取液总体积/(测定时所吸取体积×样品重)
1.6 数据分析
使用 SPSS 22.0数据分析软件,进行单因素ANOVA方差分析比较叶片鲜重、叶绿素含量、脯氨酸含量和根系干重。当差异P<0.05和P<0.01时,有统计学意义。所有试验均重复3次。
2 结果
2.1 苹果MdGPA1克隆及进化树分析
以‘嘎拉’组培苗的cDNA为模板,RT-PCR克隆到一条大约1 000 bp的条带。对克隆得到的片段进行回收测序分析。分析结果表明,目的基因片段含有一个完整的开放阅读框,长度为1 173 bp。该基因编码390个氨基酸,命名为MdGPA1。这是从苹果中分离到的第一个G蛋白α亚基基因。
将苹果MdGPA1氨基酸序列与白梨、梅、桃、拟南芥、烟草等16种不同植物的GPA1氨基酸序列比对构建进化树。进化树分析结果表明,苹果MdGPA1与白梨PbGPA1亲缘关系最近,同源性最高(图1)。
2.2 苹果MdGPA1的表达分析
qRT-PCR分析MdGPA1在10年生‘嘎啦’苹果不同器官中的表达情况。结果表明,MdGPA1在苹果叶片中的表达量最高,在根中的表达量次之,在茎与果实中的表达量相对较低(图2)。
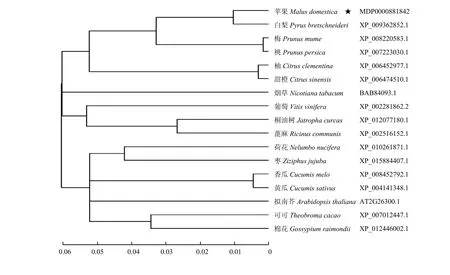
图1 MdGPA1与其他植物GPA1蛋白的系统进化树Fig. 1 Phylogenetic tree constructed using MdGPA1 and GPA1 proteins of other plants
分别用 NaCl(150 mmol·L-1)、甘露醇(150 mmol·L-1)、10% PEG、5% H2O2、低温(4℃)处理‘嘎啦’组培苗6 h,检测植株中MdGPA1的相对表达量。结果表明,在 NaCl、甘露醇、PEG、4℃胁迫条件下,MdGPA1的表达量明显下调,其中在NaCl胁迫条件下MdGPA1下调最明显,甘露醇胁迫次之。在H2O2胁迫处理下,MdGPA1表达量明显上调(图3)。
2.3 载体构建与转基因烟草鉴定
用Pst I和BamH I限制性内切酶分别对pMD18-T中间载体和pCAMBIA-1300表达载体进行酶切反应,将酶切产物回收后在16℃进行连接反应。连接产物转化大肠杆菌感受态细胞。成功筛选到阳性克隆,获得MdGPA1-pCAMBIA-1300植物过表达载体(图4)。
将构建的 MdGPA1过表达载体转化农杆菌LBA4404,进而用筛选到的阳性农杆菌侵染烟草叶片,通过PCR鉴定MdGPA1转基因烟草(图5-A),并通过半定量RT-PCR检测MdGPA1转基因烟草表达水平(图5-B)。获得L1、L3和L4三个转基因株系(图5)。
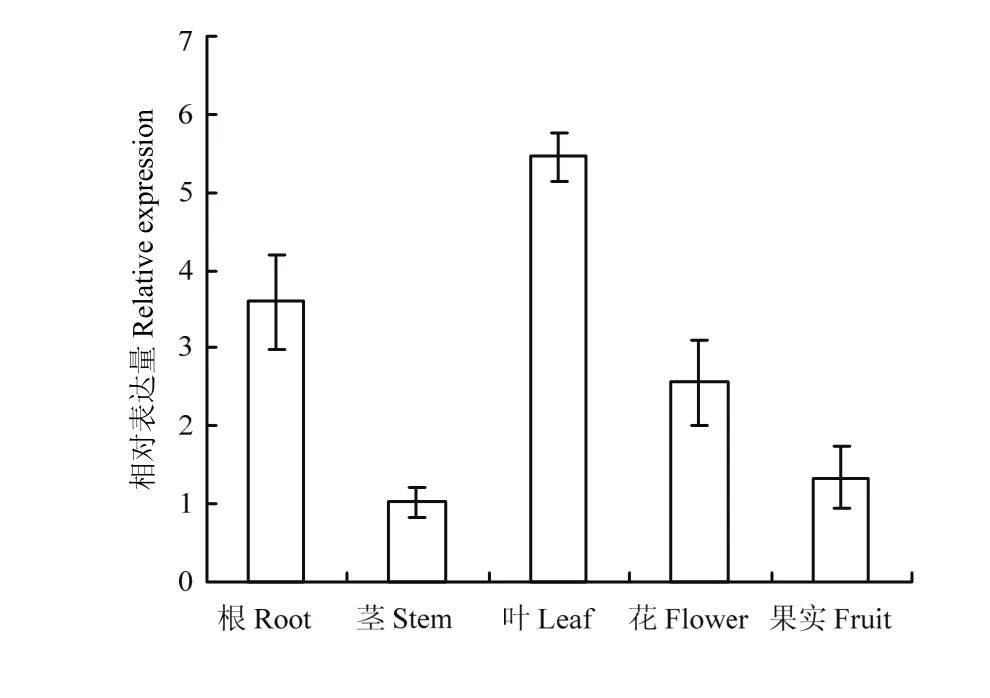
图2 MdGPA1在苹果不同器官中的相对表达量Fig. 2 Relative expression of MdGPA1 in different organs of apple
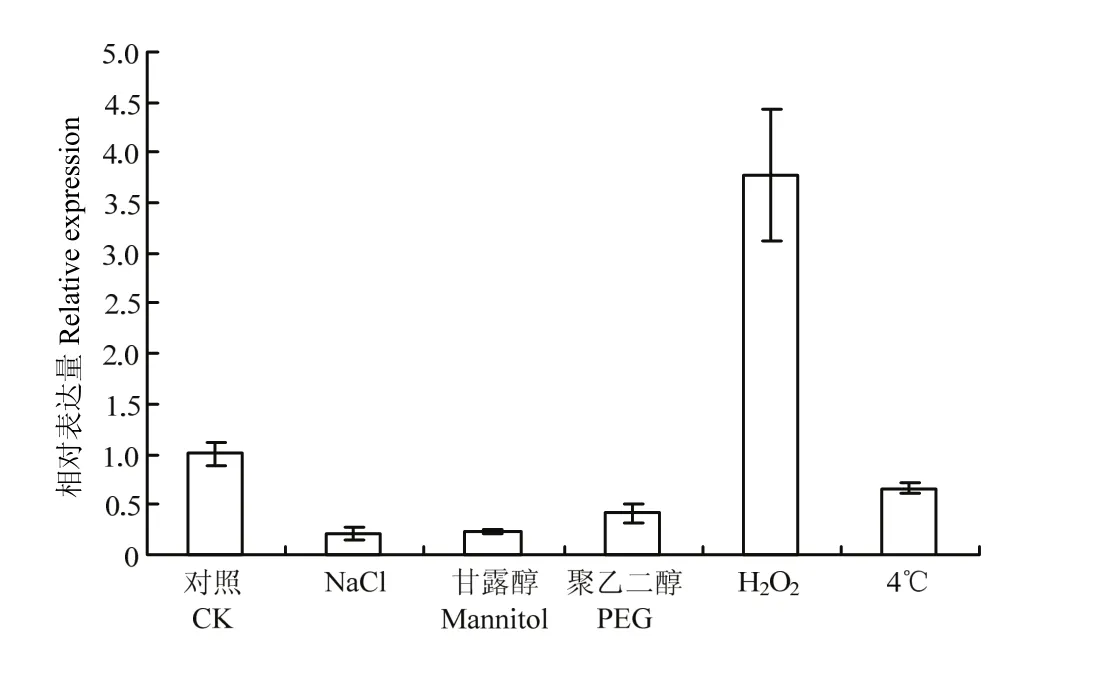
图3 MdGPA1在不同逆境条件下的相对表达量Fig. 3 Relative expression of MdGPA1 in response to various stresses
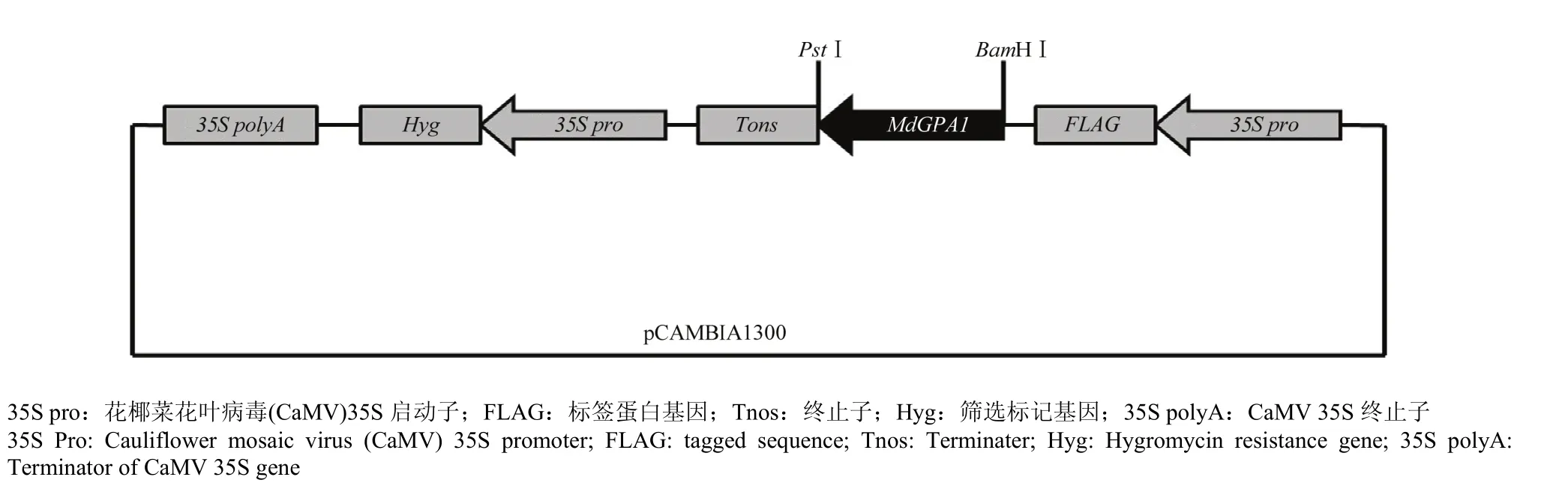
图4 MdGPA1-pCAMBIA-1300结构示意图Fig. 4 Schematic diagram of the MdGPA1-pCAMBIA-1300 structure
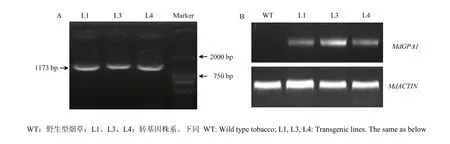
图5 转基因烟草鉴定(A)及MdGPA1表达水平检测(B)Fig. 5 Identification of transgenic tobacco (A) and detection of MdGPA1 expression in transgenic tobacco (B)
2.4 过量表达MdGPA1基因提高烟草对干旱的敏感性
同时干旱处理野生型烟草和MdGPA1 T1代转基因烟草。20 d后转基因烟草表现出更为严重的萎蔫,而野生型烟草仅出现部分萎蔫性状(图 6)。对干旱处理的烟草进行复水,3 d后,野生型烟草恢复正常生长状态,而MdGPA1过量表达的烟草仍然保持萎蔫状态,无法恢复。为了进一步分析,对复水处理后烟草的鲜重、叶绿素含量以及脯氨酸含量进行了统计。结果显示,干旱处理后的MdGPA1转基因烟草的叶片鲜重、叶绿素含量以及脯氨酸含量均显著低于野生型(图 6)。同时,对根系的观察结果表明干旱处理后MdGPA1转基因烟草根系的形态与干重(图 7)都显著小于野生型。以上结果说明MdGPA1转基因烟草对干旱胁迫更加敏感,过量表达MdGPA1基因降低了烟草的抗旱能力。
3 讨论
植物所生长的环境是动态变化的,所以植物必须能够感受外界环境刺激,并对外界环境产生响应。G蛋白是细胞质膜上重要的跨膜信号转导分子,将胞外信号转导为胞内信号,并激活下游相应的效应器。虽然其在植物体内的编码基因相对于动物较少,但它却在植物体内发挥了重要作用[12]。对于G蛋白已有大量较为深入的研究。前人研究结果表明,G蛋白参与植物多个信号转导过程,包括响应植物体内的激素信号与糖信号[11];参与调控气孔运动和离子通道[17];参与植物对病原体的防卫[18];参与植物光信号转导[19]等。G蛋白同样可以调控植物的形态发育,包括影响植物侧根的生长[20],花和果荚的形成[21],花粉管的发育[22],叶片的形态[23]和下胚轴的长度[24]。

图6 野生型和MdGPA1转基因烟草干旱处理(A)及其叶片鲜重(B)、叶绿素含量(C)、脯氨酸含量测定(D)Fig. 6 Drought treatment of wild type and transgenic tobacco (A) and the measurement on fresh weight (B), chlorophyll content (C) and proline content (D) of wild type and transgenic tobacco

图7 野生型和MdGPA1转基因烟草干旱处理后根系形态(A)和根系干重(B)Fig.7 Root morphology (A) and dry weight (B) of wild type and transgenic tobacco after drought treatment
G蛋白α亚基作为最先被克隆出来的G蛋白亚基,在G蛋白参与的信号转导过程中起到了关键作用,在植物体内几乎所有组织中都有表达。CHOUDHURY等[25]研究发现G蛋白α亚基基因GPA1影响植物节间发育。ULLAH等[26]在拟南芥中过量表达GPA1,增强了拟南芥对GA的敏感性,推测GPA1可能参与GA信号转导途径进而影响种子萌发。WARPEHA等[27]发现GCR1、GPA1、PRN1、NF-Y信号链能够参与植物的蓝光响应。ZHANG等[28]发现激活GPA1能够通过叶绿体蛋白酶 FtsH抑制叶绿体的形成。NILSON等[29]通过试验验证了 GPA1能够调控植物的蒸腾效率。CHAKRABORTY等[30]最近研究结果表明GPA1调控的基因参与了多达79个生物学过程,包含了生物与非生物胁迫[31]、植物发育、类黄酮的生物合成、硝酸盐和磷酸盐响应等过程。结合本研究结果表明,G蛋白作为植物体内非常重要的跨膜信号转导蛋白,在将胞外信号转为胞内信号过程中扮演着极其关键的角色。GPA1的过量表达,会导致植物对干旱胁迫的过度响应。
4 结论
克隆获得了MdGPA1,该基因编码390个氨基酸。进化树分析表明苹果MdGPA1与白梨PbGPA1亲缘关系最近。定量表达分析结果显示MdGPA1在苹果根、茎、叶、花和果实中均有表达,并且在叶中表达量最高;MdGPA1受多种胁迫响应,在NaCl、甘露醇、PEG、4℃胁迫条件下表达量明显下调,在H2O2胁迫处理下表达量明显上调;MdGPA1转基因烟草表现出对干旱敏感的表型特征,表明MdGPA1在响应植物抗旱胁迫中发挥着重要的负调控作用。
[1] 朱莺, 黄继荣. 植物异三聚体 G蛋白研究进展. 植物生理学通讯, 2010(4): 309-316.
ZHU Y, HUANG J R. Research progress in plan of heterotrimeric G protein. Chinese Plant Physiology Communications, 2010(4): 309-316. (in Chinese)
[2] ASSMANN S M. Heterotrimeric and unconventional GTP binding proteins in plant cell signaling. The Plant Cell, 2002, 14(suppl. 1): S355-S373.
[3] MA H, YANOFSKY M F, MEYEROWITZ E M. Molecular cloning and characterization of GPA1, a G protein alpha subunit gene from Arabidopsis thaliana. Proceedings of the National Academy of Sciences of the USA, 1990, 87(10): 3821-3825.
[4] JONES J C, DUFFY J W, MACHIUS M, TEMPLE B R, DOHLMAN H G, JONES A M. The crystal structure of a self-activating G protein α subunit reveals its distinct mechanism of signal initiation. Science Signaling, 2011, 4(159): ra8.
[5] MILLNER P A. Heterotrimeric G-proteins in plant cell signaling. New Phytologist, 2001, 151(1): 165-174.
[6] WANG X Q, ULLAH H, JONES A M, ASSMANN S M. G protein regulation of ion channels and abscisic acid signaling in Arabidopsis guard cells. Science, 2001, 292(5524): 2070-2072.
[7] PANDEY S, ASSMANN S M. The Arabidopsis putative G protein-coupled receptor GCR1 interacts with the G protein α subunit GPA1 and regulates abscisic acid signaling. The Plant Cell, 2004, 16(6): 1616-1632.
[8] CHAKRAVORTY D, TRUSOV Y, ZHANG W, ACHARYA B R, SHEAHAN M B, MCCURDY D W, ASSMANN S M, BOTELLA J R. An atypical heterotrimeric G-protein γ-subunit is involved in guard cell K+-channel regulation and morphological development in Arabidopsis thaliana. The Plant Journal, 2011, 67(5): 840-851.
[9] 马鲜歌, 贺军民. 异三聚体G蛋白在UV-B诱导拟南芥气孔关闭中的作用. 中国农业科学, 2012, 45(5): 848-853.
MA X G, HE J M. Role of heterotrimeric G protein in UV-B-Induced Arabidopsis stomatal closure. Scientia Agricultura Sinica, 2012, 45 (5):848-853. (in Chinese)
[10] JONES A M, ECKER J R, CHEN J G. A reevaluation of the role of the heterotrimeric G protein in coupling light responses in Arabidopsis. Plant Physiology, 2003, 131(4): 1623-1627.
[11] ULLAH H, CHEN J G, YOUNG J C, IM K H, SUSSMAN M R, JONES A M. Modulation of cell proliferation by heterotrimeric G protein in Arabidopsis. Science, 2001, 292(5524): 2066-2069.
[12] PERFUS-BARBEOCH L, JONES A M, ASSMANN S M. Plant heterotrimeric G protein function: insights from Arabidopsis and rice mutants. Current Opinion in Plant Biology, 2004, 7(6): 719-731.
[13] TEMPLE B R S, JONES A M. The plant heterotrimeric G-protein complex. Annual Review of Plant Biology, 2007, 58: 249-266.
[14] HUANG H, WEISS C A, MA H. Regulated expression of the Arabidopsis G protein α subunit gene GPA1. International Journal of Plant Sciences, 1994, 155(1): 3-14.
[15] GAZZARRINI S, MCCOURT P. Cross-talk in plant hormone signalling: what arabidopsis mutants are telling us. Annals of Botany, 2003, 91(6): 605-612.
[16] WEERASINGHE R R, SWANSON S J, OKADA S F, GARRETT M B, KIM S Y, STACEY G, BOUCHER R C, GILROY S, JONES A M. Touch induces ATP release in Arabidopsis roots that is modulated by the heterotrimeric G-protein complex. FEBS Letters, 2009, 583(15): 2521-2526.
[17] COURSOL S, FAN L M, LE STUNFF H, SPIEGEL S, GILROY S, ASSMANN S M. Sphingolipid signalling in Arabidopsis guard cells involves heterotrimeric G proteins. Nature, 2003, 423(6940): 651-654.
[18] TRUSOV Y, JORDÁ L, MOLINA A, BOTELLA J R. G Proteins and Plant Innate Immunity. Integrated G Proteins Signaling in Plants. Springer Berlin Heidelberg, 2010: 221-250.
[19] OKAMOTO H, MATSUI M, DENG X W. Overexpression of the heterotrimeric G-protein α-subunit enhances phytochrome-mediated inhibition of hypocotyl elongation in Arabidopsis. The Plant Cell, 2001, 13(7): 1639-1652.
[20] CHEN J G, GAO Y, JONES A M. Differential roles of Arabidopsis heterotrimeric G-protein subunits in modulating cell division in roots. Plant Physiology, 2006, 141(3):887-897.
[21] LEASE K A, WEN J, LI J, DOKE J T, LISCUM E, WALKER J C. A mutant Arabidopsis heterotrimeric G-protein β subunit affects leaf, flower, and fruit development. The Plant Cell, 2001, 13(12): 2631-2641.
[22] WU Y, XU X, LI S, LIU T, MA L G, SHANG Z L. Heterotrimeric G-protein participation in Arabidopsis pollen germination through modulation of a plasmamembrane hyperpolarization-activated Ca2+-permeable channel. New Phytologist, 2007, 176(3): 550-559.
[23] CHAKRAVORTY D, BOTELLA J R. Over-expression of a truncated Arabidopsis thaliana, heterotrimeric G protein γ subunit results in a phenotype similar to α and β subunit knockouts. Gene, 2007, 393(1/2):163-170.
[24] ULLAH H, CHEN J G, TEMPLE B, BOYES D C, ALONSO J M, DAVIS K R, ECKER J R, JONES A M. The β-subunit of the Arabidopsis G protein negatively regulates auxin-induced cell division and affects multiple developmental processes. The Plant Cell, 2003, 15(2): 393-409.
[25] CHOUDHURY S R, PANDEY S. Specific subunits of heterotrimeric G proteins play important roles during nodulation in soybean. Plant Physiology, 2013, 162(1): 522-533.
[26] SCHULER B, SECKLER R. Role of a heterotrimeric G protein in regulation of Arabidopsis seed germination. Plant Physiology, 2002, 129(2): 897-907.
[27] WARPEHA K M, UPADHYAY S, YEH J, ADAMIAK J, HAWKINS S I, LAPIK Y R, ANDERSON M B, KAUFMAN L S. The GCR1, GPA1, PRN1, NF-Y signal chain mediates both blue light and abscisic acid responses in Arabidopsis. Plant Physiology, 2007, 143(4): 1590-1600.
[28] ZHANG L, WEI Q, WU W, CHENG Y, HU G, HU F, SUN Y, ZHU Y, SAKAMOTO W, HUANG J. Activation of the heterotrimeric G protein α-subunit GPA1 suppresses the ftsh-mediated inhibition of chloroplast development in Arabidopsis. The Plant Journal, 2009, 58(6): 1041-1053.
[29] NILSON S E, ASSMANN S M. The α-subunit of the Arabidopsis heterotrimeric G protein, GPA1, is a regulator of transpiration efficiency. Plant Physiology, 2010, 152(4): 2067-2077.
[30] CHAKRABORTY N, SHARMA P, KANYUKA K, PATHAK R R, CHOUDHURY D, HOOLEY R, RAGHURAM N. G-protein α-subunit (GPA1) regulates stress, nitrate and phosphate response, flavonoid biosynthesis, fruit/seed development and substantially shares GCR1 regulation in A. thaliana. Plant Molecular Biology, 2015, 89(6): 559-576.
[31] 张占全, 宋水山, 张英春, 杨文香, 刘大群. 异三聚体 G蛋白参与小麦抗叶锈病反应的研究. 中国农业科学, 2009, 42(1): 117-123.
ZHANG Z Q, SONG S S, ZHANG Y C, YANG W X, LIU D Q. Involvement of the heterotrimeric G protein in the defense responses of wheat to Puccinia triticina. Scientia Agricultura Sinica, 2009, 42(1): 117-123. (in Chinese)
(责任编辑 赵伶俐)
Molecular Cloning and Functional Characterization of the α-Subunit of Heterotrimeric G Protein Gene MdGPA1 of Apple
LI Rui, AN JianPing, YOU ChunXiang, WANG XiaoFei, HAO YuJin
(College of Horticulture Science and Engineering, Shandong Agricultural University/State Key Laboratory of Crop Biology/MOA Key Laboratory of Horticultural Crop Biology(Huanghuai Region)and Germplasm Innovation, Tai’an 271018, Shandong)
【Objective】As an important signal transduction molecule in plant biology, heterotrimeric G protein plays an important role in the stimulation of the external environment, the functions in regulation of responses to biotic and abiotic stresses and transmembrane signal transduction. A α-subunit of the apple heterotrimeric G protein named MdGPA1 was cloned from Malus ×domestica ‘Royal Gala’. Its basic biological functions were identified in transgenic tobacco. It provides a reference for the study of the molecular mechanism of perennial woody plants in response to environmental factor signal transduction. 【Method】MdGPA1gene was cloned by homology sequence alignment and PCR technique. The phylogenetic tree of GPA1 homologous species was constructed using MEGA5.0. The induced expression and tissue-specific expression profiles of MdGPA1 gene in apple with abiotic stress were detected by real-time fluorescent quantitative PCR (qRT-PCR). A plant over-expression vector of MdGPA1 was constructed and used to transform tobacco by Agrobacterium-mediated method. The phenotypic and physiological performance of the transformants were characterized under drought stresses to investigate the function of MdGPA1 on stress resistance in tobacco.【Result】A α-subunit of the apple heterotrimeric G protein named MdGPA1 (MDP0000309677) was cloned from Malus ×domestic‘Royal Gala’. Sequence analysis showed that the length of MdGPA1 gene is 1 173 bp, which encoded 390 amino acids. A phylogenetic tree indicated that the apple MdGPA1 exhibited the highest sequence similarity to Pyrus bretschneideri PbGPA1. The qRT-PCR analysis indicated that MdGPA1 has the highest expression levels of expression in apple leaves and response to drought stress, low temperature and salt abiotic stress. Expression levels were significantly down regulated at 150 mmol·L-1NaCl, 150 mmol·L-1mannitol, 10% PEG and 4℃ abiotic stress, and the expression level was significantly increased under 5% H2O2stress treatment. The MdGPA1 transgenic tobacco showed a drought sensitive phenotype. The fresh weight, chlorophyll content of the leaves and proline content of MdGPA1 transgenic tobacco were significantly lower than that of the wild type tobacco. Compared to the wild type, the root morphology of MdGPA1 transgenic tobacco was lower than that of the wild type, and the dry weight was significantly lower than that of the wild type.【Conclusion】The MdGPA1 is involved in the process of plant environment stimulation, and has different responses to abiotic stresses such as drought, low temperature and salt. Transgenic tobacco was more sensitive to drought stress than the wild type tobacco. The experimental results indicate that MdGPA1 plays a negative role in response to drought stress in plants.
apple; heterotrimeric G protein; MdGPA1; expression analysis; functional identification
2016-05-27;接受日期:2016-09-12
国家自然科学基金(31430074)、教育部创新团队支持计划(IRT15R42)、山东省现代农业产业技术体系(SDAIT-06-03)
联系方式:李睿,E-mail:liruisdau@163.com。通信作者王小非,E-mail:xfwang2004@163.com。通信作者郝玉金,E-mail:haoyujin@sdau.edu.cn
