‘早酥’和‘南果梨’16个部位多酚物质组成及含量分析
2017-02-16张小双郑迎春曹玉芬田路明董星光张莹齐丹霍宏亮
张小双,郑迎春,曹玉芬,田路明,董星光,张莹,齐丹,霍宏亮
(中国农业科学院果树研究所/农业部果品质量安全风险评估实验室(兴城),辽宁兴城 125100)
‘早酥’和‘南果梨’16个部位多酚物质组成及含量分析
张小双,郑迎春,曹玉芬,田路明,董星光,张莹,齐丹,霍宏亮
(中国农业科学院果树研究所/农业部果品质量安全风险评估实验室(兴城),辽宁兴城 125100)
【目的】通过对脆肉型梨品种‘早酥’和软肉型梨品种‘南果梨’16个部位多酚物质种类和含量的分析,揭示梨品种不同器官或组织内多酚物质组成及含量,以期找到提取多酚物质的最佳部位,为梨多酚物质的利用提供依据。【方法】以‘早酥’梨和‘南果梨’为试材,采用超高效液相色谱法测定其16个部位多酚物质的组成和含量。以熊果苷、没食子酸、原儿茶酸、新绿原酸、原花青素B1、DL-儿茶素、绿原酸、隐绿原酸、咖啡酸、原花青素B2、丁香酸、表儿茶素、原花青素C1、洋藓素、P-香豆酸、槲皮素-阿拉伯-葡糖苷、反式阿魏酸、芦丁、槲皮素-3-半乳糖苷、槲皮素-3-葡糖苷、木犀草-7-O-葡糖苷、异绿原酸B、莰菲醇-3-O-芸香糖苷、槲皮素-阿拉伯糖苷、异绿原酸 A、水仙苷、异鼠李素-3-O-半乳糖苷、异鼠李素-3-O-葡糖苷、根皮苷、白藜芦醇、肉桂酸、二水槲皮素、根皮素、芹菜素和山奈黄酮醇35种多酚化合物标准品,对‘早酥’梨和‘南果梨’16个部位进行多酚的定量和定性分析。【结果】‘早酥’梨共检测到23种多酚物质,包括简单酚类2种,苯甲烯类1种,咖啡酰奎宁酸类5种,黄烷醇类5种,黄酮醇类9种和二氢查耳酮类1种;‘南果梨’共检测到21种多酚物质,包括简单酚类2种,酚酸类1种,苯甲烯类1种,咖啡酰奎宁酸类4种,黄烷醇类4种和黄酮醇类9种。‘早酥’梨16个部位以幼嫩叶片多酚含量最高,为93.82 mg·g-1,果肉多酚含量最低,为0.63 mg·g-1;熊果苷和绿原酸为各部位所共有,除果肉外,其他部位含量最高的多酚均是熊果苷,为0.08—64.86 mg·g-1;所检测到的6大类多酚中,每类含量最高的依次为熊果苷、丁香酸、绿原酸、表儿茶素、木犀草-7-O-葡糖苷和根皮苷,分别为403.5、0.04、79.83、16.16、9.07和0.13 mg·g-1;成熟叶柄所测酚种类最多为14种,木质部所测酚种类最少为3种。‘南果梨’16个部位以幼嫩叶片多酚含量最高,为104.04 mg·g-1,种子含量最低,为2.66 mg·g-1;熊果苷和绿原酸为各部位共有,除果肉和果心外,其他部位含量最高的多酚均为熊果苷,为0.87—51.75 mg·g-1;所检测到的6大类多酚中,每类含量最高的依次为熊果苷、原儿茶酸、表儿茶素、丁香酸、绿原酸、表儿茶素和木犀草-7-O-葡糖苷,分别为357.29、0.01、0.08、122.15、12.89和4.87 mg·g-1;成熟叶柄和果皮所测酚种类最多,为13种;果心所测酚种类最少,为3种。‘早酥’梨和‘南果梨’多酚含量最高的部位均为幼嫩叶片,果皮所测酚比果肉所测酚的组成及含量更丰富,花柄所测酚含量高于花,韧皮部所测酚种类和含量均高于木质部。【结论】‘早酥’梨和‘南果梨’所测酚中熊果苷和绿原酸为16个部位共有,且熊果苷是总含量最高的多酚;除根皮苷和原儿茶酸外,其他所测酚种类相同,幼嫩叶片多酚物质组成及含量均较丰富,可作为多酚提取资源进行开发利用。
梨;多酚;组成;含量;高效液相色谱
0 引言
【研究意义】随着科技的发展和人类对“抗衰老”、“抗辐射”、“抗炎症”和“抗癌”食品的不断追求,植物多酚已经成为科学界研究的热点。多酚有很强的抗氧化能力和清除自由基的能力,以及提高免疫力、保护神经、抗癌、抗衰老[1-4]等功能。水果中多酚含量丰富,是人类摄取多酚的主要来源。梨是中国第3大水果,种植面积和产量仅次于苹果和柑橘,深受消费者的喜爱,因此,对梨多酚的研究具有重要意义。对‘早酥’梨和‘南果梨’16个部位多酚物质组成和含量进行研究,以明确多酚的组成特点及含量水平,揭示多酚物质丰富的部位,为梨种质资源多酚的利用提供依据。【前人研究进展】目前,对梨种质资源多酚的研究主要集中在果实和叶片上[5-6],对梨其他部位多酚的报道却甚少。史国安等[6]研究了红皮沙梨和褐皮沙梨果实的总酚含量。LEONTOWICZ等[7]证明果皮中的总酚含量是果肉的2倍。李丽梅等[8]研究了梨果心与果皮中多酚提取工艺。LIN和HARNLY[9]从16种梨皮中鉴定出了53种多酚类物质。另外,近年来对其他水果多酚研究较多,例如葡萄、核桃、草莓和苹果等[10-13],但对梨不同部位多酚的研究较少,且对亚洲梨的研究也远远落后于欧洲梨[1,6,8,14-16]。【本研究切入点】梨多酚的研究主要集中在提取工艺[17]和梨果实、果皮等常见部位含酚量的测定,对梨其他部位多酚含量和组成方面的研究极少。【拟解决的关键问题】本研究分别在不同生长期选取‘早酥’梨和‘南果梨’16个不同的部位,对其进行超高效液相色谱(Ultra Performance Liquid Chromatography,UPLC)测定,揭示梨品种不同部位多酚物质组成及含量的差异,以期找到提取多酚类物质的最佳部位。
1 材料与方法
1.1 试验材料
试验在国家果树种质兴城梨、苹果圃进行,土壤类型为砂质壤土。选择‘早酥’梨和‘南果梨’为试材,砧木为杜梨,2003年定植,株行距3 m×4 m,常规栽培管理,树势中庸。2014—2015年,在‘早酥’梨和‘南果梨’相应物候期采集试验材料包括花朵、花柄、幼嫩叶片、幼嫩叶柄、成熟叶片、成熟叶柄、新梢的韧皮部、新梢的木质部、一年生枝条的韧皮部、一年生枝条的木质部、果皮、果肉、果心、种子、叶芽和花芽,共 16个部位,采集方法参照曹玉芬[18]。将采集的这些材料干燥至恒重后将其粉粹,并保存在-20℃冰箱中备用。
1.2 试剂
熊果苷(Arbutin)、没食子酸(Gallic acid)、原儿茶酸(3,4-Dihydroxybenzoic acid)、新绿原酸(Neochlorogenic acid)、原花青素B1(Procyanidins B)、DL-儿茶素(DL-catechin)、绿原酸(Chlorogenic acid)、隐绿原酸(Cryptochlorogenic acid)、咖啡酸(3,4-Dihydroxycinnamic acid)、原花青素 B2(Procyanidins B2)、丁香酸(Syringic acid)、表儿茶素(Epicatechin)、原花青素C1(Pro-cyanidins C1)、洋藓素(Cyclohexanecarboxylic acid)、P-香豆酸(P-Hydroxycinnamic acid)、槲皮素-阿拉伯-葡糖苷(Quercetin-arab-glucoside)、反式阿魏酸(Rans-4-hydroxy-3-methoxycinnamic acid)、芦丁(Rutin)、槲皮素-3-半乳糖苷(Quercetin-3-galactoside)、槲皮素-3-葡糖苷(Quercetin-3-glucoside)、木犀草-7-O-葡糖苷(Luteolin-7-O-glucoside)、异绿原酸 B(Isochlorogenic acid B)、莰菲醇-3-O-芸香糖苷(Kaempferol-3-O-rutinoside)、槲皮素-阿拉伯糖苷(Avicularin)、异绿原酸A(Isochlorogenic acid A)、水仙苷(Isorhamnetin-3-rutinoside)、异鼠李素-3-O-半乳糖苷(Isorhamnetin-3-O-galactoside)、异鼠李素-3-O-葡糖苷(Isorhamnetin-3-O-glucoside)、根皮苷(Phlorizin dihydrate)、白藜芦醇(Resveratrol)、肉桂酸(cinnamic acid)、二水槲皮素(Qutercetin dihydrate)、根皮素(Phloretin)、芹菜素(Apigenin)和山奈黄酮醇(Kaemferol),纯度均≥98%,购自Sigma公司;甲醇、乙醇、乙腈和甲酸等均为色谱纯。
1.3 仪器
Acquity UPLC H-class超高效液相色谱仪(美国Waters公司);Oasis HBL 6CC(200 mg)固相萃取小柱(美国Waters公司);R-210旋转蒸发仪(瑞士BUCHI公司);Mill-Q Direct8水纯化系统(美国Millipore公司);0.22 μm滤膜(天津津腾实验设备有限公司);Acquity UPLC HSS T3色谱柱(2.1 mm ×100 mm,1.8 μm)(美国Waters公司);DFT-50手提式中药粉碎机(温岭市林大机械有限公司);CF16RXII立式大容量高速离心机(日本日立公司);SK-12TC超声波清洗器(上海科导超声仪器有限公司)。
1.4 提取工艺流程
参照郑迎春等[19]的方法并加以改进(下同),称取试样1.0000 g加液氮冷冻研磨(重复3次),加入23 mL 70%的甲醇,室温下进行超声波(超声功率为500 W)提取30 min,10 000 r/min离心5 min,取上清液并加23 mL 70%甲醇,超声波提取并离心(同上),加入棕色瓶定容至50 mL(为粗提液),取5 mL粗提液于35℃旋蒸近干,样品过已用甲醇和水活化好的固相萃取小柱,于5 mL水洗固相萃取小柱2次(除去叶绿素、糖和强极性化合物[20]),5 mL甲醇洗固相萃取小柱2次收集溶液,将收集液于35℃旋蒸近干,用70%甲醇定容至5 mL,样品过0.22 μm滤膜,待进行UPLC测定。
1.5 标样的配制、色谱条件和方法验证
参照郑迎春等[19]的方法并加以改进。
1.6 梨16个部位多酚类物质的UPLC检测
按照以上条件处理样品,对‘早酥’梨、‘南果梨’的花(不含柄)、花柄、幼叶、幼叶叶柄、叶片、叶柄、新梢韧皮部、新梢木质部、一年生枝韧皮部、一年生枝木质部、果皮、果肉、果心、种子、叶芽、花芽共 16个部位进行多酚物质组成和含量的 UPLC检测。
1.7 数据处理及分析
利用Excel和SAS 9.2软件对梨16个部位多酚物质的数据进行分析。
2 结果
2.1 ‘早酥’梨多酚物质组成及含量
‘早酥’梨16个部位共检测到23种多酚类物质,各部位所检测到的多酚种类和含量见表 1,各部位总酚含量为0.63—93.82 mg·g-1,其中简单酚2种,苯甲烯1种,咖啡酰奎宁酸5种,黄烷醇5种,黄酮醇9种,二氢查耳酮1种。
2.1.1 ‘早酥’梨 16个部位多酚含量 幼嫩叶片和幼嫩叶柄含量最高,分别为 93.82 mg·g-1和 80.10 mg·g-1,其次是新梢韧皮部、花柄、一年生枝条的韧皮部和成熟叶,为62.97—68.93 mg·g-1;再次是成熟叶柄、花、新梢的木质部、一年生枝条的木质部、花芽和叶芽,为9.13—52.03 mg·g-1;其余均在9 mg·g-1以下,分别为果皮、种子、果心和果肉,为0.63—6.06 mg·g-1(表1)。各部位所检测的多酚物质种类和含量差异显著,表现出丰富的多样性(表2)。
果肉含量最高和最低的多酚为绿原酸和异绿原酸A,含量分别为0.19 mg·g-1和0.01 mg·g-1。果心、一年生枝条韧皮部和果皮含量最高的多酚均为熊果苷,分别为1.42、4.16和3.59 mg·g-1;含量最低的多酚均为异绿原酸 A,分别为 0.01、0.14和 0.01 mg·g-1。新梢木质部和一年生枝条木质部含量最高的多酚均为熊果苷,分别为7.43 mg·g-1和6.11 mg·g-1;含量最低的多酚均为新绿原酸,分别为0.07 mg·g-1和0.04 mg·g-1。幼嫩叶、新梢韧皮部、花和叶芽含量最高的多酚均为熊果苷,分别为 52.01、57.91、18.83和5.33 mg·g-1;含量最低的均为隐绿原酸,分别为1.14、0.13、0.06和0.04 mg·g-1。幼嫩叶柄、成熟叶柄、花柄、种子和花芽含量最高的多酚均为熊果苷,分别为64.86、44.92、47.31、0.31和6.04 mg·g-1;含量最低的多酚分别为表儿茶素、洋藓素、槲皮素-3-半乳糖苷、槲皮素-3-葡糖苷和丁香酸,分别为0.25、0.13、0.05、0.01和0.02 mg·g-1。除果肉外,其他部位含量最高的多酚均为熊果苷,为 0.08—64.86 mg·g-1。
2.1.2 简单酚 ‘早酥’梨检测到的简单酚包括熊果苷和白藜芦醇,其中熊果苷是16个部位所共有,含量为0.08—64.86 mg·g-1;白藜芦醇在幼叶、幼叶叶柄、叶芽和花芽中均被检测到,含量为0.02—1.63 mg·g-1。熊果苷的含量远高于白藜芦醇,为主要的简单酚类(表1)。简单酚总含量在16个部位差异显著,幼嫩叶柄含量最高,果肉含量最低,呈现出明显的多样性(表2)。
2.1.3 咖啡酰奎宁酸 ‘早酥’梨共检测到5种咖啡酰奎宁酸,分别是新绿原酸、绿原酸、隐绿原酸、洋藓素和异绿原酸A。成熟叶柄检测到5种,总含量为4.45 mg·g-1;幼嫩叶、成熟叶、新梢韧皮部、一年生枝条韧皮部、叶芽、花芽和花检测到除洋藓素以外的其他4种,含量为1.37—32.58 mg·g-1;果心、幼嫩叶柄和花柄检测到除隐绿原酸和洋藓素以外的其他3种咖啡酰奎宁酸,含量为1.05—14.40 mg·g-1;果皮检测到绿原酸、洋藓素和异绿原酸 A,总量为 0.61 mg·g-1;果肉、新梢木质部和一年生枝条木质部分别检测到2种咖啡酰奎宁酸,果肉检测到绿原酸和异绿原酸A,含量为0.2 mg·g-1,后两者检测到新绿原酸和绿原酸,含量为0.20—0.26 mg·g-1;种子只检测到绿原酸,含量为0.24 mg·g-1(表1)。不同部位检测到的咖啡酰奎宁酸种类不同,且不同部位咖啡酰奎宁酸的含量差异显著(表2)。
2.1.4 黄烷醇 ‘早酥’梨检测到5种黄烷醇,分别是原花青素B1、原花青素B2、原花青素C1、DL-儿茶素和表儿茶素,总含量为0.16—16.8 mg·g-1。种子、新梢韧皮部、一年生枝条韧皮部、叶芽和花芽检测到4种,种子检测到除 DL-儿茶素外的其他黄烷醇,总含量为1.95 mg·g-1,后四者含有原花青素B2、原花青素C1、DL-儿茶素和表儿茶素,总含量为2.32—16.8 mg·g-1;果肉和果皮分别检测到 2种黄烷醇,前者为原花青素B2和表儿茶素,总量为0.35 mg·g-1,后者为DL-儿茶素和表儿茶素,含量为1.30 mg·g-1;幼嫩叶、成熟叶、幼嫩叶柄、成熟叶柄、花柄和花只检测到表儿茶素,总含量为 0.16—0.54 mg·g-1;其他部位均未检测到黄烷醇类多酚物质。其中表儿茶素含量最高,16个部位总含量为16.16 mg·g-1,是其他黄烷醇含量的3—500倍(表1)。
2.1.5 黄酮醇 ‘早酥’梨共检测到9种黄酮醇,总含量为 0.09—7.44 mg·g-1。成熟叶柄和果皮分别检测到 7种,其中芦丁、槲皮素-3-半乳糖苷、槲皮素-3-葡糖苷、木犀草-7-O-葡糖苷、水仙苷和异鼠李素-3-O-半乳糖苷为两者共有,另外,成熟叶片含有扁蓄苷,果皮含有异鼠李素-3-O-葡糖苷,两部分的总酚含量分别为2.16 mg·g-1和0.56 mg·g-1。花检测到6种黄酮醇,分别为芦丁、槲皮素-3-半乳糖苷、槲皮素-3-葡糖苷、木犀草-7-O-葡糖苷、莰菲醇-3-O-芸香糖苷和水仙苷,总含量为4.28 mg·g-1。成熟叶和花柄分别检测到5种,其中芦丁、槲皮素-3-半乳糖苷、槲皮素-3-葡糖苷和木犀草-7-O-葡糖苷为共有。成熟叶检测到扁蓄苷,花柄检测到水仙苷,两个部位的总含量分别为5.14 mg·g-1和1.35 mg·g-1。幼嫩叶检
测到芦丁、槲皮素-3-半乳糖苷、槲皮素-3-葡糖苷和木犀草-7-O-葡糖苷 4种黄酮醇,总含量为7.44 mg·g-1。一年生枝条韧皮部、种子和花芽只检测到 1种黄酮醇,分别为异鼠李素-3-O-葡糖苷、槲皮素-3-葡糖苷和水仙苷,含量分别为0.46、0.01和0.09 mg·g-1(表1)。经SAS分析,幼嫩叶、成熟叶、成熟叶柄、花柄和花的含量差异性不显著,其他部位均表现出显著的多样性(表2)。
2.1.6 丁香酸和二氢查耳酮 ‘早酥’梨只在叶芽和花芽检测到这2类多酚,分别为丁香酸和根皮苷。其中丁香酸16个部位总含量为0.04 mg·g-1,叶芽和花芽含量均为0.02 mg·g-1。根皮苷总含量0.13 mg·g-1,叶芽含量为0.07 mg·g-1,花芽含量为0.06 mg·g-1,表明其不是主要的多酚类物质。
2.2 ‘南果梨’多酚物质组成及含量
‘南果梨’共检测到21种多酚物质,各部位检测到的多酚种类和含量见表3,包括简单酚类2种,酚酸类1种,苯甲烯类1种,咖啡酰奎宁酸类4种,黄烷醇类 4种和黄酮醇类 9种,含量为 2.66—104.04 mg·g-1。
2.2.1 ‘南果梨’16个部位多酚含量 ‘南果梨’幼嫩叶和幼嫩叶柄含量最高,分别是 104.44 mg·g-1和103.00 mg·g-1,其次是成熟叶、新梢韧皮部、一年生枝条韧皮部、成熟叶柄、花柄和花,为 36.26—62.02 mg·g-1;再次是新梢木质部、一年生枝条木质部、果皮、叶芽和花芽,含量为6.36—13.61 mg·g-1;其余均在6 mg·g-1以下,分别是果肉、果心和种子,含量为2.66—3.53 mg·g-1。南果梨不同部位多酚种类和含量差异显著(表4)。
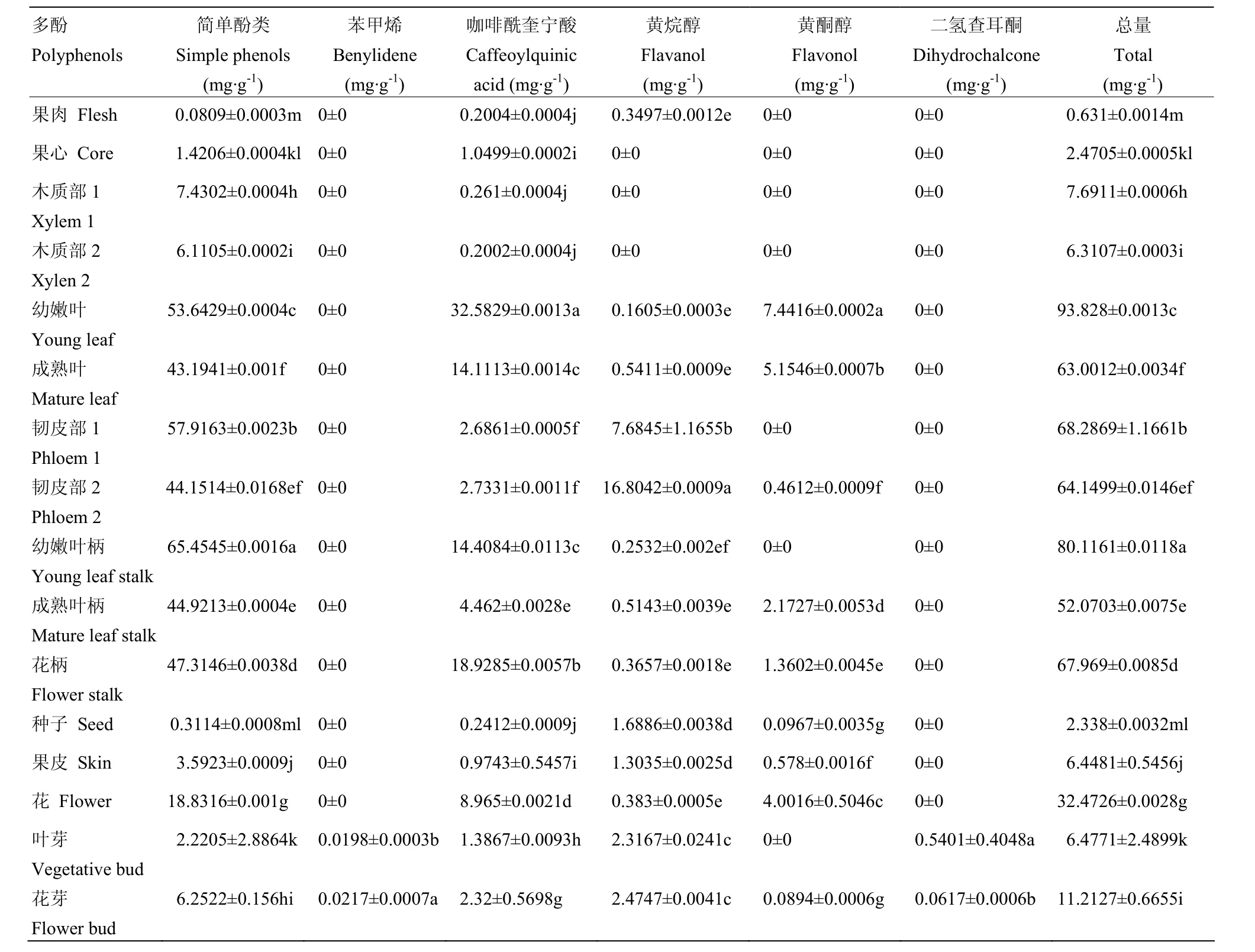
表2 ‘早酥’梨所测酚在16个部位的分布情况Table 2 The distribution of measured phenols in 16 parts of ‘Zaosu’ pear
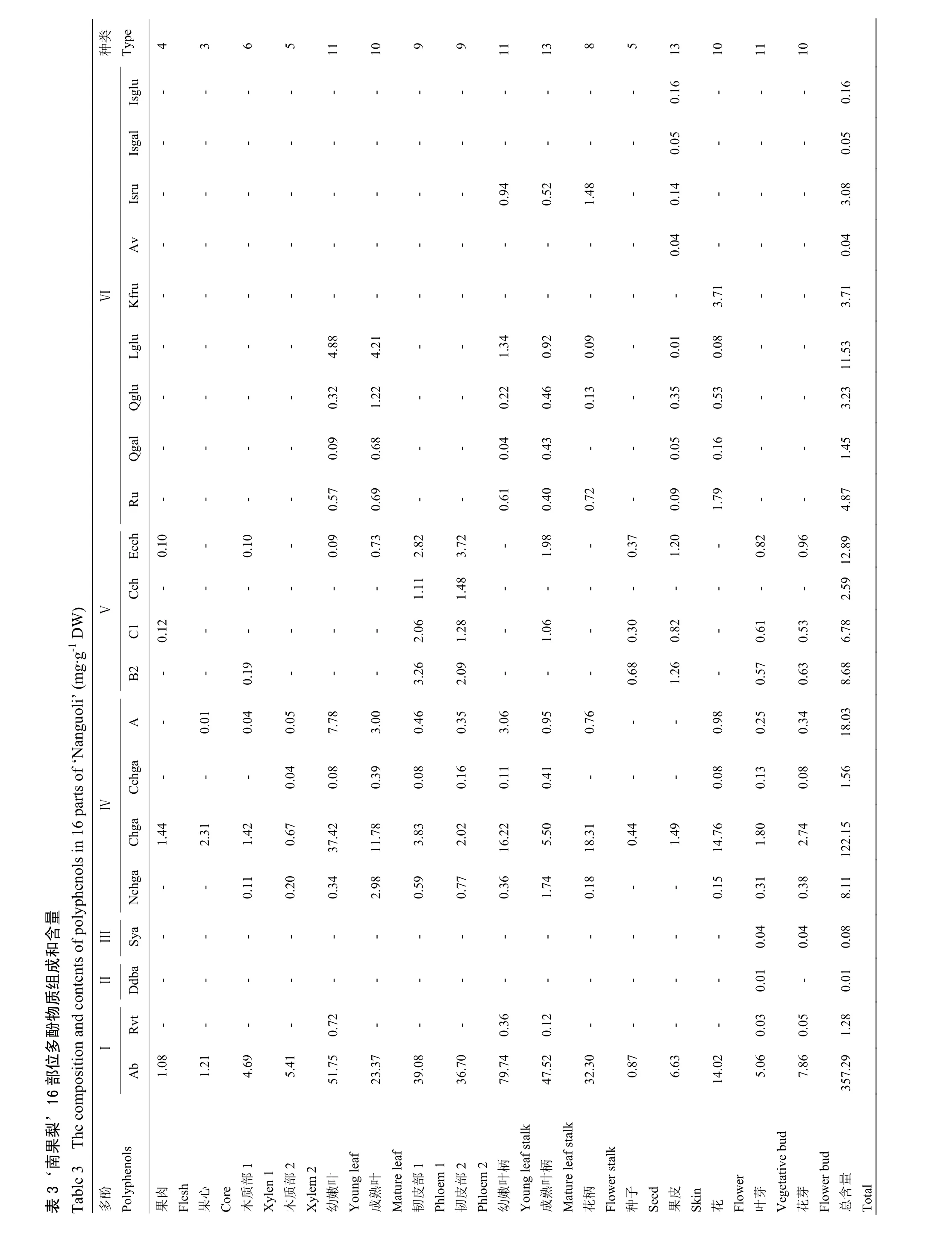
果肉和果心含量最高的多酚均为绿原酸,分别为1.44 mg·g-1和2.31 mg·g-1;含量最低的多酚分别为表儿茶素和异绿原酸A,均为0.10 mg·g-1。新梢木质部和一年生枝条木质部含量最高和最低的多酚均分别为熊果苷和异绿原酸 A,为 4.69、5.41 mg·g-1和0.04、0.05 mg·g-1。幼嫩叶片、成熟叶片、新梢韧皮部和花含量最高的多酚均为熊果苷,分别为51.75、23.37、39.08和14.02 mg·g-1;含量最低的均为隐绿原酸,分别为0.08、0.39、0.08和0.08 mg·g-1。新梢韧皮部含量最高和最低的多酚分别为熊果苷和异绿原酸A,含量分别为36.70 mg·g-1和0.35 mg·g-1。幼嫩叶柄、成熟叶柄、花柄、种子、果皮、叶芽和花芽含量最高的多酚均为熊果苷,分别为79.74、47.52、32.30、0.87、6.63、5.06和7.86 mg.g-1;含量最低的分别为新绿原酸、卢丁、原花青素C1、木犀草-7-O-葡糖苷、原儿茶酸和丁香酸,为0.36、0.40、0.09、0.30、0.01、0.01和0.04 mg·g-1。除果肉和果心外,其他部位含量最高的多酚均为熊果苷,为 0.87—51.75 mg·g-1。
2.2.2 简单酚、酚酸和苯甲烯 ‘南果梨’的16个部位检测到2种简单酚类、1种酚酸和1种苯甲烯,分别为熊果苷、白藜芦醇、原儿茶酸和丁香酸。熊果苷为16个部位所共有的,含量为0.87—79.74 mg·g-1,其中幼嫩叶柄含量最高,种子含量最低;白藜芦醇只在幼嫩叶、幼嫩叶柄、成熟叶柄、叶芽和花芽中存在,含量为0.03—0.72 mg·g-1;原儿茶酸只存在于叶芽中,含量为0.01 mg·g-1;丁香酸存在于叶芽和花芽,含量均为0.04 mg·g-1(表3)。
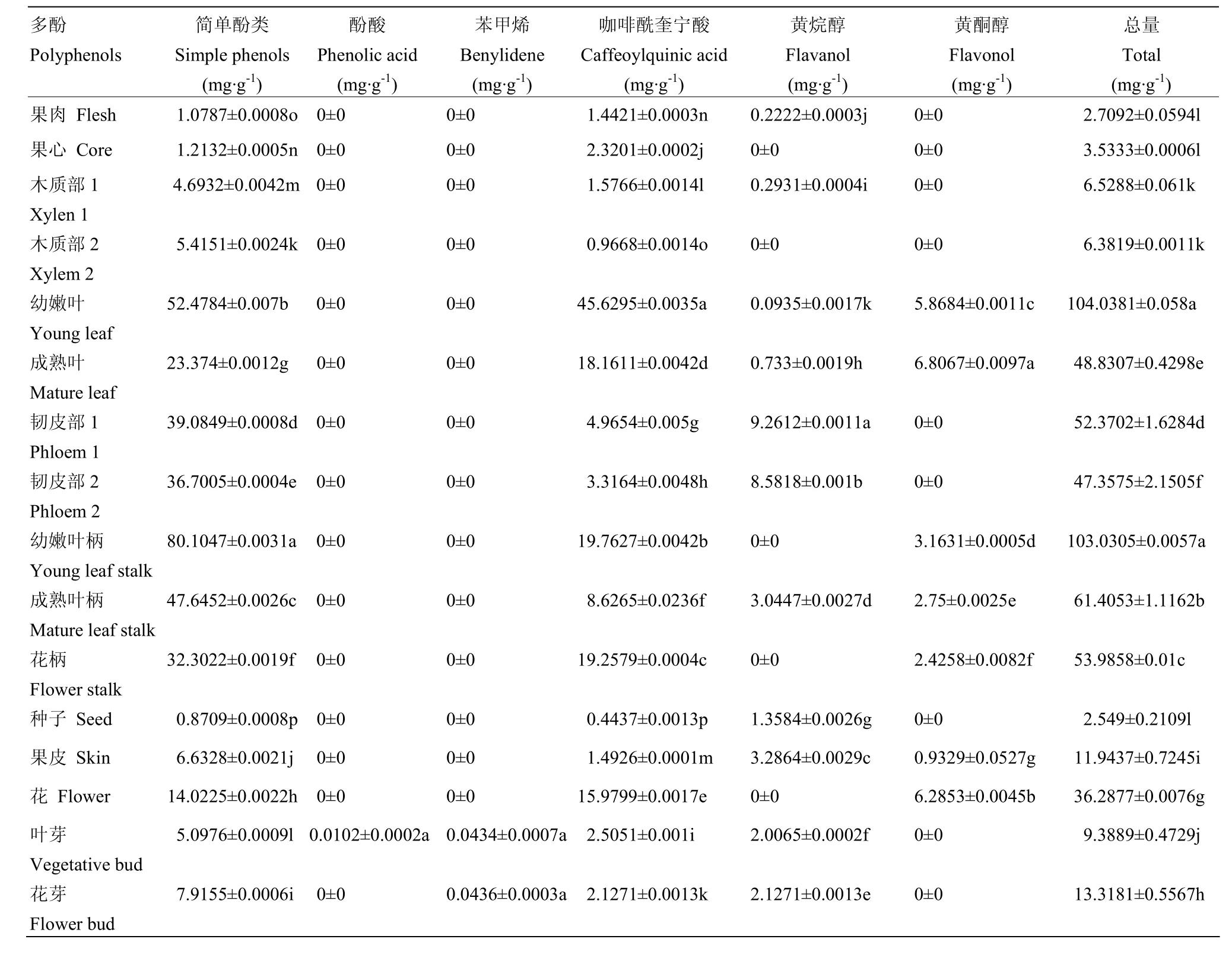
表4 ‘南果梨’所测酚在16个部位的分布情况Table 4 The distribution of measured polyphenols in 16 parts of ‘Nanguoli’
2.2.3 咖啡酰奎宁酸 ‘南果梨’共检测到4种咖啡酰奎宁酸,分别是新绿原酸、绿原酸、隐绿原酸和异绿原酸A,16个部位总含量为0.44—45.62 mg·g-1。除了果肉、果心、新梢木质部、花柄、种子和果皮,其他10个部位均检测到4种咖啡酰奎宁酸,其中幼嫩叶含量最高,为45.62 mg·g-1,一年生枝条木质部含量最低,为0.96 mg·g-1;新梢木质部和花柄检测到除隐绿原酸外的其他3种咖啡酰奎宁酸,含量为1.57—19.25 mg·g-1;果心检测到2种,分别是绿原酸和异绿原酸A,总含量为2.31 mg·g-1;果肉、种子和果皮只检测到绿原酸,含量分别为1.44、0.44和1.49 mg·g-1(表3)。‘南果梨’所含的咖啡酰奎宁酸无论在含量、种类和分布位置都具有很大的差异性,多样性丰富(表4)。
2.2.4 黄烷醇 ‘南果梨’检测到4种黄烷醇,分别是原花青素B2、原花青素C1、DL-儿茶素和表儿茶素,16个部位总含量为0.00—9.25 mg·g-1,其中新梢韧皮部含量最高。新梢韧皮部和一年生枝条韧皮部检测到4种,总含量分别为9.82 mg·g-1和8.57 mg·g-1;种子、果皮、叶芽和花芽检测到除 DL-儿茶素之外的其他3种黄烷醇,总含量为1.35—3.28 mg·g-1;新梢木质部、果肉和成熟叶柄分别检测到2种黄烷醇,其中新梢木质部检测到原花青素B2和表儿茶素,总含量为0.29 mg·g-1;果肉和成熟叶柄检测到原花青素C1和表儿茶素,总含量分别为0.22 mg·g-1和3.04 mg·g-1;幼嫩叶和成熟叶只检测到表儿茶素,含量为 0.09 mg·g-1和0.73 mg·g-1;其他部位均未检测到黄烷醇类多酚物质(表 3)。除了果心、一年生枝条木质部、幼嫩叶柄和花柄外,其他部位的黄烷醇含量都表现出显著的差异性(表4)。
2.2.5 黄酮醇 ‘南果梨’共检测到9中黄酮醇,分别为芦丁、槲皮素-3-半乳糖苷、槲皮素-3-葡糖苷、木犀草-7-O-葡糖苷、莰菲醇-3-O-芸香糖苷、扁蓄苷、水仙苷、异鼠李素-3-O-半乳糖苷和异鼠李素-3-O-葡糖苷,16个部位总含量为0.89—6.81 mg·g-1,其中成熟叶含量最高,果皮含量最低;果皮检测到除莰菲醇-3-O-芸香糖苷外的其他 9种黄酮醇,总含量为 0.89 mg·g-1;幼嫩叶柄、成熟叶柄、花柄和花均检测到 5种黄酮醇,芦丁、槲皮素-3-半乳糖苷、槲皮素-3-葡糖苷、木犀草-7-O-葡糖苷为4个部位所共有。另外,前三者还含有水仙苷,仅在花中检测到莰菲醇-3-O-芸香糖苷,总含量为 2.42—6.27 mg·g-1;幼嫩叶和成熟叶检测到4种黄酮醇,分别为芦丁、槲皮素-3-半乳糖苷、槲皮素-3-葡糖苷和木犀草-7-O-葡糖苷,总含量为5.86—6.80 mg·g-1;其他部位均未检测到黄酮醇类多酚(表3);各部位黄酮醇含量差异显著(表4)。
3 讨论
3.1 ‘早酥’梨和‘南果梨’16个部位多酚物质组成和含量的异同点
‘早酥’梨是由中国农业科学院果树研究所1956年以‘苹果梨’为母本,‘身不知’为父本杂交育成[21],肉质细脆,汁液极多,味甜,在辽宁、河北、江苏、甘肃、陕西等地广泛栽培,为脆肉型梨品种的典型代表;‘南果梨’原产于辽宁省鞍山市,在鞍山、海城栽培最多,肉质软溶、汁液多,甜酸味浓,为中国独有的软肉型梨品种[22]。本研究中‘早酥’梨 16个部位所测酚总含量为567.61 mg·g-1,‘南果梨’16个部位所测酚总含量为567.57 mg·g-1,所测酚总含量基本相同。‘早酥’梨和‘南果梨’均检测到简单酚,且均包括熊果苷和白藜芦醇,熊果苷为16个部位共有,白藜芦醇在幼嫩叶片、幼嫩叶柄、叶芽和花芽中被检测到,‘南果梨’的成熟叶柄也被检测到含有白藜芦醇,简单酚是两种梨最主要的多酚大类。‘早酥’梨和‘南果梨’均检测到咖啡酰奎宁酸、黄烷醇和黄酮醇,这3大类多酚中,‘早酥’梨比‘南果梨’多含有2种,分别为洋藓素(咖啡酰奎宁酸)和原花青素B1(黄烷醇),其他种类均相同。‘早酥’梨单独含有根皮苷,只在叶芽和花芽中存在,含量为0.04 mg·g-1,‘南果梨’单独含有原儿茶酸(酚酸),只存在于叶芽中,含量为0.01 mg·g-1。‘早酥’梨与‘南果梨’的总多酚种类和含量基本相同,差异不明显。
3.2 多酚物质在‘早酥’梨和‘南果梨’16个部位分布情况
‘早酥’梨和‘南果梨’所检测到的多酚物质在16个部位的含量和分布均差异显著,表现出明显的多样性。其中,熊果苷和绿原酸在各部位均被检测到,根皮苷仅在‘早酥’梨的叶芽和花芽中被检测到。GORNAS等[23]在对苹果果实不同部位多酚的研究中,证明绿原酸和熊果苷在茎、种子、果肉、果皮、果心均被检测到,且是果肉最主要的多酚物质,但仅在种子里检测到根皮苷。‘早酥’梨和‘南果梨’多酚含量最高的部位均为幼嫩叶片和幼嫩叶柄,多酚含量较低的部位均为果肉、果心和种子,两个品种成熟叶片中所测酚含量均不如幼嫩叶片高,但含量均在 49 mg·g-1以上,与 RENARD 等[24]证明的苹果叶中和OLIVEIRA[25]等证明的海棠叶中多酚物质最丰富相符,且OLIVEIRA等[25]认为海棠叶中的多酚物质高于果实、果皮和种子,与笔者的研究结果一致,说明叶片的多酚提取应获得更大的关注。果皮中所测酚含量和种类均比果肉多且丰富,与以往油梨与苹果的研究结果相同[26-27],CUI等[28]和SALTA等[29]也证明了梨果皮比梨果肉检测到的多酚物质更加丰富。‘早酥’梨和‘南果梨’的花中多酚总含量均在32 mg·g-1以上,花柄中多酚含量均在53 mg·g-1以上,可作为有价值的潜在功能食品的多酚来源[30]。GORNAS等[23]对苹果茎中多酚进行了研究,但未涉及木质部和韧皮部,本研究显示新梢木质部和一年生枝条木质部多酚含量均在8 mg·g-1以下,不建议作为多酚提取的重要部分,新梢韧皮部和一年生枝条的韧皮部多酚含量均在53 mg·g-1以上,可考虑作为多酚提取有效部位。
4 结论
脆肉型‘早酥’梨和软肉型‘南果梨’总含量最高的多酚均为熊果苷。16个部位中幼嫩叶片多酚含量最高,成熟叶柄中种类最为丰富。熊果苷和绿原酸在16个部位均被检测到;根皮苷为‘早酥’梨特有,原儿茶酸为‘南果梨’特有,两者均不是主要的多酚物质。果皮中所测酚含量和种类均比果肉丰富;花中多酚含量较花柄低;韧皮部多酚含量较木质部高。‘早酥’梨和‘南果梨’各部位均可作为多酚提取的材料来源,其中幼嫩叶可作为主要的多酚提取部位。
[1] 王雪飞, 张华. 多酚类物质生理功能研究的进展. 食品研究与开发, 2012, 33(2): 211-214.
WANG X F, ZHANG H. Research advances of polyphenols physiology function. Food Research and Development, 2012, 33(2): 211-214. (in Chinese)
[2] CORVAZIER E, MACLOUF J. Interference of some flavonoids and non-steroidal anti-inflammatory drugs with oxidative metabolism of arachidonic acid by human platelets and neutrophils. Biochimica Et Biophysica Acta, 1985, 835(2): 315-321.
[3] PAULKE A, NÖLDNER M, SCHUBERTZSILAVECZ M. St. John's wort flavonoids and their metabolites show antidepressant activity and accumulate in brain after multiple oral doses. Pharmazie, 2008, 63(4): 296-302.
[4] 谢棒祥, 张敏红. 生物类黄酮的生理功能及其应用研究进展. 动物营养学报, 2003, 15(2): 11-15.
XIE B X, ZHANG M H. The recent advances on the function and application of flavonoids. Acta Zoon Ut RimentaI Sinica, 2003, 15(2): 11-15. (in Chinese)
[5] 董忠义, 晓彤. 梨的药用功效. 绿化与生活, 1994, 4(2): 15-16.
DONG Z Y, XIAO T. Medicinal effect of pear. Journal of Greening and Life, 1994, 4(2): 15-16. (in Chinese)
[6] 史国安, 郭香凤, 张国海. 沙梨果实多酚类活性成分及抗氧化活性分析. 植物资源与环境学报, 2000, 9(3): 57-58.
SHI G A, GUO X F, ZHANG G H. The recent advances on the function and application of flavonoids. Journal of Plant Resources and Environment. 2000, 9(3): 57-58. (in Chinese)
[7] LEONTOWICZ H, GORINSTEIN S, LOJEK A. Comparative content of some bioactive compounds in apples, peaches and pears and their influence on lipids and antioxidant capacity in rats. Journal of Nutritional Biochemistry, 2002, 13(10): 603-610.
[8] 李丽梅, 何近刚, 关军锋. 梨果心与果皮中多酚提取工艺的研究.保鲜与加工, 2014(4): 40-44.
LI L M, HE J G, GUAN J F. Extraction technology of polyphenols in core and peel of pears. Storage and Process, 2014(4): 40-44. (in Chinese)
[9] LIN L Z, HARNLY J M. Phenolic compounds and chromatographic profiles of pear skins (Pyrus spp.). Journal of Agricultural & Food Chemistry, 2008, 56(19): 9094-9101.
[10] MASA A, VILANOVA M, POMAR F. Varietal differences among the flavonoid profiles of white grape cultivars studied by highperformance liquid chromatography. Journal of Chromatography A, 2007, 1164(1/2): 291-297.
[11] HYE-JEONG PARK, HYEON-CHEOL CHA. Flavonoids from leaves and exocarps of the grape Kyoho. Korean Journal of Biological Sciences, 2010, 7(4): 327-330.
[12] 冯晨静, 关军锋, 杨建民. 草莓果实成熟期花青苷、酚类物质和类黄酮含量的变化. 果树学报, 2003, 20(3): 199-201.
FENG C J, GUAN J F, YANG J M. Change of the content of anthocyanin, phenolic and flavonoid compounds in strawberries during the maturation. Journal of Fruit Science, 2003, 20(3): 199-201. (in Chinese)
[13] 聂继云, 吕德国, 李静. 22种苹果种质资源果实类黄酮分析. 中国农业科学, 2010, 43(21): 4455-4462. NIE J Y, LÜ D G, LI J. A preliminary study on the flavonoids in fruits of 22 apple germplasm resources. Scientia Agricultural Sinica, 2010, 43(21): 4455-4462. (in Chinese)
[14] LEE K H, CHO J Y, LEE H J. Isolation and identification of phenolic compounds from an Asian pear (Pyrus pyrifolia Nakai) fruit peel. Food Science & Biotechnology, 2011, 20(6): 1539-1545.
[15] 曾少敏, 杨健, 王龙. 梨果实酚类物质含量及抗氧化能力. 果树学报, 2014, 31(1): 39-44.
ZENG S M, YANG J, WANG L. Study on phenolics content and its antioxidant activity in the fruits of pear species. Journal of Fruit Science, 2014, 31(1): 39-44. (in Chinese)
[16] 江丽芳. 雪花梨梨皮多酚含量测定. 化学工程与装备, 2011(12): 168-172.
JIANG L F. Determination of polyphenol content of snow pear skin. Chemical Engineering & Equipment, 2011(12): 168-172. (in Chinese)
[17] 张娜, 王国祥, ABACAR JOSE DANIEL. 超高效液相色谱法分析稻米酚酸化合物组分及其含量. 中国农业科学, 2015, 48(9): 1718-1726.
ZHANG N, WANG G X, ABACAR JOSE DANIEL. Determination of phenolic acids in rice by Ultra-High Performance Liquid Chromatography. Scientia Agricultural Sinica, 2015, 48(9): 1718-1726. (in Chinese)
[18] 曹玉芬. 梨种质资源描述规范和数据标准. 北京: 中国农业出版社, 2006.
CAO Y F. Descriptors and Data Standard for Pear (Pyrus spp.). Beijing: China Agricultulture Press, 2006.
[19] 郑迎春, 李静, 曹玉芬. 梨叶片中9种多酚类物质的UPLC测定方法. 果树学报, 2015, 32(6): 1258-1266.
ZHENG Y C, LI J, CAO Y F. Development and validation of a UPLC method for 9 polyphenols determination in pear leaves. Journal of Fruit Science. 2015, 32(6): 1258-1266. (in Chinese)
[20] CHEN S, WU B H, FANG J B. Analysis of flavonoids from lotus (Nelumbo nucifera) leaves using high performance liquid chromatography/photodiode array detector tandem electrospray ionization mass spectrometry and an extraction method optimized by orthogonal design. Journal of Chromatography A, 2012, 1227(5): 145-153.
[21] 袁宝仓. 宁南山区早酥梨栽培技术. 现代农业科技, 2014(20): 84-84.
YUAN B C. Cultivation Technique of ‘Zaosu’in Ning Nanshan District. Horticulture, 2014(20): 84-84. (in Chinese)
[22] 曹玉芬. 中国梨品种. 北京: 中国农业出版社, 2014: 96.
CAO Y F. Pear Varieties in China. Beijing: China Agriculture Press, 2014: 96. (in Chinese)
[23] GORNAS P, MISINA I, OLSTEINE A. Phenolic compounds in different fruit parts of crab apple: Dihydrochalcones as promising quality markers of industrial apple pomace by-products. Industrial Crops & Products, 2015, 74: 607-612.
[24] RENARD C M G C, DUPONT N, GUILLERMIN P. Concentrations and characteristics of procyanidins and other phenolics in apples during fruit growth. Phytochemistry, 2007, 68(8): 1128-1138.
[25] OLIVEIRA A P, PEREIRA J A, ANDRADE P B. Phenolic profile of Cydonia oblonga Miller leaves. Journal of Agricultural & Food Chemistry, 2007, 55(19): 7926-7230.
[26] 黄思思, 宁德生, 夏梦雯. 油梨不同部位总酚含量、抗氧化及抗菌活性. 广西科学院学报, 2016, 32(2): 1-4.
HHUANG S S, NING D S, XIA M W. Total phenolic content in vitro antioxidantand antimicrobial activities from different parts of avocado. Journal of Guangxi Academy of Science, 2016, 32(2): 1-4. (in Chinese)
[27] 张桂芝, 籍保平, 田芳. 苹果不同部位多酚的组成及抗氧化活性研究. 食品工业科技, 2015, 36(19): 133-137.
ZHANG G Z, JI B P, TIAN F. Composition and antioxidant activity of apple polyphenols in apple tissue zones. Science and Technology of Food Industry, 2015, 36(19): 133-137. (in Chinese)
[28] CUI T, KOZO NAKAMURA, MA L. Analyses of Arbutin and Chlorogenic Acid, the Major Phenolic Constituents in Oriental Pear. Journal of Agricultural & Food Chemistry, 2005, 53(10): 3882-3887.
[29] SALTA J, MARTINS, RUI G S. Phenolic composition and antioxidant activity of Rocha pear and other pear cultivars-A comparative study. Journal of Functional Foods, 2010, 2(2): 153-157.
[30] HE J, YIN T, CHEN Y. Phenolic compounds and antioxidant activities of edible flowers of Pyrus pashia. Journal of Functional Foods, 2015, 17: 371-379.
(责任编辑 赵伶俐)
The Composition and Content of Polyphenols in 16 Parts of ‘Zaosu’ and ‘Nanguoli’
ZHANG XiaoShuang, ZHENG YingChun, CAO YuFen, TIAN LuMing, DONG XingGuang, ZHANG Ying, QI Dan, HUO HongLiang
(Research Institute of Pomology, Chinese Academy of Agricultural Sciences/Laboratory of Quality and Safety Risk Assessment for Fruit (Xingcheng), Ministry of Agriculture, Xingcheng 125100, Liaoning)
pear; polyphenol; composition; content; UPLC
2016-06-06;接受日期:2016-09-01
国家现代梨产业技术体系建设专项(CARS-29-01)、中国农业科学院科技创新工程(CAAS-ASTIP-2016-RIP)
联系方式:张小双,Tel:18811773275;E-mail:xiaoshuangzhang@163.com。郑迎春,Tel:15733521806;E-mail:zhengyingchunaiyy@163.com。张小双和郑迎春为同等贡献作者。通信作者曹玉芬,Tel:0429-3598125;E-mail:yfcaas@263.net
Abstract:【Objective】 In order to find out the best parts for polyphenol extraction and also provide the basic information for further utilization of pear germplasm, the composition and contents of polyphenols in 16 different tissues of two pear cultivars (crisp-fleshed cultivar, ‘Zaosu’, and soft-fleshed cultivar, ‘Nanguoli’) were analyzed. 【Method】 UPLC method was applied to determine the composition and contents of polyphenols in 16 parts of ‘Zaosu’ and ‘Nanguoli’, and 35 standard phenolic compounds were used for the detection. Namely, arbutin, gallic acid, 3,4-dihydroxybenzoic acid, neochlorogenic acid, procyanidins B1, DL-catechin, chlorogenic acid, cryptochlorogenic acid, 3,4-dihydroxycinnamic acid, procyanidins B2, syringic acid, epicatechin, pro-cyanidins C1, cyclohexanecarboxylic acid, P-hydroxycinnamic acid, quercetin-arab-glucoside, rans-4-hydroxy-3-met-hoxycinnamic acid, rutin, quercetin-3-galactoside, quercetin-3-glucoside, luteolin-7-O-glucoside, isochlorogenic acid B, kaempferol-3-O-rutinoside, avicularin, isochlorogenic acid A, isorhamnetin-3-rutinoside, isorhamnetin-3-O-galactoside, isorhamnetin-3-O-glucoside, phlorizin dihydrate, resveratrol, cinnamic acid, qutercetin dihydrate, phloretin, apigenin and kaemferol.【Result】Twenty-three polyphenols, including two simple polyphenols, one benylidene, five kinds of caffeoylquinic acid, five flavanols, nine flavonols and one dihydrochalcone were detected in ‘Zaosu’. Twenty-one polyphenols, including two simple polyphenols, one phenolic acid, two kinds of benylidene, four kinds of caffeoylquinic acid, four flavanols and nine flavonols were detected in ‘Nanguoli’. For ‘Zaosu’, young leaves had the highest contents of polyphenols (93.82 mg·g-1), while flesh had the least (0.63 mg·g-1). Arbutin and chlorogenic acid were observed in all tested tissues, and the former was analyzed to be the most important polyphenol in all detected tissues except the flesh, with the contents ranging from 0.08 mg·g-1to 64.86 mg·g-1. Arbutin, syringic acid, chlorogenic acid, epicatechin, luteolin-7-O-glucoside and phlorizin dihydrate were the primary polyphenols in the six categories of detected polyphenols, with the contents of 403.5, 0.04, 79.83, 16.16, 9.07 and 0.13 mg·g-1, respectively. Different varieties of polyphenols were also detected in each tissue, 14 kinds of polyphenols were detected in mature leaf stalk and three kinds in xylem. For ‘Nanguoli’, young leaves had the highest contents of polyphenols (104.04 mg·g-1), while seeds had the least (2.66 mg·g-1). Arbutin and chlorogenic acid existed in all tested tissues, and the former was analyzed to be the most important polyphenol in all detected tissues except flesh and core, with the contents ranging from 0.87 mg·g-1to 51.75 mg·g-1. Arbutin, 3, 4-dihydroxybenzoic acid, chlorogenic acid, epicatechin, luteolin-7-O-glucoside and phlorizin dehydrate were the primary polyphenols in the six categories of detected polyphenols, with the contents of 357.29, 0.01, 0.08, 122.15, 12.89 and 4.87 mg·g-1, respectively. Up to 13 different polyphenols were detected in mature leaf stalk and skin and at least three in the core. Among the 16 detected tissues, young leaves contained the highest contents of polyphenols in both ‘Zaosu’ and ‘Nanguoli’. Fruit skin showed higher contents and more diversity of polyphenols than fruit core, flower stalk had higher contents of polyphenols than flower and phloem showed higher contents and more diversity of polyphenols than xylem. 【Conclusion】 Arbutin and chlorogenic acid were detected in all parts of ‘Zaosu’ and ‘Nanguoli’, and arbutin was the polyphenol with the highest content. The kinds of polyphenols detected in this research were unanimous except phlorizin and protocatechuic acid. Young leaves were relatively abundant in the composition and contents of polyphenols and therefore could be used as extraction resources for further development and utilization.
