重庆麦区小麦品种(系)抗条锈性评价与基因分析
2017-02-16李北徐琪杨宇衡王琪琳曾庆东吴建辉穆京妹黄丽丽康振生韩德俊
李北,徐琪,杨宇衡,王琪琳,曾庆东,吴建辉,穆京妹,黄丽丽,康振生,韩德俊
(1西北农林科技大学旱区作物逆境生物学国家重点实验室,陕西杨凌712100;2西北农林科技大学农学院,陕西杨凌712100;3西南大学植物保护学院,重庆 400716;4西北农林科技大学植物保护学院,陕西杨凌712100)
(1State Key Laboratory of Crop Stress Biology in Arid Areas, Northwest A&F University, Yangling 712100, Shaanxi;2College of Agronomy, Northwest A&F University, Yangling 712100, Shaanxi;3College of Plant Protection, Southwest University, Chongqing 400716;4College of Plant Protection, Northwest A&F University, Yangling 712100, Shaanxi)
重庆麦区小麦品种(系)抗条锈性评价与基因分析
李北1,2,徐琪1,2,杨宇衡1,3,王琪琳1,4,曾庆东1,4,吴建辉1,4,穆京妹1,2,黄丽丽1,4,康振生1,4,韩德俊1,2
(1西北农林科技大学旱区作物逆境生物学国家重点实验室,陕西杨凌712100;2西北农林科技大学农学院,陕西杨凌712100;3西南大学植物保护学院,重庆 400716;4西北农林科技大学植物保护学院,陕西杨凌712100)
【目的】重庆是中国小麦条锈病流行体系中重要冬繁区,准确评价该地区小麦品种(系)对当前小麦条锈病流行小种的抗性和了解抗条锈基因在该区的分布状况,为小麦安全生产、品种合理布局及小麦抗条锈育种工作提供依据。【方法】从该区征集了18份当地主栽品种和89份高代品系材料,应用中国小麦条锈菌流行生理小种条中32(CYR32)、条中33(CYR33)、V26/G22-9和V26/CM42,在杨凌进行苗期分小种(CYR32、CYR33、V26/G22-9和V26/CM42)温室抗病性鉴定、并于2015年和2016年连续两年分别进行杨凌成株期条锈菌混合小种(CYR32、CYR33)人工接种病圃和天水自然诱发条锈菌病圃鉴定,根据苗期和田间成株期的抗病性鉴定结果对其进行抗病类型分类和评价;结合抗谱分析、参照单基因系材料的感病结果,及以Yr5、Yr9、Yr10 、Yr15、Yr17、Yr18和Yr26等7个已知抗条锈基因的标记分别进行的分子检测分析,推测小麦材料可能携带抗病基因。【结果】在107份参鉴材料中,苗期对CYR32与CYR33均表现免疫或者近免疫的品种(系)有57份,占53.27%;对CYR32、CYR33和V26/CM42均表现免疫或者近免疫的品种(系)只有11份,占10.28%;对CYR32、CYR33和V26/G22-9均表现免疫或者近免疫的品种(系)只有9份,占8.41%。综合评价,全生育期抗性的材料仅有8份,占7.48%;成株期抗病材料仅有9份,占8.41%;感病材料90份,占84.11%。分子检测表明,供试材料中21份可能含有Yr9,39份可能含有Yr26,17份可能含有Yr17,3份可能含有Yr18。其他材料中未检测到上述Yr基因(分子标记)的存在,其中没有发现可能含Yr5、Yr10和Yr15的材料。8份具有全生育期抗性的材料,未检测到上述Yr基因(分子标记)的存在,可能含有未检测到的其他抗病基因。【结论】重庆地区小麦品种(系)对小麦条锈菌当前流行小种的抗性整体水平较低,尤其是含Yr26的材料在育种中被广泛而单一地利用。建议利用多基因聚合育种等手段提高当地小麦品种的抗条锈性。
小麦条锈病;抗病基因;标记辅助检测;重庆麦区
0 引言
【研究意义】由条形柄锈菌(Puccinia striiformis f. sp. tritici)引起的小麦条锈病是世界性气传病害,具有流行性强、波及范围广、破坏性大等特点[1-3]。中国大部分小麦主产区都面临该病害威胁,每年因其造成损失严重。四川盆地是中国小麦条锈菌最重要的冬繁区,是引起东部麦区条锈病春季流行最重要的菌源输出地[2,4-6]。因此,有效降低冬繁区菌源量,调控其菌源毒性结构,对中国小麦条锈病大区综合治理具有重要意义。重庆地处四川盆地东部,小麦种植面积维持13万hm2左右[7],为小麦条锈病常发区,是小麦条锈菌冬繁区与长江中下游麦区的接合部位,是陕南及黔西小麦条锈菌冬繁区与长江中下游冬麦区的接合部位,是条锈菌最重要的冬繁区之一,在中国条锈病大区流行中,扮演着对菌源进行选择性放大繁殖的“桥梁”作用[5]。目前,重庆小麦主导品种是渝麦系列(占70%以上),其次是川麦系列和内麦系列[7],以及其他农民种植多年的自留品种。全面了解重庆地区小麦品种(系)抗条锈性水平,以及抗病基因应用情况,对于当地及整个东部麦区小麦生产安全有重要意义。【前人研究进展】种植小麦抗病品种被认为是控制条锈病最经济、最有效、最环保的方法,然而条锈菌新小种的产生和发展是小麦抗性“丧失”的主要原因[8]。迄今为止,中国已经发生了7次小麦品种大面积“丧失”抗性事件[9-11]。自 2000年以来,条中32(CYR32)和条中 33(CYR33)已成为中国最主要的毒性小种,二者对中国1B/1R等众多小麦抗源具有毒力[12-13]。由于携带Yr26(=Yr24)的92R系和贵农系抗源对CYR32和CYR33等当时的主要流行小种具有良好抗病性,因此,在条锈病发病严重的西南麦区和西北麦区被广泛应用。然而,2009年以来,在四川西北部和甘肃南部等地先后发现对小麦抗条锈基因Yr26具有毒性的菌株[14],特别是有些新菌系对Yr10和Yr26等抗病基因具有联合毒性,这将导致中国当前生产上应用较多的携带Yr26的92R系列抗源和贵农系列抗源将面临抗性丧失的威胁[4,15]。HAN等[4]对四川盆地中西部麦区主要栽培小麦品种(系)进行抗病性评价和抗条锈病基因分析,结果表明,参试85份小麦品种(系)中,仅有4个品种表现全生育期抗病性,20个品种苗期感染所有参试小种,特别是对Yr26有毒性的类群对76.5%品种对表现苗期感病,基因分析表明,38.8%品种携带Yr26。【本研究切入点】同为中国小麦条锈菌重要冬繁区的重庆麦区,在该病害流行中起到关键作用,然而其小麦品种(系)抗性水平和抗病基因分布情况至今未见系统研究。这对于指导抗病育种,抗病品种的合理布局和病害预测预报是不利的。【拟解决的关键问题】本研究从重庆麦区征集了107份当前小麦主栽品种(18份)以及高代品系材料(89份),分别进行苗期分小种、成株期混合小种和“天水自然诱发条锈菌病圃”不同地点、多层次的抗条锈病性鉴定,同时利用已知抗条锈病基因 Yr5[16]、Yr9[17]、Yr10[17]、Yr15[18]、Yr17[19]、Yr18[20-21]和Yr26[22]等标记进行分子检测,同时结合抗谱鉴定结果和育种系谱回查等数据,对小麦品种(系)进行抗病基因分析,以期对当前重庆麦区小麦品种(系)抗条锈性水平和抗病基因应用情况进行整体评估,为当地小麦抗病育种方向确立和抗病品种(基因)的合理布局,以及病害的预测预报提供依据,而且对中国大区范围条锈病害持续控制策略的制定具有重要参考价值。
1 材料与方法
1.1 试验材料
供试的重庆主栽品种以及高代品系材料,共计107份,由西南大学农学院提供。抗条锈近等基因系材料由美国华盛顿州立大学陈贤明教授提供。
苗期抗条锈病鉴定分别采用当前流行小种CYR32和CYR33及V26/CM42和V26/G22-9(表1)。其中,V26/CM42标样来自四川,V26/G22-9标样来自甘肃。成株期混合小种接种鉴定,杨凌人工诱发条锈菌病圃采用条锈菌小种包括 CYR32、CYR33混合小种,同时在甘肃天水设置小麦条锈菌自然发病圃鉴定。供试菌种由西北农林科技大学植物病理研究所经单孢分离获得,并经一系列小麦条锈病鉴别寄主鉴定,隔离繁殖后备用。
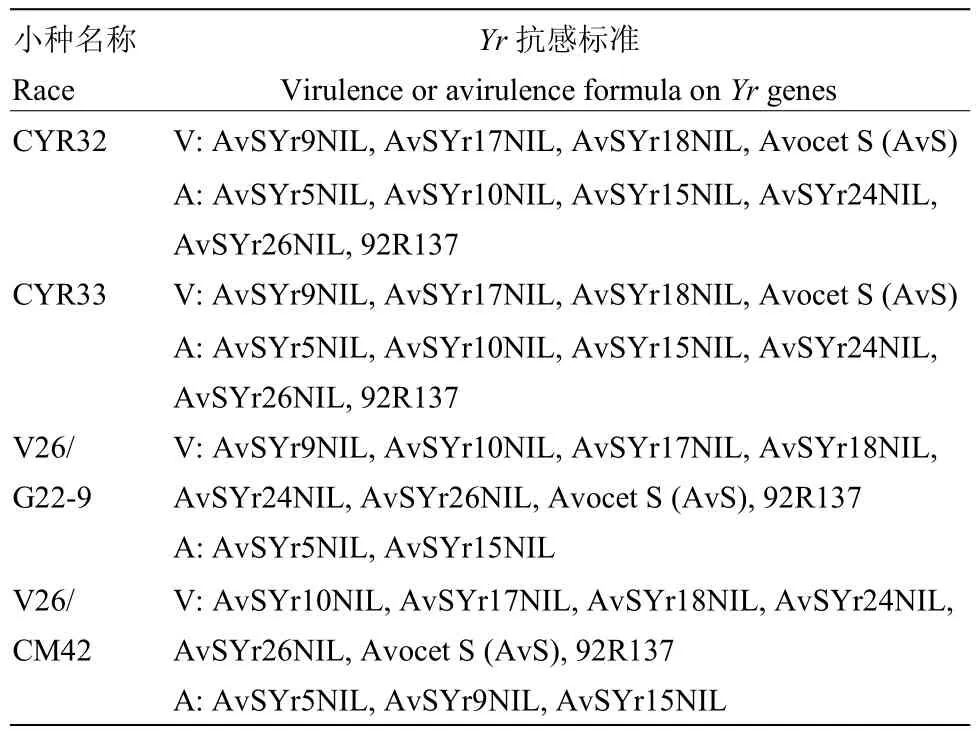
表1 参试小种基于Yr单基因系和Yr26载体品种的毒谱分析Table 1 Infection types of Puccinia striiformis f. sp. tritici races used in the study and their virulence spectra on Yr single-gene lines and Yr26 donor line
1.2 苗期接种鉴定
苗期鉴定参考文献[13],在西北农林科技大学植物病理研究所温室中进行,参鉴小麦品种(系)分别接种条锈菌CYR32、CYR33、V26/CH42和V26/G22-9,以铭贤 169作为感病对照。将参鉴材料播于 8 cm× 8 cm的花盘中,每份材料种10—15粒,于温室中培养。小麦2叶期接种,条锈菌夏孢子与滑石粉按照1﹕50混匀,抖粉法接种,在保湿箱中培养24 h后,于温室中培养。光/暗周期为16 h/8 h,昼夜温度为18℃/12℃[23]。待感病对照充分发病时记载反应型,此后每隔3 d调查1次,累计调查3次以上,按照0—9级标准[24]记载反应型。
1.3 人工诱发条锈病抗性鉴定
于2014—2016年,每年在陕西杨凌西北农林科技大学实验站设置条锈菌人工病圃,进行成株期抗条锈病鉴定。每份小麦材料种植2行(行长100 cm,行距25 cm),每隔20个品种种植2行小偃22作为发病指示品种,供试品种两侧垂直种植1行感病品种铭贤169作为诱发行。每年3月中上旬小麦拔节初期,在诱发行混合接种小麦条锈菌流行小种条中 32(CYR32)和条中 33(CYR33),4月中下旬及 5月中旬,感病指示品种小偃22均匀发病后,调查成株期小麦发病情况。按照参考文献[24-26]的方法,分别调查反应型(infection type,IT)和严重度(severity,S),按0—9级标准记载反应型,根据IT抗病级别分为4个类型[27]:抗病(resistance,R,IT:0—3)、中抗(moderate resistance,MR,IT:4—6)、中感(moderate susceptible,MS,IT:7)、感病(susceptible,S,IT:8—9)。参考文献[28]标准记载严重度:0、5%、10%、20%、30%、40%、50%、60%、70%、80%、90%和100%。
1.4 自然诱发条锈病抗性鉴定
条锈病自然发病圃设置在甘肃省天水市平南镇万家村(北纬34°27′,东经105°56′,海拔1 697 m),种植方式同上。分别于5月中旬至6月中旬,待感病指示品种小偃22充分发病时,进行成株期抗条锈性鉴定,至少鉴定3次,鉴定标准同上。
1.5 抗病基因分子检测
选用Yr5、Yr9、Yr10、Yr15、Yr17、Yr18和Yr26共7个抗病基因已开发的标记对参鉴材料进行分子检测[29-30]。用改良的 CTAB法[31]提取幼叶 DNA;分别按照相关文献的方法对各 Yr基因的标记进行扩增和检测。
2 结果
2.1 参鉴品种(系)条锈病抗病评价
2.1.1 参鉴品种(系)苗期鉴定结果分析 分别采用当前流行的小种CYR32、CYR33和对Yr26有毒性的2个新菌系:V26/CM42和V26/G22-9,对参鉴的18份当地主栽品种和 89份高代品系材料进行抗病鉴定(表2)。参鉴材料中,苗期抗条锈病(IT≤6)流行小种CYR32、CYR33、V26/G22-9和V26/CM42的分别有62(57.94%)份、72(67.29%)份、13(12.15%)份和32(29.91%)份,其中,有57份对CYR32和CYR33都有抗性,约占53%;有11份对CYR32、CYR33、V26/CM42都有抗性,约占10%;有9份对CYR32、CYR33和V26/G22-9都有抗性,约占8%;仅有9份对4个参鉴小种都具有抗性,约占8%,且都为高代品系材料。表明重庆地区小麦参鉴品种在苗期对于当前流行小种整体抗性水平较低,主栽品种尤为显著。
2.1.2 参鉴品种(系)成株期鉴定结果分析 在杨凌设置人工诱发条锈菌病圃和天水的自然诱发条锈菌病圃,对参鉴材料进行成株期鉴定(表 2)。在杨凌诱发当前流行小种(CYR32和CYR33)的人工病圃条件下,参鉴材料中抗病材料 57份(53.27%),感病材料50份(46.73%);在天水自然诱发圃中,17份(15.89%)材料在成株期表现抗病性,其余 90份(84.11%)表现为感病。对比两地结果,其中,有40份(37.38%)材料在杨凌抗病,在天水变为感病材料,由于甘肃南部和四川北部地区条锈菌群体毒性结构复杂[32],最近的研究表明这些地区条锈菌的优势小种为CYR32、CYR33以及毒性频率正在升高的对Yr26有毒性的小种[33],参照两地单基因系材料的感病情况,推测可能由于天水自然诱发圃菌源毒性结构复杂造成。
2.1.3 参鉴品种(系)条锈病抗病综合评价 综合苗期和成株期抗性鉴定结果,绵麦374等8份具有全生育期抗性(all stage resistance,ASR),约占7.48%;无主栽品种,内麦836等9份具有成株期抗性(adult plant resistance,APR),约占8.41%,主栽品种占3份,川麦68等90份完全感病(susceptible,S),约占84.11%,主栽品种占15份。值得关注的是参鉴材料中,具有全生育期抗性的材料仅占8份,其中并没有当地主栽品种,这种情况会加速冬繁区条锈菌的哺育和传播,为春季流行区提供充足菌源。
2.2 参鉴品种(系)的抗病基因分析
利用已开发的小麦抗条锈病主效基因Yr5、Yr9、Yr10、Yr15、Yr17、Yr18和Yr26的稳定可靠的分子标记,对参鉴的小麦进行分子标记筛查,分别以Avocet S(AvS)和各个单基因系材料作为阴阳对照(表1),结合抗病表现和检测结果综合分析(表 2)。参鉴的107份材料中,21份检测到Yr9标记;17份检测到Yr17标记;3份检测到Yr18标记;39份检测到Yr26标记。另外,6份同时检测到Yr9和Yr17标记;6份同时检测到Yr17和Yr26标记;仅1份同时检测到Yr18和Yr26标记。未检测到Yr5、Yr10和Yr15的标记。8份具有全生育期抗性的材料可能含有未检测到的抗病基因。图1为Yr基因使用情况,图2为部分小麦品种用WE173检测Yr26电泳图,电泳图谱的分子检测结果与抗性表型和系谱分析的综合结果相符。
在18份当地主栽品种中,渝麦7号和昌麦26检测到Yr9标记,约占11%;滇麦1号和昌麦26检测到Yr17标记,约占11%;仅有糯麦1号检测到Yr18标记,约占5%;川麦104等6份材料检测到Yr26标记,约占33%;而仅有昌麦26同时检测到Yr9和Yr17 2个基因标记。
在89份高代品系材料中,南30-7等19份材料检测到Yr9标记,约占21%;西2474等15份材料检测到Yr17标记,约占17%;川13015等2份材料检测到Yr18标记,约占2%;绵06-367等33份材料检测到Yr26标记,约占37%;5区3等5份材料同时检测到Yr9和Yr17标记;13/2-3-71等6份材料同时检测到Yr17和Yr26标记;仅12/川育16同时检测到Yr18和Yr26标记;共计12份材料同时检测到2个基因的标记,约占13%。
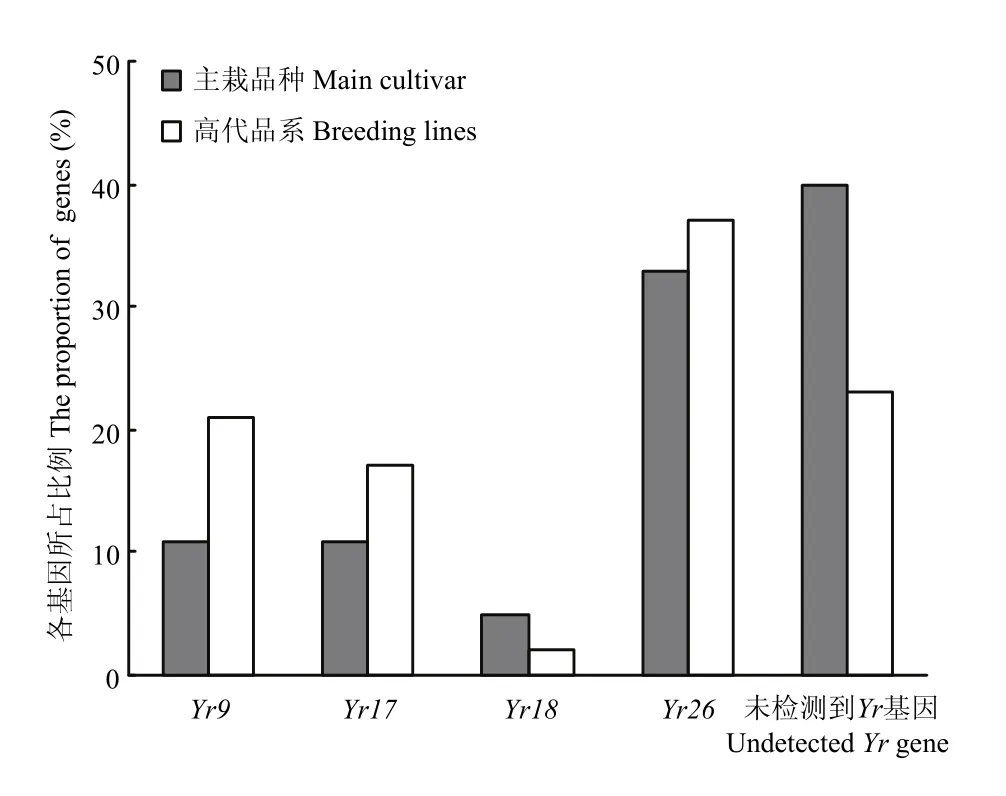
图1 Yr使用情况Fig. 1 Used condition of Yr gene
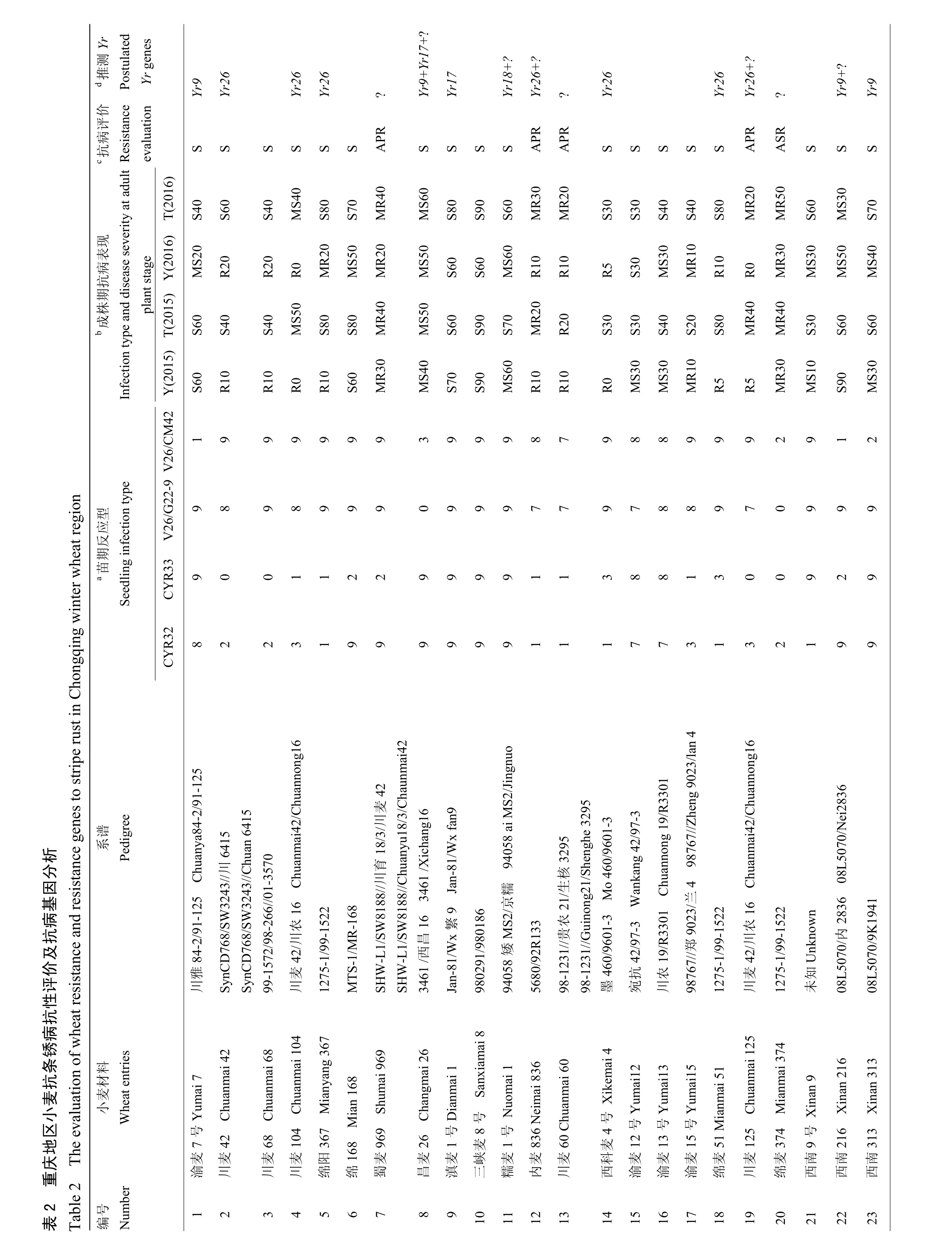
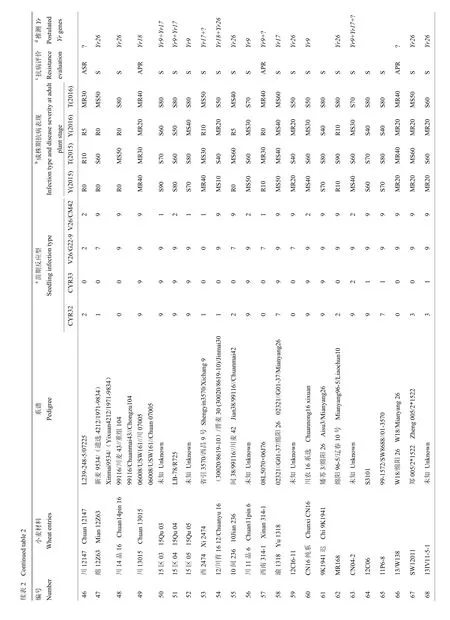
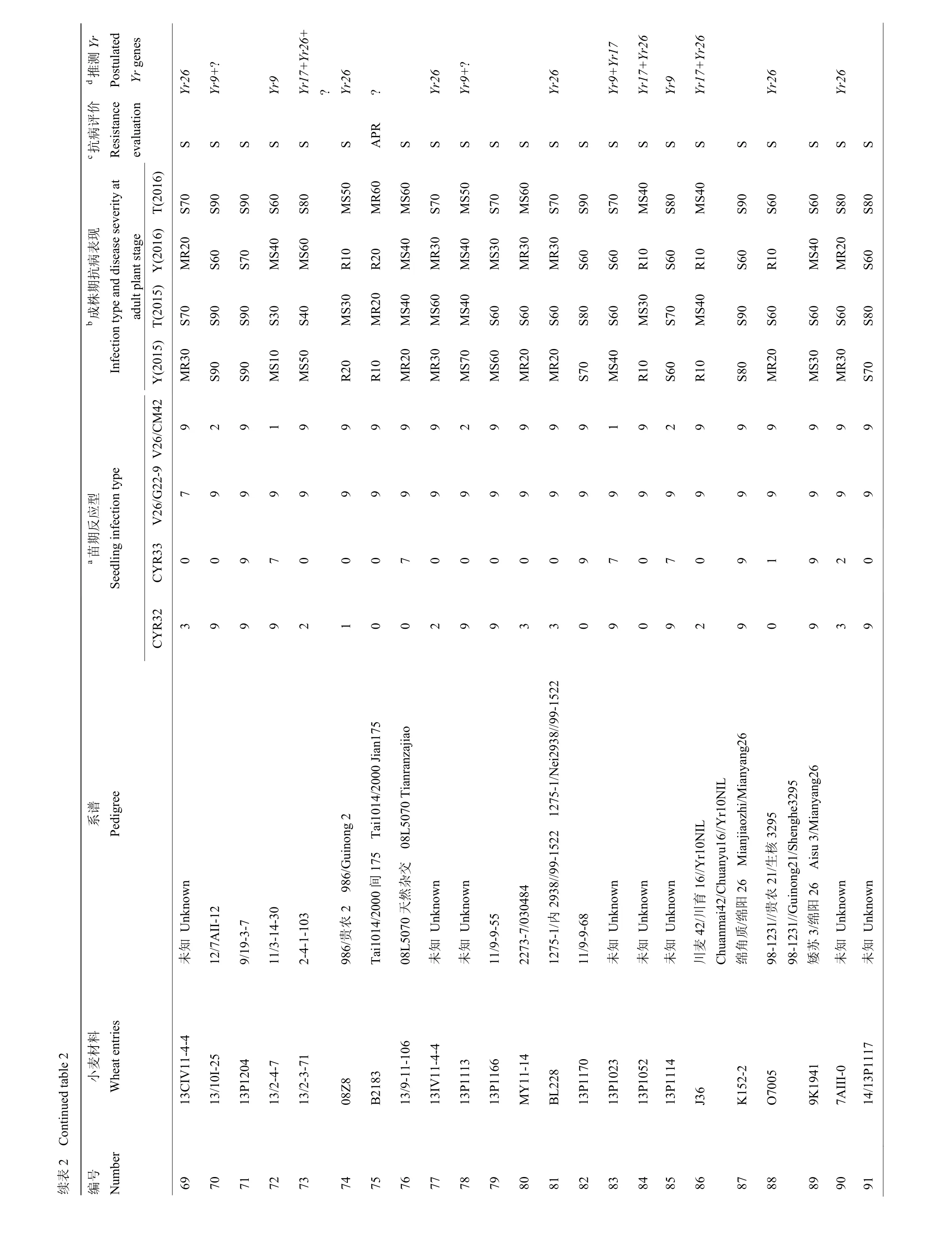
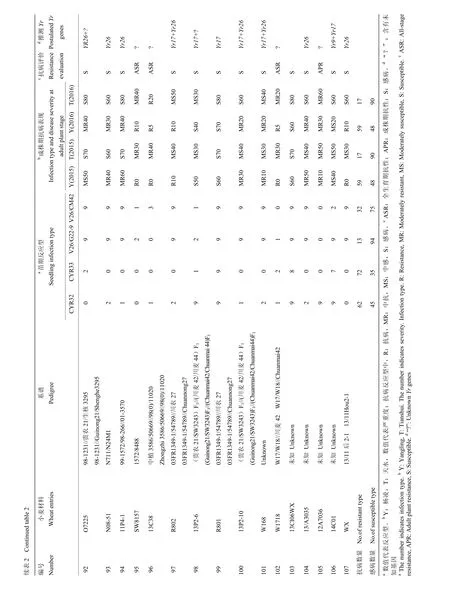
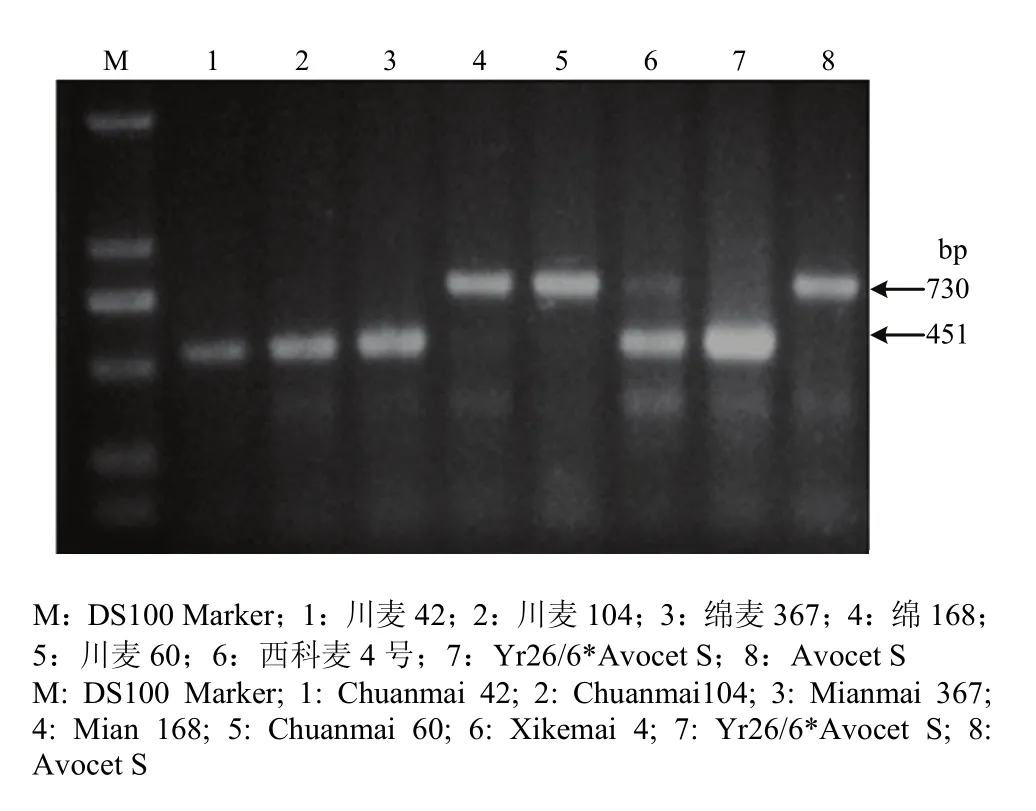
图2 WE173检测部分小麦材料的Yr26电泳图Fig. 2 The PCR products of WE173 for Yr26 detection
3 讨论
3.1 重庆麦区在中国小麦条锈病大区流行中的地位
四川盆地是中国小麦条锈菌重要的冬繁区,在条锈病大区流行中具有重要地位[2,4]。由于其亚热带季风性湿润气候,“温暖”冬季最低气温平均为 6—8℃,因此,晚秋(10月下旬至11月初)播种的小麦始终保持生长,为条锈菌大量繁殖提供了机会。与越夏区“迁徙式”侵染增殖方式不同,冬繁区的条锈菌,从11月至翌年3月,可“定居”在同一品种上持续发生多次自侵染循环(polycyclic disease with autoinfection),一方面强化了病原菌适应性进化(淘汰适应性差的个体);另一方面,小麦品种依据其所携带Yr基因,选择性地使与之有匹配毒性的条锈菌小种得以快速大量增殖。位于四川盆地东南部的重庆地区(东经105°17′—110°11′、北纬 28°10′—32°13′),是来自陇南和川西北“东进”菌源和来自云贵“北上”菌源的冬季繁殖汇聚地[5,32,34-36],往往于1月中下旬条锈病显症,2月出现发病中心,3月初条锈病发病面积可达2万hm2左右,4月下旬感病最严重,感病面积达4万hm2左右。这些感病麦田无疑产生大量条锈菌的夏孢子,随气流向东部黄淮和长江中下游麦区传播。众所周知,3—4月期间,正好是中国东部广大麦区小麦返青、拔节-抽穗期,如果接受到冬繁区的菌源,必将导致更大规模的条锈病流行[2-3]。作为条锈菌菌源输出地的重庆麦区,对于春季向各地流行区输出菌源结构有关键性影响。因此,重庆地区推广的主栽品种应具备两方面的职能:(1)减少春季流行区菌源量;(2)稳定病原菌毒性小种的群体结构,特别要避免对新毒性小种进行“选择性”放大增殖,否则将导致条锈病大区流行。因此,重庆麦区小麦品种应具有苗期抗病性,且所用主效抗病基因必须多样化,同时必须有别于菌源越夏易变区小麦品种。
3.2 当前重庆地区小麦品种(系)的抗条锈病水平
本研究对重庆麦区主栽品种和高代品系共 107份材料进行苗期和成株期抗条锈性鉴定,结果表明,参鉴的18份主栽品种中,3份表现为成株期抗性,15份表现为感病;在89份高代品系材料中,仅有8份表现为全生育期抗性,6份表现为成株期抗性,其余75份表现为感病。苗期分小种鉴定结果表明,57份材料对当前的流行小种CYR32和CYR33具有抗性,然而,当鉴定小种中加入来自四川小麦品种川麦42标样分离的新菌系V26/CM42和来自甘肃天水小麦抗源贵农22标样分离的V26/G22新菌系后,分别仅有11份和9份保持苗期抗性,且均为高代品系材料。表明重庆麦区当前小麦品种(系)苗期抗条锈病性水平整体较低,这意味着一定气候条件合适,90%以上的小麦品种(系)都可以成为各小种的哺育品种,将为东部广大麦区提供春季流行菌源。综合苗期和成株期鉴定结果,该地区小麦品种(系)对当前流行小种的整体抗锈性水平偏低,因此,目前,乃至相当长一段时间,很难通过品种抗病性来有效降低冬繁区输出的菌源量。建议在有效压缩感病品种面积的同时,在条锈病病准确预测、预报基础上,加强化学防控。
3.3 重庆地区小麦品种(系)抗条锈病基因应用状况
重庆小麦抗条锈病基因的布局,在考虑保证当地小麦安全生产的同时也要顾及全国条锈病流行的大局。本研究集抗病表现,分子检测结果和品种(系)系谱追踪进行综合分析,在 107份重庆小麦品种(系)中,39份鉴定出携带Yr26,约占36%,根据这些材料的系谱分析,发现Yr26载体品种主要有川麦42、人工合成小麦及贵农系列,对小种CYR32、CYR33表现抗性,随着对 Yr26有毒性的小种V26/G22-9和V26/CM42出现,其苗期和成株期抗性相应丧失,与系谱分析和参试小种的毒性基因分析一致。当前新毒性小种V26对Yr26和Yr10都具备毒性[15],然而重庆地区Yr26应用过于频繁,当对Yr26有毒性的新小种出现时,易导致该地麦区大面积抗性丧失,甚至波及东部麦区的生产安全,导致新毒性小种大区流行,这一现实值得育种家们重视。Yr9和Yr17分别在参鉴品种中约占20%和16%,鉴定结果显示Yr9对V26/CM42仍具有抗性,而Yr17已经完全丧失抗性,与参试小种的毒性基因分析一致。在分子检测过程中,虽然发现了一些基因聚合和品种在应用,但是在新小种的侵染下,仍然不具备抗病能力。此外,可能还有未知基因的具备全生育期抗性的绵麦374、川13071等8份材料,对新的毒性小种V26/G22-9和V26/CM42依然保持良好抗性,对当地小麦抗锈育种和安全生产具有重大的应用潜力。
3.4 重庆地区小麦品种(系)培育方向
重庆地区小麦品种(系)抗条锈水平普遍偏低,主栽品种尤为严重,未发现全生育期抗性的材料,小麦条锈菌可以继续扩大繁殖,可为春季流行区提供充足菌源。参鉴的高代品系材料总体抗性水平比主栽品种有所提高,建议加强全生育期抗性品种的选育,并合理搭配使用避免大面积种植单一抗性基因品种,尽可能实现品种抗病基因多样化[37],减缓病菌的繁殖和积累,减少优势小种的出现频率。作为重要的小麦条锈菌冬繁区,重庆地区可通过合理布局抗病基因,稳定病原菌毒性小种的群体结构,降低新流行小种的产生频率,遏制新毒性小种的哺育及向春季流行区传播,避免其危害黄淮海和长江中下游麦区。建议对重庆麦区主栽品种(系)进行多年多点的抗病鉴定和评价,在了解材料中所含抗病基因的基础上[38],选有限的主效抗病基因,特别是一些具有全生育期抗病性新基因的使用,淘汰严重感病的品种,压缩主栽品种川麦42、绵麦367等感病材料的使用面积,推迟新致病小种的产生和蔓延,进一步优选新的高抗品种来提高小麦抗病育种的整体水平。
4 结论
重庆地区小麦品种(系)抗条锈性整体水平极度偏低,必须挖掘具有全生育期抗病性的新抗源,加强条锈病病害的预报和化学防治,以减少春季流行区菌源量,避免大区流行;Yr26过于单一使用,建议加强抗病基因多样化,利用多基因聚合等手段聚合 Yr5、 Yr15和其他新的有效全生育期抗病基因,以及加强如Yr18等成株期抗病基因的使用,提高抗病性,稳定病原菌毒性小种的群体结构。
[1] RAPILLY F. Yellow rust epidemiology. Annual Reviews of Phytopathology, 1979, 17: 59-73.
[2] 李振岐, 曾士迈. 中国小麦锈病. 北京: 中国农业出版社, 2002: 370-373.
LI Z Q, ZENG S M. Wheat Rust in China. Beijing : China Agriculture Press, 2002: 370-373. (in Chinese)
[3] ZENG S M, LUO Y. Long-distance spread and interregional epidemics of wheat stripe rust in China. Plant Disease, 2006, 90(8): 980-988.
[4] HAN D J, WANG Q L, CHEN X M, ZENG Q D, WU J H, XUE W B, ZHAN G M, HUANG L L, KANG Z S. The emerging Yr26-virulent races of Puccinia striiformis f. sp. tritici are threatening the wheat production in the Sichuan basin, China. Plant Disease, 2015, 99(6): 754-760.
[5] 杨宇衡, 宿巧燕, 王泽乐, 周天云, 刘祥贵, 毕朝位, 余洋, 康振生. 重庆市小麦条锈病发生规律和影响因素分析. 西北农科技大学学报(自然科学版), 2016(9):151-157.
YANG Y H, SU Q Y, WANG Z L, ZHOU T Y, LIU X G, BI C W, YU Y, KANG Z S. Occurrence regularity and influencing factors of wheat stripe rust in Chongqing. Journal of Northwest A&F University (Natural Science Edition), 2016(9):151-157. (in Chinese)
[6] 张培禹, 曾庆东, 王琪琳, 康振生, 韩德俊. 四川盆地小麦品种(系)抗条锈性鉴定与评价. 麦类作物学报, 2012(4): 779-783.
ZHANG P Y, ZENG Q D, WANG Q L, KANG Z S, HAN D J. Identification and evaluation of resistance to stripe rust in current wheat cultivars (lines) form Sichuan Basin. Journal of Traticeae Crops, 2012(4): 779-783. (in Chinese)
[7] 卢建文, 李伯群. 重庆小麦产业的现状问题及对策. 南方农业, 2014(22): 49-51.
LU J W, LI B Q. The status quo of chongqing wheat industry problems and countermeasures. South China Agriculture, 2014(22): 49-51. (in Chinese)
[8] LINE R F, CHEN X M. Successes in breeding for and managing durable resistance to wheat rusts. Plant Disease, 1995, 79(12): 1254-1255.
[9] ZENG S M, ZHANG Z S. Epidemiology Research for Plant Resistance Breeding. Beijing: Science Press, 1988.
[10] WAN A M, NIU Y C, WU L R. Physiologic specification of stripe rustof wheat in China during 1991-1996. Acta Phytopathologica Sinica, 1999, 29(1): 15-21.
[11] LI Q, XIA T, LI J J. Determination of pathogenic range of T4 new strains of Puccinia strifformis f.sp. tritici to ‘Zhou4’. Acta Phytopathologica Sinica, 2011, 41(6): 604-610.
[12] KANG Z S, ZHAO J, HAN D J, ZHANG H C, WANG C F, HAN Q M, GUO J, HUANG L L. Status of wheat rust research and control in China//BGRI 2010 Technical Workshop Oral Presentations. St Petersdurg, Russia, 2010(5): 1-21.
[13] 韩德俊, 王琪琳, 张立, 魏国荣, 曾庆东, 赵杰, 王晓杰, 黄丽丽,康振生. “西北-华北-长江中下游”条锈病流行区系当前小麦品种(系)抗条锈病性评价. 中国农业科学, 2010, 43(14): 2889-2896.
HAN D J, WANG Q L, ZHANG L, WEI G R, ZENG Q D, ZHAO J, WANG X J, HUANG L L, KANG Z S. Evaluation of resistance current wheat cultivars to stripe rust in Northwest China, North China and Middle and Lower Reaches of Changjiang River epidemic area. Scientia Agricultura Sinica, 2010, 43(14): 2889-2896. (in Chinese)
[14] LIU T G, PENG Y L, CHEN W Q, ZHANG Z Y. First detection of virulence in Puccinia striiformis f. sp tritici in China to resistance genes Yr24 (=Yr26) present in wheat cultivar Chuanmai 42. Plant Disease, 2010, 94(9): 1163.
[15] 刘太国, 章振羽, 刘博, 高利, 彭云良, 陈万权. 小麦抗条锈病基因Yr26毒性小种的发现及其对我国小麦主栽品种苗期致病性分析.植物病理学报, 2015(1):41-47.
LIU T G, ZHANG Z Y, LIU B, GAO L, PENG Y L, CHEN W Q. Detection of virulence to Yr26 and pathogenicity to Chinese commercial winter wheat cultivars at seedling stage. Acta Phytopathologica Sinica, 2015(1): 41-47. (in Chinese)
[16] YAN G P, CHEN X M, LINE R F, WELLINGS C R. Resistance gene-analog polymorphism markers co-segregating with the Yr5 gene for resistance to wheat stripe rust. Theoretical and Applied Genetics, 2003, 106(4): 636-643.
[17] SMITH P H, KOEBNER R, BOYD L A. The development of a STS marker linked to a yellow rust resistance derived from the wheat cultivar Moro. Theoretical and Applied Genetics, 2002, 104(8): 1278-1282.
[18] MURPHY L R, SANTRA D, KIDWELL K, YAN G, CHEN X, CAMPBELL K G. Linkage maps of wheat stripe rust resistance genes Yr5 and Yr15 for use in marker-assisted selection. Crop Science, 2009, 49(5): 1786-1790.
[19] BARIANA H S, MCINTOSH R A. Characterization and origin of rust and powderymildew resistance genesin VPM1 wheat. Euphytica, 1994, 76(1/2): 53-61.
[20] LAGUDAH E S, KRATTINGER S G, HERRERA-FOESSEL S, SINGH R P, HUERTA-ESPINO J, SPIELMEYER W, BROWNGUEDIRA G, SELTER L L, KELLER B. Gene-specific markers for the wheat gene Lr34/Yr18/Pm38 which confers resistance to multiple fungal pathogens. Theoretical and Applied Genetics, 2009, 119(5): 889-898.
[21] 曾庆东, 吴建辉, 王琪琳, 韩德俊, 康振生. 持久抗病基因Yr18在中国小麦抗条锈育种中的应用. 麦类作物学报, 2012(1): 13-17.
ZENG Q D, WU J H, WANG Q L, HAN D J, KANG Z S. Application of durable resistance gene Yr18 to stripe rust in Chinese wheat breeding. Journal of Traticeae Crops, 2012(1): 13-17. (in Chinese)
[22] WANG C M, ZHANG Y P, HAN D J, KANG Z S , LI G P, CAO A Z, CHEN P D. SSR and STS markers for wheat stripe rust resistance gene Yr26. Euphytica, 2008, 159(3): 359-366.
[23] 周新力, 詹刚明, 黄丽丽, 韩德俊, 康振生. 80份国外春小麦种质资源抗条锈性评价. 中国农业科学, 2015, 48(8): 1518-1526.
ZHOU X L, ZHAN G M, HUANG L L, HAN D J, KANG Z S. Evaluation of resistance to stripe rust in eighty abroad spring wheat germplasms. Scientia Agricultura Sinica, 2015, 48(8): 1518-1526. (in Chinese)
[24] MCNEAL F H, KONZAC C F, SMITH E P, TATE W S, RUSESLL T S. A uniform system for recording and processing cereal research data//Agricultural Research Service Bulletin. Washington: United States Department of Agriculture, 1971: 34-121.
[25] TESTER M, LANGRIDGE P. Breeding technologies to increase crop production in a changing world. Science, 2010, 327(5967): 818-822.
[26] LOWE I, JANKULOSKI L, CHAO S, CHEN X, SEE D, DUBCOVSKY J. Mapping and validation of QTL which confer partial resistance to broadly virulent post-2000 North American races of stripe rust in hexaploid wheat. Theoretical and Applied Genetics, 2011, 123(1): 143-157.
[27] 魏国荣, 韩德俊, 赵杰, 王晓杰, 王琪琳, 黄丽丽, 康振生. 小麦成株期抗条锈病种质筛选与评价. 麦类作物学报, 2011(2): 376-381.
WEI G R, HAN D J, ZHAO J, WANG X J, WANG Q L, HUANG L L, KANG Z S. Identification and evaluation of adult plant resistance to stripe rust in wheat germplasms. Journal of Traticeae Crops, 2011(2): 376-381. (in Chinese)
[28] PETERSON R F, CAMPELL A, HANNAH A. A diagrammatic scale for estimating rust intensity on leaves and stems of cereals. Canadian Journal of Research, 1948: 426-496.
[29] ZENG Q D, HAN D J, WANG Q L, YUAN F P, WU J H, ZHANG L, WANG X J, HUANG L L, CHEN X M, KANG Z S. Stripe rustresistance and genes in Chinese wheat cultivars and breeding lines. Euphytica, 2014, 196(2): 271-284.
[30] ZHANG X J, HAN D J, ZENG Q D, DUAN Y H, YUAN F, SHI J, WANG Q, WU J, HUANG L, KANG Z. Fine mapping of wheat stripe rust resistance gene Yr26 based on collinearity of wheat with brachypodium distachyon and rice. PLoS ONE, 2013, 8: e578853.
[31] HILL-AMBROZ K L, BROWN-GUEDIRA G L, FELLERS J P. Modified rapid DNA extraction protocol for high throughput microsatellite analysis in wheat. Crop Science, 2002, 42(6): 2088-2091.
[32] BROWN J, HOVMOLLER M S. Epidemiology-aerial dispersal of pathogens on the global and continental scales and its impact on plant disease. Science, 2002, 297(5581): 537-541.
[33] 王付平, 詹刚明, 魏国荣, 黄丽丽, 康振生, 韩青梅. 陇南不同区域内两个小麦品种上条锈菌群体的毒性分析. 麦类作物学报, 2014(8): 1146-1152.
WANG F P, ZHAN G M, WEI G R, HUANG L L, KANG Z S, HAN Q M. Population virulence analysis of Puccinia striiformis f. sp. tritici on two wheat cultivars in different zones in Longnan. Journal of Traticeae Crops, 2014(8): 1146-1152.
[34] CHEN W Q, XIE S X. In Research Progress in Plant Protection and Plant Nutrition. Beijing: China Agriculture Press, 1999: 276-277.
[35] CHEN W Q, KANG Z S, MA Z H, XU S C, JIN S L, JIANG Y. Integrated management of wheat stripe rust caused by Puccinia striiformis f. sp. tritici in China. Agricultural Sciences in China, 2013(46): 4254-4262.
[36] 陈万权, 徐世昌, 吴立人. 中国小麦条锈病流行体系与持续治理研究回顾与展望. 中国农业科学, 2007, 40(增刊1): 177-183.
CHEN W Q, XU S C, WU L R. Epidemiology and sustainable management of wheat stripe rust caused by Puccinia striiformis West. in China: A historical retrospect and prospect. Scientia Agricultura Sinica, 2007, 40(supplement 1): 177-183. (in Chinese)
[37] WU L R, NIU Y C. Strategies of sustainable control of wheat stripe rust in China. Scientia Agricultura Sinica, 2000, 33(5): 46-54.
[38] 刘太国, 邱军, 周益林, 徐世昌, 陈怀谷, 刘艳, 高利, 刘博, 郑传临, 陈万权. 中国冬小麦区域试验品种抗病性评价. 中国农业科学, 2015, 48(15): 2967-2975.
LIU T G, QIU J, ZHOU Y L, XU S C, CHEN H G, LIU Y, GAO L, LIU B, ZHENG C L, CHEN W Q. Multi-disease resistance evaluation of Chinese advanced winter wheat lines for the national regional test. Scientia Agricultura Sinica, 2015, 48(15): 2967-2975. (in Chinese)
(责任编辑 李莉)
Stripe Rust Resistance and Genes in Chongqing Wheat Cultivars and Lines
LI Bei1,2, XU Qi1,2, YANG YuHeng1,3, WANG QiLin1,4, ZENG QingDong1,4, WU JianHui1,4, MU JingMei1,2, HUANG LiLi1,4, KANG ZhenSheng1,4, HAN DeJun1,2
【Objective】China has one of the largest stripe rust epidemic areas in the world. Chongqing, as an importantoverwintering region, plays a key role in wheat stripe rust epidemic. Understanding of resistance levels of the wheat cultivars (lines) and the application of Yr genes in this region may provide valuable recommendations for managing the disease.【Method】A total of 18 varieties and 89 advanced lines of wheat were tested at seedlings stage with four Chinese predominant stripe rust races CYR32, CYR33, V26/G22-9 and V26/CM42 of Puccinia striiformis f. sp. tritici. In field tests, wheat entries were evaluated for stripe rust resistance in Yangling, Shaanxi, artificially inoculated with mixture of CYR32 and CYR33. In Tianshui, Gansu Province, an over-summering region, the entries were evaluated under natural infection in 2015 and 2016, based on the seedling and field reactions, the resistance of the germplasms was classified and assessed. Based on the reactions of Yr single-gene lines, molecular markers for Yr5, Yr9, Yr10, Yr15, Yr17, Yr18, Yr26 were used to detect the corresponding genes.【Result】Among the 107 entries, 57 (53.27%) were resistant to both CYR32 and CYR33, 11(10.28% ) were resistant to CYR32, CYR33 and V26 / CM42, 9 (8.41%) were resistant to CYR32, CYR33 and V26/G22-9. 8 (7.48%) lines were resistance both at seedling and adult stages, 9 (8.41%) were resistant at adult plant stage, 90 (84.11%) were susceptible. Among the tested materials, 21 germplasms may contain Yr9 gene, 39 lines(varieties) may contain Yr26 gene, 17 materials may contain Yr17 gene, and 3 may contain Yr18 gene. Other materials controlled by unknown resistance genes. And Yr5, Yr10 and Yr15 were absent in the test lines. The 8 all-stage resistant materials were not detected the presence of the Yr5, Yr9, Yr10, Yr15, Yr17, Yr18 and Yr26 genes, and they may contain other resistance genes.【Conclusion】The level of resistance of wheat varieties (lines) in the region of Chongqing to tested races is extremely low, and Yr26 materials were used with high frequency especially as the rise of the V26/G22-9 and V26/CM42Yr26-virulent races. It was recommended that in order to improve the diversity of resistance gene, use of resistant varieties is important.
stripe rust; resistance genes; maker-assisted detection; Chongqing wheat region
(1State Key Laboratory of Crop Stress Biology in Arid Areas, Northwest A&F University, Yangling 712100, Shaanxi;2College of Agronomy, Northwest A&F University, Yangling 712100, Shaanxi;3College of Plant Protection, Southwest University, Chongqing 400716;4College of Plant Protection, Northwest A&F University, Yangling 712100, Shaanxi)
2016-08-01;接受日期:2016-10-24
国家“973”计划(2013CB127700)、国家公益性行业(农业)科研专项(201203014)、国家自然科学基金(31371924)、高等学校学科创新引智计划(B07049)、中央高校基本科研业务费专项资金(XDJK2016A020)
联系方式:李北,E-mail:libeinxy@163.com。徐琪,E-mail:787106936@qq.com。李北和徐琪为同等贡献作者。通信作者康振生,E-mail:kangzs@ nwsuaf.edu.cn。通信作者韩德俊,E-mail:handj@nwsuaf.edu.cn
