Thermotoga neapolitana中α-半乳糖苷酶基因的克隆表达与酶学性质研究
2017-02-16毕云枫徐琳琳王溪竹王玉华
毕云枫,徐琳琳,姜 珊,李 娜,王溪竹,王玉华*
(吉林农业大学食品科学与工程学院,吉林长春130118)
Thermotoga neapolitana中α-半乳糖苷酶基因的克隆表达与酶学性质研究
毕云枫,徐琳琳,姜 珊,李 娜,王溪竹,王玉华*
(吉林农业大学食品科学与工程学院,吉林长春130118)
将新阿波罗栖热袍菌(Thermotoga neapolitana)的耐热α-半乳糖苷酶基因经PCR扩增,以pET-28a为表达载体,转化至大肠杆菌(Escherichia coli)BL21(DE3)中进行表达,用0.8 mmol/L的异丙基-β-D-硫代半乳糖苷(IPTG)诱导,采用超声波细胞破碎菌体得到α-半乳糖苷酶。通过十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)的方法获得α-半乳糖苷酶的分子质量约为35 ku。并对α-半乳糖苷酶的酶学性质进行研究,结果表明:该α-半乳糖苷酶的最适反应温度为85℃;最适反应pH值为5.0;在金属离子对酶活影响的研究中发现Al3+、Na+、K+、Ca2+、Mg2+、Zn2+、Co2+对酶活起到促进作用,Cu2+、Fe2+、Ag2+、Mn2+、Ni2+的终浓度达到100 mmol/L时对酶活有较强的抑制作用;具有较好的热稳定性,在95℃处理38 h后仍具有50%的活性。
α-半乳糖苷酶;基因克隆;表达;酶学性质
α-半乳糖苷酶(α-galactosidase,α-gal)又称α-D-半乳糖苷水解酶、α-D-半乳糖苷酶A、蜜二糖酶。属外切糖苷酶,是水解酶的一种。α-半乳糖苷酶具有较强的水解能力,可催化水解α-D-半乳糖苷末端非还原性α-D-半乳糖残基,包括半乳糖寡糖、半乳甘露聚糖和半乳糖脂,也可水解蜜二糖、棉子糖、水苏糖[1-2]。α-半乳糖苷酶在自然界分布较为广泛,常存在于动物、植物及微生物中,主要应用在食品加工、饲料生产、医药研发等。由于豆类植物中含有α-半乳糖苷,这种含糖衍生物被人和动物摄食到体内后很难消化,易引起胀气、腹泻等症状,影响人和动物对营养物质的吸收,而α-半乳糖苷酶的水解特性恰好能够降解豆类植物中的α-D-半乳糖苷,利于人和动物对豆类植物中营养物质的吸收,工业中常将α-半乳糖苷酶用于豆类食品的加工及饲料生产中用来改善抗营养因子,促进动物生长[3-5]。有研究报到α-半乳糖苷酶可改变红血球类型,人类常见的血液类型有A、B、AB、O型,其中,O型为通用血型,而B型与O型的区别在于B型红细胞膜表面糖链末端连接α-半乳糖苷,因此,可利用α-半乳糖苷酶将B型糖链末端的α-半乳糖苷水解掉,实现B→O血型的转变,在制备通用血型时α-半乳糖苷酶可作为血型转变的工具酶[6-7]。现代医学研究表明,α-半乳糖苷酶可用于治疗由于α-半乳糖苷酶A缺乏而引起糖鞘脂代谢障碍的法布里病,在治疗中α-半乳糖苷酶可弥补先天缺陷,改善患者全身脂质的代谢[8-9]。对α-半乳糖苷酶的研究还涉及到产α-半乳糖苷酶的菌株来源、酶学性质及应用研究等[10-12],但普遍酶反应温度较低,难以适应实际应用。
新阿波罗栖热袍菌(Thermotoga neapolitana)是一种超嗜热菌,可用于发酵制氢[13-14],经培养后可产多种嗜热酶(如α-葡萄糖苷酶、纤维素酶、直链淀粉酶、木聚糖酶等),这些酶由于具有较强的耐热性而具有广泛的应用前景[15-16]。目前,对于耐热酶的研究较多,耐热酶因其特殊的酶学性质而具有广泛的应用前景,耐热酶来源的原始菌株多为嗜热菌和超嗜热菌,这些嗜热菌的培养条件极为苛刻,因此,通过基因克隆和基因重组的手段使得高温酶的基因片段在常温菌中表达,可实现大规模培养并可大量获得所需高温酶。因此,本研究从新阿波罗栖热袍菌(Thermotoga neapolitana)DSM4359中获取α-半乳糖苷酶基因片段,利用基因重组手段以pET-28a为载体,通过大肠杆菌(Escherchia coil)BL21(DE3)进行表达,得到新型α-半乳糖苷酶,并对该α-半乳糖苷酶的酶学性质进行研究,旨在得到具有较高反应温度及较强耐热性的α-半乳糖苷酶,为大规模工业生产提供理论参考。
1 材料与方法
1.1 材料与试剂
1.1.1 菌株和载体
新阿波罗栖热袍菌(Thermotoga neapolitana)DSM4359由Laura Dipasquale教授惠赠,大肠杆菌(Escherichia coli)BL21(DE3)及质粒pET-28a由本实验室保存。
1.1.2 主要试剂
细菌基因组DNA提取试剂盒,高纯质粒小量制备试剂盒:北京百泰克生物技术有限公司;十二烷基硫酸钠-聚丙烯酰胺凝胶电泳制备试剂盒:北京博特森生物技术有限公司;酵母浸粉、胰蛋白胨、琼脂粉:英国OXOID公司;氯化钠、碳酸钠、乙酸、乙酸钠、柠檬酸、柠檬酸钠、磷酸氢二钠、磷酸二氢钠、氢氧化钠、盐酸:北京化工厂;硫酸卡那霉素(kanamycin sulfate):北京Solarbio科技有限公司;异丙基-β-D-硫代半乳糖苷(isopropyl-β-D-thiogalactoside,IPTG)、咪唑:美国Genview公司;考马斯亮蓝R-250:上海化学试剂有限公司;三羟甲基氨基甲烷(Tris)、甘氨酸(Gly)、4-硝基苯基-β-D-吡喃葡萄糖苷、对硝基苯-α-D-葡萄糖吡喃苷、对-硝基苯酚(p-nitrophenol,pNP):北京鼎国昌盛生物技术有限公司;乳糖、蔗糖、海藻糖、麦芽糖、松二糖、纤维二糖、明串珠菌二糖、龙胆二糖、曲二糖、昆布二糖、蔗糖、甘露聚糖、普鲁兰多糖、羧甲基纤维素(carboxymethylcellulose,CMC)、昆布糖、木聚糖、纤维素、凝胶多糖、淀粉、菊糖、4-硝基苯基-α-D-吡喃半乳糖苷、4-硝基苯基-β-D-吡喃半乳糖苷、4-硝基苯基-α-D-吡喃甘露糖苷、4-硝基苯基-β-D-吡喃甘露糖苷、4-硝基苯基-α-L-吡喃岩藻糖苷、4-硝基苯基-β-D-吡喃岩藻糖苷、4-硝基苯基-β-D-吡喃木糖苷、4-硝基苯基-α-L-吡喃鼠李糖苷、4-硝基苯基-α-L-吡喃阿拉伯糖苷:北京百灵威科技有限公司。
1.1.3 培养基
LB培养基:酵母浸粉5 g/L,胰蛋白胨1.0 g/L,NaCl 1.0 g/L,固体培养基添加15 g/L琼脂粉,NaOH调节pH至7,120℃、20 min高压灭菌。
1.2 仪器与设备
FA1204B电子天平:上海佑科仪器仪表有限公司;Red-96G型PCR扩增仪:上海山富科学仪器有限公司;DYY-11型电泳仪:北京市六一仪器厂;WMW-02型电热恒温培养箱:湖北省黄石市医疗器械厂;KYC-100B空气恒温摇床:上海新苗医疗器械制造有限公司;JYP2-Ⅱ超声波细胞破碎仪:宁波新芝生物科技股份有限公司;GL-16G-Ⅱ高速冷冻离心机:上海安亭科学仪器厂;UV-1800紫外分光光度计:日本岛津公司。
1.3 方法
1.3.1 α-半乳糖苷酶工程菌的构建
根据GeneBank数据库中公布α-半乳糖苷酶信息设计并合成引物。上游引物:5′-CGCGGCAGCCATATGGCTAGCATGGAGATCTTCAAAAGA-3′,内切酶为NheⅠ;下游引物:3′-TTGTCGACGGAGCTCGAATTCTCATTCTC TCTCACCCTCTTCGTAG-5′,内切酶为EcoRⅠ。以源于新阿波罗栖热袍菌(Thermotoga neapolitana)DSM4359的基因组为模板,利用上下游引物对目的基因进行聚合酶链反应(polymerase chain reaction,PCR)扩增,PCR反应体系:10×PCR buffer 2.5 μL、脱氧核苷三磷酸(deoxynucleside triphosphate,dNTP)2 μL、上游引物1 μL、下游引物1 μL、Taq酶1 μL、脱氧核糖核酸(deoxyribonucleic acid,DNA)模板1 μL、双蒸水17.5 μL。将总25 μL的反应体系稍加离心使各成分混合均匀后立即进行PCR,95℃预变性5 min后进入循环阶段:94℃变性40 s,58℃退火30 s,在72℃下延伸60s,循环阶段循环3次,最后在72℃延伸7min。用NheⅠ和EcoRⅠ对PCR产物进行双酶切,后切胶回收并对目的基因进行纯化,利用DNA连接酶将α-半乳糖苷酶基因与pET-28a载体质粒进行连接,15℃连接12 h。将重组载体质粒送至生工生物工程(上海)股份有限公司处进行测序并对结果进行测定。
将重组后的质粒转化至感受态细胞Escherchia coil BL21(DE3)中,涂布于硫酸卡那霉素抗性的LB固体培养基上,37℃培养12 h,筛选阳性菌落,于LB液体培养基中培养12 h,即得到α-半乳糖苷酶的工程菌。
1.3.2 工程菌中α-半乳糖苷酶的诱导表达
将构建好的工程菌在硫酸卡那霉素抗性的LB固体培养基上进行培养,在37℃恒温培养箱中恒温培养12 h。挑取活化后的单菌落于硫酸卡那霉素抗性的LB液体培养基中培养12 h,继续接入已灭菌的LB液体培养基进行诱导培养,接菌量为2%,菌体培养至吸光度值OD600nm为0.4~0.5,加入0.8 mmol/L的IPTG进行诱导,6 h后取出7 000 r/min离心15 min,收集菌体,用pH值为5.0,浓度为50 mmol/L的乙酸(HAc)-乙酸钠(NaAc)缓冲溶液悬浮菌体,在冰水浴下进行超声波细胞破碎(400 W,超声时间3 s,间隔时间5 s,90次),破碎后细胞液6 000 r/min离心10 min,收集上清液即为α-半乳糖苷酶。
1.3.3 α-半乳糖苷酶的纯化及分子质量确定
用His TrapTM HP柱对目的蛋白α-半乳糖苷酶进行纯化。纯化条件:结合缓冲溶液(磷酸钠20 mmol/L、NaCl 0.5mol/L、咪唑20mmol/L),洗脱缓冲溶液(磷酸钠20mmol/L、NaCl0.5mol/L、咪唑500mmol/L),收集洗脱液,置于D25mm透析袋(截流分子质量6 000~8 000 u)中,放入pH 7.5的Tris-HCl透析液中透析12 h,聚乙二醇除去多余水分,10%的十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDS-PAGE)测定蛋白分子质量。
1.3.4 α-半乳糖苷酶底物特异性
α-半乳糖苷酶对底物具有高度的专一性,很少会产生副产物。试验所选取的底物有二糖、多糖以及糖苷(见表1),通过试验确定α-半乳糖苷酶最佳底物。

表1 α-半乳糖苷酶受试底物Table 1 Tested substrates ofα-galactosidase
1.3.5 α-半乳糖苷酶酶活的测定
配制200 μL酶反应体系:10 μLα-半乳糖苷酶粗酶液,10μL4-硝基苯基-α-D-吡喃半乳糖苷,180μL50mmol/L HAc-NaAc缓冲溶液(pH 5.0)。65℃水浴反应20 min,加入400 μL浓度为1 mol/LNa2CO3终止反应,于波长410 nm处测定吸光度值。按照pNP的标准曲线回归方程y=0.08889x+ 0.302 63计算α-半乳糖苷酶活。α-半乳糖苷酶酶活定义:每分钟产生1 μmol对-硝基苯酚(p-nitrophenol,pNP)的酶的量为一个酶活单位(U)。
1.3.6 α-半乳糖苷酶的酶学性质
(1)α-半乳糖苷酶最适反应温度
设定α-半乳糖苷酶反应温度条件:45℃、55℃、65℃、75℃、85℃、95℃,按1.3.4中的方法配制好反应体系,水浴反应20 min后,加入反应体系2倍体积的Na2CO3浓度为1 mol/L终止反应,于波长410 nm处测定吸光度值,同时做空白对照组,以测定的最高酶活为100%,计算其他相对酶活。
(2)α-半乳糖苷酶最适反应pH值
设定α-半乳糖苷酶反应pH值范围为pH 3.0~11.0。配制缓冲溶液:柠檬酸-柠檬酸钠pH 3.0-5.0,HAc-NaAc pH 5.0~6.0,磷酸氢二钠-磷酸二氢钠pH 6.0~8.0,Tris-HCl pH 8.0~9.0,Gly-NaOH pH 9.0~11.0。按1.3.4中描述的方法配制反应体系,以测定最高酶活为100%,计算其他相对酶活。
(3)金属离子对α-半乳糖苷酶的影响
选取金属离子Mg2+、Na+、Cu2+、Ag+、Ni2+、Ca2+、Al3+、K+、Mn2+、Zn2+、Fe2+、Co2+,按1.3.4中的方法配制酶反应体系,其中酶的量与底物的量不变,减少缓冲溶液的量,加入金属离子,使每种金属离子在反应体系中的终浓度为1mmol/L、10 mmol/L、100 mmol/L。以测定的最高酶活为100%,计算其他相对酶活。
(4)α-半乳糖苷酶的热稳定性
选取温度75℃、85℃、95℃进行α-半乳糖苷酶的热稳定性试验,将α-半乳糖苷酶在选取的试验温度下进行保温处理,每1 h取样一次,按1.3.4中的方法配制反应体系,以测定的最高酶活为100%,计算其他相对酶活。
2 结果与分析
2.1 α-半乳糖苷酶的分子质量
α-半乳糖苷酶的SDS-PAGE测定结果见图1。由图1可知,α-半乳糖苷酶可在宿主菌中表达,分子质量约为35ku。
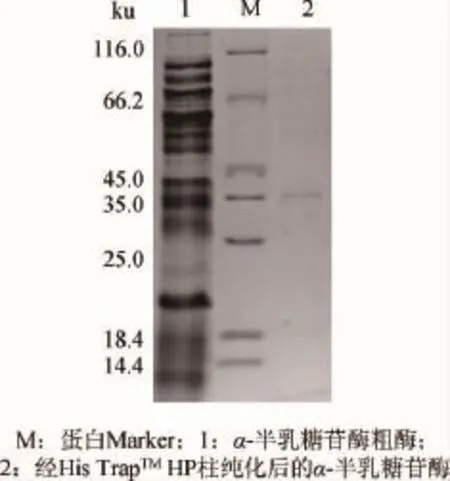
图1 α-半乳糖苷酶的分子质量SDS-PAGE测定结果Fig.1 SDS-PAGE determination results of molecular mass of α-galactosidase
2.2 α-半乳糖苷酶底物特异性
α-半乳糖苷酶分别以二糖、多糖以及糖苷为特异性底物进行反应,得到α-半乳糖苷酶的底物特异性结果见表2。

表2 α-半乳糖苷酶的底物特异性Table 2 Substrate specificity ofα-galactosidase
由表2可知,4-硝基苯基-α-D-吡喃半乳糖苷作为显色底物,可被半乳糖苷酶降解为半乳糖和黄色的对-硝基苯酚(pNP),经酶解后显色十分明显,且实验方法简便,实验成本低,因此选用4-硝基苯基-α-D-吡喃半乳糖苷为底物。根据pNP的标准曲线回归方程计算α-半乳糖苷酶的酶活力为5.819 U/mL。
2.3 α-半乳糖苷酶的酶学性质
2.3.1 α-半乳糖苷酶的最适反应温度

图2 α-半乳糖苷酶最适反应温度Fig.2 Optimal reaction temperature ofα-galactosidase
由图2可知,在反应体系相同条件下,α-半乳糖苷酶的酶活力随着所在的反应体系温度的上升而上升,当反应温度达到85℃时,α-半乳糖苷酶的酶活力达到最大值100%,随着反应温度的继续上升,α-半乳糖苷酶的酶活略有下降。由此可得,α-半乳糖苷酶的最适反应温度为85℃。
2.3.2 α-半乳糖苷酶的最适反应pH值
由图3可知,α-半乳糖苷酶的酶活力随反应环境pH值的变化而有所改变,反应环境的起始pH值为3.0时,α-半乳糖苷酶的相对酶活为55.75%;当pH值在3.0~5.0范围,α-半乳糖苷酶的酶活力随反应环境pH值的增加而逐渐增大;当pH值为5.0时,酶活力达到最大值100%;当酶反应环境pH值>5.0之后,α-半乳糖苷酶反应活力逐渐下降。因此,α-半乳糖苷酶的最适pH值为5.0。
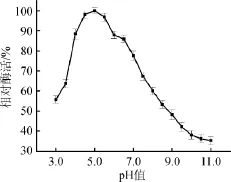
图3 α-半乳糖苷酶最适反应pH值Fig.3 Optimal reaction pH ofα-galactosidase
2.3.3 金属离子对α-半乳糖苷酶的影响
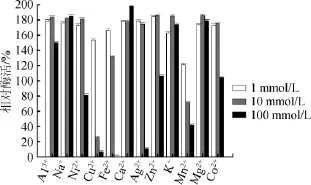
图4 金属离子对α-半乳糖苷酶的影响Fig.4 Effect of metal ions onα-galactosidase
由图4可知,不同金属离子以及同种金属离子的不同浓度对酶活有不同的影响。在实验选取的12种金属离子中Al3+、Na+、K+、Ca2+、Mg2+、Zn2+、Co2+在设定的三种浓度梯度下均对α-半乳糖苷酶具有不同程度的促进作用,其中Ca2+的终浓度达到100 mmol/L时α-半乳糖苷酶的活力提升约2倍;当浓度为10 mmol/L时Cu2+和Mn2+对酶活具有明显的抑制作用;而Cu2+、Fe2+、Ag2+、Mn2+、Ni2+这五种金属离子浓度为1mmol/L可促进α-半乳糖苷酶的活力,当终浓度达到100 mmol/L时可明显抑制α-半乳糖苷酶的活力,尤其Fe2+浓度达到100mmol/L时,几乎完全抑制α-半乳糖苷酶的活力。
2.3.4 α-半乳糖苷酶的热稳定性
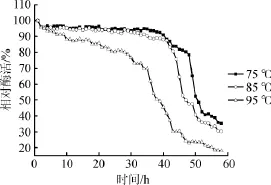
图5 α-半乳糖苷酶的热稳定性Fig.5 Thermal stability of α-galactosidase
由图5可知,试验选取的三个温度梯度进行保温处理,随着保温时间的延长,α-半乳糖苷酶的酶活力保持相对的稳定性,其中75℃和85℃的趋势在保温时间达到45 h时,酶活力开始明显下降,当保温时间达到50 h时,α-半乳糖苷酶仍具有50%的酶活力;而95℃保温处理的α-半乳糖苷酶热稳定性较差,在30 h以后酶活力开始明显下降,当保温时间超过38 h以后酶活力<50%。由此可见,经基因重组构建后得到的新α-半乳糖苷酶具有较好的热稳定性。
3 结论
本研究将源于嗜热菌新阿波罗栖热袍菌(Thermotoga neapolitana)DSM4359的半乳糖苷酶耐热基因片段经基因重组的方法成功构建耐热型α-半乳糖苷酶,在对α-半乳糖苷酶底物特异性选择中,筛选出最佳反应底物4-硝基苯基-α-D-吡喃半乳糖苷,由HisTrapTMHP纯化后的α-半乳糖苷酶经SDS-PAGE检测到分子质量约为35 ku。酶学性质的试验结果显示,这种新α-半乳糖苷酶的最适反应温度为85℃,与其他研究报道中提到的α-半乳糖苷酶的最适反应温度相比较高,且热稳定性极强[17-18];最适反应pH值为5.0,该最适pH值可以保证α-半乳糖苷酶在豆制品加工中不受环境影响,提高降解豆制品中的棉子糖等抗营养因子的程度,使得豆制品的吸收利用率得以提高[19-20];100 mmol/L的Ca2+对α-半乳糖苷酶酶活具有极大的促进作用,可使α-半乳糖苷酶酶活提升近2倍,100 mmol/L的Fe2+可几乎完全抑制α-半乳糖苷酶酶活。结果表明,本研究得到的新型α-半乳糖苷酶具有较好的酶学性能,因此应用前景可观。
[1]郝桂娟,张凯,王学智,等.α-半乳糖苷酶的研究进展[J].中国畜牧兽医,2013,40(3):149-154.
[2]YU J H,GUO T T,XUE R G,et al.A protease-resistant α-galactosidase fromPleurotus citrinopileatuswith broad substrate specificity and good hydrolytic activity on raffinose family oligosaccharides[J].Process Biochem,2016,51(4):491-499.
[3]YAN Y C,ERIC M X,ALMA D T,et al.The pH-dependent protection ofα-galactosidase activity by proteins against degradative enzymes during soymilkin vitrodigestion[J].LWT-Food Sci and Technol,2016,6 (69):244-250.
[4]林谦,蒋桂韬,张旭,等.不同水平α-半乳糖苷酶对1~21日龄爱拔益加肉鸡生长性能的影响及相关机理研究[J].动物营养学报,2015,27(8):2466-2475.
[5]蒋小丰,戴求仲,蒋桂韬,等.α-半乳糖苷酶对断奶仔猪生产性能、血液生化指标和营养物质消化率的影响[J].家畜生态学报,2009,30(6):44-49.
[6]MARTIN L O.SI14 stripped red cells-efforts to eliminate A and B antigens from the blood supply[J].Transfusion Med,2006,16(s1):9-19.
[7]MARTIN L O,HENRIK C.Modifying the red cell surface:towards an ABO-universal blood supply[J].Br J Haematol,2008,140(1):3-12.
[8]JARMILA L,VINCENZO D,ROCCO L,et al.Characterization of human dermal fibroblasts in Fabry disease[J].J Cell Physiol,2016,231(1): 192-203.
[9]OZELSANCAK R,UYAR B.p.R301X mutation and variable phenotypic appearance of Fabry disease[J].Am J Case Rep,2016,17(5):315-319.
[10]辛永平,孔文涛,陆文伟,等.Paenibacillussp.K1α-半乳糖苷酶酶学性质[J].山东大学学报:理学版,2015,50(1):50-55.
[11]DANIEL L F,VAL RIA M G,MARISA V Q,et al.Covalent immobilization ofα-galactosidase fromPenicillium griseoroseumand its application in oligosaccharides hydrolysis[J].Appl Biochem Biotechnol, 2009,158(3):540-551.
[12]林谦,蒋桂韬,张旭,等.饲料添加α-半乳糖苷酶对AA肉鸡屠宰性能及血清生化、激素指标的影响[J].家畜生态学报,2016,37(3):27-33.
[13]NIRAKAR P,LAURA D,GIULIANA D,et al.Kinetic modeling of fermentative hydrogen production byThermotoga neapolitana[J].Int J Hydrogen Energy,2016,41(9):4931-4940.
[14]马诗淳,罗辉,尹小波,等.厌氧产氢微生物研究进展[J].微生物学通报,2009,38(8):1244-1252.
[15]SO Y J,JIN S K,KYOUNG H C,et al.Structure of a novelα-amylase AmyB fromThermotoga neapolitanathat produces maltose from the nonreducing end of polysaccharides[J].Acta Crystallogr,2013,69(3): 442-450.
[16]OKAZAKI F,NAKASHIMA N,OGINO C,et al.Biochemical characterization of a thermostable β-1,3-xylanase from theHyperthermophilic eubacterium,Thermotoga neapolitanastrain DSM 4359[J].Appl Microbiol Biotechnol,2012,97(15):6749-6757.
[17]NAIDU R B,RISHIKESH K G,KAMINI N R.Production ofα-galactosidase fromAspergillus foetidusMTCC 6322 by solid state fermentation and its application in soymilk hydrolysis[J].Indian J Exp Biol, 2016,54(1):72-75.
[18]李丽满,易戈,韦阳道,等.Neosartorya fischeri α-半乳糖苷酶酶学性质的研究[J].饲料研究,2016(8):40-44.
[19]WANG H M,SHI P J,LUO H Y,et al.A thermophilicα-galactosidase fromNeosartorya fischeriP1 with high specific activity,broad substrate specificity and significant hydrolysis ability of soymilk[J].Bioresour Technol,2014,153(2):361-364.
[20]VAL RIA M G,SEBASTIO T D R,MAURILIO A M,et al.Characterization ofα-galactosidases from germinating soybean seed and their use for hydrolysis of oligosaccharides[J].Phytochemistry,2001,58(1): 67-73.
Cloning and expression of α-galactosidase gene fromThermotoga neapolitanaand α-galactosidase property
BI Yunfeng,XU Linlin,JIANG Shan,LI Na,WANG Xizhu,WANG Yuhua*(College of Food Science and Engineering,Jilin Agriculture University,Changchun 130118,China)
The heat resistant α-galactosidase gene fromThermotoga neapolitanawas amplified by PCR.Using the pET-28a as expression vector,the gene was converted into(Escherichia coli)BL21(DE3)and expressed.After 0.8 mmol/L isopropylthio-β-D-galactoside(IPTG)inducing,the modifiedE.coilcell was broken by ultrasonic wave and α-galactosidase was gotten.The molecular mass of α-galactosidase was about 35 ku by SDS-PAGE.The α-galactosidase property was researched.The results showed that the optimal reaction temperature of α-galactosidase was 85℃,the optimal reaction pH was 5.0.Al3+,Na+,K+,Ca2+,Mg2+,Zn2+,and Co2+had a promoting effect on α-galactosidase activity.Cu2+,Fe2+,Ag2+,Mn2+,and Ni2+had a strong inhibiting effect on α-galactosidase activity when the final concentration reached 100 mmol/L.The α-galactosidase had good thermal stability and still had 50%activity at 95℃for 38 h.
α-galactosidase;gene cloning;expression;characterizations enzyme property
TS261.1
0254-5071(2017)01-0061-05
10.11882/j.issn.0254-5071.2017.01.012
2016-10-28
吉林省教育厅“十二五”科学技术研究项目(吉教科合字[2015]第207号);吉林省科技厅科技创新人才培育计划项目(201405 19011JH);吉林省科技厅科技成果转化计划项目(20130302017NY)
毕云枫(1976-),男,副教授,博士,研究方向为食品酶学。
*通讯作者:王玉华(1972-),女,教授,博士,研究方向为食品微生物学及功能性食品。
