蓝靛果椰子复合酵素发酵工艺优化
2017-02-16战伟伟魏晓宇高本杰李敬龙
战伟伟,魏晓宇,高本杰,李敬龙*
(1.山东商业职业技术学院食品药品学院,山东济南250103;2.齐鲁工业大学生物工程学院,山东济南250353)
蓝靛果椰子复合酵素发酵工艺优化
战伟伟1,魏晓宇2,高本杰2,李敬龙2*
(1.山东商业职业技术学院食品药品学院,山东济南250103;2.齐鲁工业大学生物工程学院,山东济南250353)
以蓝靛果和椰子为主要原料,研究复合酵素原液的发酵工艺。经单因素试验分析了发酵温度、原料配比、菌种比例3个主要因素对复合酵素的影响,以花色苷含量、超氧化物歧化酶(SOD)酶活力、残糖量、总黄酮含量为考察指标,通过设计正交试验确定蓝靛果椰子复合酵素最佳工艺。结果表明,在发酵温度为33℃,发酵时间为70 d,酵母菌与双歧杆菌配比为2:1,蓝靛果果浆与椰子果浆质量比为5:1的发酵条件下,得到的蓝靛果椰子复合酵素中花色苷含量为12.17 mg/g,总黄酮含量20.31 mg/g、SOD酶活力为56.74 U/mL、残糖量为4.22 mg/mL,产品酸度适宜,香味突出,口味独特。
蓝靛果;椰子;复合酵素;发酵工艺
蓝靛果(Lonicera caerulea)属忍冬科,是一种野生浆果类植物,种子极小,出汁率极高,含有丰富的氨基酸、维生素和生物活性物质,有着比蓝莓等相似植物更佳优越的抗氧化活性,营养保健价值极高。花色苷和黄酮类化合物作为蓝靛果果实中的功能成分,具有若干有益的生理功能和药理作用,其中花色苷具有消除自由基、抗衰老、抗氧化和提高免疫力的功能,黄酮类化合物可促进人体内的血液循环、防治老年人的心血管疾病。
椰子含有丰富的蛋白质、维生素B族及微量元素钾、镁等,是一种营养保健的纯天然绿色食品。椰子中椰肉占30%,椰子水占25%[1],椰水子风味纯正、清凉解渴;椰肉能有效地补充细胞内液,滋润皮肤,有驻颜美容的作用。综合利用椰子的果实,可充分发挥椰子的生物功效和经济价值。
酵素技术是由日本磐亚株式会社的微生物专家岛本觉也[2]从柴田欣司氏应用微生物生产农肥中分离出的3类共24种有益菌,将其按一定比例混合制成酵素菌原菌。经岛本家族3代人50年的潜心研究,逐步形成了“酵素菌农业应用法”[3]。20世纪末以来先后被20多个国家和地区引进推广,现已广泛应用于世界许多国家的种植业、养殖业和食品加工业等领域,
国际上大部分的酵素行业都在模仿日本酵素企业的制备方式与用料配比,产品与功能单一,而国内对酵素的研究尚处于发展阶段,我国台湾地区[4]万大集团生产的万大酵素、台湾鼎杰生物科技有限公司生产的“酵傲人生”牌复合酵素以及台湾宝芝林国际生物科技有限公司生产的养命酵素、本草汉方酵素等具有一定的创新性与产品竞争力。虽然日本的酵素制作工艺相对成熟,但因其采用的原料多以蔬菜、药草为主,其风味并不能让消费者接受,所以果蔬酵素的发展空间与市场潜力依然巨大。
本研究是利用蓝靛果和椰肉椰汁,通过优化发酵工艺,控制发酵温度、原料配比、菌种比例等关键参数,得到具有美白抗氧化、抗菌消炎、润肠通便、解酒护肝等保健功能的复合酵素[5]。蓝靛果椰子复合发酵的工艺优化不仅为蓝靛果与椰子的高效利用提供了新的选择,具有一定的的研究与经济价值。
1 材料与方法
1.1 材料与试剂
蓝靛果、椰子:济南银座鲜果蔬批发市场;矿泉水:济南家家悦超市;酵母菌:齐鲁工业大学现代酿酒装置与技术研究室菌种保藏室;白砂糖:山东博雅食品有限公司;葡萄糖、3,5-二硝基水杨酸(dinitrosalicylic acid,DNS)、氢氧化钠、酒石酸钾钠、重苯酚、亚硫酸钠、芦丁标准品(纯度>98%)、无水乙醇、硝酸铝、亚硝酸钠:中国药品生物制品所;花青素3-阿拉伯糖苷(纯度>98%):上海同田生物技术股份有限公司;果胶酶(酶活10 000 U/g)、纤维素酶(酶活20 000 U/g):上海经科化学科技有限公司。
1.2 仪器与设备
CF-KB片式臭氧发生器:北京山美水美环保高科技有限公司;HR7632型打浆机:广州飞利浦家庭电器有限公司;T4可见分光光度计:北京通用仪器有限公司;TG256A电子天平:上海恒平科技仪器有限公司;HWS26电热恒温水浴锅:上海森信实验仪器有限公司;SW-CJ-3D净化工作台:苏州净化设备有限公司;GZX-637电热恒温培养箱:天津泰斯特有限公司;TGL-12G-C高速离心机:上海精密科学仪器厂;WS-232型立式压力蒸汽灭菌器:常州市大型仪器设备中心。
1.3 方法
1.3.1 工艺流程

1.3.2 操作要点
(1)蓝靛果与椰子预处理
用流动水冲去蓝靛果表面泥沙,将臭氧发生器通入无菌水中再次清洗蓝靛果,之后沥干去核,将果肉粉碎打浆,之后按果浆体积的40%添加矿泉水,同时添加果胶酶2.5%,搅拌混匀后在26℃条件下静置30 min;椰子去皮,椰子汁导出后,将椰肉挖出,并与椰子汁混合打浆,后加入纤维素酶3%,搅拌均匀,28℃条件下静置30 min。
(2)发酵原料及菌种添加
将处理好备用的蓝靛果果浆和椰子果浆按适当比例混合,加入到发酵罐中,按照体积比为5∶6添加纯净水,调节pH至6.25、糖度至12%;按照2.7 g/L的接种量添加由酵母菌和双歧杆菌组成的混合菌种(干菌种添加到15倍质量、含2.5%的葡萄糖水中,以25~30℃恒温活化80~120min),并搅拌混匀。
(3)调节控制发酵
调节发酵罐内温度至33℃,恒温密闭发酵70 d,前50 d每48 h检测一次发酵液pH,后20 d每12 h检测一次,当发酵液pH降至4且不再产生气泡时,发酵结束。
(4)后熟与过滤
调节发酵罐内温度至4℃,静置恒温密闭保藏30 d,使发酵原液中的酯、醇、酚类物质充分反应,生成酵香。后熟处理后,导出发酵原液,再经80~100 r/min离心15 min,过滤取上层清液与中层浊液,弃去下层沉淀与固液混合物,即得蓝靛果椰子复合酵素原液。
1.3.3 单因素试验设计
调整发酵温度分别为29℃、31℃、33℃、35℃、37℃;蓝靛果与椰子浆质量比分别为1∶3、1∶1、3∶1、5∶1、7∶1;酵母菌与双歧杆菌菌种比例分别设定为1∶3、2∶3、1∶1、3∶2、2∶1。采用单一变量控制法进行单因素试验,所有分组样品发酵完成后对各组的蓝靛果椰子复合酵素花色苷吸光度值、超氧化物歧化酶(superoxyde dismutase,SOD)酶活力、残糖量、黄酮类物质含量进行测定。
1.3.4 正交试验设计
在单因素试验的基础上,选取发酵温度(A),蓝靛果果浆与椰子果浆质量比(B)和酵母菌与双歧杆菌菌种比例(C)为3个因素,以花色苷吸光度值、SOD酶活力、残糖量、黄酮类物质含量为考察指标,进行正交试验,优化蓝靛果椰子复合酵素发酵工艺条件,正交试验因素与水平见表1。

表1 蓝靛果椰子复合酵素的工艺优化正交试验因素与水平Table 1 Factors and levels of orthogonal experiments for process optimization ofLonicera caeruleaand coconut compound enzyme
1.3.5 SOD酶活测定
酶活力单位的定义:在1mL反应液中,每分钟抑制邻苯三酚自氧化速率达50%时的酶量定义为一个酶活力单位。SOD酶活力测定:参照文献[6]中的方法,其计算公式如下:

式中:A0为自氧化速率,min-1;A1为加入酶后的氧化速率,min-1;N为稀释倍数;V0为定义体积,mL;Va为反应总体积,mL;VE:加入的酶体积,mL。
1.3.6 其他指标测定
(1)花色苷含量测定
利用体积分数为75%的酸化乙醇(向75%的乙醇中添加浓HCl,调节pH值为3~4)提取复合酵素中的花色苷,测定其吸光度值,得到波长325 nm处花色苷标准曲线回归方程及相关系数,借此可间接测得花色苷的含量。
花色苷标准曲线的制作:通过紫外分光光度计分别测定不同质量浓度花色苷标准溶液在波长520 nm处的吸光度值,以花色苷的质量浓度(x,mg/g)为横坐标,吸光度值(y)为纵坐标,制作花色苷标准曲线,得到标准回归曲线方程:y=0.047 6x+0.007 2,R2=0.997 2。
(2)蛋白质含量测定:采用国标GB 5009.5—2010《食品中蛋白质的测定》中的凯氏定氮法。
(3)脂肪含量测定:采用索式提取法[7]。
(4)总糖和还原糖含量测定:采用费林试剂直接滴定法。
(5)氨基酸含量的测定:采用国标GB/T 5009.124—2003《食品中氨基酸的测定》中的方法进行测定。
(6)维生素C含量的测定:采用国标GB/T 15038—2006《葡萄酒、果酒通用分析方法》中2,6-二氯靛酚滴定法。
(7)还原糖含量测定:采用DNS法[8]。
(8)黄酮类物质含量测定:采用分光光度法[9]。
2 结果与分析
2.1 蓝靛果、椰子的基本成分
制作酵素前,结合已知数据文献和实际测定,得到蓝靛果果浆和椰子果浆的总糖、蛋白质、花色苷、黄酮类物质等成分的含量,结果分别见表2和表3。
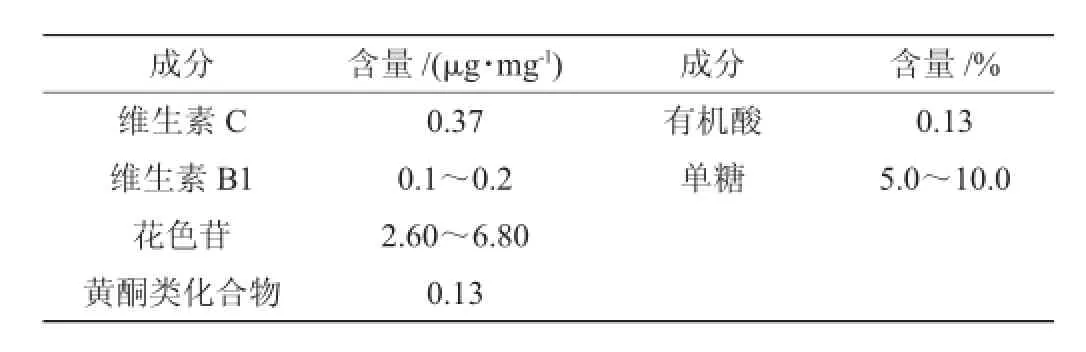
表2 蓝靛果果浆基本成分及含量[10]Table 2 Basic components and contents ofLonicera caeruleapulp

表3 椰子果浆基本成分及含量[11]Table 3 Basic components and contents of coconut pulp
由表2和表3可知,蓝靛果中还有丰富的氨基酸、维生素以及大量的黄酮和花色苷,椰油是良好的食用油脂,类脂物的含量很少,食用后不会使人体血液中的胆固醇含量增加。两种水果的含糖量较高,是制作酵素优选材料。其中蓝靛果中的花色苷,是纯天然的抗衰老的营养补充剂,它的抗氧化性能比维生素E和维生素C高出若干倍。花色苷具有增强视力,消除眼睛疲劳和延缓脑神经衰老的功能。椰肉味干,性平,具有补益脾胃的功能。以蓝靛果和椰子作为酵素原料,既提高了酵素的营养含量,也互补了两种水果的风味口感。
2.2 发酵温度对蓝靛果椰子复合酵素发酵的影响
发酵温度的高低将直接影响复合酵素中菌体的生长,不同温度对发酵产品影响结果见表4。

表4 发酵温度对复合酵素发酵的影响Table 4 Effect of fermentation temperature on compound enzyme fermentation
由表4可知,随着发酵温度改变,复合酵素中SOD酶含量与残糖量也发生了明显变化,SOD酶含量先逐渐升高后快速降低,残糖量逐渐下降但趋势放缓。分析可知,当发酵温度较低时,混合菌种代谢缓慢,特别是双歧杆菌生理活动较弱,代谢物SOD酶及各种产物含量较低,残糖量高,整体发酵效率低;当发酵温度逐渐升高时,高温抑制了混合菌种内酶的活性,进而抑制菌种的生长与代谢,所产生的酶量与各产物减少,整体表观活性有所下降;当发酵温度在33℃左右时,酵母菌代谢旺盛,SOD酶含量最高、活性最强,残糖含量较低。发酵温度过高或过低均不能达到混合菌种的最大发酵效率。因此选择33℃作为蓝靛果椰子复合酵素的发酵温度。
2.3 蓝靛果与椰子果浆质量比对复合酵素发酵的影响
不同蓝靛果与椰子果浆质量比对发酵产品的影响结果见表5。
由表5可知,随着蓝靛果果浆比例的逐渐增大,花色苷吸光度值(即花色苷含量)和总黄酮含量不断上升,但上升趋势趋于平缓;同时残糖量也发生了变化,随着椰果果浆添加量的降低而大幅减少,随蓝靛果添加比例的提高而慢慢增加。分析数据可知,由于花色苷和黄酮类物质主要存在于蓝靛果中,随蓝靛果添加比例的提高而增加,但由于底物浓度不断提高,花色苷和黄酮类物质在复合酵素发酵原液中的溶解度不断降低,故其含量的增加趋势逐渐放缓;由于发酵前需要调节糖度至12%,故物料配比对残糖量的影响可忽略不计。因此,选择蓝靛果浆与椰子果浆质量比为5:1。

表5 原料比例对复合酵素的影响Table 5 Effect of ratio of raw materials on compound enzyme fermentation
2.4 菌种比例对蓝靛果椰子复合酵素发酵的影响
不同酵母菌与双歧杆菌配比对发酵产品的影响结果见表6。
由表6可知,在复合菌种中,随着酵母菌添加比例的提高,复合酵素原液中花色苷的含量和残糖量不断下降,而SOD酶含量不断增加,总黄酮量基本保持稳定。分析可知,酵母菌属兼性好氧菌,对糖分的利用途径和效率均优于属厌氧菌的双歧杆菌,因此酵母菌所产生的SOD酶产量与自身含量成正相关,且酵母菌添加比例越高,复合酵素中残糖含量就越低;双歧杆菌的代谢主产物为乙酸与乳酸,而花色苷是花色素与糖以糖苷键结合而成的一类化合物,花色素在酸性环境中易保持稳定,故花色苷含量与双歧杆菌含量成正相关。综合考虑发酵效率与抗氧化功效,选取酵母菌与双歧杆菌配比为2∶1为最佳。
2.5 正交试验结果分析
为确定蓝靛果椰子复合酵素各关键参数,设计3因素3水平L9(33)正交试验,以发酵温度、蓝靛果果浆与椰子果浆质量比、酵母菌与双歧杆菌配比为3个影响因素,对蓝靛果椰子复合酵素的发酵工艺进行优化,正交试验结果与分析见表8。
由表8可知,3个因素对蓝靛果椰子复合酵素中花色苷含量的影响结果排序为蓝靛果与椰子果浆质量比>发酵温度=酵母与双歧杆菌配比,最佳组合为A2B2C3,即发酵温度为33℃,蓝靛果与椰子果浆质量比为5:1,酵母与双歧杆菌配比为2:1,此工艺条件下花色苷含量为12.17 mg/g,总黄酮含量20.31 mg/g、SOD酶活力为56.74 U/mL、残糖量为4.22 mg/mL。3个因素对蓝靛果椰子复合酵素中总黄酮含量的影响结果排序为蓝靛果与椰子果浆质量比>酵母与双歧杆菌配比>发酵温度,最佳组合为A2B3C1,即发酵温度为33℃,蓝靛果与椰子果浆质量比为7:1,酵母与双歧杆菌配比为2:3,此工艺条件下花色苷含量为10.012 mg/g,总黄酮含量27.22 mg/g,SOD酶活力为56 U/mL、残糖量为4.58 mg/mL。3个因素对蓝靛果椰子复合酵素中SOD酶活力的影响结果排序为发酵温度>蓝靛果与椰子质量比>酵母与双歧杆菌配比,最佳组合为A2B2C3,即发酵温度为33℃,蓝靛果与椰子质量比为5:1,酵母与双歧杆菌配比为2:1,此工艺条件下花色苷含量为12.17 mg/g、总黄酮含量20.31mg/g、SOD酶活力为56.74U/mL、残糖量为4.22mg/mL。3个因素对蓝靛果椰子复合酵素中残糖量的影响结果排序为酵母与双歧杆菌配比>发酵温度>蓝靛果与椰子果浆质量比,最佳组合为A3B1C3,即发酵温度为35℃,蓝靛果与椰子质量比为3:1,酵母与双歧杆菌配比为2:1,此工艺条件下花色苷含量为10.639 mg/g、总黄酮含量20.67 mg/g、SOD酶活力为48.98 U/ml、残糖量为4.13 mg/mL。
综合考虑,蓝靛果椰子复合酵素发酵工艺以A2B2C3组合为最佳酿造工艺。此工艺条件下,产生的复合酵素中花色苷含量为12.17 mg/g,总黄酮含量20.31 mg/g、SOD酶活力为56.74 U/mL、残糖量为4.22 mg/mL。成品为深紫红色,具有蓝靛果与椰奶香气。
2.7 产品的品质指标分析
2.7.1 产品感官指标
色泽:颜色呈深紫红色,色泽均匀、透亮;口感:自然醇厚,入口顺滑,微酸[12];香气:果香芬芳,椰奶香味足,优雅协调;滋味:酸甜适口,味道调和,果味浓郁;组织状态:体态均匀,无沉淀、无悬浮物。
2.7.2 产品理化指标

表9 蓝靛果椰子复合酵素的理化指标Table 9 physicochemical indexes ofLonicera caeruleaand coconut compound enzyme
2.7.3 微生物指标

表10 复合酵素的微生物指标Table 10 Microbial indexes ofLonicera caeruleaand coconut compound enzyme
结果表明,该工艺条件下制得的蓝靛果椰子复合酵素符合国标GB 25594—2010《食品工业用酶制剂》以及GB 2758—2012《发酵酒及其配制酒》中相关要求。
3 结论
通过单因素及正交试验分析,蓝靛果椰子复合酵素的最佳工艺确定为:发酵温度33℃发酵70 d,蓝靛果与椰子果浆质量比为5:1,酵母菌与双歧杆菌配比为3:2。此工艺下生产的蓝靛果椰子复合酵素,其品质指标均符合相关国标要求[13]。
该复合酵素采用东北蓝靛果和南方椰子作原材料进行发酵,发酵产品颜色呈鲜紫色,液体通透,同时蓝靛果特有的花色苷作为一种效用明显的抗氧化剂能有效防止色素氧化[14-15],提高了复合酵素的稳定性,延长了酵素的保质期;利用椰子汁和椰子肉特有的椰淡奶香风味弥补了蓝靛果的微苦涩的口感,口感自然醇厚,入口绵柔顺滑,酸度适宜;气味上,椰子独特的椰淡奶香味混合蓝靛果浓厚的果香味,椰香与果香浑然一体、互相交叠,给人带来极大的舒适与满足感;本实验研究一种新型复合酵素的酿制工艺,为蓝靛果与椰子的深加工提供了新的途径,为酵素研发领域提供了新的思路。
[1]陈英,余雄伟,龚文发,等.植物酵素发酵特性及风味物质变化的研究[J].饮料工业,2015(2):9-12.
[2]岛本邦彦.岛本生物农业应用法[M].潍坊:酵素菌素世界社中国山东总部,1996:5-15.
[3]HUANG H Y,KORIVI M,TSAI C H,et al.Supplementation ofLactobacillus plantarumK68 and fruit-vegetable ferment along with high fat-fructose diet attenuates metabolic syndrome in rats with insulin resistance[J].Evid Based Complement Alternat Med,2013,2013(1): 943020-943020.
[4]杨婧娟,李娜,赵声兰.一种酵素的配方优化研究[J].中国酿造,2016,35(1):95-99.
[5]焦岩,王振宇.蓝靛果花色苷超声波辅助提取优化及其降血脂作用[J].中国食品学报,2010,10(2):52-59.
[6]张宏,谭竹钧.四种邻苯三酚自氧化法测定超氧化物歧化酶活性方法的比较[J].内蒙古大学学报,2002,11(6):677-678
[7]马骥,陆慧贤.超氧化物歧化酶检测试剂盒抗干扰性能评价[J].国际检验医学杂志,2015(7):982-984.
[8]葛瑞宏,储瑞蔼,李井泉,等.桂圆酵素制备及其抗氧化性研究[J].食品科技,2015(8):262-267.
[9]李文星.蓝靛果花色苷提取及其抗肿瘤功能机理的初步研究[D].哈尔滨:东北林业大学,2011.
[10]李淑芹,李延冰,姜福臣,等.野生植物─蓝靛果营养成分研究[J].东北农业大学学报,1994(4):401-404.
[11]康尔歌,赵晋府,孟旭.椰肉成分的测定及相关比较[J].现代食品科技,2002,18(4):48-49.
[12]赵玉红,苗雨,张立钢.双酶法提取蓝靛果果渣中花色苷酶解条件的研究[J].中国食品学报,2008,8(4):75-79.
[13]郭艳萍,赵金安.葡萄酵素天然发酵过程中抗氧化性能研究[J].食品研究与开发,2016,37(10):51-55.
[14]YANG D X,LI X L,CHEN P Q,et al.Application of a novel compound enzyme in broiler feed[J].J Food Sci Biotechnol,2013,11(2):87-91.
[15]CHAOVANALIKIT A,THOMPSON M M,WROLSTAD R E.Characterization and quantification of anthocyanins and polyphenolics in blue honeysuckle(Lonicera caeruleaL.)[J].J Agr Food Chem,2004,52(4): 48-52.
Optimization of fermentation process ofLonicera caeruleaand coconut compound enzyme
ZHAN Weiwei1,WEI Xiaoyu2,GAO Benjie2,LI Jinglong2*(1.College of Food and Drug,Shandong Institute of Commerce and Technology,Jinan 250103,China; 2.College of Bioengineering,Qilu University of Technology,Jinan 250353,China)
The fermentation process of compound enzyme solution was researched withLonicera caeruleaand coconut as the main raw material.The effects of three main factors,such as fermentation temperature,ratio of raw materials and starter culture proportion,on the activity of compound enzyme were analyzed by single factor experiments.Using the anthocyanin content,superoxide dismutase(SOD)activity,residual sugar and total flavonoid contents as evaluation indexes,the optimum process conditions ofLonicera caeruleaand coconut compound enzyme were determined by orthogonal experiments.The results showed that the anthocyanins content,total flavonoid content,SOD activity and residual sugar content in the L.caeruleaand coconut compound enzyme were 12.17 mg/g,20.31 mg/g,56.74 U/ml and 4.22 mg/ml,respectively,with the conditions of fermentation temperature 33℃,time 70 d,ratio of yeast andBifidobacterium2:1,the mass ratio ofL.caeruleaand coconut 5:1,.The compound enzyme obtained was appropriate acidity,prominent fragrance and unique taste.
Lonicera caerulea;coconut;compound enzyme;fermentation process
TS262.7
0254-5071(2017)01-0191-05
10.11882/j.issn.0254-5071.2017.01.040
2016-08-12
济南市科技创业企业支持计划(201502109)
战伟伟(1980-),女,硕士研究生,研究方向为生物活性物质。
*通讯作者:李敬龙(1961-),男,教授,本科,研究方向为生物活性物质。
