急性下壁或合并右心室心肌梗死患者左心衰竭的危险因素分析
2017-02-16陈小艳徐元杰孔繁亮吴同果
陈小艳,徐元杰,孔繁亮,吴同果
急性下壁或合并右心室心肌梗死患者左心衰竭的危险因素分析
陈小艳,徐元杰,孔繁亮,吴同果
目的: 探讨急性下壁或合并右心室心肌梗死患者心力衰竭(心衰)的危险因素。
心肌梗死;心力衰竭;危险因素
心血管疾病日益成为人类死亡的主要因素,而在心血管疾病中急性心肌梗死(AMI)和心力衰竭(心衰)患者住院率最高[1]。心衰是AMI的最常见且危险的并发症之一,冠状动脉粥样硬化、梗死面积及心室重构等是AMI合并心衰的主要影响因素[2]。研究显示,下壁AMI较前壁AMI有更好的短期及长期的临床预后[3],下壁AMI心衰发生率也比前壁AMI低,但也有研究显示下壁AMI的患者也有不良的临床预后[4],近期研究提示,从长期评估下壁AMI比前壁AMI有更高的死亡率[5];下壁AMI并发高度房室传导阻滞较前壁AMI高,房室传导阻滞(AVB)在下壁AMI病例中约占11%~15%[6]。有研究显示,伴有AVB的下壁或合并右心室AMI可能与大的梗死面积有关[6],下壁或合并右心室AMI发生心衰患者冠状动脉病变严重,梗死面积大和缺血更广泛,住院病死率高,及时正确的处理方式对降低AMI的病死率有重要意义。
1 资料与方法
研究对象:选择2013-01至2015-06期间在广州市红十字会医院心血管内科住院的下壁或合并右心室AMI患者143例资料,其中男性88例,女性55例,均符合AMI的诊断标准[7]入选:(1)典型胸骨后或心前区剧烈压榨性疼痛持续时间≥10~20 min; (2)心电图Ⅱ,Ⅲ,aVF导联中至少2个导联出现新的病理性Q波或Ⅱ,Ⅲ,aVF导联中至少2个导联可见弓背向上ST 段抬高≥0.1 mV;(3)心肌损伤标志物升高;右心室梗死的诊断基于胸前导联V3R和(或) V4R ST段抬高≥0.1 mV。排除标准:合并其他器质性心脏病如心脏瓣膜病、心肌病、先天性心脏病,确诊或高度怀疑恶性肿瘤患者,慢性阻塞性肺病,晚期肾功能不全及既往有心功能不全未控制等病例。心衰的诊断依据2013年美国心脏病学会基金会 /美国心脏协会心衰管理指南[8],采用Killip分级:Ⅰ级指无肺部啰音;Ⅱ级指双下肺野啰音未超过一半; Ⅲ级指双肺啰音超过一半(急性肺水肿);Ⅳ级指心原性休克。住院期间出现Killip分级Ⅱ级及以上定义为心衰。胸前导联ST段下移定义为至少2个导联J点后80 ms下移≥ 0.1 mV。将患者以下移最明显导联的部位进一步分为V1~3导联 ST段压低为主和V4~6导联 ST段压低为主。恶性室性心律失常包括:心室颤动、心室扑动和反复发作性持续性室性心动过速。中间型室性心律失常包括:频发的室性期前收缩、短阵室性心动过速[9]。将心房颤动、恶性室性心律失常及中间型室性心律失常记录为心律失常事件。根据患者住院期间Killip分级Ⅱ级及以上分为心衰组和非心衰组,其中心衰组81例,非心衰组62例。
收集资料与辅助检查:记录患者入院时临床特征,包括年龄、性别、高血压病史等。即刻记录患者心电图、血常规、 肌钙蛋白T、N末端B型利钠肽原(NT-proBNP)。入院24 h内检测血肌酐(Scr)、血尿素氮(BUN)、胱抑素、超敏C反应蛋白(hs-CRP)等;部分患者完善心脏多普勒超声(仪器为美国GE vividE9)评价患者室壁运动情况。并记录患者入院后连续4天补液量,如出现左心室功能不全,使用利尿剂的情况。
冠状动脉造影:采用直径法,冠状动脉狭窄程度>5O%为阳性,无狭窄或有狭窄但未达到上述标准者为阴性,前降支(LAD)、回旋支(LCX)或右冠状动脉(RCA)中1支有狭窄者为单支病变,2支有病变为双支病变,3支均有病变为3支病变,左主干病变者,无论LAD或LCX有无病变,均视为双支病变,若同时合并RCA病变侧为3支病变。并记录植入临时起搏器手术。
统计学处理:采用SPSS 13.0软件进行统计学分析。所有计量资料用均数±标准差表示,两组间比较采用t检验。计数资料采用χ2检验,以P<0.05为差异有统计学意义。筛选出心衰的高危因素,采用单因素Logistic回归分析,下壁或合并右心室AMI患者入院后发生心衰的危险因素,采用多因素前向回归法进行Logistic回归分析,P<0.05为差异有统计学意义。
2 结果
一般临床资料比较(表1):与非心衰组比较,心衰组年龄偏大,高血压、女性比例、既往冠心病、hs-CRP、胱抑素、Scr、BUN、AVB、入院时NT-proBNP、住院最高NT-proBNP、胸片提示渗出、胸前导联ST段压低、以V4~6导联ST段压低为主、术中使用临时起搏器、入院后第2、3、4天补液量、心律失常、缺血事件均明显升高,差异有统计学意义(P<0.05)。入院时收缩压及舒张压明显下降,差异有统计学意义(P<O.05)。糖尿病、吸烟、既往经皮冠状动脉介入治疗(PCI)、入院时肌钙蛋白T、以V1~3导联ST段压低为主、左心室射血分数(LVEF)、左心室舒张末期内径(LVDd)、左心室短轴缩短分数(FS)、E峰与A峰比值(E/A)、局部室壁运动障碍、冠状动脉造影入路的外周血管、入院后第1天补液量等比较,差异无统计学意义(P>0.05)。
单因素Logistic回归分析(表2): 各危险因素对心衰事件的单因素Logistic回归分析显示高血压、女性、hs-CRP、入院时舒张压、Scr、入院后第3天补液量、以V4~6导联ST段压低为主与下壁或合并右室AMI患者心功能相关。
表1 心衰组与非心衰组一般临床资料比较
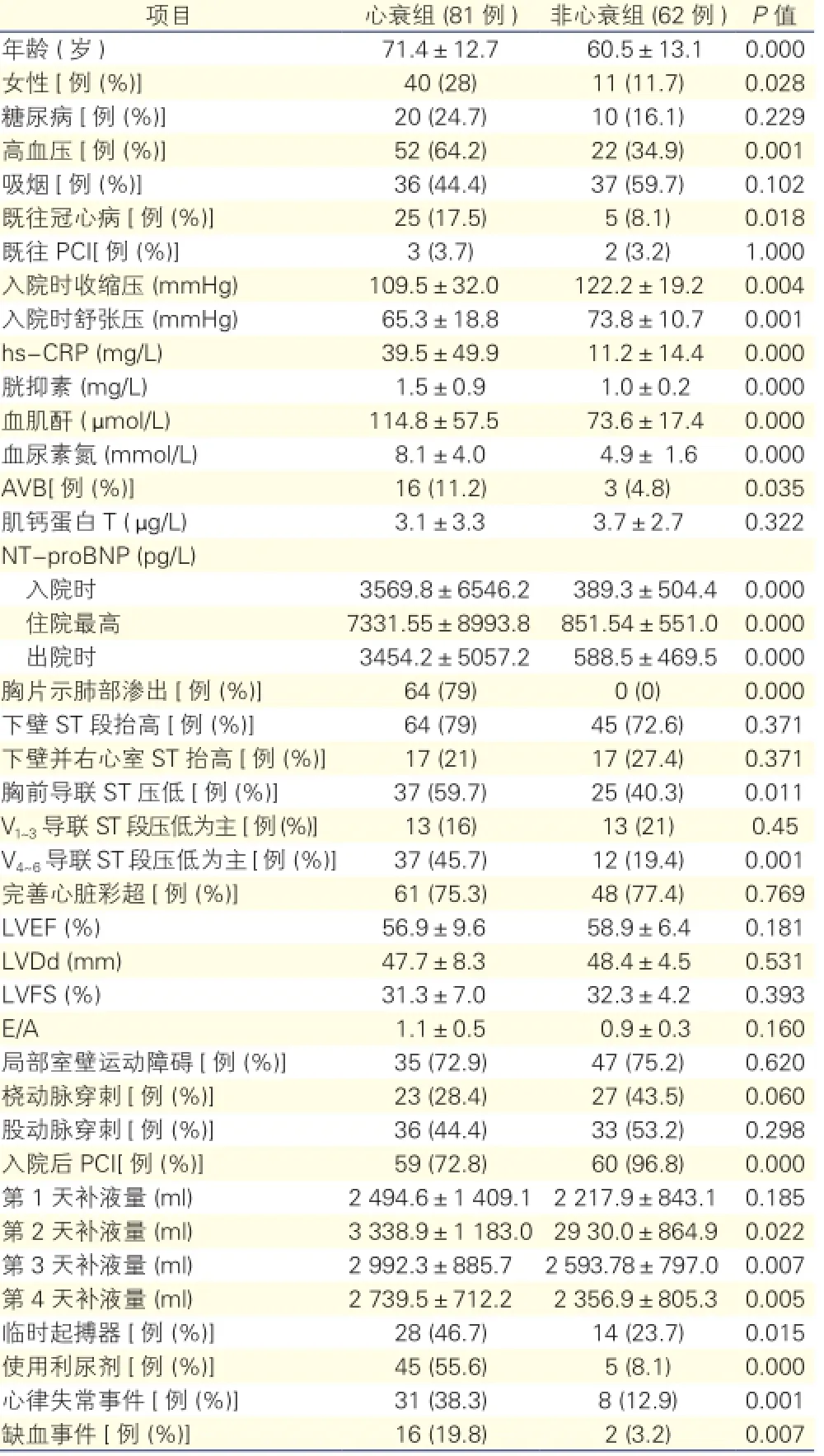
表1 心衰组与非心衰组一般临床资料比较
注:PCI:经皮冠状动脉介入治疗;hs-CRP:超敏C反应蛋白;AVB:房室传导阻滞;NT-proBNP:N末端B型利钠肽原;LVEF:左心室射血分数;LVDd:左心室舒张期内径;LVFS:左心室短轴缩短分数;E/A: 舒张早期心室充盈速度最大值/舒张晚期心室充盈速度最大值;缺血事件:为住院期间及出院1个月内死亡、心绞痛发作、新发心肌梗死;1 mmHg=0.133 kPa
?
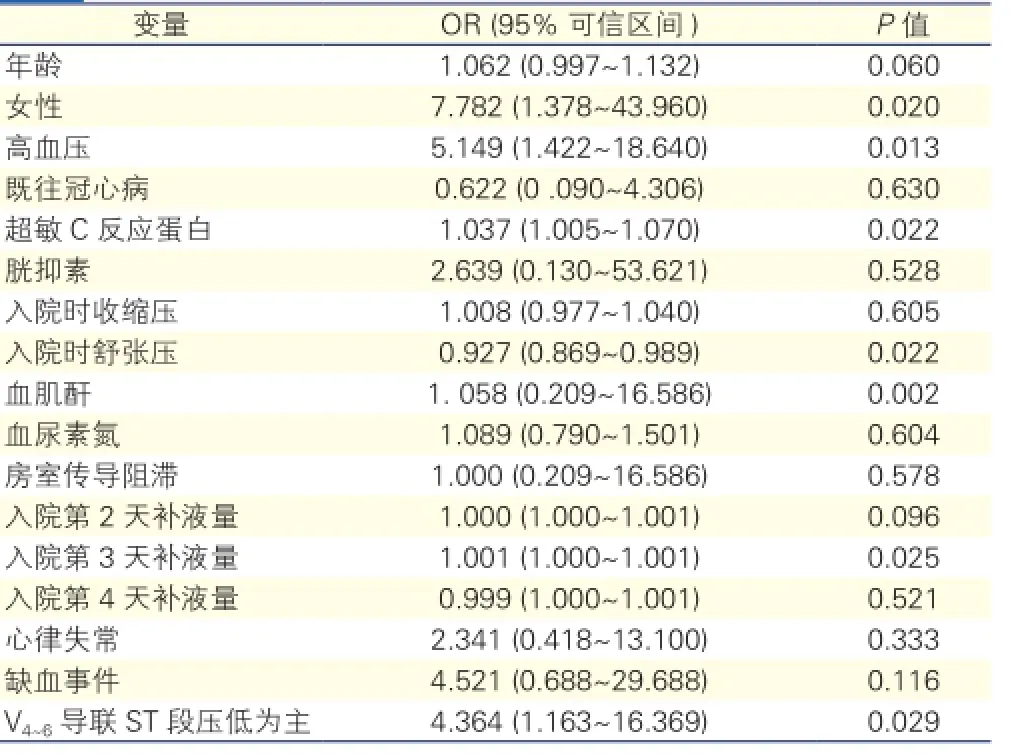
表2 危险因素对心衰事件的单因素Logistic回归分析
多因素Logistic回归分析(表3):将上述经单因素回归分析差异有统计学意义的因素进行多因素Logistic回归分析,结果显示,高血压、女性、hs-CRP、入院时舒张压、Scr、以V4~6导联 ST段压低为主是下壁或合并右心室AMI患者发生心衰的危险因素因素。

表3 危险因素对心衰事件的多因素Logistic回归分析
3 讨论
下壁或合并右心室AMI常见,下壁或合并右心室AMI早期心衰与右心室收缩功能降低有关,主要表现为低血压,甚至休克。适当补液可以纠正低血压和休克状态。但常常存在液体潴留,3天后,右心室功能可以完全恢复,增加左心室充盈,甚至导致肺水肿,完全区别于左心室心肌梗死,应引起临床医生注意右心室心肌梗死的特殊性,强调心肌梗死后3天,血压恢复后,及时合理限制补液、注意利尿剂使用,以便预防左心衰竭。目前对下壁或合并右心室AMI发生左心衰竭的临床报道较少,本研究旨在提高临床医师的警惕性。本研究通过对143例急性下壁或合并右心室AMI患者的回顾性研究,发现急性下壁或合并右心室AMI患者住院期间出现心衰患者与患者既往高血压病史、入院时舒张压、女性、hs-CRP、Scr及伴V4~6导联ST段压低为主的患者有关,表明上述因素是下壁或并右室AMI患者住院期间发生心衰的独立危险因素。
有研究显示,高血压并发AMI患者具有血压下降、心功能不全、再梗死率及死亡率高等特点[10],与本研究中心衰组患者高血压发病率高及入院时患者收缩压、舒张压均低以及心衰组住院期间及1个月内发生缺血事件高的结果相符。并经回归分析显示高血压及入院时舒张压低是下壁或合并右心室AMI发生心衰的危险因素。研究表明,收缩压与心血管危险之间的关系呈现U形曲线关系[11]。AMI后,交感神经兴奋性及外周阻力增加,能够在一定程度上维持舒张压水平,随着心室重构使得心脏顺应性下降,导致左心室充盈压升高,舒张压下降,可引起心血管事件发生及左心功能不全进一步加重[12]。有证据表明,患者在AMI期间,过度降压 (特别是舒张压过低),易导致不良后果及梗死面积扩大。日本学者研究发现在一定范围内高舒张压是运动相关心肌缺血的保护因素[13]。本研究数据也显示舒张压越低,心衰发生率越高,在动脉粥样硬化已经很严重的老年人,低舒张压导致的冠状动脉血流灌注减少是其增加冠心病风险的主要原因。
本研究显示,女性是下壁或合并AMI发生心衰的危险因素,而结合心脏彩超提示LVEF、FS、E/A、LVDd在两组比较差异均无统计学意义。有研究评估,LVEF值保留的心衰占所有临床心衰的50%[14],并且其比例正不断上升,也有研究显示,随着年龄的升高,在LVEF保留的心衰中显示越来越多的患者为女性[15],这可能是女性心脏病患者对早期的血管疾病的认识不够重视,未及时得到治疗,如对高血压未及时控制,而高血压是舒张功能不全的最大危险因素之一[16],心肌对血压升高的反应存在性别差异, 女性对血压升高后发生心肌肥厚与僵硬比男性更明显[17]。
hs-CRP是一种系统炎症反应标志性因子,在动脉粥样硬化、心肌梗死等心脏病患者血循环中均有升高。本研究中显示hs-CRP为下壁或合并右心室AMI患者发生心衰的危险因素,近年许多证据表明,心衰的过程中存在炎性系统的慢性激活,心衰时,由于心输出量下降,组织缺氧及灌注不足,机体处于应激状态,直接或间接参与高血压、高脂血症、内皮功能紊乱等的发生,除对神经内分泌系统的激活和机体炎症反应进行调节外[18],还存在广泛的免疫及淋巴系统的激活,使体内快速分泌C反应蛋白并释放入血液中,从而血清中的C反应蛋白升高。
本研究显示,心衰组与非心衰组比较Scr及BUN差异具有统计学意义,经相关回归分析表明,Scr为预测下壁或合并右心室AMI并发心衰的危险因素。既往研究已证实,肾功能不全患者,钠水潴留可加重患者心脏负荷,进而引起心功能不全,其死亡危险性明显增加,且二者存在恶性循环促进作用,心功能越差,肾灌注受影响,肾功能不全发生率明显升高[19]。国内研究也发现肾功能不全的冠心病患者冠状动脉病变广泛,钙化明显,接受再血管化治疗率低,随访期心血管事件的发生率高[20]。
本研究还表明心电图以V4~6导联ST段压低为主的表现是下壁或合并右心室AMI并发心衰的危险因素,心电图以V4~6导联ST段压低为主的表现,又称“下壁心肌梗死并远方心肌缺血”,反映了左冠系统前降支狭窄病变,即广泛的冠状动脉疾病及短暂的弥漫性缺血改变,导致左心室舒张能力降低,增加左心室舒张末期压力,影响左心房血液向左心室充盈,继而影响肺静脉回流,甚至导致急性肺水肿。
本研究比较心衰与非心衰两组高度AVB及心律失常均有统计学意义。有研究显示,下壁AMI合并完全性AVB是心肌梗死面积大的标志[6],梗死面积越大心衰发生率越高;也有研究显示,心房颤动在舒张功能不全的患者中较常见[16],心房颤动使心脏舒张功能受限,可加重心衰。众所周知,下壁AMI的病变靶血管多为RCA,RCA供应右心系统,如果急性闭塞,极易引起右心功能不全,此时治疗主要为恢复右心系统容量,需大量补液。本研究中所有入组患者均记录入院后连续4天补液量,经计量资料显示入院第1天补液量两组无统计学意义,考虑为患者入院时间不一所致,而第2、3、4天过分增加补液量是导致心衰的高危因素,经回归分析示第3天补液量的增多对左心功能不全的形成极为重要,右心室AMI后约72 h,右心室功能恢复,增加左心室充盈,此时及此后如仍补液过量,极易形成左心衰,此时应限制补液量或适当使用利尿剂,故临床医师应积累经验,警惕有补液过量、治疗过度的人为因素的存在。有研究显示,过分扩张右心室容量可进一步使左心室输出量降低,因为心包内压力增大,导致心包抑制效应[21],故在补液的同时应兼顾右室与左室舒张后的均衡,有研究表明补液应维持肺楔压18~24 mmHg[22],如仍补液增加肺楔压,并不能增加左心室输出量[22],反而增加左心衰的机率,如补液后仍不能维持血压,此时应使用收缩外周血管药物维持血压。
本研究中心脏彩超室壁运动障碍与心衰无明显相关性,考虑可能与样本量偏少有关。同时本研究记录心律失常未能细分心律失常类型,也仅纳入了住院的下壁或(和)右心室AMI且部分行冠状动脉造影患者,且为回顾性研究,未能对AMI发病到就诊时间、既往心血管药物应用情况进一步分析,因此有一定的局限性。
[1] Chun S1, Tu JV, Wijeysundera HC, et al. Lifetime analysis of hospitalizations and survival of patients newly admitted with heart failure. Circ Heart Fail, 2012, 5: 414-421.
[2] Zornoff LA, Paiva SA, Duarte DR, et al. Ventricular remodeling after myocardial infarction: concepts and clinical implications. Arq Bras Cardiol, 2009, 92: 150-164.
[3] Nienhuis MB, Ottervanger JP, Dambrink JH, et al. Comparative predictive value of infarct location, peak CK, and ejection fraction after primary PCI for ST elevation myocardial infarction. Coron Artery Dis, 2009, 20: 9-14.
[4] Yip HK, Wu CJ, Fu M, et al. Clinical features and outcome of patients with direct percutaneous coronary intervention for acute myocardial infarction resulting from left circumflex artery occlusion. Chest, 2002, 122: 2068-2074.
[5] Gomez JF, Zareba W, Moss AJ, et al. Prognostic value of location and type of myocardial infarction in the setting of advanced left ventricular dysfunction. Am J Cardiol, 2007, 99: 642-646.
[6] Jim MH, Chan AO, Tse HF, et al. Clinical and angiographic findings of complete atrioventricular block in acute inferior myocardial infarction. Ann Acad Med Singapore, 2010, 39: 185-190.
[7] 中华医学会心血管病学分会, 中华心血管病杂志编辑编委会. 急性ST段抬高型心肌梗死诊断和治疗指南. 中华心血管病杂志, 2015, 43: 380-393.
[8] Yancy CW, Jessup M, Bozkurt B, et al. 2013 ACCF /AHA guideline for the management of heart failure: a report of the American College of Cardiology Foundation /American Heart Association Task Force on Practice Guidelines.J Am Coll Cardiol, 2013, 62: e147-239.
[9] 李庚山, 李莉, 任自文, 等. 心脏猝死的防治建议. 中国心脏起搏与心电生理杂志, 2002, 6: 401-416.
[10] Hamon M, Agostini D, Le Page O, et al. Prognostic impact of right ventricular involvement in patients with acute myocardial infarction: meta-analysis. Crit Care Med, 2008, 36: 2023-2033.
[11] 段留法, 郑秋甫, 张丽萍, 等. 老年男性高血压降压治疗后动态舒张压与心血管事件发生的危险.中国老年医学杂志, 2005, 25: 122-124.
[12] Chonchol M, Goldenberg I, Moss AJ, et al. Risk factors for sudden cardiac death in patients with chronic renal insufficiency and left ventricular dysfunction. Am J Nephrol, 2007, 27: 7-14.
[13] Yamagishi H, Yoshiyama M, Shirai N, et al. Protective effect of high diastolic blood pressure during exercise against exercise-induced myocardial ischemia. Am Heart J, 2005, 150: 790-795.
[14] Zheng H, Li Y, Xie N. Association of serum total bilirubin levels with diastolic dysfunction in heart failure with preserved ejection fraction. Biol Res, 2014, 47: 7.
[15] Steinberg BA, Zhao X, Heidenreich PA, et al. Trends in patients hospitalized with heart failure and preserved left ventricular ejection fraction: prevalence, therapies, and outcomes. Circulation, 2012, 126: 65-75.
[16] Sherazi S, Zaręba W. Diastolic heart failure: predictors of mortality. Cardiol J, 2011, 18: 222-232.
[17] Meyer S, Brouwers FP, Voors AA, et al. Sex differences in new-onset heart failure. Clin Res Cardiol, 2015, 104: 342-350.
[18] 刘海波, 高润霖, 陈纪林, 等. C-反应蛋白与冠心病患者冠状动脉斑块形态的关系. 中国循环杂志, 2002, 17: 130-132.
[19] 冯会英, 冯国鹏, 高瑾, 等. 血清糖类抗原与N末端B型利钠肽原在肾功能衰竭合并心力衰竭患者中的诊断价值. 中国循环杂志, 2015, 30: 359-362.
[20] 苗冬梅, 曹瑞华, 刘源, 等. 老年人慢性肾功能不全对冠心病预后的影响.中华老年多器官疾病杂志, 2010, 9: 127-130.
[21] Brookes C, Ravn H, White P, et al. Acute right ventricular dilatation in response to ischemia significantly impairs left ventricular systolic performance. Circulation, 1999, 100: 761-767.
[22] Inohara T, Kohsaka S, Fukuda K. The challenges in the management of right ventricular infarction. Eur Heart J Acute Cardiovasc Care, 2013, 2: 226-234.
Risk Factor Analysis for Left Heart Failure in Patients With Acute Inferior or Combining Right Ventricular Myocardial Infarction
CHEN Xiao-yan, XU Yuan-jie, KONG Fan-liang, WU Tong-guo.
Department of Cardiology, Guangzhou Red Cross Hospital, Medical College of Jinan University, Guangzhou (510220), Guangdong, China
WU Tong-guo, Email: wutongguo@sohu.com.
Objective: To explore the risk factors for heart failure (HF) occurrence in patients with inferior or combining right ventricular myocardial infarction (MI).Methods: A total of 143 patients with inferior or combining right ventricular myocardial infarction (MI) in our hospital from 2013-01 to 2015-06 were studied. Based on HF occurrence, the patients were divided into 2 groups: HF group, n=81 and Non-HF group, n=62. The risk factors related to HF occurrence as age, gender and hypertension were retrospectively studied and compared between 2 groups.Results: Compared with Non-HF group, HF group had more patients with hypertension, female gender, higher blood levels of Hs-CRP and creatinine, more volume of fluid input on the 3rd day of admission and the higher ratio of V4-6 ST segment depression in ECG; while obviously lower diastolic blood pressure (DBP) at admission. Multivariate Logistic regression analysis indicated that hypertension (OR=3.275, 95% CI 1.220-8.793), female gender (OR=13.236, 95% CI 3.476-50.405), Hs-CRP (OR=1.029, 95% CI 1.005-1.070), low DBP at admission (OR=0.945, 95% CI 0.911-0.979), serum creatinine (OR=1.053, 95% CI 1.029-1.078) and V4-6 ST segment depression in ECG (OR=4.118, 95% CI 1.395-12.154) were positively related to HF occurrence in relevant patients.Conclusion: The incidence of HF has been relatively high in patients with inferior or combining right ventricular MI; hypertension, female gender, low DBP at admission, blood level of Hs-CRP, serum creatinine, V4-6 ST segment depression in ECG were the independent risk factor for HR occurrence.
Myocardia1 infarction; Heart failure; Risk factors (Chinese Circulation Journal, 2017,32:21.)
2016-02-15)
(编辑:宁田海)
510220 广东省,广州市红十字会医院 暨南大学医学院附属广州红十字会医院
陈小艳 硕士研究生 主要从事急性冠状动脉综合征诊断和治疗研究 Email:1056832648@qq.com 通讯作者:吴同果 Email:wutongguo@sohu.com中图分类号:R54 文献标识码:A 文章编号:1000-3614(2017)01-0021-05 doi:10.3969/j.issn.1000-3614.2017.01.006
方法: 将我院2013-01至2015-06期间143例因急性下壁或合并右心室心肌梗死入院患者按是否发生心衰,分为心衰组81例,非心衰组62例,从年龄、性别、高血压等因素对心衰形成的危险因素进行回顾性分析。
结果: 心衰组高血压、女性、超敏C反应蛋白、血肌酐、入院后第3天补液量、以V4~6导联ST段压低为主发生比例显著高于非心衰组,而入院时舒张压显著低于非心衰组。经多因素Logistic回归分析显示,高血压[OR=3.275,95%可信区间(CI): 1.220~8.793)、女性(OR=13.236,95%CI: 3.476~ 50.405)、超敏C反应蛋白(OR=1.029,95%CI: 1.005~1.070)、入院时低舒张压(OR=0.945,95%CI: 0.911~0.979)、血肌酐(OR=1.053,95%CI: 1.029~1.078)、以V4~6导联ST段压低为主(OR=4.118,95%CI: 1.395~12.154)均与心衰事件呈正相关。
结论: 急性下壁或合并右心室心肌梗死患者发生心衰比例较高,且受多种因素影响。其中高血压、女性、入院时舒张压、超敏C反应蛋白、血肌酐、伴V4~6导联ST段压低为主是急性下壁或合并右心室心肌梗死患者发生心衰的独立危险因素。
