再生障碍性贫血患者B细胞及其介导的体液免疫状况研究
2017-02-16沈英英武利强林圣云
沈英英 武利强 王 博 邓 姝 林圣云
·论 著·
再生障碍性贫血患者B细胞及其介导的体液免疫状况研究
沈英英 武利强 王 博 邓 姝 林圣云
目的 观察再生障碍性贫血(AA)患者B细胞及其介导的体液免疫状况。方法AA患者65例,其中非重型再生障碍性贫血(NSAA)35例,重型再生障碍性贫血(SAA)30例,同期正常体检者25名(正常组)。速率散射比浊法检测AA组与正常组免疫球蛋白(IgG、IgA及IgM)含量,比较免疫球蛋白表达情况。流式法检测AA组与正常组CD20+、CD19+CD38+、CD5+CD19+比例。结果(1)AA组和正常组患者各免疫球蛋白浓度差异无统计学意义(P>0.05);SAA患者IgA、IgM、IgG浓度低于NSAA患者(1.46g/L比1.97g/L,P<0.05;1.47g/L比1.50g/L,P<0.05;10.80g/L比11.05g/L,P<0.05);(2)AA组B淋巴细胞亚群中CD20+比例明显低于正常组(9.00%比12.12%,P<0.05);CD19+CD38+、CD19+CD5+比例明显高于正常组(6.23%比3.80%,P<0.05;2.43%比1.90%,P<0.05);SAA和NSAA患者CD20+比例差异无统计学意义(P>0.05),SAA患者CD19+CD38+、CD19+CD5+比例明显高于NSAA患者(6.80%比4.40%,P<0.05;7.35%比1.80%,P<0.05);(3)AA患者强化免疫抑制治疗(IST)无效患者CD19+CD38+、CD19+CD5+比例均高于治疗有效患者(12.30%比4.53%,P<0.05;7.70%比1.93%,P<0.05)。结论AA患者存在B淋巴细胞介导的体液免疫紊乱,B淋巴细胞功能紊乱的AA患者对IST疗效差。
再生障碍性贫血;免疫球蛋白;B淋巴细胞亚群
再生障碍性贫血(aplastic anemia,AA)是一类免疫介导的造血功能衰竭综合征。目前认为AA主要病机是T细胞功能亢进引起的免疫异常[1-2]。因此,通常采用抗胸腺细胞免疫球蛋白(ATG)/抗淋巴细胞免疫球蛋白(ALG)联合环胞霉素A(CSA)治疗。这种强化免疫抑制治疗(immunosuppressive therapy,IST)虽然获得较高的疗效[3-5],但除外早期死亡病例,10%~30%的SAA患者对上述治疗无效或ATG+CSA治疗后复发,对于这部分对IST应答较差的AA患者,目前没有统一并且有效的治疗方法。骨髓移植虽然疗效显著,但也仅有30%的AA患者可以找到相合的同胞供体,若再涉及到身体状况等其他因素,许多患者不能得到适合的骨髓移植治疗。针对部分再障患者疗效较差的治疗现状,我们推测B淋巴细胞及其介导的异常体液免疫在部分AA的发病机制中可能存在(尤其是在对IST无效的患者中),我们从B淋巴细胞介导的体液免疫的角度来探究其在AA中的作用和机制。
1 资料与方法
1.1 临床资料 2014年4月—2014年10月在浙江中医药大学附属第一医院血液科住院的AA患者65例,男34例,女31例,年龄16~70岁,平均(40.46± 15.85),重型再生障碍性贫血(severe aplastic anemia,SAA)30例,非重型再生障碍性贫血(non severe aplastic anemia,NSAA)35例,IST治疗有效44例,IST治疗无效21例。正常组25名,为同期本院健康体检者,男13名,女12名,年龄25~55岁,平均(42.0±11.30)岁。两组一般资料比较差异无统计学意义(P>0.05)。
1.2 试 剂 CD3、CD5、CD19、CD20及CD38等各种荧光标记单克隆抗体为美国Beckman Coulter公司产品(试剂批号分别为A07749、A08932、A04929、A054659、A07778)。
1.3 方 法
1.3.1 标本采集 AA患者治疗前及治疗后3个月各取外周静脉血2mL置于干燥管内,室温自然凝固30min,3000r/min离心20min分离血清,分装后置于-80℃冰箱冻存。正常组取2mL外周静脉血置于干燥管内,用同样方法分离和冻存血清。
1.3.2 检测方法 速率散射比浊法测定血清免疫球蛋白。流式法检测B淋巴细胞亚群。
1.4 统计学方法 应用SPSS17.0软件,分类资料采用卡方检验,各组数据以均值±标准差(±s)表示。偏态分布资料采用中位数与四分位数[M(P25,P75)]表示,用非参数统计方法Mann-whitney U进行秩和检验,以P<0.05为差异有统计学意义。
2 结果
2.1 AA组患者与正常组免疫球蛋白浓度比较 AA组和正常组的各免疫球蛋白浓度差异无统计学意义(P>0.05);NSAA组免疫球蛋白浓度(IgA、IgM、IgG)高于SAA组,差异有统计学意义(P<0.05),见表1~2。

表1 AA组患者和正常组免疫球蛋白浓度比较[(g/L),M(P25,P75)]

表2 NSAA组和SAA组患者免疫球蛋白浓度比较[(g/L),M(P25,P75)]
2.2 AA组患者和正常组B淋巴细胞亚群比较 AA组患者B淋巴细胞亚群中CD20+比例明显低于正常组(P<0.05);CD19+CD38+、CD19+CD5+比例明显高于正常组(P<0.05),见表3。SAA组和NSAA组间CD20+比例差异无统计学意义(P>0.05),CD19+ CD38+、CD19+CD5+比例SAA组明显高于NSAA组(P<0.05),见表4。AA患者IST治疗无效组患者CD19+CD38+、CD19+CD5+比例均高于有效组患者(P<0.05),见表5。
3 讨论
免疫紊乱引起造血抑制是AA的重要发病机制之一。人体内T淋巴细胞介导的细胞免疫和B淋巴细胞介导的体液免疫相互联系,相互依存。研究[6]表明,AA患者骨髓中B细胞通过协同刺激因子影响调节性T细胞(CD4+CD25highFoxp3+Treg)导致T细胞异常活化,进而使骨髓造血功能衰竭。也有研究从AA患者体内发现针对自身抗原的特异性抗体以及血清中IgG片段[7]。研究者在AA患者体内检出了针对自身抗原的特异性抗体,认为自身特定抗原在引起T细胞克隆性增殖以及细胞免疫功能异常的同时,也能够引起B淋巴细胞介导的体液免疫紊乱。
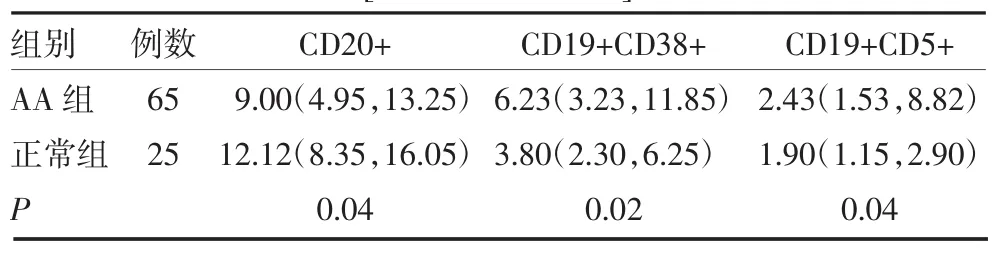
表3 AA组患者和正常组B细胞亚群比较[%,M(P25,P75)]
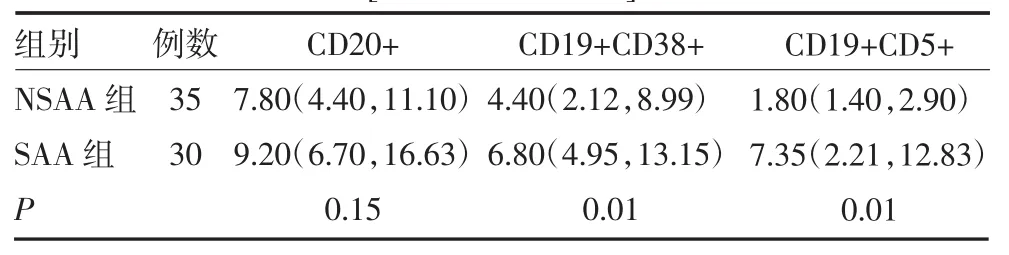
表4 NSAA组和SAA组患者B细胞亚群计数比较[%,M(P25,P75)]
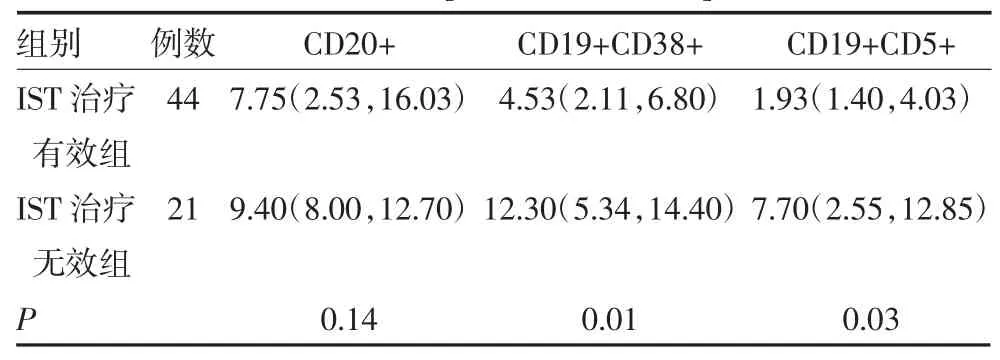
表5 IST治疗有效组和IST治疗无效组B细胞亚群计数比较[%,M(P25,P75)]
免疫球蛋白由正常浆细胞产生,能够识别并特异性结合抗原,参与人体的体液免疫,具有激活补体以及抗菌抗病毒作用。AA患者免疫球蛋白的表达情况目前尚无明确的定论,大多数学者认为AA患者I-gA、IgG、IgM浓度比健康人群偏低,治疗后患者血象恢复时复查该水平可见表达较前升高[8]。也有研究认为免疫球蛋白浓度在AA患者和健康人之间无差异[9]。近期一项研究[10]检测全血细胞减少症患者骨髓单个核细胞膜抗体类型发现复发患者以IgG为主,并认为产生IgG是激活记忆B细胞的主要生物学功能,IgG的升高与疾病难治及复发有关。本研究发现,AA组外周血免疫球蛋白较正常组虽有下降,但差异无统计学意义(P>0.05)。SAA患者的免疫球蛋白(IgM、IgG)浓度明显低于NSAA组(P<0.05),可能与AA存在骨髓及造血微环境的缺陷,不能有效支持B细胞正常分化和增殖有关,也可能与Th细胞功能异常,不能有效激活B细胞,引起免疫球蛋白的产生功能障碍;而免疫球蛋白的下降使得机体抗感染能力降低,增加了感染风险,这可能在一定程度上影响到疾病的预后。
CD5+CD19+B淋巴细胞是B淋巴细胞的一个分支,CD5分子是一个高分子糖蛋白,目前已有多项研究发现在系统性红斑狼疮、重症肌无力等疾病中存在CD5+B细胞升高[11-12]。CD5+CD19+B细胞可识别多种细菌表面抗原,包括细菌表面的多糖、脂多糖(LPS),尤以碳水化合物反应最强,是机体抵抗外来病原微生物感染的第一道防线[13]。它同时具有抗原提呈,产生自身抗体和促炎细胞因子的功能。CD19分子存在于B淋巴祖细胞分化以及成熟的全过程,是B淋巴细胞的限制性抗原。其能够调节B淋巴细胞的活化及增殖,以及参与B淋巴细胞信号的传导,代表了B淋巴细胞活化与增殖水平。骨髓单个核细胞中CD19+细胞增加可能提示存在体液免疫紊乱[14]。CD38+为B淋巴细胞膜表面激活标志,与B淋巴细胞的发育成熟有关。通过与T细胞受体及B细胞受体的结合,CD38参与T淋巴细胞的共刺激,其表达阳性可以作为B淋巴细胞活化的标志。本研究发现正常人B淋巴细胞亚群基本上不表达或低表达,说明在生理状态下,B淋巴细胞处于静止状态,基本上无B淋巴细胞的激活。本研究显示,AA患者的CD20+B淋巴细胞数量明显低于正常组(P<0.05),提示大部分患者的B淋巴细胞功能低下,这也与Sevilla等[15]研究相似,他们发现AA患者B细胞表达明显减低,但在移植后完全恢复。结果还显示AA组患者CD19+CD38+B淋巴细胞、CD19+CD5+B淋巴细胞数量明显高于正常组,SAA组患者CD19+CD38+B淋巴细胞、CD19+CD5+B淋巴细胞数量明显高于NSAA组患者(P<0.05)。CD19+CD5+B淋巴细胞数量的升高可能与Th2或者感染因素对CD5+CD19+B淋巴细胞的激活有关[13],可以解释SAA容易受到细菌侵袭;CD5+ CD19+B淋巴细胞的数量增高可能提示AA患者受到了某些抗原的刺激,通过抗原提呈,产生自身抗体和促炎细胞因子,参与SAA的发病。CD19+CD38+B淋巴细胞也是活化的B淋巴细胞,对白细胞各亚型作用明显,因此认为它可能与AA的发病存在关联。根据AA患者对IST应答率,CD5+CD19+B淋巴细胞、CD19+CD38+B淋巴细胞升高者,IST治疗效果均减低,提示B淋巴细胞功能紊乱患者对常规IST治疗效果较差。
机体免疫系统的调控机制广泛而复杂,以T淋巴细胞为主的细胞免疫和B淋巴细胞为主的体液免疫相互联系、相互影响。B细胞可以通过协同刺激分子以及调节性T淋巴细胞影响T细胞的活化增殖和凋亡,引起AA的发病。B淋巴细胞及其介导的体液免疫对AA的发病机制有着重要的作用和影响。CD5+CD19+B淋巴细胞、CD19+CD38+B淋巴细胞增高,导致自身抗体的产生是B细胞抑制造血的原因之一[16],可以为针对B细胞功能紊乱的治疗如丙种球蛋白和抗CD20单抗提供理论依据和参考。本研究因AA患者的血细胞较少,抗体的检测仅进行了ELISA法,若通过Western-Blot法检测,可能准确率更高。
[1]Yin XX,Liu CF,Li LZ.Significance of CD4+CD25+CD127(low)regulatory T cells and notch1 pathway in the pathogenesis of aplastic anemia[J].Zhonghua Xue Ye Xue Za Zhi,2008,20(29):308-311.
[2]Chen J,Ellison FM,Eckhaus MA,et al.MinorAntigen h60-mediatedaplastic anemia is ameliorated by immunosuppression and the infusion of regulatory T cells[J].J Immunol, 2007,178(7):4159-4168.
[3]Young NS,Bacigalupo A,Marsh JC.Aplastic anemia:pathophysiology and treatment[J].Bid Blood Marrow Transplant,2010,16(1 suppl):S119-S125.
[4]Demir E1,Cigerci Günaydin N,Karadas N,et al.A successful desensitization protocol for horse-derived antithymocyte globulin in severe aplastic anemia[J].Pediatr Allergy Immunol,2015,26(2):168-172.
[5]Chen M,Liu C,Zhuang J,et al.Long-term follow-up study of porcine anti-human thymocyte immunoglobulin therapy combined with cyclosporine for severe aplastic anemia[J]. Eur J Haematol,2016,96(3):291-296.
[6]GaipaG,BassoG,Maglia O,et al.Drug-induced immunophenotypic modulation in childhood ALL:Implications forminimal residual diseasedetection[J].Leukemia,2005,19(1):49-56.
[7]Liu H,Mihara K,Kinmra A,et al.Introduction of apoptosis in CD34+cells by sera from patients with aplastic anemia[J].Hiroshima J Med Sci,1999,48(2):57-63.
[8]张焱,李晓红,王春美.儿童ITP和AA的细胞免疫与体液免疫变化[J].医药论坛杂志,2010,31(4):17-19.
[9]李军军,田伟.慢性再生障碍性贫血病儿治疗前后免疫功能的变化[J].青岛大学医学院学报,2005,41(2):165-166.
[10]Wang Y,Fu R,Liu H,el al.Memory B(CD5+CD19+ CD27+)lymphocyte in patients with immune-related pancytopenia[J].Chinese Journal of Hematology,2014,35(8):719-723.
[11]付蓉,邵宗鸿.CD5+B淋巴细胞与自身免疫性疾病[J].国外医学·输血及血液学分册,2001,24(6):486-488.
[12]Morbach H,Singh SK,Faber C,et al.Analysis of RAG expression by peripheral blood CD5+and CD5-B cells of patients with childhood systemic lupus erythematosus[J]. Ann Rheum Dis,2006,65(4):482-487.
[13]AritaM,KodamaS.Single cellanalysisofadenoidCD5+B cells and their protective contribution stonasopharyngeal immunity[J].Laryngoscope,2003,113(3):484.
[14]牛占恩.免疫相关性全血细胞减少症(IRP)B淋巴细胞及其CD5+B细胞数量检测的临床意义[J].中国现代医学杂志,2011,21(25):3140-3142.
[15]Sevilla DW,Emmons FN,Colovai AI.Hematogones are markedly reduced in pediatric acquired aplastic anemia:multiparametric flowcytometric analysis[J].Leuk Lymphoma,2009,50(12):1951-1957.
[16]陈静静,冯建明,李文倩,等.B细胞及其分泌的抗体在免疫相关性全血细胞减少症中的研究进展[J].世界最新医学信息文摘,2016,16(57):55-56.
(收稿:2016-05-26 修回:2016-08-12)
B Lymphocytes and Humoral Immunity in Patients with Aplastic Anemia
SHEN Yingying,WU Liqiang, WANG Bo,DENG Shu,LIN Shengyun.Department of Hematology,Zhejiang Chinese Medical Hospital,Hangzhou (310006),China
Objective To investigate the changes and clinical significance of B-lymphocyte subsets and the humoral immunity in aplastic anemia(AA)patients.MethodsSixty-five AA patients were recuited in this study,of which 35 were non-severe AA(NSAA)patients and 30 were severe AA(SAA)patients.Twenty-five healthy subjects served as controls.Rate immune scatter turbidimetry was used to detect the concentration of immunoglobulin(IgA, IgM and IgG)in AA patients and controls.Flow cytometry assay was used to determine the expression of CD20+B lymphocytes,activated CD19+CD38+B lymphocytes,and B lymphocyte subset CD5+CD19+.ResultsNo significant difference in immunoglobulin concentrations was found between AA group and control group(P>0.05),while the concentrations of IgA,IgM,and IgG in SAA group were lower than those in NSAA group(1.46 g/L vs 1.97 g/L;1.47 g/L vs 1.50 g/L;10.80 g/L vs 11.05 g/L;all P<0.05).The expression of CD20+B lymphocytes in AA group was significantly lower than that of control group(9.00%vs 12.12%,P<0.05);the expression of CD19+CD38+,CD19+CD5+ B lymphocytes in AA group was significantly higher than that of control group(6.23%vs 3.80%;2.43% vs 1.90%;all P<0.05);no difference in CD20+B lymphocytes expression was noted between SAA group and NSAA group(P>0.05),but CD19+CD38+,CD19+CD5+B lymphocytes expression in SAA group were higher than those in NSAA group(6.80%vs 4.40%;7.35%vs 1.80%;P<0.05).AA patients who were responding to immunosuppressive therapy had a significantly lower expression of CD19+CD38+,and CD19+CD5+B lymphocytes than those of transfusion dependent patients(4.53%vs 12.30%;1.93%vs 7.70%;all P<0.05).ConclusionB lymphocytes me-diated humoral immune disorder exists in AA patients,and the patients with dysfunction B lymphocytes show poor therapeutic effect.
aplastic anemia;immunoglobulin;B lymphocyte subsets
国家中医临床研究基地业务建设科研专项(No.JDZX2015121);浙江省公益性技术应用研究计划(No.2014c33273)
浙江省中医院血液科(杭州310006)
林圣云,Tel:18072946912;E-mail:syy19881029@163.com
