三角帆蚌热休克蛋白70基因克隆及其表达分析
2017-02-15吴圣楠隗黎丽李海军付建平刘
吴圣楠隗黎丽李海军付建平刘 毅
(1. 江西师范大学生命科学学院, 南昌 330022; 2. 江西农业大学动物科学学院, 南昌 330045)
三角帆蚌热休克蛋白70基因克隆及其表达分析
吴圣楠1隗黎丽2李海军1付建平1刘 毅1
(1. 江西师范大学生命科学学院, 南昌 330022; 2. 江西农业大学动物科学学院, 南昌 330045)
对三角帆蚌HSP70基因序列进行全长克隆及其分子生物学分析, 并检测其在不同水温刺激下鳃组织中的表达变化。通过高通量转录组测序获得三角帆蚌HSP70基因(HcHSP70)长片段, 采用3′ RACE对其进行了3′末端克隆, 经拼接得到HcHSP70 cDNA全长序列。采用多种分子生物学软件对HcHSP70 cDNA全长序列进行了特征分析, 采用实时荧光定量PCR技术检测了其组织分布, 并结合Western-blot技术检测蚌鳃中该基因mRNA与蛋白经不同水温刺激后的表达变化。结果显示, HcHSP70 cDNA全长为2298 bp, 其中开放阅读框为1974 bp, 编码657个氨基酸。预测分子量大小为71.6 Ku, pH7.0时的理论等电点为5.61。氨基酸序列分析表明, HcHSP70氨基酸序列含HSP70家族的3个标签序列(I9DLGTTYS16、I197FDLGGGTFDVSIL210和I336VLVGGSTRIPKVQK350), 与长牡蛎及泥蚶的HSP70同源性最高(91%)。实时荧光定量PCR检测结果显示, HcHSP70在鳃、性腺、肝胰腺、外套膜及肌肉等5种被检组织中均有表达, 以肝胰腺中的表达水平最高。实时荧光定量PCR与Western-blot技术检测皆表明, 蚌鳃组织中HcHSP70基因与蛋白的表达量在37℃时达到最高, 而在40℃水温刺激下表达水平下调至正常值, 表明其在适应高温刺激时发挥了重要作用。
三角帆蚌; 热休克蛋白70; 序列分析; 基因表达; 水温刺激
热休克蛋白家族(Heat shock proteins, HSPs)是一类应激反应性蛋白, 通常作为危险信号以提高机体适应热的能力及对抗多种压力刺激。在感染、缺氧、饥饿和缺水等条件刺激下也能诱导出该蛋白, 故也称之为热应激蛋白[1]。HSPs结构高度保守,通常执行管家基因功能和保护功能, 包括细胞骨架保护、免疫调节、抑制细胞凋亡等多种功能[2,3]。根据相对分子量大小, HSPs成员分为4个主要家族: HSP90、HSP70、HSP60及小HSP家族[4]。研究表明, HSP70家族分子在帮助机体细胞应对各种不利环境中起关键作用[5,6]。HSP70具备分子伴侣功能, 可帮助细胞内多肽保持未折叠状态, 保障其顺利通过内质网或线粒体膜, 以实现蛋白质的正确组装[7]。作为热休克蛋白家族中最保守的蛋白, HSP70广泛存在于各种生物体内, 迄今已从植物[8]、动物[9]及微生物[10]体内成功克隆出HSP70基因的全长。
无脊椎软体动物缺少获得性免疫系统, 其对外界感染的防御只能基于先天免疫系统来识别异己分子, 最终实现机体的自我保护[11,12]。为抵御外界不利环境胁迫, 软体动物体内的HSP70分子所发挥的免疫保护作用十分关键。迄今已成功从合浦珠母贝(Pinctada martensii)[13]、南极帽贝(Laternula elliptica)[14]及福寿螺(Pomacea canaliculata)[9]等多种软体动物中克隆出HSP70全长序列。
三角帆蚌(Hyriopsis cumingii)是我国最重要的淡水育珠蚌, 其培育的珍珠产量占淡水育珠产量的95%以上[15]。近年来由于病害影响, 给我国淡水育珠业造成了重大经济损失。深入开展三角帆蚌HSPs分子的分子生物学研究, 将有助于其病害防治。在之前的工作中, 作者曾报道三角帆蚌热休克蛋白60的相关研究[16]。本文将对三角帆蚌HSP70基因序列进行全长克隆及其分子生物学分析, 并检测其在不同水温刺激下鳃组织中的表达变化。
1 材料与方法
1.1 材料
本研究所用三角帆蚌购自南昌市人民公园菜市场, 长度为(14.5±0.5) cm。洗净后暂养于盛有曝气自来水的水族箱(100 cm×60 cm×45 cm)中。使用充气泵充气饲养, 每天换水1次, 暂养1周确认蚌体健康无病后开始实验。三角帆蚌饲养条件同文献[16]。
1.2 总RNA的提取及cDNA第一链合成
使用Invitrogen公司的Trizol试剂盒提取总RNA, 操作过程中所用琉璃器皿及金属器械经180℃高温烘烤6h以上使RNase彻底失活, 使用Thermo公司的无RNase离心管及枪头, 具体总RNA提取过程参考试剂盒的操作说明进行。
以提取的RNA为模板, 使用Oligo-dT为逆转录引物及Clontech公司Power-ScriptTMReverse Transcriptase合成cDNA第一链, cDNA合成按TaKaRa Prime-ScriptTMReverse Transcriptase Kit操作手册进行。
1.3 HcHSP70 cDNA全长的获得
由转录组高通量测序获得始于HcHSP70 cDNA 5′末端的一段长序列(2298 bp), 转录组测序工作由北京贝瑞和康生物技术有限公司完成。根据此序列,采用SMARTerTMRACE cDNA Amplification Kit试剂盒(BD, Biosciences Clontech)获得该基因的3′端序列。根据已知的局部HSP70 cDNA序列设计出两条正向引物HSP70F1和HSP70F2 (表 1)。
首先使用逆转录酶SMARTScribeTMReverse Transcriptase和引物3′CDS primer A对总RNA进行逆转录合成cDNA, 使用试剂盒中的Long引物和Short引物, 按比例1∶3混合为通用引物UPM。使用引物HSP70-F1和UPM, 以上面合成的cDNA为模板进行第一轮PCR扩增; 将第一轮PCR扩增产物稀释50倍, 然后用引物HSP70F2和UPM进行第二轮PCR扩增, 将第二轮PCR产物进行电泳并用Tiangen公司的琼脂糖凝胶DNA回收试剂盒回收cDNA目的片段后对目的条带进行切胶回收纯化, 纯化后的PCR产物连接到pMD18-T克隆载体上, 转化大肠杆菌DH5α感受态细胞, 经检测后挑取阳性克隆测序,最后进行全长序列拼接, 得到HcHSP70 cDNA全长序列。用于HcHSP70基因扩增与表达的引物见表 1。

表 1 用于HcHSP70扩增和表达的引物Tab. 1 Primers used in amplification and expression of HcHSP70
1.4 HcHSP70基因序列分析与系统进化树构建
使用NCBI上的BLAST (http://www.ncbi.nlm. gov/BLAST/)进行核苷酸及氨基酸序列分析。利用ExPASy (http://expasy.pku.edu.com)上软件分析HcHSP70氨基酸序列与开放阅读框(ORF); 采用NCBI BLASTp进行序列同源基因搜索。采用Clustal W 2.1和Mega 5.0软件比较HcHSP70与其他物种HSP70氨基酸序列同源性, 使用邻接法(N-J法)构建基于氨基酸序列的系统进化树, 并采用自展法对其可靠性进行分析验证(1000个假重复数)。用于氨基酸比对和进化树构建的基因名称及其 GenBank序列登录号见表 2。
1.5 HcHSP70 mRNA在不同组织中的表达
从暂养蚌的水族箱中选取3个蚌, 取鳃(Gi)、性腺(Go)、肝胰腺(He)、外套膜(Ma)及肌肉(Mu)等5种组织, 用Trizol法提取总RNA, 用紫外分光仪(UV-5100)测定浓度并统一稀释至100 ng/μL, 各取2 μL反转录成cDNA, 利用实时荧光定量PCR技术检测室温下(25℃) HcHSP70在三角帆蚌不同组织中的表达。
HcHSP70各个样本的cDNA使用BIO-RAD CFX系统(Bio-Rad)进行实时荧光定量PCR扩增。根据已获得的HcHSP70 cDNA全长, 设计出特异引物HSP70-F和HSP70-R(表 1), 用于扩增出HcHSP70基因3′端99 bp的片段。根据三角帆蚌β-actin基因(HM045420.1)设计出可得到129 bp的内参β-actin基因的引物β-actin F和β-actinR(表 1)。优化后的反应体系为: Real Master Mix SYBR Green 9 μL, 各引物0.5 μL, 50× ROX Reference Dye 0.5 μL, cDNA 1 μL,去离子水8.5 μL。扩增条件为: 95℃预变性3min, 95℃ 10s, 55℃ 20s, 72℃ 20s, 40个循环; 末次延伸72℃, 5s; 在每个循环的延伸阶段同步多次采集荧光。PCR扩增结束后立即进行熔解曲线分析, 以验证扩增的特异性。从65℃上升到95℃保持增长速度为0.5 ℃/s。各样品均设置3次重复。
1.6 鳃组织HcHSP70在不同水温刺激后的表达变化
实时荧光定量PCR将蚌分成6组(每组放置3个), 分别于25℃(对照组), 28℃、31℃、34℃、37℃及40℃水温放置2h, 正常水温下恢复1h后取其鳃组织。Trizol法提取各组织的总RNA, 利用实时荧光定量PCR法检测HcHSP70基因水平在鳃组织中的表达变化, PCR扩增条件同1.5, 选择三角帆蚌β-actin作为内参基因。所用引物见表 1。
Western blot利用Western blot技术检测鳃组织中HcHSP70蛋白在不同水温刺激后的表达变化。取-80℃冻存的鳃组织, 加入裂解缓冲液(1.0% NP-40 in 50 mmol/L Tris-HCl, 50 mmol/L EDTA, 1 mmol/L PMSF)冰上匀浆。匀浆后冰上静置30min后4℃, 12000 r/min离心30min, 离心分离掉不溶性细胞碎片收集上清, 制得蛋白样品。使用SDS-PAGE凝胶制备试剂盒(金斯瑞, 南京)采用10% SDS-PAGE凝胶体系将蛋白样品电泳分离, 再将蛋白转移至PVDF膜。然后使用5%脱脂奶粉封闭2h, 加入HSP70一抗(1∶1000, 金斯瑞) 4℃孵育过夜。HSP70一抗所用的免疫原为多肽, 肽与KLH的偶联物, 序列为CHMKSTVEDQNLKDK。使用TBST (TBST: 0.1% Tween-20, 50 mmol/L Tris-HCl, 200 mmol/L NaCl)洗膜三次, 每次5—10min。然后加入羊抗兔HRP二抗(1∶5000, 金斯瑞)室温孵育1h, TBST漂洗后, 使用NBT/BCIP避光显色, 使用Chemi Doc XRS(BIO-RED, 美国)自动曝光采集Western杂交图像。以β-actin蛋白作为内参蛋白, 实验过程与HSP70相同。
1.7 数据分析
荧光定量实验获得的数据使用比较Ct方法, 根据荧光曲线的Ct值以及标准曲线使用SPSS 15.0进行单因素方差分析, P<0.05 (*)。
2 结果
2.1 HcHSP70 cDNA全长及推导的氨基酸序列特征
通过3′RACE-PCR拼接得到三角帆蚌HSP70基因cDNA(GenBank登录号: AHN82525.1)的全长为2298 bp, 其中5′端非翻译区76 bp, 3′端末端248 bp,有典型的加尾信号(AATAAA)和PolyA尾巴。该基因开放阅读框为1974 bp, 编码657个氨基酸, 预测分子量大小为71.6 Ku, 当pH为7.0时的理论等电点为5.61。
HcHSP70氨基酸序列含有三个HSP70家族典型的标签序列: 9—16 (IDLGTTYS), 197—210 (IF DLGGGTFDVSIL)以及336—350 (IVLVGGSTRIP KVQK)。并且具有ATP酶结构域131—137 (AEAY LGK)以及双向核定位信号246—262 (KRKHKR DMKDNKRAVRR), 该信号位点可能涉及HcHSP70选择性易位进入核仁中。同时发现缩氨酸结合位点299—305 (RARFEEL), 两个糖基化位点360—363 (NKSI)和487—490 (NVSA), 以及其他典型的重复位点GGXP在 622—633的位置上。此外, 高保守的细胞质HSP70羧基末端保守区域EEVD位于654—657位氨基酸上。
多重比对结果证明HcHSP70符合HSP70s所有特征。使用SignalP 4.0预测HcHSP70无信号肽, TMHMM预测HcHSP70无跨膜区。
2.2 HcHSP70序列同源性及系统进化树
通过BLAST同源搜索, 发现推导出的三角帆蚌HSP70的氨基酸序列与其他物种相应的序列显示出较高的亲缘性。从基因库中选取13个物种的HSP70或HSC70氨基酸序列, 分别来自软体动物:长牡蛎(Crassostrea gigas)、泥蚶(Tegillarca granosa)、海湾扇贝(Argopecten irradians)和栉孔扇贝(Azumapecten farreri), 脊索动物: 草鱼(Ctenopharyngodon idella)与铜鱼(Coreius guichenoti), 节肢动物: 二化螟(Chilo suppressalis)、小地老虎(Agrotis ipsilon)与豆髯须夜蛾(Hypena tristalis), 哺乳动物:小家鼠(Mus musculus)、绵羊(Ovis aries)与人(Homo sapiens), 扁形动物: 三角涡虫(Dugesia japonica)。比对结果显示HcHSP70与长牡蛎和泥蚶同源性最高, 达到91%, 而与人的同一性最低, 仅为33%。通过邻接法构建HcHSP70系统进化树发现, HcHSP70与4种软体动物(长牡蛎、泥蚶、海湾扇贝和栉孔扇贝)聚为一支(图 1)。
2.3 HcHSP70组织表达
使用实时荧光定量PCR分析HcHSP70 mRNA在不同组织间特异性地表达情况, 结果表明在室温条件下HcHSP70 mRNA在全部5种被检组织中均有表达, 以肝胰腺中的表达水平最高, 其次为性腺, 而在鳃、外套膜及肌肉等3种组织中相对较低(图2)。
2.4 在不同水温刺激下鳃HcHSP70 mRNA及其蛋白的表达变化
经不同水温刺激2h后, 鳃HcHSP70基因表达量随水温上升出现上调, 相比对照组(25℃), 28℃、31℃、34℃水温刺激后分别出现1.8倍、2.0倍及2.2倍上调(图 3a)。而当刺激水温为37℃时, HcHSP70基因表达量急剧上升, 为对照组的14.4倍, 显著高于其他温度。水温为40℃时, 其表达量又急剧下降, 仅为对照组的2.3倍。
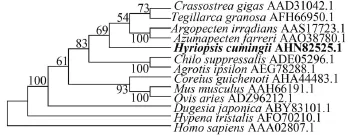
图 1 HSP70基因系统进化树Fig. 1 Phylogenetic tree based on HSP70 gene使用ClustalW 2.1软件进行序列比对, MEGA 5.0按邻接法构建系统进化树, 结点处数值代表1000评估的自举检验置信度Full-length amino acid sequences were aligned using ClustalW 2.1 and a phylogenetic tree was constructed using Neighbor-Joining algorithm with MEGA 5.0 (1000 bootstrap)
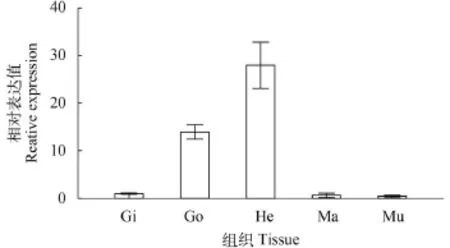
图 2 HcHSP70在三角帆蚌不同组织中的表达Fig. 2 The expression of HcHSP70 in different tissues of H. cumingiiqRT-PCR法检测HcHSP70在鳃(Gi)、性腺(Go)、肝胰腺(He)、外套膜(Ma)及肌肉(Mu)5种组织中的相对表达, 以β-actin作内参qRT-PCR was performed to detect the expression of HcHSP70 in 5 different tissues including gonad (Go), gill (Gi), hepatopancreas (He), mantle (Ma) and muscle (Mu). β-actin was used as an inner control to normalize the samples
Western blot检测结果也显示, 当刺激水温为37℃时, HcHSP70蛋白表达量达到最高, 明显高于其他水温刺激后的表达量(图 3b)。
3 讨论
HSP70作为热休克蛋白家族中最保守的蛋白广泛存在于各种生物体内[17]。以贝类动物为例, 合浦珠母贝[13]、南极帽贝[14]、福寿螺[9]等物种HSP70分别编码652、653和653个氨基酸。本研究克隆得到的三角帆蚌HSP70基因开放阅读框为1974 bp, 编码657个氨基酸, 与贝类其他物种十分接近。序列分析结果显示, HcHSP70含有HSP70家族的典型标签序列, 包括: 3个保守签名序列(IDLGTTYS、IFD LGGGTFDVSIL、IVLVGGSTRIPKIQK)、ATPase功能域、底物肽结合结构域、C末端区域存在3个连续重复的4肽序列和EEVD序列以及其他HSP家族特征性功能结构域[18—20]。同源性分析表明, HcHSP70与其他软体动物HSP70基因具有很高的同源性, 与泥蚶和长牡蛎同一性最高, 达91%, 而与人HSP70同一性仅为33%。在系统发育树中, 脊椎动物、软体动物及节肢动物HSP70s序列各自分开并形成可信度较高的簇, HcHSP70与其他4种软体动物HSP70(长牡蛎、泥蚶、海湾扇贝和栉孔扇贝)聚为一支, 可以确认本研究所获序列为HSP70家族成员。

图 3 三角帆蚌鳃组织中HcHSP70经不同水温刺激后的表达变化Fig. 3 Expression of HcHSP70 under different water temperaturea. 实时荧光定量qRT-PCR方法检测三角帆蚌鳃组织中Hc-HSP70经6种不同水温刺激后的表达变化, 刺激水温分别为25、28、31、34、37及40℃。以β-actin作为内参。星号(*)表示热激后HcHSP70 mRNA相对表达量显著高于对照组(25℃) (P<0.05)(n=3); b. Western blot法检测三角帆蚌鳃组织中Hc-HSP70蛋白经不同水温刺激后的表达变化, 以β-actin蛋白作为内参a. qRT-PCR was performed to detect the expression of HcHSP70 in 6 different temperature of gill (Gi) from H. cumingii under 25, 28, 31, 34, 37 and 40℃. β-actin was used as an internal control to normalize the samples. The asterisks indicate the values which were significantly different from control (P<0.05); b. Expression of the HcHSP70 protein in response to high temperature detected by Western blot. The intensities of HcHSP70 protein bands were normalized against the β-actin protein
尽管HSP70广泛存在于各类生物体内, 但各物种HSP70的表达具有组织特异性。近江牡蛎HSP70在外套膜、鳃、消化腺、肌肉及心脏中均有表达,在肌肉中表达量最高[21]。褶纹冠蚌HSP70在鳃组织中的表达量较高, 其次是肌肉[22]。本研究发现HcHSP70在不同组织中也均有表达, 而以肝胰腺中的表达最高, 其次是性腺, 而在鳃、外套膜及肌肉中的表达量较低(图 2)。此结果与缢蛏Hsc70的组织表达情况相似[23]。
作为一种应激蛋白, HSP70可帮助生物体迅速适应环境变化以抵御外界不良损害[4]。曲凌云等检测到热刺激可使栉孔扇贝鳃组织中HSP70表达明显升高, 而在肌肉、外套膜及性腺组织中未检测到变化[24]。此外, 鳃组织因与水环境直接接触, 对水温变化较为敏感, 更容易发生热休克反应[25]。本研究利用实时荧光定量PCR和Western-blot技术从mRNA和蛋白质水平分别检测不同温度刺激对三角帆蚌鳃组织中HSP70表达的影响。结果显示, 鳃组织中HcHSP70表达量随水温上升而上调, 且当刺激水温度到达37℃时, HcHSP70 mRNA和蛋白表达量皆急剧上升(图 3)。此结果与其他研究类似, 雄性福寿螺PcHSP70也在39℃水温刺激下表达量最高[26]。而牡蛎的鳃与外套膜组织中HSP70表达量在35℃时即达到最高[27]。
值得注意的是, 当刺激水温达到40℃时, HcHSP70 mRNA和蛋白的表达量又急剧下降并恢复至正常水平。此结果与西伯利亚鲟[25]、福寿螺[26]和牡蛎[27]等物种HSP70的研究结果相似, 当刺激水温不断升高时HSP70表达量都出现先上升后下降的现象。推测较高水温刺激下的三角帆蚌机体内与HcHSP70相关的免疫应答水平也受到极大的抑制,具体机制有待于进一步深入研究。
[1]Santoro M G. Heat shock factors and the control of the stress response [J]. Biochemical Pharmacology, 2000, 59(1): 55—63
[2]Pramod S. Roles of heat-shock proteins in innate and adaptive immunity [J]. Nature Reviews Immunology, 2002, 2(3): 185—194
[3]Benarroch E E. Heat shock proteins: multiple neuroprotective functions and implications for neurologic disease [J]. Neurology, 2011, 76(7): 660—667
[4]S Lindquist A, Craig E A. The heat-shock proteins [J]. Annual Review of Genetics, 1988, 22(2): 631—677
[5]Sung D Y, Kaplan F, Guy C L. Plant Hsp70 molecular chaperones: Protein structure, gene family, expression and function [J]. Physiologia Plantarum, 2001, 113(4): 443—451
[6]Yoshimi T, Hiroshige O Y. Induction profile of HSP70-cognate genes by environmental pollutants in Chironomidae [J]. Environmental Toxicology & Pharmacology, 2009, 28(2): 294—301
[7]Jiang X R, Yang J. Molecular chaperone and protein folding [J]. Anhui Institute of Education, 2001, 19(3): 55—56 [姜先荣, 杨杰. 分子伴侣与蛋白质折叠. 安徽教育学院学报, 2001, 19(3): 55—56]
[8]Fei J, Wang Y S, Zhou Q, et al. Cloning and expression analysis of HSP70 gene from mangrove plant Kandelia obovata under cold stress [J]. Ecotoxicology, 2015, 24(7): 1—9
[9]Song H M, Mu X D, Gu D E, et al. Molecular characteristics of the HSP70 gene and its differential expression in female and male golden apple snails (Pomacea canaliculata) under temperature stimulation [J]. Cell Stress & Chaperones, 2014, 19(4): 1—11
[10]Ohta T, Saito K, Kuroda M, et al. Molecular cloning of two new heat shock genes related to the hsp70 genes in Staphylococcus aureus [J]. Journal of Bacteriology, 1994, 176(15): 4779—4783
[11]Bachère E, Gueguen Y, Gonzalez M, et al. Insights into the anti-microbial defense of marine invertebrates: the penaeid shrimps and the oyster Crassostrea gigas [J]. Immunological Reviews, 2004, 198(1): 149—168
[12]Schmid-Hempel P. Variation in immune defence as a question of evolutionary ecology [J]. Proceedings Biological Sciences, 2003, 270(1513): 357—366
[13]Huang G J, Qu N N, Yu D H, et al. Molecular cloning and expression of HSP70 genes from Pinctada martensii [J]. Journal of Fishery Sciences of China, 2007, 14(5): 726—732 [黄桂菊, 曲妮妮, 喻达辉, 等. 合浦珠母贝热休克蛋白hsp70基因的克隆与表达分析. 中国水产科学, 2007, 14(5): 726—732]
[14]Hyun P, In-Young A, Hye Eun L. Expression of heat shock protein 70 in the thermally stressed antarctic clam Laternula elliptica [J]. Cell Stress & Chaperones, 2007, 12(3): 275—282
[15]Li J l, Qian R H, Bao B L, et al. RAPD analysis on genetic diversity among the stocks of Hyriopsis cumingii from the five large lakes of China [J]. Journal of Shanghai Fisheries University, 2005, 14(1): 1—5 [李家乐, 钱荣华,鲍宝龙, 等. 中国五大湖三角帆蚌群体遗传多样性的RAPD分析. 上海海洋大学学报, 2005, 14(1): 1—5]
[16]Wu S N, Liu D W, Liu Y, et al. Cloning and expression of heat shock protein 60 gene from Hyriopsis cumingii [J]. Acta Hydrobiologica Sinica, 2014, 38(5): 897—902 [吴圣楠, 刘大伟, 刘毅, 等. 三角帆蚌热休克蛋白60基因克隆及其表达分析. 水生生物学报, 2014, 38(5): 897—902]
[17]Boorstein W R, Ziegelhoffer T, Craig E A. Molecular evolution of the HSP70 multigene family [J]. Journal of Molecular Evolution, 1994, 38(1): 1—17
[18]Boutet I, Tanguy A, Moraga D. Organization and nucleotide sequence of the European flat oyster Ostrea edulis heat shock cognate 70 (hsc70) and heat shock protein 70 (hsp70) genes [J]. Aquatic Toxicology, 2003, 65(2): 221—225
[19]Isabelle B, Arnaud T, Sabrina R, et al. Molecular identification and expression of heat shock cognate 70 (hsc70) and heat shock protein 70 (hsp70) genes in the Pacific oyster Crassostrea gigas [J]. Cell Stress & Chaperones, 2003, 8(1): 76—85
[20]Hamdoun A M, Cheney D P, Cherr G N. Phenotypic Plasticity of hsp70 and hsp70 gene expression in the pacific oyster (Crassostrea gigas): implications for thermal limits and induction of thermal tolerance [J]. Biology Bulletin, 2003, 205(2): 160—169
[21]Zhang Z, Zhang Q. Molecular cloning, characterization and expression of heat shock protein 70 gene from the oyster Crassostrea hongkongensis responding to thermal stress and exposure of Cu(2+) and malachite green [J]. Gene, 2012, 497(2): 172—180
[22]Xie Y H, Hu B Q, Wen C G. Cloning and expression analysis of HSP70 gene from Cristaria plicata [J]. Journal of Nanchang University (Natural Science), 2011, 35(5): 457—463 [谢彦海, 胡宝庆, 文春根. 褶纹冠蚌热休克蛋白HSP70基因的克隆及表达研究. 南昌大学学报: 理科版, 2011, 35(5): 457—463]
[23]Feng B B, Niu D H, Zhong Y M, et al. Molecular characteristics and expression analysis of ScHsc70 cDNA in Sinonovacula constricta [J]. Journal of Fishery Sciences of China, 2012, 19(1): 33—44 [冯冰冰, 牛东红, 钟玉民,等. 缢蛏ScHsc70 cDNA的分子特性和表达分析. 中国水产科学, 2012, 19(1): 33—44]
[24]Qu L Y, Xiang J H, Shun X Q, et al. Expression analysis of HSP70 in Various tissues of Chlamys farreri under thermal stress [J]. High Technology Letters, 2005, 15(5): 96—100 [曲凌云, 相建海, 孙修勤, 等. 温度刺激下栉孔扇贝不同组织热休克蛋白HSP70的表达研究. 高技术通讯, 2005, 15(5): 96—100]
[25]Tian Z H, Xu S G, Wang W, et al. Effects of acute thermal stress on HSP70 mRNA, physiology and nonspecific immunity in Siberian Sturgeon (Acipenser baerii) [J]. Acta Hydrobiologica Sinica, 2013, 37(2): 344—350 [田照辉, 徐绍刚, 王巍, 等. 急性热应激对西伯利亚鲟HSP70 mRNA表达、血清皮质醇和非特异性免疫的影响. 水生生物学报, 2013, 37(2): 344—350]
[26]Song H M, Mu X D, Gu D E, et al. Molecular characteristics of the HSP70 gene and its differential expression in female and male golden apple snails (Pomacea canaliculata) under temperature stimulation [J]. Cell Stress & Chaperones, 2014, 19(4): 1—11
[27]Piano A, Asirelli C, Caselli F, et al. Hsp70 expression in thermally stressed Ostrea edulis, a commercially important oyster in Europe [J]. Cell Stress & Chaperones, 2002, 7(3): 250—257
CLONING AND EXPRESSION ANALYSIS OF HEAT SHOCK PROTEIN 70 GENE FROM HYRIOPSIS CUMINGII
WU Sheng-Nan1, WEI Li-Li2, LI Hai-Jun1, FU Jian-Ping1and LIU Yi1
(1. College of Life Sciences, Jiangxi Normal University, Nanchang 330022, China; 2. College of Animal Science and Technology, Jiangxi Agricultural University, Nanchang 330045, China)
In the present study, the cDNA sequence of Hyriopsis cumingii HSP70 (HcHSP70) was cloned by 3′rapid amplification of cDNA ends methods (3′-RACE) based on a long chain sequence of HcHSP70 and it was determined by high flux sequencing for transcriptome of H. cumingii blood cells, and its expression in the different tissues was detected with quantitative real time polymerase chain reaction (qRT-PCR). Results showed that the full-length of HcHSP70 cDNA was 2298 bp long including a 1974 bp open reading frame (ORF) encoding a polypeptide of 657 amino acids that estimated molecular mass of 71.6 Ku and an isoelectric point of 5.67. Sequence comparison indicated that HcHSP70 shares the highest identity (91%) with HSP70 of Tegillarca granosa and Crassostrea gigas. HcHSP70 mRNA expressed in all 5 detected tissues (hepatopancreas, gonad, gill, mantle, muscle) with the highest expression in hepatopancreas. Both mRNA and protein level of HcHSP70 in gill significantly up-regulated at 37℃ and rapidly reduced to normal level under 40℃.
Hyriopsis cumingii; Heat shock protein 70; Cloning; Gene expression; Thermal stress
Q344+.1; S917
A
1000-3207(2017)01-0050-06
10.7541/2017.7
2016-02-01;
2016-06-20
国家自然科学基金项目(31060359); 江西省自然科学基金(20122BAB204017)资助 [Supported by the National Natural Science Foundation of China (31060359); the Natural Science Foundation of Jiangxi Province (20122BAB204017)]
吴圣楠(1992—), 女, 江西鹰潭人; 硕士研究生; 主要从事分子免疫学研究。E-mail: wusn2013@163.com
刘毅, E-mail: yiliusan@sina.com
