兴国红鲤ER基因克隆表达及EE2暴露对肝中ER表达的影响
2017-02-15宋明月单喜双陈细华岳华梅叶欢杨晓鸽李创举
宋明月单喜双陈细华岳华梅叶 欢杨晓鸽李创举
(1. 中国水产科学研究院长江水产研究所, 农业部淡水生物多样性保护重点实验室, 武汉 430223; 2. 上海海洋大学水产与生命学院, 上海 201306)
兴国红鲤ER基因克隆表达及EE2暴露对肝中ER表达的影响
宋明月1,2单喜双1,2陈细华1岳华梅1叶 欢1杨晓鸽1李创举1
(1. 中国水产科学研究院长江水产研究所, 农业部淡水生物多样性保护重点实验室, 武汉 430223; 2. 上海海洋大学水产与生命学院, 上海 201306)
为评估环境内分泌干扰物对鱼类的影响, 研究克隆了兴国红鲤雌激素受体(Estrogen receptor, ER)4种亚型ERα、ERβ、ERβ1、ERβ2的全长cDNA序列, 氨基酸序列比对发现兴国红鲤ERs分别与3种鲤科鱼类相应亚型具有较高的同源性。实时荧光定量PCR (qRT-PCR)检测结果表明, 4种ER亚型mRNA在雌雄成体组织中呈现差异表达, 雌性个体中, 肝、卵巢和肠中4种ERs的表达量均较高; 在雄性个体中, ERα和ERβ主要在肝中表达, ERβ1、ERβ2分别在肠和精巢中的表达量最高。将150日龄的兴国红鲤幼鱼分别暴露在0.01、0.1和1 nmol/L的17α-乙炔基雌二醇(EE2)中4周, 检测了雌性幼鱼肝中4种ER基因的表达变化情况。在EE2中暴露1—2周后, 兴国红鲤雌性幼鱼肝中ERα基因的表达水平有极显著的提升; 各浓度 EE2能持续显著促进其肝中ERβ的表达; 在1—2周内各浓度EE2对 ERβ1表达有所抑制; 第1周EE2能够抑制ERβ2基因mRNA的表达, 并在0.01 nmol/L时抑制作用达到了显著的水平。上述研究结果表明, EE2暴露能诱导或抑制兴国红鲤雌性幼鱼肝中ER亚型的表达, 相对于ERβ、ERβ1和ERβ2、ERα可作为EE2短期(1—2周)敏感性生物学标记。
雌激素受体; 兴国红鲤; EE2; 实时荧光定量PCR
雌激素主要通过雌激素受体(ER)发挥生理作用[1], ER属于核受体超家族(Nuclear receptor super family)成员[2]。ER参与的雌激素信号转导通路主要有两种[3]: 一种是基因组水平的调控, 包括依赖雌激素反应原件(Estrogen response element, ERE)的经典信号通路和不依赖ERE介导的基因组ER信号通路; 另一种是非基因组水平上的调控, 包括ER信号与其他信号转导连接的通路和非配体依赖的信号通路[4]。高等脊椎动物中雌激素受体有ERα和ERβ两种亚型[5,6], 在大多数硬骨鱼类中有ERα、ERβ1和ERβ2三种亚型[7,8], 虹鳟中存在4种亚型: ERα、ER alpha2、ERβ1和ERβ2[9]。
17α-乙炔基雌二醇(17-α ethinylestradiol, EE2)作为一种环境内分泌干扰物(Environmental Endocrine Disrupting Chemicals, EDCS)通过工业废水、生活污水、农牧业排水进入自然界[10—12], 且不易降解。在自然界水体中[13,14]EE2的浓度范围为0.05— 115 ng/L不等; 水体中的EE2进入生物有机体能够模仿机体内源雌激素与ER结合或与机体内源雌激素竞争ER分子, 干扰机体正常的内分泌系统。研究表明, EE2暴露不仅能够引起Vtg (Vitellogenin, 卵黄蛋白原)、ER等基因表达的变化[15—17], 而且对硬骨鱼类的生殖方面有重要作用[18,19], 对鱼类的生长、免疫等生理活动的调节也有一定的影响[20]。
兴国红鲤(Cyprinus carpio var singuonensis)是一种经济鱼类, 1—2年性成熟, 温度适应范围广, 易于饲养, 产卵量大。一般用于环境内分泌干扰物风险评估的硬骨鱼类主要是模式鱼类如斑马鱼(Danio rerio)[21]、稀有鮈鲫(Gobiocypris rarus)[17,22]等, 但这些鱼类并不能完全代表野生鱼类的风险评估[23]。本研究通过RT-PCR和RACE (Rapid-amplification of cDNA ends)方法获得兴国红鲤4种ER基因(ERα、ERβ、ERβ1、ERβ2)的全长cDNA序列, 并采用定量PCR (Quantitative real-time polymerase chainreaction, qRT-PCR)方法研究兴国红鲤成体4种ER基因的组织表达特征及EE2暴露对兴国红鲤雌性幼鱼肝中ER mRNA表达的影响, 旨在探讨ER mRNA是否可以作为EE2的评价标志物。
1 材料与方法
1.1 试验动物和试剂
试验鱼取自中国水产科学研究院长江水产研究所窑湾试验场。取1龄的兴国红鲤成鱼(♀/♂)的肝、脾、心、性腺、肾、肌肉、肠、脑等组织, 用于组织总RNA提取。用于暴露的兴国红鲤幼鱼为150日龄[(3.3±0.054) g]。暴露之前将EE2 (Sigma, CAS. No. 57-63-6)溶于二甲基亚砜(Dimethyl Sulfoxide, DMSO)(CAS. No. 67-68-5)溶液。
1.2 EE2暴露实验
参考Liao等[16]和Wang等[17]的研究, 本研究设置3个浓度EE2处理组: 0.01、0.1和1 nmol/L, 对照组仅加入DMSO (体积分数<0.01%), 每个处理组/对照组设置3个平行。暴露实验所用水箱为80 L, 所盛曝气自来水体积为60 L。实验采用半静水方式水生生物毒性实验法进行实验。每天换水一半, 并添加相应量的EE2母液(100 nmol/L)以保证各缸药品的浓度不变。暴露时间为4周(28d), 实验全天用充气泵增氧并及时清除排泄物。实验水温(25±1)℃,光照周期为16h∶8h(白昼/黑暗)。暴露过程中无个体死亡。分别在暴露7d、14d、21d和28d四个时间点采样, 每次采样每缸随机取3尾雌幼鱼, 采集肝样品后立即放入RNA Save (Biological Industries)中保存备用。
1.3 总RNA的提取、单链cDNA及SMART cDNA合成
总RNA提取方法参照SV Total RNA Isolation System (Promega, 美国)试剂盒说明书, 以兴国红鲤雌性成鱼的肝和卵巢组织总RNA为模板, 按照Super SMART®PCR cDNA Synthesis Kit操作手册的方法合成兴国红鲤肝和卵巢的SMART cDNA。幼鱼肝的第一链cDNA用PrimeScript®RT reagent Kit with gDNA Eraser(TaKaRa, Japan)试剂盒合成。
1.4 ERs基因全长cDNA的克隆及序列分析
根据鲤(Cyprinus carpio) ER基因cDNA序列(鲤ERα、ERβ、ERβ1、ERβ2的GenBank登录号分别为BAF99812.1、BAB91218.1、BAF99813.1、BAF99814.1)设计引物(表 1)分别扩增ERα、ERβ、ERβ1、ERβ2的保守区域片段。根据所得保守片段,分别设计特异引物(表 1)扩增四种亚型的5′端和3′端(以ERα为例: ERα-F和ERα-R扩增保守区域片段, ERα-R1和ERα-R2扩增5′端; ERα-F1和ERα-F2扩增3′端)。采用RT-PCR和RACE方法, 以肝cDNA为模板克隆ERα、ERβ和ERβ1全长cDNA序列, 以卵巢cDNA为模板克隆ERβ2全长cDNA序列, 扩增产物均纯化后连入pMD19-T载体, 转化大肠杆菌感受态细胞(DH5α)扩培, 通过M13引物进行菌液PCR检测阳性克隆, 送上海生工生物工程技术服务有限公司测序。采用Clustal X 1.8软件将推算的ER氨基酸序列和NCBI公布的氨基酸序列比对。利用Mega6软件邻接法(Neighbor-Joining, N-J)构建系统发生树。

表 1 本研究所用的引物序列Tab. 1 Primers used in the present study
1.5 ERs mRNA的组织分布的检测
根据所得到的兴国红鲤ERα、ERβ、ERβ1和ERβ2 cDNA序列设计定量引物: RT-ERαF和RTERαR等(表 1), 以兴国红鲤雌雄成体组织(心、肝、脾、鳃、肾、脑、性腺、肌肉、肠) cDNA为模板进行qRT-PCR扩增, 并以兴国红鲤β-actin特异性引物β-actin F和β-actin R (表 1)作为内参基因, PCR在Bio-Rad CFX96TM Real Time System仪上进行, 反应程序为95℃预变性10min, 95℃变性15s, 58℃退火15s, 72℃延伸15s, 循环数为40。
1.6 EE2暴露后ERs mRNA表达量的测定
用qRT-PCR方法检测, 对照组及各处理组分别取3个样品, 每个样品采用3个平行, PCR反应体系为: SYBR Green PCR Master Mix 10 μL, 上下游引物(浓度为10 μmol/L)各1 μL, cDNA模板1 μL和双蒸水2 μL。反应程序为95℃预变性10min, 95℃变性15s, 58℃退火15s, 72℃延伸15s, 循环数为40。
1.7 统计分析
ERs mRNA表达量用相对表达量=2-ΔΔCt的方法, ΔΔCt=(Ct目的基因-Ct参考基因)EE2处理组-(Ct目的基因-Ct参考基因)对照组[24], 实验数据均为平均值±标准差(SD)。用SPSS软件进行单因素方差分析比较处理组和溶剂对照组的差异, P<0.05表明差异显著, P<0.01表明差异极显著。
2 结果
2.1 兴国红鲤ERs基因全长序列克隆
本研究克隆得到了兴国红鲤4种ER亚型的全长cDNA序列(GenBank登录号: ERα, KU205259; ERβ, KU205260; ERβ1, KU205261; ERβ2, KU205262)。ERα全长2109 bp, 包含189 bp的5′非翻译区(Untranslated Regions, UTR)和237 bp的3′UTR, 开放阅读框(Opening reading frame, ORF)为1683 bp, 编码560个氨基酸; ERβ全长2147 bp, 包含330 bp的5′UTR、编码559个氨基酸的1680 bp ORF和137 bp的3′UTR; ERβ1全长2300 bp, 包含364 bp的5′UTR、编码585个氨基酸的1758 bp ORF和178 bp的3′UTR; ERβ2全长2007 bp, 包含156 bp的5′UTR、编码544个氨基酸的1635 bp ORF和216 bp的3′UTR。
2.2 兴国红鲤ER氨基酸序列同源性及系统发生分析
兴国红鲤4种ER分别与鲤、鲫等鲤科鱼类相应ER亚型的氨基酸序列具有较高的相似性: ERα与鲤、台湾铲颌鱼(Onychostoma barbatulum)、稀有鮈鲫的序列相似性分别为99%、90%和92%; ERβ与鲤、银鲫(Carassius auratus gibelio)、倒刺鲃(Spinibarbus denticulatus)的序列相似性分别为98%、92%和92%; ERβ1与鲤、台湾铲颌鱼、彭泽鲫(Carassius auratus var. pengze)的序列相似性分别为97%、86%和87%; ERβ2与鲤、彭泽鲫、稀有鮈鲫的序列相似性分别为99%、89%和92%。
利用Clustal X和Mega 6.0分析软件, 采用N-J法对兴国红鲤及其他脊椎动物的ERs进行系统发生分析, 如图 1所示, ER聚为两类, 鱼类及更高等的脊椎动物ERα聚成一类, ERβ、ERβ1和ERβ2聚为一类;兴国红鲤的4种亚型分别与鲤的相应亚型亲缘关系最近。
2.3 兴国红鲤ERs的组织表达
ERα、ERβ、ERβ1和ERβ2基因在兴国红鲤成体组织中广泛表达(图 2), 以各ER基因mRNA在雌性脑组织中的表达量作为对照, ERα在雌性兴国红鲤肝、肠和卵巢中的表达量比较高(图 2A); ERβ主要在雌、雄兴国红鲤的肝、肠和雌鱼的卵巢中表达(图 2B); ERβ1主要在雌性兴国红鲤肠、肝、脑以及雄性兴国红鲤的肠和精巢中表达(图 2C); ERβ2主要在雌雄兴国红鲤的肝, 性腺和肠中表达(图2D)。
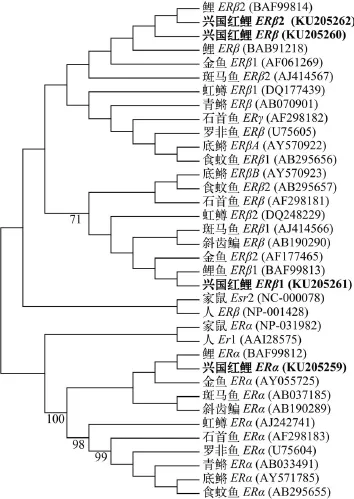
图 1 兴国红鲤及其他脊椎动物雌激素受体系统进化树Fig. 1 The phylogenetic tree of ER for Cyprinus carpio var singuonensis and other vertebrates
2.4 EE2暴露对兴国红鲤幼鱼肝中四种ERs亚型表达影响
经过4周的EE2暴露试验, 雌性兴国红鲤幼鱼肝中ER各亚型的表达量均发生变化(图 3), 在EE2暴露第1、2周, ERα基因mRNA的表达极显著地升高,但第3周1 nmol/L的暴露组明显降低(图 3A)。3个EE2处理组ERβ的表达均有不同程度的升高, 并且随着处理浓度的升高, 表达量也会相应地增加; 在第3周时, 0.1和1 nmol/L处理组ERβ的表达量达到了最高值, 到第4周有所下降(图 3B)。ERβ1基因mRNA表达量第1、2周受到明显抑制, 第3周以后0.1 nmol/L的暴露组有明显的上升趋势(图 3C)。EE2处理第1周, ERβ2基因的表达受到明显抑制, 处理浓度为0.01 nmol/L时抑制作用达到了显著的水平; 处理第3周时0.1 nmol/L EE2抑制ERβ2基因表达的作用减弱(图 3D)。
3 讨论
在高等脊椎动物中雌激素受体只存在ERα和ERβ两种亚型, 但硬骨鱼类的雌激素受体类型比哺乳动物等复杂。鲤中存在4种ER亚型: ERα、ERβ、ERβ1和ERβ2, Watabe等在2002年克隆得到了鲤的ERβ亚型, Katsu等[25]在2008年克隆得到了鲤的3种亚型: ERα、ERβ1和ERβ2。本研究克隆得到兴国红鲤ERα、ERβ、ERβ1和ERβ2的全长cDNA序列, 这与先前的研究结果一致。鱼类ERs氨基酸序列比对结果表明: 兴国红鲤的4种ERs与鲤的相应亚型氨基酸序列的一致性高达97%以上, 且与其他几种鲤科鱼类的一致性也在86%以上, 这要高于鳉科、慈鲷科等鱼类, 并且在系统发育分析树中也得到了同样的结果。这些结果表明ERs在鲤科鱼类中高度保守。

图 2 荧光定量PCR检测兴国红鲤成体组织中ERs mRNA的转录水平Fig. 2 The mRNA lever of ERs in various tissues of adult Cyprinus carpio var singuonensis by real-time qPCR
兴国红鲤四种亚型ERα、ERβ、ERβ1和ERβ2基因在雌鱼肝中的表达均有较高水平, 与彭泽鲫[26]、大鳞副泥鳅(Paramisgurnus dabryanus anus)[27]和黑头呆鱼(Pimephales promelas)[28]肝中ERs的表达情况一致。研究表明, 雌鱼肝中ERα、ERβ、ERβ1和ERβ2表达量均高于雄性, 雌激素E2 激活的ERα 能够诱导肝中Vtg表达水平的升高[29], 进而影响鱼类的性腺发育; 但加州鲈(Micropterus salmoides)[30]和斑马鱼[31]中的研究表明, ERβ1和ERβ2没有参与此过程。在本研究中, 雌鱼中ERβ、ERβ1和ERβ2的表达量高于雄鱼, 可能是由于所选试验鱼种类与发育程度的差别导致靶基因表达的不同[32]。ERα在雌性兴国红鲤肝、肠和卵巢中的表达量比较高, 该结果与稀有鮈鲫(Gobiocypri srarus)[17]的结果一致; ERα和ERβ在精巢中的表达量高于卵巢, 说明ERs在性腺中的表达具有差异性。ERs各亚型在雄性兴国红鲤精巢中的表达量也有较高的水平, 说明雌激素早已不是传统意义上只对雌鱼产生作用, 同时ERs各亚型在其他组织中不同程度的表达也说明雌激素受体在兴国红鲤中具有广泛的生理功能。
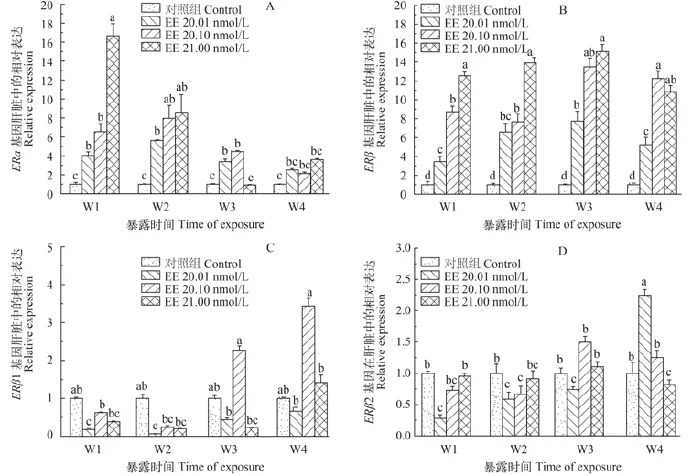
图 3 荧光定量PCR检测EE2暴露4周兴国红鲤幼鱼肝中ERs mRNA的转录水平Fig. 3 The effect of EE2 on the expression of ERs in liver of juveniles Cyprinus carpio var singuonensis
不同浓度(0.01、0.1和1 nmol/L)的EE2暴露处理对兴国红鲤雌性幼鱼肝中ERs的表达产生了抑制或促进作用。暴露试验中, 第1周和第2周ERα mRNA表达量明显增大, 与大鳞副泥鳅[27]和斑马鱼[31]的结果一致, 第3周1 nmol/L的暴露组明显降低, 说明ERα基因对1 nmol/L EE2短期(1—2周)反应的敏感性。3个EE2处理组ERβ的表达均有不同程度的升高, 且其表达量与处理浓度呈正相关; 但随着暴露时间的延长, 在暴露第4周, ERβ的表达量呈下降趋势, 这可能是受毒性作用影响的结果。ERβ1 mRNA表达量在暴露第1、2周受到明显抑制, 在彭泽鲫[26]中也得出同样的结果。ERβ2基因的表达在处理第1周受到抑制, 第3周时0.01 nmol/L EE2抑制ERβ2基因表达的作用减弱, 可能说明随着暴露时间的推移,鱼类肝对低浓度(0.01 nmol/L)的EE2产生了耐受作用。上述研究表明, 经EE2暴露4周, 兴国红鲤雌性幼鱼肝中4个ER的表达量均有变化; 其中ERα可以作为环境EE2的短期(1—2周)敏感性生物学标志物;同时, 本研究也为EE2对兴国红鲤肝中ERs表达影响的研究提供了一定的分子依据。
[1]Couse J F, Korach K S. Estrogen receptor null mice: what have we learned and where will they lead us [J]? Endocrine Reviews, 1999, 20(3): 358—417
[2]Faulds M H, Pettersson K, Gustafsson J A, et al. Crosstalk between ERs and signal transducer and activator of transcription 5 is E2 dependent and involves two functionally separate mechanisms [J]. Molecular Endocrinology, 2001, 15(11): 1929—1940
[3]Edwards D P. Regulation of signal transduction pathwaysestrogen and progesterone [J]. Annual Review Physiology, 2005, 67: 335—376
[4]O'Dowd B F, Nguyen T, Marchese A, et al. Discovery of three novel G-protein-coupled receptor genes [J]. Genomics, 1998, 47(2): 310—313
[5]Kuiper G G, Enmark E, Pelto-Huikko M, et al. Cloning of a novel receptor expressed in rat prostate and ovary [J]. Proceedings of the National Academy of Sciences of the United States of America, 1996, 93(12): 5925—5930
[6]Mosselman S, Polman J, Dijkema R. ERβ: identification and characterization of a novel human estrogen receptor [J]. FEBS Letters, 1996, 392(1): 49—53
[7]Tan N S, LamT J, Ding J L. The first contiguous estrogen receptor gene from a fish, Oreochromis aureus: evidence for multiple transcripts [J]. Molecular and Cellular Endocrinology, 1996, 120(2): 177—192
[8]Xia Z, Patiño R, Gale W L, et al. Cloning, in vitro expression, and novel phylogenetic classification of a channel catfish estrogen receptor [J]. General and Comparative Endocrinology, 1999, 113(3): 360—368
[9]Nagler J J, Cavileer T, Sullivan J, et al. The complete nuclear estrogen receptor family in the rainbow trout: Discovery of the novel ERα2 and both ERβ isoforms [J]. Gene, 2007, 392(1—2): 164—173
[10]Sarmah A K, Northcott G L, Leusch F D L, et al. A survey of endocrine disrupting chemicals (EDCs) in municipal sewage and animal waste effluents in the Waikato region of New Zealand [J]. Science of the Total Environment, 2006, 355(1—3): 135—144
[11]Chiara B, Roberta C, Giuseppe D. Monitoring natural and synthetic estrogens at activated sludge sewage treatment plants and in a receiving river water [J]. Environmental Science and Technology, 2000, 34(24): 5059—5066
[12]Aris A Z, Shamsuddina A S, Praveena S M. Occurrence of 17α-ethynylestradiol (EE2) in the environment and effect on exposed biota: a review [J]. Environment International, 2014, 69: 104—119
[13]Braga O, Smythe G A, Schäfer A I, et al. Steroid estrogens in ocean sediments [J]. Chemosphere, 2005, 61(6): 827—833
[14]Zhou H D, Wang X L, Gao M J, et al. Distribution of endocrine disrupting compounds in wastewater treatment plants of Beijing. China [J]. Water & Wastewater, 2009, 25(23): 75—78 [周海东, 王晓琳, 高密军, 等. 北京污水厂进、出水中内分泌干扰物的分布. 中国给水排水. 2009, 25(23): 75—78]
[15]Tan H, Li Y W, Rao J J, et al. The expression of three gonadotropin subunits in response to 17α-ethynylestradiol in male Pelteobagrus fulvidraco [J]. Acta Hydrobiologica Sinica, 2015, 39(6): 1117—1125 [谭号, 李英文,饶剑军, 等. 乙炔基雌二醇(EE2)对雄性黄颡鱼GtH 3个亚基基因表达的影响. 水生生物学报, 2015, 39(6): 1117—1125]
[16]Liao T, Xu Y, Zhong X P, et al. Comparative wtellogenic responses in zebrafish (Brachydanio rerio) and rare minnow (Gobiocypris rarus) exposed to 17α-ethinylestradiol [J]. Acta Hydrobiologica Sinica, 2005, 29(5): 513—517 [廖涛, 徐盈, 钟雪萍, 等. EE2对稀有鮈鲫和斑马鱼幼鱼体内卵黄蛋白原诱导的比较. 水生生物学报, 2005, 29(5): 513—517]
[17]Wang H P, Wang J J, Wu T T, et al. Molecular characterization of estrogen receptor genes in Gobiocypris rarus and their expression upon endocrine disrupting chemicals exposure in juveniles [J]. Aquatic Toxicology, 2011, 101(1): 276—287
[18]Baatrup E, Henriksen P G. Disrupted reproductive behavior in unexposed female zebrafish (Danio rerio) paired with males exposed to low concentrations of 17α-ethinylestradiol (EE2) [J]. Aquatic Toxicology, 2015, 160: 197—204
[19]Liu H Y, Cai J, Rao J J, et al. Inhibitory effect of EE2 on the expression of genes encoding steroidogenic enzymes responsible for estrogen production in zebrafish female [J]. Journal of Chongqing Normal University (Natural Science Edition), 2016, 33(1): 24—28 [刘虹余, 蔡静, 饶剑军, 等. EE2抑制斑马鱼雌性内源雌激素合成酶的表达. 重庆师范大学学报(自然科学版), 2016, 33(1): 24—28]
[20]Shved N, Berishvili G, Hausermann E, et al. Challenge with 17alpha-ethinylestradiol (EE2) during early development persistently impairs growth, differentiation, and local expression of IGF-I and IGF-Ⅱ in immune organs of tilapia [J]. Fish and Shellfish Immunology, 2009, 3(26): 524—530
[21]Menuet A, Le P Y, Torres O, et al. Analysis of the estrogen regulation of the zebrafish estrogen receptor (ER) reveals distinct effects of ER alpha, ERbeta1 and ERbeta2 [J]. Journal of Molecular Endocrinology, 2004, 32(3): 975—986
[22]Wang J J, Liu X L, Wang H P, et al. Expression of two cytochrome P450 aromatase genes is regulated by endocrine disrupting chemicals in rare minnow Gobiocypris rarus juveniles [J]. Comparative Biochemistry and Physiology Part C: Toxicology and Pharmacology, 2010, 152(3): 313—320
[23]Jobling S, Tylera C R. Endocrine disruption, parasites and pollutants in wild freshwater fish [J]. Parasitology, 2003, 126(7): S103—S107
[24]Livak K J, Schmittgen T D. Analysis of relative gene expression data using real-time quantitative PCR and the 2 (-Delta Delta C (T)) method [J]. Methods, 2001, 25(4): 402—408
[25]Katsu Y, Lange A, Miyagawa S, et al. Cloning, expression and functional characterization of carp, Cyprinus carpio, estrogen receptors and their differential activations by estrogens [J]. Journal of Applied Toxicology,2013, 33(1): 41—49
[26]Zheng Y, Wang L H, Li M, et al. Molecular characterization of five steroid receptors from pengze crucian carp and their expression profiles of juveniles in response to17α-ethinylestradiol and 17α-methyltestosterone [J]. General and Comparative Endocrinology, 2013, 191: 113—122
[27]Zhang Y Y, Wang H P, Qin F, et al. Molecular characterization of estrogen receptor genes in loach Paramisgurnus dabryanus and their expression upon 17α-ethinylestradiol exposure in juveniles [J]. General and Comparative Endocrinology, 2012, 178(2): 194—205
[28]Filby A L, Tyler C R. Molecular characterization of estrogen receptors 1, 2a, and 2b and their tissue and ontogenic expression profiles in fathead minnow (Pimephales promelas) [J]. Biology of Reproduction, 2005, 73(4): 648—662
[29]Valentina M, Augustine A. Transcriptional modulation of brain and hepatic estrogen receptor and P450arom isotypes in juvenile Atlantic salmon (Salmo salar) after waterborne exposure to the xenoestrogen, 4-nonylphenol [J]. Aquatic Toxicology, 2006, 77(2): 167—177
[30]Sabo-Attwood T, Kroll K J, Denslow N D. Differential expression of large-mouth bass (Micropterus salmoides) estrogen receptor isotypes alpha, beta, and gamma by estradiol [J]. Molecular and Cellular Endocrinology, 2004, 218(1—2): 107—118
[31]Menuet A, Page Y L, Torres O, et al. Analysis of the estrogen regulation of the zebrafish estrogen receptor (ER) reveals distinct effects of ERα, ERβ1 and ERβ2 [J]. Journal of Molecular Endocrinology, 2004, 32(3): 975—986
[32]Zang Y, Li S S, Liu Y, et al. Research and application of reproductive endocrine regulation related functional genes in cultured fishes [J]. Journal of Fishery Sciences of China, 2010, 17(2): 363—368 [张勇, 李水生, 刘云, 等.养殖鱼类生殖内分泌调控相关功能基因的研究和应用.中国水产科学, 2010, 17(2): 363—368]
CLONE AND EXPRESSION OF ER GENES IN XINGGUO RED CARP AND THEIR EXPRESSION IN LIVER UPON EE2 EXPOSURE IN JUVENILES
SONG Ming-Yue1,2, SHAN Xi-Shuang1,2, CHEN Xi-Hua1, YUE Hua-Mei1, YE Huan1, YANG Xiao-Ge1and LI Chuang-Ju1
(1. Key Laboratory of Freshwater Biodiversity Conservation, Ministry of Agriculture of China, Yangtze River Fisheries Research Institute, Chinese Academy of Fishery Sciences, Wuhan 430223, China; 2. College of Fisheries and Life, Shanghai Ocean University, Shanghai 201306, China)
The full-length cDNAs of estrogen receptors, ERα, ERβ, ERβ1 and ERβ2, were cloned from Xingguo red carp (Cyprinus carpio var singuonensis, Cs). The amino acid sequence of Cs ERs shared the highest identity with their counterparts of three cyprinid species. The ERs highly expressed in the liver, ovary and intestines of female Cs. In male Cs, ERα and ERβ mRNAs were mainly expressed in liver, and ERβ1 and ERβ2 mainly observed in intestine and testis, respectively. The mRNA level of ERα mRNAs was significantly up-regulated in in liver of Juveniles (150 dph) exposed to different concentrations (0.01, 0.1 and 1 nmol/L) of 17α-ethinylestradiol (EE2) for 1 and 2 weeks. The hepatic ERβ mRNA expression was dramatically increased by EE2 exposure, and ERβ1 mRNA expression was suppressed by EE2 for 1 and 2 weeks. The expression of ERβ2 mRNA was suppressed in the 1-week group with the highest suppression at 0.01 nmol/L of EE2. This study showed that EE2 differently regulated the expression of four ERs genes in liver. Compared to ERβ, ERβ1 and ERβ2, ERα is a more sensitive biomarker for short-term (1—2 week) EE2 exposure.
Estrogen receptor; Cyprinus carpio var singuonensis; 17α-Ethinylestradiol; Quantitative real-time PCR
Q344+.1
A
1000-3207(2017)01-0026-07
10.7541/2017.4
2016-01-08;
2016-05-17
国家高技术研究发展计划项目(2011AA100401)资助 [Supported by the National High Technology Research and Development Program of China (2011AA100401)]
宋明月(1990—), 女, 河南新乡人; 硕士研究生; 主要研究方向为鱼类分子遗传。E-mail: mysong90@163.com
李创举, 博士, 副研究员, 硕士研究生导师, E-mail: lcj@yfi.ac.cn
