优化密码子及诱导温度提高雪白根霉脂肪酶在毕赤酵母中的表达
2017-02-15王建荣刘丹妮夏雨杨玲刘金山唐业陈丽芝黄佳乐李阳源
王建荣,刘丹妮,夏雨,杨玲,刘金山,唐业,陈丽芝,黄佳乐,李阳源
(广东溢多利生物科技股份有限公司,广东 珠海,519060)
优化密码子及诱导温度提高雪白根霉脂肪酶在毕赤酵母中的表达
王建荣,刘丹妮,夏雨,杨玲,刘金山,唐业,陈丽芝,黄佳乐,李阳源*
(广东溢多利生物科技股份有限公司,广东 珠海,519060)
根据毕赤酵母密码子的偏好性,通过在线软件对雪白根霉脂肪酶基因(rnl)进行密码子优化。优化后的脂肪酶基因(rnl-opt)GC含量由原来的46%提高到49%,碱基A, T, C,G均匀分布,减少了AT和GC富集区,适应指数由0.82提升到0.85。将rnl-opt连接到表达载体pPICZαA并转入毕赤酵母X33中。将含有rnl和rnl-opt的重组工程菌在摇瓶和50 L发酵罐中进行诱导表达。摇瓶培养条件下,含有rnl和rnl-opt重组工程菌的最大酶活分别为458 、956 U/mL。50 L发酵罐培养条件下,含有rnl和rnl-opt重组工程菌的最大酶活和总蛋白浓度分别为14 856 、30 500 U/mL和3.61、7.8 g/L。为了进一步提高含rnl-opt重组工程菌的表达酶活,对其在50 L发酵罐培养的诱导温度进行优化,当诱导温度为22 ℃时,含rnl-opt重组工程菌的酶活和细胞湿重均达到最大值分别为39 520 U/mL和461 g/L。相对于30 ℃,酶活和细胞湿重分别提高了30%和16%。
密码子优化;诱导温度优化;雪白根霉;脂肪酶
脂肪酶在油水界面上可催化天然底物油脂水解,在非水相体系中又可催化转酯和酯合成等多种反应,由于其特殊的酶学性质使其在不同的工业领域具有广泛的应用潜力[1]。根霉属脂肪酶作为微生物脂肪酶主要来源之一,因其具有高度的1,3位置专一性,使其在油脂改性、生物柴油、食品加工等领域具有广泛的应用潜力[2-3]。研究表明,来源于米根霉的脂肪酶,能水解甘油三酯生成甘油二酯,可应用于油脂改性领域;同时米根霉脂肪酶还具有良好的酯化能力,广泛应用于生物柴油的研究[4-5]。华根霉脂肪酶能够增加面包的比容和弹性,降低面包的硬度使其适用于烘焙行业[6]。来源于雪白根霉的脂肪酶主要应用于油脂改性、加工等领域[7]。
毕赤酵母作为一种成熟的真核表达系统,具有许多优点:如遗传操作简单;具有完整的蛋白加工系统并且很少分泌自身内源蛋白;培养简单,易于进行高密度发酵培养等[8]。为了进一步提高异源蛋白在毕赤酵母的表达量,科研工作者发明了许多方法如:提高基因在重组酵母的拷贝数,改变表达载体的启动子及信号肽,密码子优化,优化发酵条件等[9-11]。密码子和温度优化能有效的提高异源蛋白在毕赤酵母的表达量:编码异源蛋白的基因中存在许多低频密码子,这些低频密码子大大降低了异源蛋白的转录和翻译,通过优化编码异源蛋白基因的密码子可提高其在毕赤酵母的表达水平[12-13];降低诱导温度可以提高重组工程菌的细胞活性以及重组蛋白的稳定性,从而提高异源蛋白的表达量[14]。
本课题组在之前的研究中,从雪白根霉中克隆得到一条脂肪酶基因,根据毕赤酵母密码子偏好性分析,发现其存在许多低频密码子[15]。为了提高雪白根霉脂肪酶在毕赤酵母的表达,在本研究中首次结合了密码子和诱导温度优化2种方法,为雪白根霉脂肪酶在毕赤酵母的高效表达奠定基础。
1 材料与方法
1.1 材料
1.1.1 试剂及培养基
Zeocin购自美国Invitrogen公司。高保真Q5酶、T4DNA连接酶购自北京NEB公司;限制性内切酶EcoRI和Not I购自宝生物工程(大连)有限公司;质粒提取试剂盒、PCR纯化试剂盒均购自天根生化有限公司。橄榄油购自益海嘉里投资有限公司。其他常规试剂均为国产分析纯或进口分装。引物由苏州金维智公司合成。
大肠杆菌用LB液体及LBZ固体培养基进行培养。毕赤酵母转化子用固体YPDZ培养基进行筛选。转化子筛选以及摇瓶培养所用的培养基分别为BMGY 和BMMY。酵母高密度发酵培养为BSM培养基。LB、LBZ、YPDZ、BMMY、BMGY和BSM培养基分别参照Invitrogen 公司的酵母指导手册进行配制。
1.1.2 载体和菌种
表达载体pPICZαA-rnl由本实验室在之前的实验中构建得到。毕赤酵母X33以及表达载体pPICZαA购自美国Invitrogen公司。克隆载体T-Vector pMD20购自宝生物工程(大连)有限公司。大肠杆菌top10为本实验室保存。
1.2 方法
1.2.1 雪白根霉脂肪酶基因密码子分析及优化
通过在线软件SignalP 4.0 server(http://www.cbs.dtu.dk/ services/ SignalP/)对雪白根霉脂肪酶进行信号肽预测。针对毕赤酵母表达系统,通过在线软件Graphical Codon Usage Analyser (http://gcua.schoedl.de/)对不含信号肽的雪白根霉脂肪酶基因(GeneBank 登陆号为:AB013496)的密码子进行分析,找出低频密码子。根据找出的低频密码子通过软件DNA2.0 software(http://www.dna20.com)对rnl进行优化。优化后的雪白根霉脂肪酶基因(rnl-opt) 由苏州金维智公司进行合成。
1.2.2 重组毕赤酵母工程菌的构建及高酶活转化子的筛选
将合成的雪白根霉脂肪酶基因(rnl-opt)用EcoRI和Not I进行酶切并和 pPICZαA进行连接,得到表达载体pPICZαA-rnl-opt。分别将表达载体pPICZαA-rnl-opt和pPICZαA-rnl线性化,转化至毕赤酵母X33。将转化产物均匀涂布于YPDZ平板上。将转化子分别接入含有1.4 mL BMGY的24孔板中,30 ℃培养36 h后,按体积分数1%的比例加入甲醇进行诱导培养,每24 h取样进行测定。脂肪酶活性测定以p-Nitrophenyl caprylate(C8)为底物,先加入100 μL pH 7.5的磷酸缓冲液,然后分别加入10 μL底物和10 μL 稀释好的酶液,反应5 min后加入100 μL 0.2 g/L的SDS溶液终止反应,最后在405 nm条件下测定OD值,根据OD值计算酶活。空白对照先加0.2 g/L的SDS溶液,其他反应步骤相同。
1.2.3 重组酵母菌摇瓶培养
为了进一步比较方法1.2.2筛选出来的高酶活转化子,将培养条件扩大到摇瓶培养。摇瓶培养参照之前报道的方法进行[16]。分别将高酶活菌株接入BMGY培养基30 ℃,250 r/min振荡过夜培养至OD600达到2~6。离心收集菌体,用BMMY培养基将菌体重悬稀释至OD600为1.0,每过24 h按体积分数1%的比例向BMMY培养基中补加甲醇。同时对菌体浓度和脂肪酶酶活进行测定。脂肪酶活性测定参照国标GBT/23535—2009报道的方法进行。
1.2.4 重组酵母工程菌的高密度发酵培养
为了进一步比较优化后的rnl-opt和原始rnl在毕赤酵母的表达酶活,将摇瓶培养筛选出来的高酶活转化子在50 L发酵罐进行高密度发酵培养。将单菌落的重组酵母工程菌接入含有50 mL YPD培养基的250 mL 三角瓶中,30 ℃,250 r/min振荡过夜培养。再将过夜培养的重组酵母工程菌按体积分数1%的接种量接入含有100 mL YPD培养基的500 mL 三角瓶中,30 ℃,250 r/min振荡过夜培养,至OD600大于10。将二次过夜培养的重组酵母工程菌按体积分数10%的接种量接入含有20 L BSM培养基的50 L发酵罐。重组酵母工程菌在50 L发酵罐的培养条件为:温度为30 ℃、ph值5.0、搅拌速度为500 r/min、空气流量为40 L/min。培养初期,以甘油作为碳源供菌体生长。当菌体湿重达到一定的量,停止流加甘油,待甘油被菌体吸收完后(溶氧迅速上升)开始用甲醇诱导。甲醇的添加量根据溶氧进行调整,整个发酵过程使溶氧大于20%。培养过程中,每24 h取样测定菌体湿重、酶活、总蛋白浓度以及SDS-PAGE电泳分析。
1.2.5 诱导温度优化
为了研究诱导温度对重组工程菌X33/rnl-opt分泌RNL的影响,将重组工程菌X33/rnl-opt在50 L发酵罐不同的诱导温度下进行诱导培养。具体步骤如下:甘油流加阶段培养温度为30 ℃,当甘油流加完进入诱导阶段,诱导温度分别为30 、28 、25、22 ℃。培养过程中,每24 h取样测定菌体湿重、酶活以及总蛋白浓度。
2 结果与分析
2.1rnl密码子分析及优化
根据毕赤酵母密码子偏好性,通过在线软件对rnl基因进行分析,发现在原始rnl基因当中存在多个低频密码子如编码Gly的GGC、编码Arg的CGA和CGT、编码Ser的AGT、编码Leu的CTC以及编码Pro的CCC(表1)。这些低频密码子影响rnl在毕赤酵母的表达。根据毕赤酵母密码子的偏好性,通过密码子优化,我们用高频密码子替换了这些低频密码子,如将编码Gly的GGC替换为GGT、编码Arg的CGA和CGT替换为AGA等。经过优化,rnl基因的密码子适应指数由0.82提升到0.85,GC含量由原来的46%提高到49%。碱基A, T, C和G均匀分布于优化后的rnl基因,减少了AT和GC富集区,利于rnl基因在毕赤酵母的表达。通过对优化后的rnl-opt基因进行分析,发现总共有232个碱基进行了优化,优化后的rnl-opt基因与原始rnl基因的相似性为85%。

表1 rnl原始基因与优化后的rnl-opt基因密码子比较
2.2 重组毕赤酵母工程菌的构建及高酶活转化子的筛选
分别将表达载体pPICZαA-rnl-opt和pPICZαA-rnl线性化,转化至毕赤酵母X33得到含有rnl-opt基因和rnl基因的重组转化子。通过分析测定,筛选到4个高酶活转化子,2个含有rnl-opt基因(命名为X33/rnl-opt-1和X33/rnl-opt-2),另外2个含有rnl基因(命名为X33/rnl-1和X33/rnl-2)。为了进一步比较这4个转化子的酶活,分别在摇瓶培养条件下测定这4个转化子的酶活及总蛋白浓度。如图1所示,摇瓶培养120 h后,X33/rnl-1、X33/rnl-2、X33/rnl-opt-1和X33/rnl-opt-2的酶活分别为458、436、925 、956 U/mL。总蛋白浓度分别为0.11、0.1、0.19 、0.21 g/L(图1)。通过分析比较,选择重组菌株X33/rnl-1和X33/rnl-opt-2做下一步实验的出发菌株。
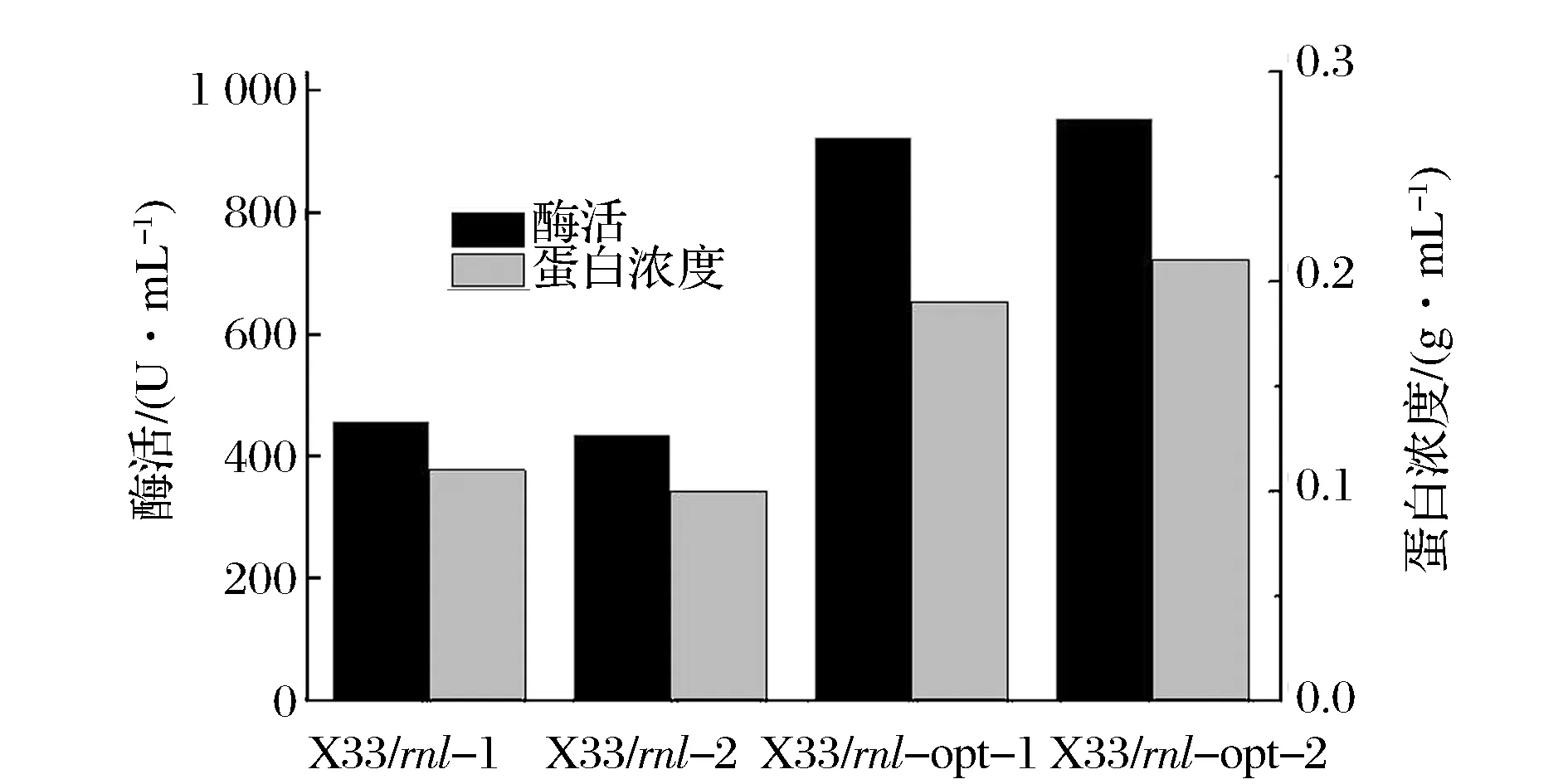
图1 重组工程菌摇瓶培养Fig.1 Lipase production and total protein concentration of recombinant strain in shake-flask level
2.3 重组酵母工程菌的高密度发酵培养
重组工程菌株X33/rnl-1和X33/rnl-opt-2在50 L发酵罐的生长及产酶曲线如图2所示。由图2可知:当诱导时间为168 h,重组工程菌X33/rnl-opt-2和X33/rnl-1的发酵酶活均达到最大分别为30 500 、 14 856 U/mL. 相对于原始基因,密码子优化后的rnl-opt基因的表达酶活提高了1.05倍。当诱导时间为192 h,重组工程菌X33/rnl-opt-2总蛋白浓度达到最大值为7.8 g/L,是重组工程菌X33/rnl总蛋白浓度的 2.16倍。当诱导时间为192 h重组工程菌X33/rnl-opt-2和X33/rnl-1的细胞湿重均达到最大值分别为405 、402 g/L。SDS-PAGE电泳分析发现(图3),重组RNL的分子量约为37 kDa,与预测的大小相近。SDS-PAGE蛋白胶表明重组工程菌X33/rnl-opt-2分泌重组RNL的量明显高于重组工程菌X33/rnl-1。用Quantity One 软件对蛋白条带进行定量分析发现上清液中重组RNL蛋白约占总蛋白含量的86%。
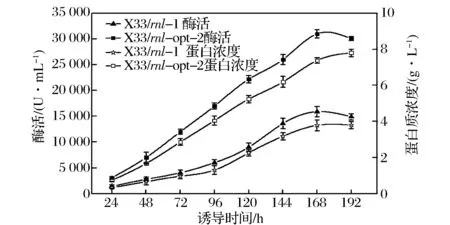
图2 重组工程菌X33/rnl-opt-2 和X33/rnl-1 50 L发酵培养Fig.2 Lipase activity and total protein content of X33/rnl-opt-2 and X33/rnl-1 during fed batch fementation in 50 L bioreactor

M-蛋白Marker;1-X33/rnl-1培养168 h上清蛋白;2-X33/rnl-opt-2培养168 h上清蛋白图3 SDS-PAGE分析重组蛋白Fig. 3 SDS-PAGE analysis of the recombinant lipase
2.4 优化诱导温度
重组工程菌X33/rnl-opt-2在不同诱导温度下的产酶和细胞湿重如图4所示。

图4 诱导温度优化Fig.4 Lipase activity and DCW of X33/rnl-opt during fed batch fementation in 50 L bioreactor under different induction temperature
由图4可知,诱导温度与重组工程菌X33/rnl-opt-2的产酶及生长有着密切的关系。随着诱导温度下降,重组工程菌X33/rnl-opt-2的产酶能力以及细胞湿重逐渐上升。当诱导温度为22 ℃时,重组工程菌X33/rnl-opt-2在50 L发酵罐诱导168 h后,酶活和细胞湿重均达到最大值分别为39 520 U/mL和461 g/L。相对于30 ℃,诱导温度为22 ℃时,酶活和细胞湿重分别提高了30%和16%。由图5可知降低诱导温度,可以提高工程菌X33/rnl-opt-2表达重组RNL的水平,随着诱导温度的降低,上清酶液中重组RNL的浓度越来越高。

M-蛋白Marker;1~4-分别是诱导温度为30,28,25和22 ℃图5 SDS-PAGE分析X33/rnl-opt-2在不同诱导温度下培养168 h后的重组蛋白Fig.5 SDS-PAGE analysis of the recombinant lipase under different induction temperature
3 讨论
毕赤酵母作为一种成熟的真核表达系统,在蛋白质表达方面有着许多优点:如培养条件简单、易于操作、便于工业化生产、可高效表达外源蛋白等。密码子优化可以有效地提高异源基因在毕赤酵母的表达水平。研究表明,根据毕赤酵母密码子偏好性对米根霉脂肪酶基因密码子进行优化使其表达酶活从28.7 U/mL提高到132.7 U/mL[17]。通过优化黑曲霉脂肪酶2的密码子,使其在毕赤酵母的表达酶活提高了11.6倍[18]。本文通过优化rnl的密码子,提高了其在毕赤酵母X33的表达量。在摇瓶培养条件下,优化后的rnl-opt最高表达酶活为956 U/mL,是原始基因表达酶活的2.08倍。在50 L发酵罐培养条件下,优化后的rnl-opt最大酶活为30 500 U/mL,是原始基因表达酶活的2.05倍。诱导温度也是影响异源蛋白在毕赤酵母表达水平的重要因素。研究表明降低诱导温度可以降低细胞的死亡率,提高细胞活性,有利于重组蛋白的表达[14]。在本研究中,我们优化了重组工程菌X33/rnl-opt-2在50 L发酵罐培养条件下的诱导温度,结果表明:降低诱导温度可以提高工程菌X33/rnl-opt-2的产酶水平以及细胞湿重;当诱导温度为22 ℃时,重组工程菌X33/rnl-opt-2的表达酶活和细胞湿重均达到最大值分别为39 520 U/mL和461 g/L。本研究中rnl-opt在毕赤酵母的最大表达酶活为39 520 U/mL,是迄今根霉来源脂肪酶在毕赤酵母表达酶活最高的,如来源于米根霉的脂肪酶在毕赤酵母的表达酶活为21 000 U/mL,来源于华根霉的脂肪酶在毕赤酵母的表达酶活587 U/mL[19-20]。但由于测定条件,培养条件、底物特异性等条件的不同,脂肪酶酶活呈现很大的差异性,因此脂肪酶酶活的比较必须在相同的条件下进行,才具有可比性。本研究结合了密码子优化和诱导温度优化2种方法将rnl-opt在毕赤酵母的最大表达酶活从14 856 U/mL 提高到39 520 U/mL。本研究结果表明,将密码子优化和诱导温度优化2种方法进行结合能有效提高异源蛋白在毕赤酵母的表达水平。
[1] SINGH A K, MUKHOPADHYAY M. Overview of fungal lipase: a review[J]. Applied Biochemistry and Biotechnology, 2012, 166(2): 486-520.
[2] 颜兴和,王栋,徐岩. 根霉脂肪酶的研究进展[J].工业微生物,2005, 35 (3): 45-49.
[3] ADAK S, DATTA S, BHATTACHARYA S. Role of spacer length in interaction between novel gemini imidazolium surfactants andRhizopusoryzaelipase[J]. International Journal of Biological Macromolecules, 2015, 81:560-567.
[4] ZHOU Gui-xiong , CHEN Guan-yi , YAN Bei-bei . Two-step biocatalytic process using lipase and whole cell catalysts for biodiesel production from unrefined jatropha oil[J]. Biotechnology Letters, 2015, 37(10):1 959-1 963.
[5] LUNA C, VERDUGO C, SANCHO E D, et al. Biocatalytic behaviour of immobilizedRhizopusoryzaelipase in the 1,3-selective ethanolysis of sunflower oil to obtain a biofuel similar to biodiesel[J]. Molecules, 2014, 19(8):11 419-11 439.
[6] 张峦, 黄立群, 喻晓蔚. 重组华根霉脂肪酶的酶学性质及其对面团热机械学和烘焙特性的影响[J].食品科学,2010, 31 (13): 158-163.
[7] KOHNO M, ENATSU M, TAKEE R, et al. Thermal stability ofRhizopusniveuslipase expressed in a kex2 mutant yeast[J]. Journal of Biotechnology, 2000, 87(3):203-210.
[8] MACAULEY S. FAZENDA M L, MCNEIL B, et al. Heterologous protein production using thePichiapastoris expression system[J]. Yeast, 2005, 22(3):249-270.
[9] TENG Da, FAN Ying, YANG Ya-lin, et al. Codon optimization ofBacilluslicheniformisbeta-1,3-1,4-glucanase gene and its expression inPichiapastoris[J]. Applied Microbiology and Biotechnology, 2007, 74(5): 1 074-1 083.
[10] WANG Xiao-feng, SHEN Xu-guang, SUN Yong-chuan, et al. Production ofYarrowialipolyticalipase LIP2 inPichiapastorisusing the nitrogen source-regulated FLD1 promoter[J]. Journal of Chemical Technology and Biotechnology, 2012, 87(4): 553-558.
[11] JIA Hui-yong, FAN Guang-sen, YAN Qiao-juan, et al. High-level expression of a hyperthermostableThermotogamaritimaxylanase inPichiapastorisby codon optimization[J]. Journal of Molecular Catalysis B: Enzymatic, 2012, 78: 72-77.
[12] YANG Jiang-ke, LIU Li-ying. Codon optimization through a two-step gene synthesis leads to a high-level expression ofAspergillusnigerlip2 gene inPichiapastoris[J]. Journal of Molecular Catalysis B: Enzymatic, 2010, 63: 164-169.
[13] LI Yi-hang, ZHANG Bo, CHEN Xiang, et al. Improvement ofAspergillussulphureusendo-beta-1,4-xylanase expression inPichiapastorisby codon optimization and analysis of the enzymic characterization[J]. Applied Biochemistry and Biotechnology, 2010, 160(5): 1 321-1 331.
[14] WANG Yun,WANG Zhi-hao, XU Qing-long, et al. Lowering induction temperature for enhanced production of polygalacturonate lyase in recombinantPichiapastoris[J]. Process Biochemistry, 2009, 44: 949-954.
[15] 王建荣,刘丹妮,李鹏. 雪白根霉脂肪酶基因在毕赤酵母中的高效表达及其酶学性质研究[J]. 食品与发酵工业,2014, 40(2): 83-88.
[16] 王建荣, 刘丹妮, 李阳源. 克氏担孢酵母脂肪酶基因在毕赤酵母中的高效表达[J]. 食品科学, 2015,36 (3):104-108.
[17] 杨江科,严翔翔,黄日波,等. 米根霉脂肪酶基因pro-ROL和m-ROL在毕赤酵母中的密码子优化、表达和酶学性质的比较分析[J]. 生物工程学报, 2011,27 (12):1 780-1 788.
[18] YANG Jiang-ke, LIU Li-ying. Codon optimization through a two-step gene synthesis leads to a high-level expression ofAspergillusnigerlip2 gene inPichiapastoris[J]. Journal of Molecular Catalysis B: Enzymatic, 2010, 63: 164-169.
[19] WANG Jian-rong, LI Yang-yuan, XU Shu-de, et al. High-level expression of pro-form lipase fromRhizopusoryzaeinPichiapastorisand its purification and characterization[J]. International Journal of Molecular Sciences, 2013,15(1): 203-217.
[20] YU Xiao-wei, WANG Le-le, XU Yan.Rhizopuschinensislipase: Gene cloning, expression inPichiapastorisand properties[J]. Journal of Molecular Catalysis B: Enzymatic, 2009, 57: 304-311
Enhanced production ofRhizopusniveuslipase inPichiapastorisby codon and fermentation optimization
WANG Jian-rong, LIU Danni, XIA Yu, YANG Ling, LIU Jin-shan, TANG Ye,CHEN Li-zhi, HUANG Jia-le,LI Yang-yuan*
(Guangdong VTR BIO-TECH Co., Ltd., Zhuhai 519060, China)
The codon usage ofRhizopusniveuslipase gene was optimized by online software according to the preferred codon usage forP.pastoris. The G+C content ofrnlwas increased from 46 to 49% and the nucleotides A, T, C and G dispersed evenly in the optimized gene to eliminate AT-or GC-rich motifs. Furthermore, the codon adaptation index was improved from 0.82 to 0.85. Thernlandrnl-optwere inserted into pPICZαA and transformed toP.pastorisX33. The recombinant strains containingrnlandrnl-optwere cultivated in shaking flask and 50 L bioreactor. In shake-flask level, the maximum lipase activity of X33/rnland X33/rnl-optwere 458 U/mL and 956 U/mL, respectively. The maximum lipase activity and total protein concentration produced by X33/rnland X33/rnl-optwere 14 856 U/mL and 30 500 U/mL, 3.61 g/L and 7.8 g/L. The induction temperature for X33/rnl-optwas optimized in 50 L bioreactor. When the induction temperature was 22 ℃, the maximum lipase activity and cell weight of X33/rnl-optreached 39 520 U/mL and 461 g/L, which was increased 60% and 80% compared with 30 ℃.
codon optimization; induction temperature optimization;Rhizopusniveus; lipase
10.13995/j.cnki.11-1802/ts.201701004
硕士,工程师(李阳源高级工程师为通讯作者,E-mail:liyangyuanvtr@163.com)。
国家高技术研究发展计划(863 计划)(No. 2014AA093514)
2015-11-09,改回日期:2016-01-13
