尘螨变应原Der f 6/pET32a(+)重组质粒构建、表达、纯化及其产物血清IgE结合率①
2017-02-15韩玉清俞黎黎张承伯崔玉宝
韩玉清 俞黎黎 周 鹰 杨 李 张承伯 崔玉宝
(东南大学医学院附属盐城医院检验科,盐城224006)
·免疫学技术与方法·
尘螨变应原Der f 6/pET32a(+)重组质粒构建、表达、纯化及其产物血清IgE结合率①
韩玉清 俞黎黎②周 鹰 杨 李②张承伯②崔玉宝③
(东南大学医学院附属盐城医院检验科,盐城224006)
目的:获得尘螨变应原第6组分Der f 6原核表达产物并检测其与尘螨过敏性哮喘患儿血清抗体IgE结合率。方法:酶切质粒pET28a(+)-Der f 6获得目的基因Der f 6,将其与pET32a(+)载体连接成质粒pET32a (+)-Der f 6,转化BL21细菌后,用异丙基硫代半乳糖苷(IPTG)诱导表达,用Ni+离子亲和层析柱纯化表达产物,用十二烷基磺酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)、免疫印迹实验(Western blot)和蛋白质串联质谱(MALDI-TOF/TOF)鉴定纯化产物。以纯化获得的产物为包被抗原建立间接ELISA法检测尘螨过敏性哮喘患儿血清抗体反应情况。结果:成功构建了原核表达质粒pET32a (+)-Der f 6,将该质粒转化E.coli BL21诱导表达,亲和层析纯化后,SDS-PAGE显示获得目的蛋白,Western blot验证其能够与载体的组氨酸标签结合,质谱鉴定其Der f 6结构一致。以此产物为包被抗原建立间接ELISA检测尘螨过敏性哮喘患儿血清,阳性率为41.3% (19/46)。结论:成功构建了原核表达质粒pET32a (+)-Der f 6,亲和纯化获得的目的蛋白具有良好的反应原性。
尘螨;变应原;基因表达;蛋白质纯化
长期以来,临床采用尘螨粗提浸液混合物诊治过敏性哮喘、过敏性鼻炎、特应性皮炎等Ⅰ型变态反应性疾病[1]。随着人们对变应原化学性质的深入了解,尘螨粗提浸液质量得到不断改进,尘螨变应原的标准化不再依赖于蛋白氮单位、质量/体积比,欧美权威部门都已引进生物和免疫化学方法改善变应原产品的标准化[2-4]。测定主要变应原的浓度也被临床认为是较好的方法,能够为了变应原免疫治疗提供更佳的方案[2-4]。尽管如此,采用纯培养的尘螨制备变应原仍然含有许多非过敏性蛋白质及其他大分子物质,不同批次产品中变应原组成、含量不同,还有可能被其他物质(甚至于蛋白水解酶)污染,而这些酶类物质可能具有过敏原性,也可能不具有变应原性,但是会引起变应原性物质的降解或者效价下降。绝大多数的变应原粗提制品含有多组主要变应原和次要变应原成分,即使采用最新技术也很难对此混合物进行标准化。
正因为上述原因,采用重组DNA技术制备重组变应原、改善变应原质量成为变态反应学研究的主流方向之一。过去20年里,几乎所有主要变应原的核酸序列都已经得到测定,细菌、酵母、昆虫病毒和植物表达体系都已经用于制备重组变应原,其产物纯度高,被认为有可能替代过敏原粗提混合物用于临床诊治疾病[2-4]。本研究将粉尘螨变应原第6组分Der f 6与原核表达载体pET32a(+)连接,并转化大肠杆菌E.coli BL21 (DE3)中表达,用纯化获得的重组融合蛋白与血清进行ELISA验证其反应原性,现将结果报告如下。
1 材料与方法
1.1 材料
1.1.1 血清 尘螨过敏性哮喘患儿血清均由我院检验科保存提供,所有患者未接受任何治疗。哮喘诊断符合WHO标准,即患儿有咳嗽、哮喘,肺部有明显的喘鸣音、湿罗音以及其他临床症状,X-线显示肺部纹理、充气过度[5]。所有患儿均经过敏原特异性IgE抗体检测显示血清粉尘螨特异性IgE阳性,并结合病史确诊。共有46例尘螨过敏性哮喘患儿入选,平均年龄(7.1±3.5) 岁,男25例、女21例。健康体检合格儿童5例,均无过敏史,为对照组,平均年龄(5.4±2.4)岁,男2例、女3例。
1.1.2 质粒、菌株、试剂 本室保存的pET28a(+)-Der f 6[6]。工具酶BamHⅠ和XhoⅠ、DNA ladder、E.coli Competent Cells JM109 (Code No.D9052)由大连TaKaRa公司生产;E.coli BL21 (DE3) Stratagene公司生产;pET32a(+) (Kit Lot No.N72770)由Novagen公司生产。过敏原特异性IgE抗体检测试剂盒由苏州浩欧博生物医药有限公司生产(YZB/国1450-2012)。
1.2 方法
1.2.1 原核表达质粒pET32a(+)-Der f 6构建 使用BamH I/Xho I双酶切载体pET28a(+)-Der f 6,切胶回收小片段即为目的基因Der f 6;使用BamH I/Xho I双酶切空质粒pET32a(+),切胶回收大片段;使用T4 DNA连接酶将Der f 6与pET32a(+)载体连接后,转化至E.coli Competent Cells JM109感受态细胞中,涂布平板,37℃倒置培养过夜;挑取单菌落,进行菌落PCR鉴定,鉴定结果阳性者进行质粒抽提。
1.2.2 质粒pET32a(+)-Der f 6表达 取0.1 μl质粒pET32a(+)-Der f 6转化50 μl BL21感受态细胞中,使用LB/Amp抗生素平板,取50 μl转化液涂布,37℃倒置培养。种培养:挑取单菌落至1 ml LB/Amp抗生素培养基中,37℃培养;再转接到5 ml LB/抗生素培养基中,37℃培养。主培养诱导:在400 ml LB/Amp抗生素培养基中,添加4 ml种培养菌液,37℃培养至OD600nm值约为0.6~0.7,添加1 mol/L IPTG 400 μl(最终浓度为1 mmol/L),28℃诱导4~5 h。菌体收集及破碎:置4℃、5 000 r/min离心10 min,去掉上清培养基。菌体沉淀加lysis buffer(10 mmol/L咪唑、50 mmol/L PBS、0.3 mol/L NaCl、5%甘油)超声破碎;12 000 r/min离心,弃上清;沉淀加变性裂解液(lysis buffer,10 mmol/L咪唑、50 mmol/L PBS、0.3 mol/L NaCl、8 mol/L尿素)重悬,12 000 r/min离心,取上清过Ni柱亲和纯化蛋白。
1.2.3 质粒pET32a(+)-Der f 6表达产物纯化与复性 蛋白质纯化过程包括平衡、上样、洗杂和洗脱。取Ni柱用裂解液(lysis buffer,10 mmol/L咪唑、50 mmol/L PBS、0.3 mol/L NaCl、8 mol/L尿素)平衡5~10个柱体积,上样:将离心后的细胞培养液上清以1 ml/min通过Ni柱收集流穿液4℃保存,再用洗杂液 1(20 mmol/L咪唑、50 mmol/L PBS、0.3 mol/L NaCl、8 mol/L尿素)洗5~10个柱体积收集洗杂液1,4℃保存;用洗杂液 2(50 mmol/L咪唑、50 mmol/L PBS、0.3 mol/L NaCl、8 mol/L尿素)洗4~5个柱体积收集洗杂液2,4℃保存。用洗脱buffer(250 mmol/L咪唑、50 mmol/L PBS、0.3 mol/L NaCl、8 mol/L尿素)洗4~5个柱体积,收集洗脱液,4℃保存。取10 μl样本+5 μl上样缓冲液混匀100℃水浴煮沸10 min,离心,得纯化产物。蛋白质复性:取上述纯化产物,加10 mmol/L裂解液(10 mmol/L咪唑、50 mmol/L PBS、0.3 mol/L NaCl、5%甘油)稀释4倍,搅拌4 h。将蛋白透析到PBS+5%甘油 buffer中,浓缩蛋白。
1.2.4 SDS-PAGE和Western blot验证纯化产物 取1 μg样本,加入5×SDS sample buffer,95℃加热10 min,上样进行SDS-PAGE电泳。电泳条件为:浓缩胶(12%)恒压90 V,约20 min,溴酚蓝到分离胶(5%)界面,分离胶恒压160 V,约30 min。将PVDF膜剪切成与Gel相同大小;放于甲醇中浸泡15 s;再放于转膜液中浸泡5~10 min。滤纸放于转膜液中浸泡5~10 min。采用半干法转膜,在转膜仪上按从上到下的顺序依次放置:(负极)滤纸-PAGE Gel-PVDF膜-滤纸(正极)。电压20 V,转膜时间90 min。将膜完全浸没在5%的脱脂奶粉-PBST溶液中,室温下摇摆封闭1 h。用5%的脱脂奶粉-PBST稀释一抗(His-tag;稀释比例:1∶2 000),室温孵育1 h,放到4℃冰箱孵育一抗过夜。第2天从4℃冰箱拿出来后,室温放置30 min,0.1%PBST洗膜3次,每次10 min。用5%的脱脂奶粉-PBST稀释二抗[羊抗鼠IgG(H+L) HRP;稀释比例:1∶2 000],室温孵育1 h。用0.1%PBST洗膜3次,每次10 min。将显色混合液加到膜上后,反应3~5 min,胶片曝光,显影2 min,定影。
1.2.5 质谱鉴定纯化产物 取纯化后的蛋白质,用MALDI-TOF/TOF质谱仪(Applied Biosystem,4800型)按中国药典2010版二部附录Ⅸ J鉴定。
1.2.6 重组融合蛋白特异性IgE检测 用酶联免疫吸附试验(Enzyme-linked immunosorbent assay,ELISA)检测pET32a(+)-Der f 6表达产物的免疫反应性。取100 μl纯化获得的原核表达产物(1 μg/ml),用0.1 mol/L磷酸盐缓冲液(Phosphate-buffer saline,PBS)进行稀释,然后加入酶标板中,8℃过夜孵育。取300 μl PBST缓冲液封闭抗原,再加入1∶4稀释后的患者血清每孔100 μl,4℃过夜孵育。加入50 μl二抗(辣根过氧化酶标记的鼠抗人IgE,1∶5 000 稀释),37℃ 孵育1 h。加100 μl四甲基联苯胺(Tramethylbenzidine,TMB),室温孵育15 min,加入50 μl NH2SO4终止反应。用酶标仪读取每孔光密度值(Optical density,OD),波长为405nm。每患者测3次,取平均值,若高于阳性阈值即判为阳性。健康体检合格儿童5名同时进行ELISA检测,其平均OD值±3 SD作为阈值。
2 结果
2.1 原核表达质粒pET32a(+)-Der f 6鉴定 用BamHⅠ和XhoⅠ双酶切质粒pET28a(+)-Der f 6,切胶回收目的基因(图1),目的片段大小约在840 bp;用T4 DNA连接酶将目的基因与pET32a(+)载体连接后转化至大肠杆菌感受态细胞,菌落PCR鉴定结果表明成功构建了原核表达质粒pET32a(+)-Der f 6,见图2。
2.2 质粒pET32a-Der f 6原核表达及其产物纯化 将原核表达质粒pET32a-Der f 6转化宿主菌E.coli BL21诱导表达,SDS-PAGE电泳显示其正常表达,但表达为包涵体。从2 000 ml发酵液收集到菌体,超声波破碎后,离心收集沉淀即为粗制的包涵体,经洗涤、溶解、过滤后,上清液经过镍琼脂糖凝胶FF亲和柱,并用不同浓度咪唑溶液洗脱并收集产物,SDS-PAGE电泳分析显示获得较纯净的目的蛋白(图3A),用Western blot验证其与His-tag结合(图3B)。得到蛋白纯度80%,浓度1 mg/ml。取纯化出来的融合蛋白质,质谱鉴定认为Der f 6结构一致。
2.3 融合蛋白ELISA检测结果 以纯化获得的pET32a(+)-Der f 6原核表达产物为包被抗原进行ELISA检测,5健康体检合格儿童血清抗体的OD值为0.199,标准差为0.015 9,以(0.199+3×0.019)=0.258为阈值,46份尘螨过敏性哮喘患儿对此融合蛋白的阳性率为41.3% (19/46),见图4。
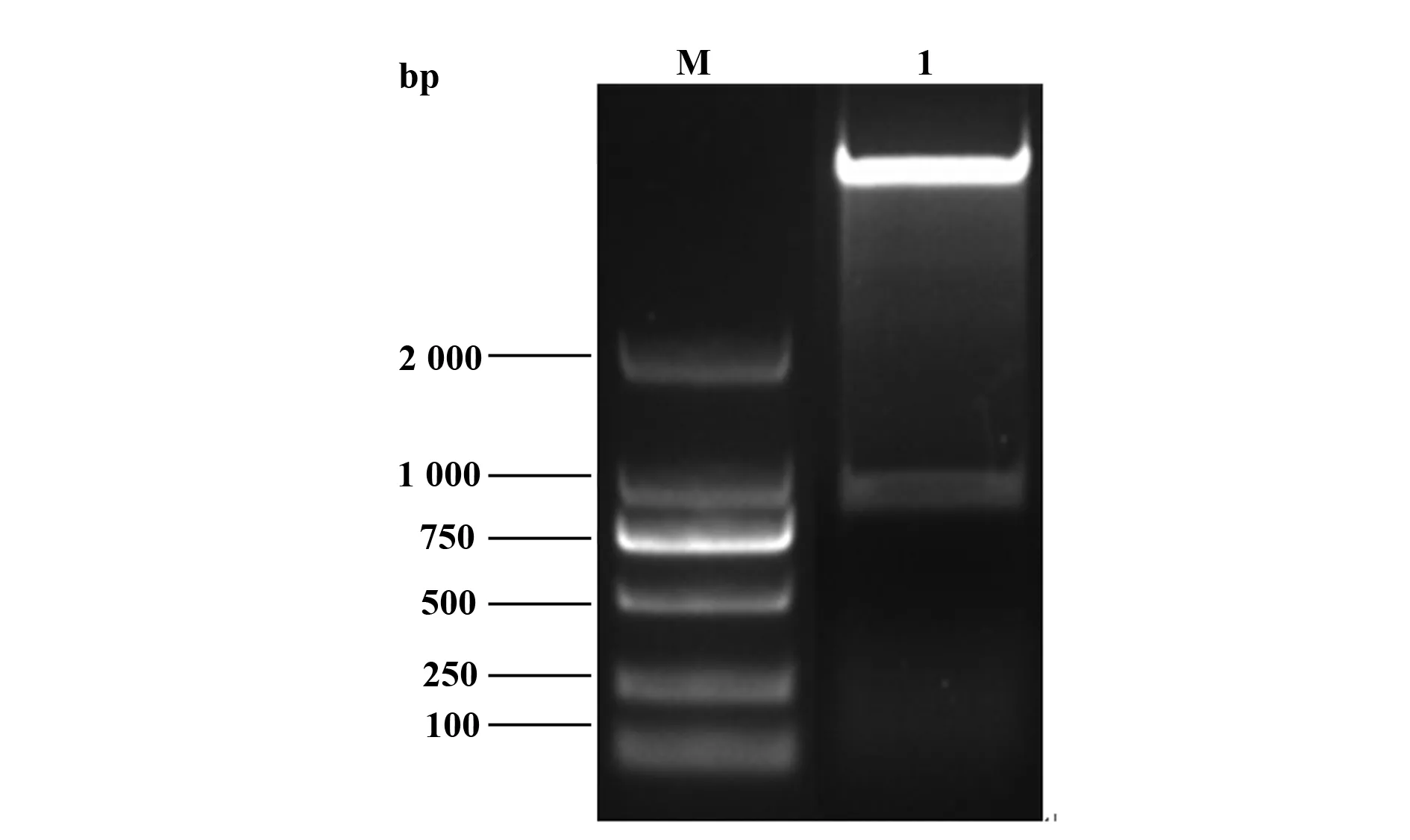
图1 质粒pET28a(+)-Der f 6 经BamHⅠ/XhoⅠ双酶切电泳图Fig.1 Restriction analysis of expression plasmids pET28a(+)-Der f 6 by BamHⅠand XhoⅠNote: Lane M.DL2000 marker;Lane 1.The products of the plasmids pET28a(+)-Der f 6 by BamHⅠand XhoⅠ.
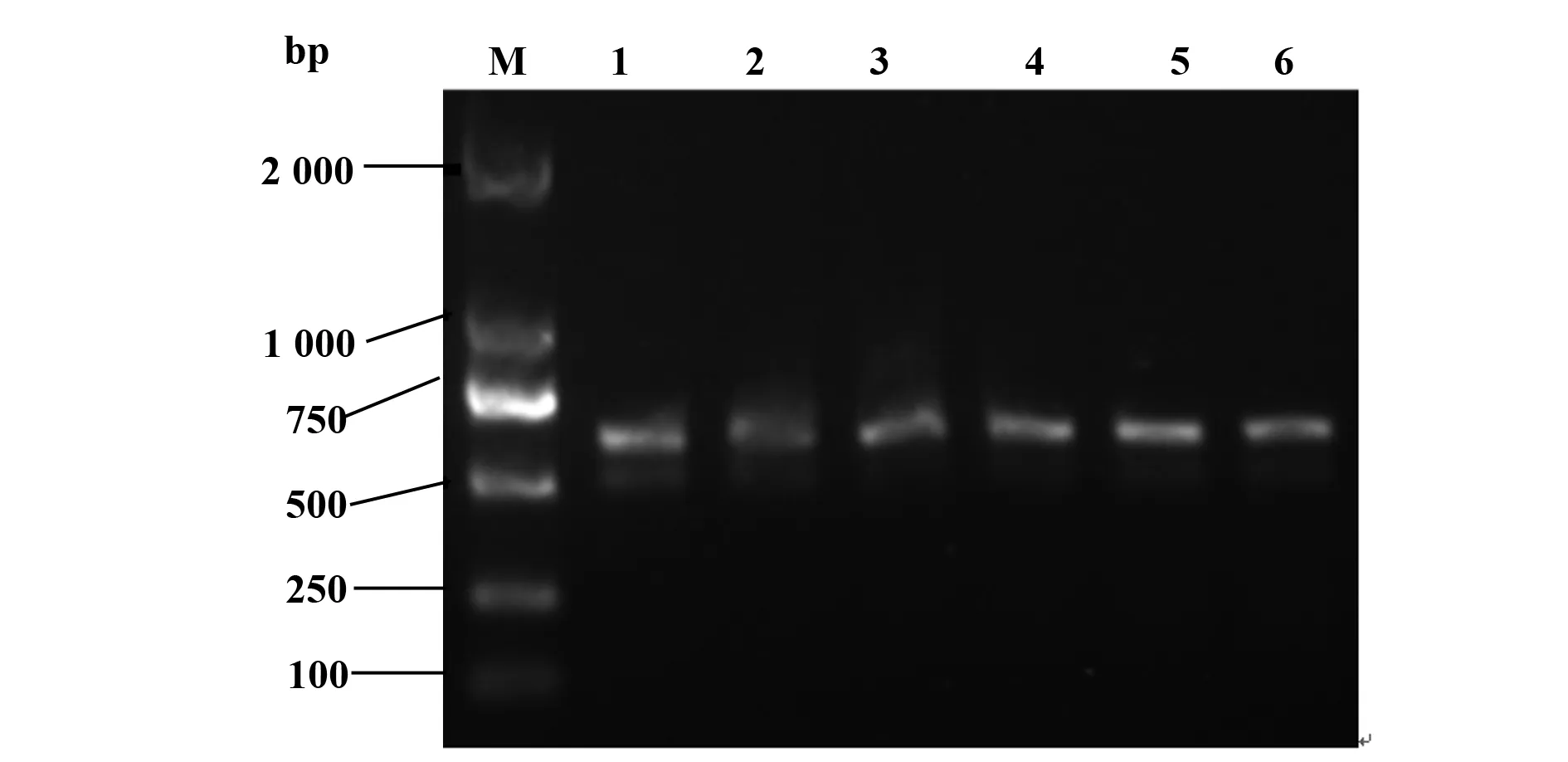
图2 pET32a(+)-Der f 6菌落PCR鉴定产物电泳图Fig.2 Electrophoretic analysis of colony PCR product of plasmids pET32a(+)-Der f 6Note: Lane M.DL2000 marker;Lane 1-6.The PCR product of the plasmids pET32a(+)-Der f 6.
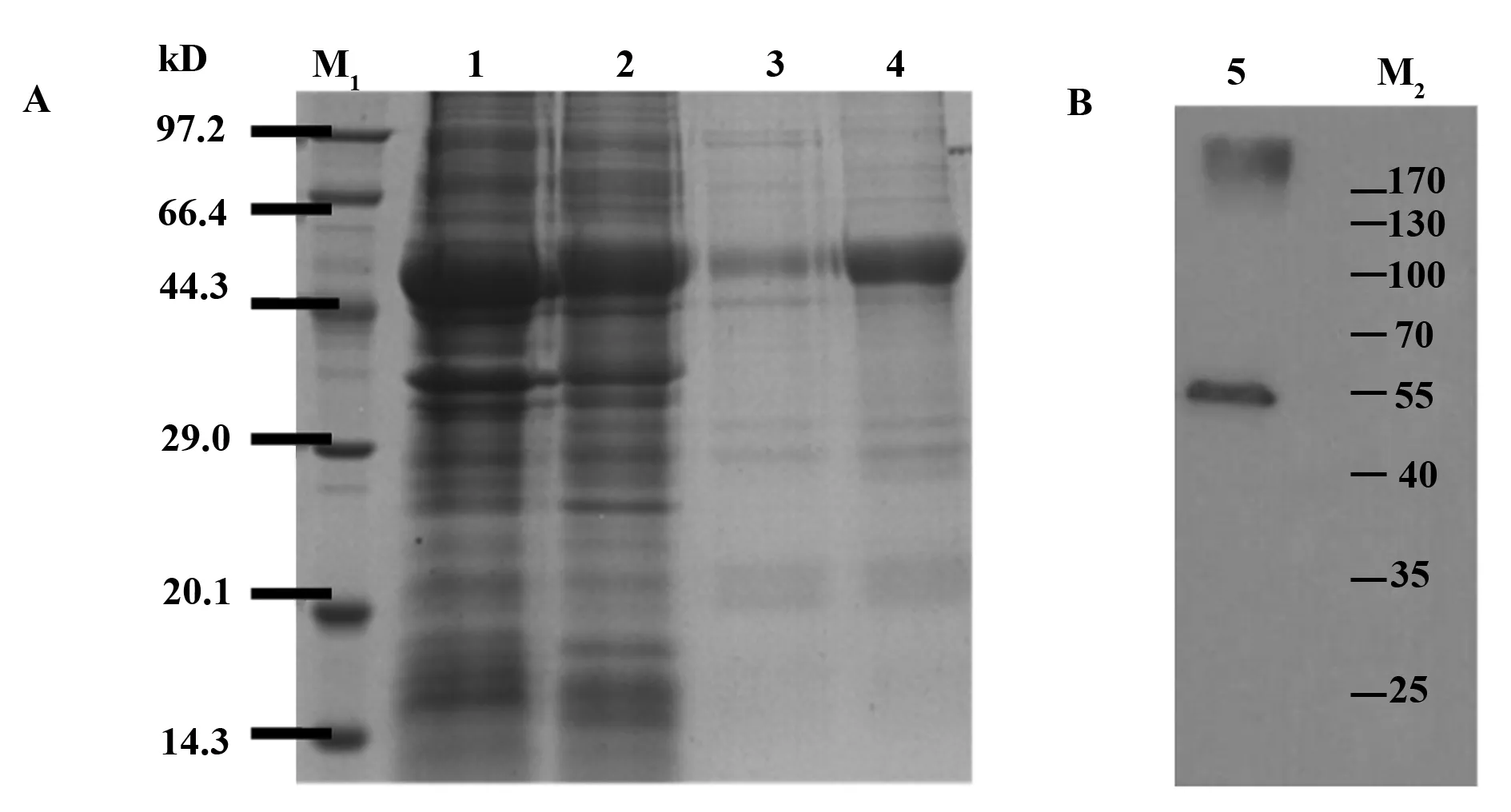
图3 SDS-PAGE和Western blot验证纯化后pET32a(+)-Der f 6原核表达产物Fig.3 SDS-PAGE analysis and Western blot analysis of expressed products of pET32a(+)-Der f 6 in E.coli BL21 cellsNote: A.SDS-PAGE analysis the recombinant proteins.Lane 1.Supernatant;Lane 2.The flow-through of the His-bind column;Lane 3.The washing;Lane 4.The elution.B.Lane 5.TaKaRa protein marker(Broad);Lane M2.Thermo scientific pierce prestained protein molecular molecular weight marker.
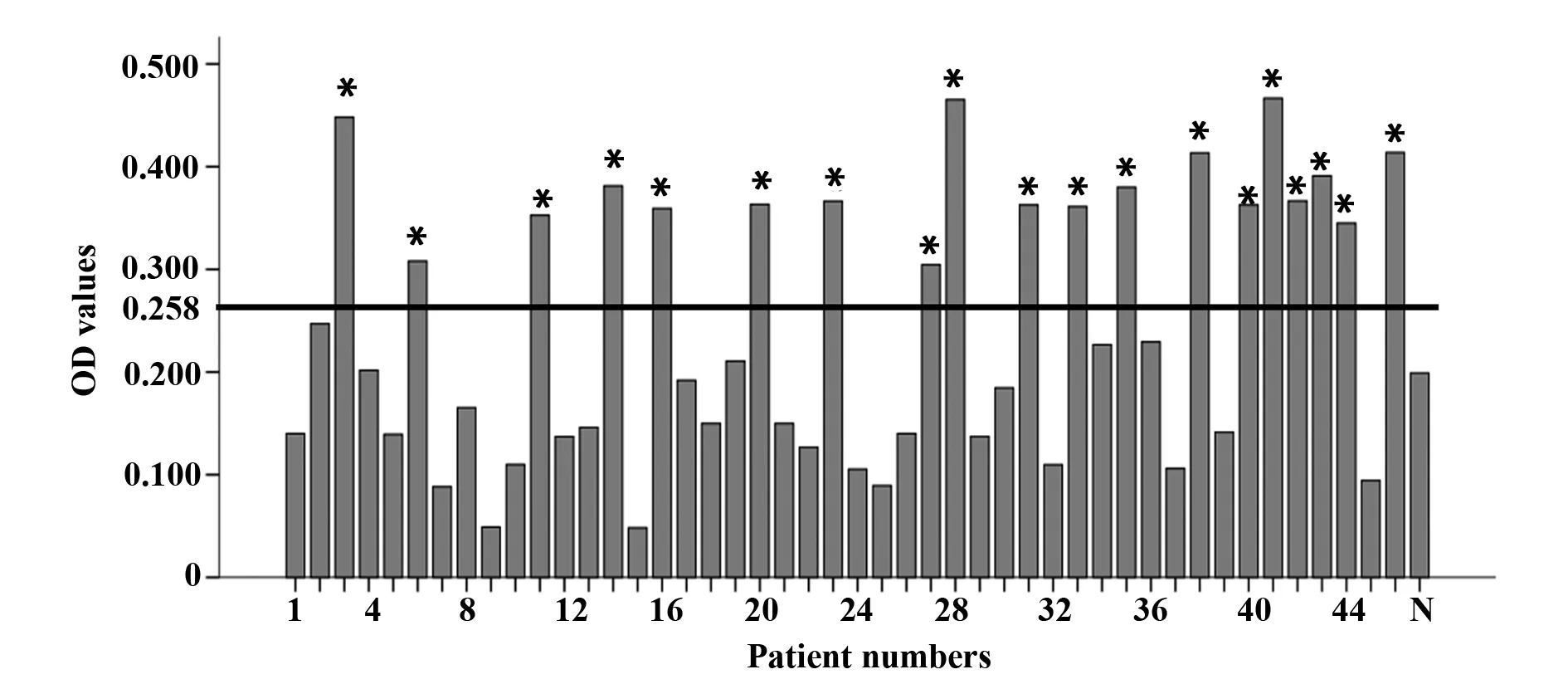
图4 纯化后的pET32a(+)-Der f 6原核表达产物IgE反应性Fig.4 IgE-binding reactivity of expressed products of pET32a(+)-Der f 6 in E.coli BL21 cellsNote: The cutoff ELISA value (mean ELISA value of healthy donors ±3SD,0.199+3×0.019=0.258) was indicated as a horizontal line.*.P<0.05.
3 讨论
我们在以前的实验中成功构建了质粒pMD19-T-Der f 6[6,7],测序结果表明Der f 6全长基因大小约840 bp,与本次实验PCR扩增出来的目的基因大小一致。采用生物信息学软件预测Der f 6全长cDNA编码蛋白质由279个氨基酸组成,相对分子质量为30 370.59 Da。本次实验将Der f 6全长cDNA与pET32a(+)连接,构建出的质粒转化E.coli BL21(DE3),用IPTG诱导表达获得成功,进一步鉴定其纯化产物,SDS-PAGE和Western blot显示出清晰的条带。因为pET32a空载体表达出来的蛋白质分子量约为21 kD,Der f 6前体蛋白30 kD,所以pET32a(+)-Der f 6表达产物应当在51 kD左右,与此次SDS-PAGE和Western blot显示出来的条带大小一致,说明本次实验成功获得了Der f 6的重组融合蛋白。
众所周知,尘螨是室内最重要的变应原来源物质之一。但是作为一种生物体,尘螨可以产生许多种蛋白质和其他的大分子物质。使用免疫印迹法和放射交叉免疫电泳等技术检测到尘螨粗提浸液中有30多条与过敏性哮喘患者血清IgE发生结合的条带,也就是说尘螨可能含有30多种变应原[8-10]。尘螨种类繁多,能够引起过敏反应的螨类主要隶属于羽螨总科(Analgoidea)的麦食螨科(Pyroglyphidae),也有食甜螨总科(Glycyphagoidea)和粉螨总科(Acaroidea)等储藏物螨类(Storage mites)[11,12]。来自不同螨种的同一组分变应原具有高度同源性,进化关系很近,具有相同的生物化学功能,如屋尘螨变应原第1组分Der p 1、粉尘螨变应原第1组分Der f 1和梅氏嗜霉螨变应原第1组分Eur m 1均为尘螨变应原第1组分。国际免疫学会联合会(The Inter-national Union of Immunological Societies,IUIS)下设过敏原命名数据库(nomenclature database,http://www.allergen.org/)已公布33组不同的螨类过敏原,其中第1、2组分为主要过敏原,可与50%以上螨粗提浸液阳性者血清IgE发生反应,因此被认为是尘螨变应原主要组分,受到国内外学者的重视,而对其余组分的研究报道较少[8-10]。我们在以前的研究成功构建了Der f 6的原核表达质粒pET28a (+)-Der f 6,转化E.coli BL21 细菌进行原核表达,取纯化产物与20例哮喘患儿血清进行ELISA,阳性结合率为45%[7]。本次实验,我们成功构建了原核表达质粒pET32a (+)-Der f 6,取纯化获得的原核表达产物与46例哮喘患儿血清进行ELISA,阳性结合率为41.3%。依次这两次ELISA实验结果,我们推测第6组分是引起尘螨过敏性哮喘的重要组分之一。
[1] Wen TH.Dermatophagoides farinae mite allergen and specific immunotherapy in Shanghai[J].Chin J Parasit Dis,2009,27(5):419-425.
[2] Valenta R,Niespodziana K,Focke-Tejkl M,etal.Recombinant allergens:what does the future hold?[J].J Allergy Clin Immunol,2011,127(4):860-864.
[3] Cromwell O,Häfner D,Nandy A.Recombinant allergens for specific immunotherapy[J].J Allergy Clin Imunol,2011,127(4):865-872.
[4] Valenta R,Linhart B,Swoboda I,etal.Recombinant allergens for allergen-specific immunotherapy:10 years anniversary of immunotherapy with recombinant allergens[J].Allergy,2011,66(6):775-783.
[5] Nicklas RA.National and international guidelines for the diagnosis and treatment of asthma[J].Curr Opin Pulm Med,1997,3(1):51-55.
[6] 崔玉宝,周 鹰,彭江龙,等.粉尘螨变应原第6组分全长cDNA克隆及生物信息学分析[J].中国免疫学杂志,2009,25(7):641-646.
[7] Cui YB,Zhou Y,Shi WH,etal.Molecular cloning,expression,sequence analyses of dust mite allergen Der f 6 and its ige-binding reactivity with mite allergic asthma patients in southeast China[J].Mol Biol Rep,2012,39(2):961-968.
[8] 杨 李,王运刚,崔玉宝.尘螨变应原免疫生物学研究进展[J].中国病原生物学杂志,2011,6(2):150-154.
[9] Saleh AM,Ali HA,Ahmed SA,etal.House dust mites:a risk factor to be considered for occupational safety or source of work-related allergens[J].J Egypt Soc Parasitol,2013,43(3):669-678.
[10] Fernández-Caldas E,Iraola Calvo V.Mite allergens[J].Curr Allergy Asthma R,2005,5(5):402-410.
[11] Cui YB,Cai HX,Zhou Y,etal.Cloning,expression and characterization of Der f 7,an allergen of Dermatiophagoides farinae from China[J].J Med Entomol,2010,47(5):868-876.
[12] Cui YB,Zhou Y,Wang YG,etal.The Group 10 Allergen of Dermatophagoides farinae (Acari:Pyroglyphidae):cDNA Cloning,Sequence Analysis,and Expression in E.coli BL21[J].J Med Entomol,2013,50(1):205-208.
[收稿2016-07-10 修回2016-08-25]
(编辑 张晓舟)
Construction of recombinant plasmids Der f 6/pET32a(+)and its expression,purification,IgE-binding reactivity
HANYu-Qing,YULi-Li,ZHOUYing,YANGLi,ZHANGCheng-Bo,CUIYu-Bao.
DepartmentofClinicalLaboratory,AffiliatedYanchengHospital,SchoolofMedicine,SoutheastUniversity,Yancheng224001,China
Objective:To obtain the prokaryotic expression product for the group 6 allergen of Dermatophagoides farine (Der f 6) and detect its IgE-binding rates with sera from asthmatic children.Methods: By enzyme digestion of pET28a(+)-Der f 6 with BamHⅠ plus XhoⅠ,the target gene Der f 6 was obtained and linked into the vector pET32a (+) to construct the recombinant plasmid pET32a(+)-Der f 6,which was then transfected into E.coli BL21 cells for expression,induced with isopropyl-β-D-thiogalactoside (IPTG),purified by affinity chromatography and identified by SDS-PAGE,Western blot and AMLDI-TOF,and tested by ELISA for IgE reactivity with sera from asthmatic children.Results: The plasmids pET32a(+)-Der f 6 were constructed,transformed into E.coli BL21 and expressed successfully.SDS-PAGE of the purification product showed a specific band,Western blot showed the successful binding between the purification product and the His-tag in the plasmids,and MALDI-TOF/TOF identified the identical structure to the allergen Der f 6.Using the ELISA method developed with the recombinant proteins as coating antigen,the positive rate was 41.3% (19/46) in asthmatic children allergic to dust mite.Conclusion: The plasmids pET32a (+)-Der f 6 were constructed successfully,expressed in E.coli BL 21 (DE3).The recombinant fusion protein has a good reactivity with sera from asthmatic children.
House dust mites;Allergen;Gene expression;Protein purification
10.3969/j.issn.1000-484X.2017.01.015
①本文为国家自然科学基金(NSFC30060166,NSFC81001330,NSFC31272369,NSFC31572319)。
韩玉清(1977年-),女,主管检验师,主要从事免疫学研究,E-mail:15189200700@163.com。
R384.4
A
1000-484X(2017)01-0076-05
②江苏盐城卫生职业技术学院,盐城224006。
③通讯作者,E-mail:ybcui1975@hotmail.com。