中药棕榈子质量控制方法研究Δ
2017-02-15杨彦坤白关亚郝旭亮
杨彦坤,王 珂,姚 静,杨 柳,白关亚,倪 艳,郝旭亮#
(1.山西中医学院中药学院,山西 太原030619; 2.山西省中医药研究院中药方剂研究所,山西 太原 030045)
·论 著·
中药棕榈子质量控制方法研究Δ
杨彦坤1*,王 珂1,姚 静2,杨 柳2,白关亚2,倪 艳2,郝旭亮2#
(1.山西中医学院中药学院,山西 太原030619; 2.山西省中医药研究院中药方剂研究所,山西 太原 030045)
目的:研究建立棕榈子药材的质量控制方法,提高其质量可控性。方法:采用对照药材为对照,进行棕榈子药材的薄层色谱鉴别;采用高效液相色谱法测定棕榈子药材中原儿茶酸含量,色谱柱为Hypersil Sino Chrom ODS-BP C18色谱柱(250 mm×4.6 mm,5 μm),流动相为乙腈-0.1%磷酸水溶液(V∶V=15 ∶85),流速0.8 ml/min,检测波长260 nm,柱温25 ℃,进样量10 μl。结果:薄层色谱图中,斑点清晰,分离度好。含量测定中,原儿茶酸进样量在0.025 8~0.309 6 μg范围内与其峰面积呈现良好的线性关系(r=0.999 7);精密度、稳定性、重复性试验的RSD分别为0.9%、1.6%、2.3%,均符合要求;平均加样回收率为97.4%,RSD为2.8%(n=9)。结论:本研究所建立的薄层色谱鉴别方法简便可行,含量测定方法快捷、准确、专属性强,可用于棕榈子药材的质量控制。
棕榈子; 质量标准; 薄层色谱; 原儿茶酸; 高效液相色谱
棕榈子,又称败棕子、棕榈笋,为棕榈科植物棕榈Trachyc-arpusfortunei(Hook.)H.Wendl.的成熟果实,始载于《本草纲目拾遗》[1]。其味苦、涩,性平,归肝、肺经,具收敛止血之功效,可用于吐血、尿血等症[2]。现代药理学研究结果表明,其具有止血、抗氧化、抗肿瘤等药理活性[3-6]。棕榈子多以单味或复方制剂广泛应用于临床,如血安胶囊(以棕榈子醇提物为原料)[7]、血尿片[8]及血尿胶囊(棕榈子、菝葜、薏苡仁组成)[9]等。但由于棕榈子质量层次不齐,不能保证制剂的质量及疗效。为了确保这些制剂的质量,原料棕榈子的质量控制至关重要,而棕榈子药材执行的标准为1992年版《中华人民共和国卫生部药材标准第一册》[2]和2003年版《贵州省中药材及民族药材质量标准》[10],质控项目单一,且鉴别方法专属性差,同时缺少含量测定项,质量控制方法可行性差,标准亟待提高。故本研究主要针对棕榈子药材专属性鉴别和含量测定进行相关研究,以期进一步完善提高该药材质量标准,保证相关制剂的质量。
1 材料
1.1 仪器
Agilent 1100型高效液相色谱仪(美国Agilent公司);LC-300B型数控超声波清洗仪(山东济宁鲁超超声设备有限公司,功率:300 W,频率:25 kHz);DV 215CD型电子分析天平(美国Ohaus公司);ZF1-I多功能紫外分析仪(上海嘉鹏有限公司)。
1.2 药品及试剂
原儿茶酸对照品(批号:110809-201205,99.9%,供含量测定用,购于中国食品药品检定研究院);棕榈子对照药材由山西省中医药研究院倪艳教授鉴定为棕榈Trachycarpusfortunei(Hook.)H.Wendl.的成熟果实;棕榈子药材(共3批,产地分别为湖北、芜湖,编号H1、H2、W1,购于安徽亳州)。甲醇、乙腈均为色谱纯,水为超纯水,其余为分析纯。
2 方法与结果
2.1 定性鉴别
取本品粉末1.0 g(过四号筛),加甲醇30 ml超声处理30 min,滤过,滤液蒸干,残渣加1 ml甲醇使其溶解作为供试品溶液。取棕榈子对照药材,按照供试品溶液的制备方法同法制备对照药材溶液。吸取上述2种溶液各10 μl,分别点于同一块硅胶G板,以环己烷-乙酸乙酯(V∶V=4 ∶1)为展开剂,展开,取出,晾干,置于波长365 nm的紫外光下观察,后喷以10%硫酸乙醇溶液,在105 ℃下加热至斑点显色清晰后置于波长365 nm的紫外光下观察,结果显示,供试品色谱中,与对照药材色谱上相应位置显相同的荧光斑点,见图1。
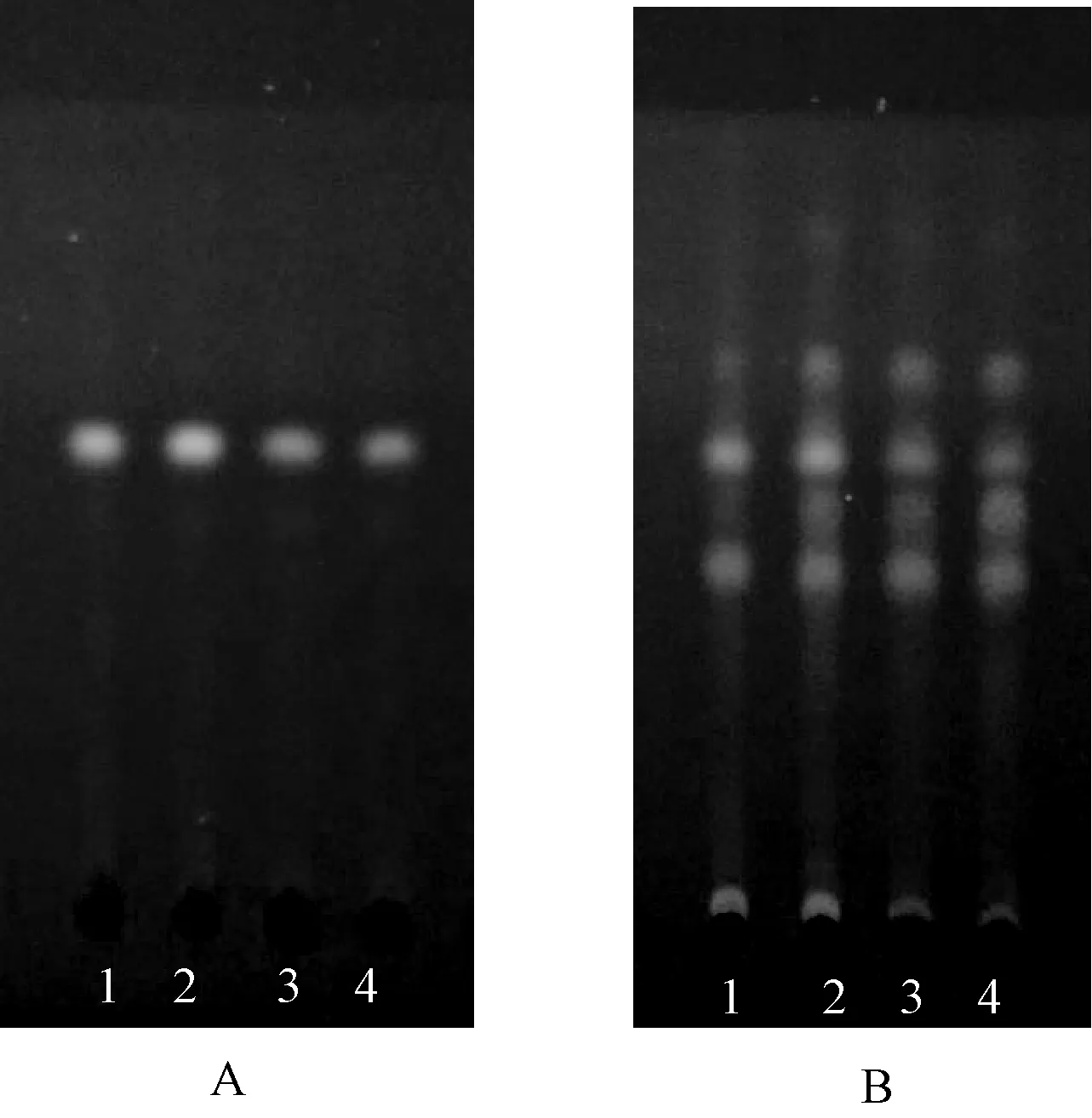
A.在波长365 nm的紫外光下检视;B.喷显色剂后在波长365 nm的紫外光下检视;1.棕榈子药材(W1);2.棕榈子对照药材;3.棕榈子药材(H1);4.棕榈子药材(H2)A.viewing under 365 nm UV;B.viewing under 365 nm UVafter spray reagent;1.Trachycarpus Fruit(W1);2.Trachycarpus Fruit control medicinal material;3.Trachycarpus Fruit(H1);4.Trachycarpus Fruit(H2)图1 棕榈子药材的薄层色谱图(温度25 ℃,相对湿度50%)Fig 1 TLC of Trachycarpus Fruit(T: 25 ℃,RH: 50%)
2.2 含量测定
2.2.1 色谱条件与系统适用性实验:色谱柱为Hypersil Sino Chrom ODS-BP C18色谱柱(250 mm×4.6 mm,5 μm);流动相为乙腈-0.1%磷酸水溶液(V∶V=15∶85);流速为0.8 ml/min;检测波长为260 nm;进样量为10 μl;柱温为25 ℃。在上述色谱条件下,理论塔板数以原儿茶酸峰计应不少于3 000,分离度>1.5,其余峰无干扰,结果见图2。
2.2.2 对照品溶液的制备:精密称取原儿茶酸对照品适量,置于10 ml容量瓶中,加甲醇溶解并定容,即得对照品溶液(质量浓度为0.025 8 mg/ml)。
2.2.3 供试品溶液的制备:取本品粉末(过四号筛)约1 g,精密称定,置于锥形瓶中,精密加入甲醇20 ml,称定质量,超声提取30 min,放冷,补足质量,摇匀,滤过,取续滤液即可。
2.2.4 线性关系考察:分别精密吸取“2.2.2”项下原儿茶酸对照品溶液1、2、5、8、10、12 μl,按“2.2.1”项下色谱条件进样测定,记录峰面积,以原儿茶酸质量(X,进样量,μg)为横坐标、峰面积(Y)为纵坐标,进行线性回归,得回归方程为Y=5 084X+13.01(r=0.999 6)。结果显示,原儿茶酸进样量在0.025 8~0.309 6 μg之间,质量与峰面积关系良好。
2.2.5 精密度试验:取“2.2.3”项下供试品(编号为W1)溶液适量,按“2.2.1”项下色谱条件连续进样6次,记录峰面积。结果显示,原儿茶酸峰面积的RSD为0.9%(n=6),表明仪器精密度良好。
2.2.6 重复性试验:精密称取样品(编号为W1)适量,按照“2.2.3”项下方法制备供试品溶液,共6份,按照“2.2.1”项下色谱条件进行测定,记录峰面积。结果显示,原儿茶酸峰面积的RSD为2.3%(n=6),表明本方法的重复性良好。
2.2.7 稳定性试验:取“2.2.3”项下供试品(编号为W1)溶液适量,分别放置0、2、4、6、8、10、12、24 h进样测定,记录峰面积。结果显示,原儿茶酸峰面积的RSD为1.6%,表明供试品溶液在24 h内基本稳定。
2.2.8 加样回收率试验:取样品(编号为W1)适量,共9份,分别加入高、中、低质量的原儿茶酸对照品,按“2.2.3”项下方法制备供试品溶液,再按“2.2.1”项下色谱条件进行测定,计算样品含量,并计算加样回收率,结果见表1。
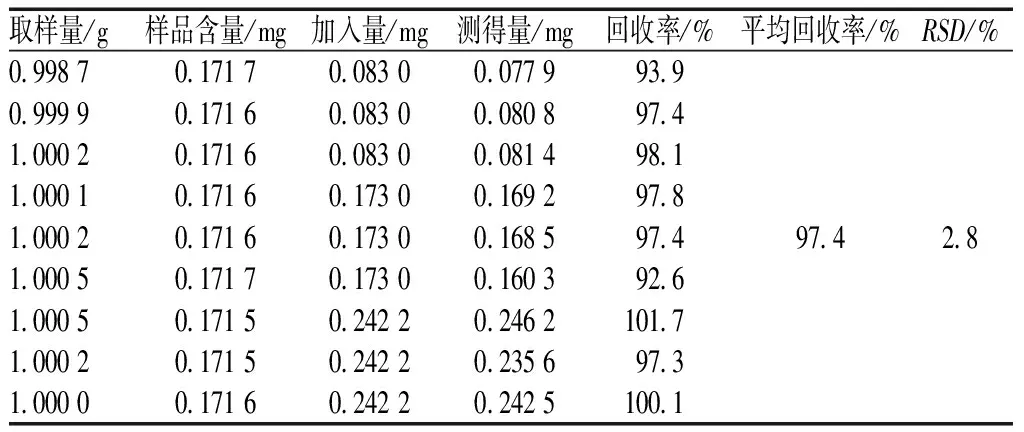
表1 加样回收率试验结果(n=9)
2.2.9 样品含量测定:取3批样品各适量,分别按“2.2.3”项下方法制成供试品溶液,再按“2.2.1”项下色谱条件进行测定,计算样品含量,结果见表2,由此可知不同产地棕榈子中原儿茶酸含量的差异较大。

A.对照品;B.供试品;C.空白对照;1.原儿茶酸A.reference substance; B.test samples; C.black control;1.protocatechuic acid图2 高效液相色谱图Fig 2 HPLC chromatography

样品编号原儿茶酸含量/(mg/g)H100566H200585W101650
3 讨论
棕榈子主要含有多元酚类、缩合鞣质类、有机酸类、固醇类及棕榈蜡、甘露聚糖等成分[5-8]。在建立棕榈子药材薄层色谱鉴别方法时,选择其对照药材作为对照,不仅专属性强,而且能够多成分全面反映其质量。此外,在观察斑点时发现,展开后不经显色直接在波长365 nm的紫外光下观察,其斑点较少,而喷洒显色剂加热后,其荧光斑点增多且清晰,最终确定用10%硫酸乙醇显色加热后在波长365 nm的紫外光下观察,斑点清晰可见。
原儿茶酸是一种重要的天然活性物质,为棕榈子药材有机酸类成分的代表,现代药理学研究表明,其具有抗炎、抗氧化、抗肿瘤、抗血小板聚集、降低血糖、降低心肌耗氧量等多方面药理活性[11-12],与棕榈子抗肿瘤、抗氧化等药理作用密切相关[3,5],故选择该成分作为棕榈子含量测定的指标。此外,采用高效液相色谱法测定原儿茶酸含量的方法较为成熟,已有大量相关文献报道[13-16]。故本研究在此基础上选择采用高效液相色谱法测定棕榈子药材中原儿茶酸含量。实验过程中考察了流速、流动相等色谱条件,最终选择以260 nm为最佳吸收波长,流速为0.8 ml/min,流动相为乙腈-0.1%磷酸水(V∶V=15 ∶85),所得色谱图中峰形较好、分离度高,且无阴性干扰。
综上所述,本研究围绕棕榈子的质量控制,分别从薄层色谱鉴别和含量测定2个方面进行研究,充分结合中药多成分特点,既鉴别了棕榈子极性较小的成分,又定量控制了极性较大的成分。通过方法的研究及系统方法学考察,所建立的质量控制方法简便快捷、合理可行、专属性强,为提高棕榈子药材标准、增加其质量可控性、保证相关制剂及临床用棕榈子药材质量提供了依据。
[1]周晖,陈小会,章亮,等.棕榈子药效部位体内抗肿瘤研究[J].海峡药学,2013,25(4):269-271.
[2]卫生部.关于颁布第一批中药材《中华人民共和国卫生部药品标准》的通知[S].卫药发〔1992〕第9号.1992-02-25.
[3]陈小会,周云凯,蒋福升,等.棕榈子提取物抗肿瘤活性研究[J].海峡药学,2012,24(6):265-267.
[4]谭新武.水龙、棕榈花的化学成分与药理活性研究[D].南宁:广西中医药大学,2009.
[5]王锐,王绪英.棕榈果实的总黄酮含量及其抗氧化活性[J].贵州农业科学,2014,42(9):59-61.
[6]王觐,薛长勇,刘英华,等.棕榈叶中黄酮类化合物的提取工艺研究[J].时珍国医国药,2008,19(3):659-660.
[7]黄花红.反相高效液相色谱法测定血安胶囊中没食子酸含量[J].中国药业,2015,24(7):51-52.
[8]张涛,王兴海,袁武会.血尿片质量控制的研究[J].现代中医药,2011,31(3):61-62.
[9]赵志军,刘铁钢.血尿胶囊薄层鉴别及原儿茶酸含量测定方法的研究[J].中成药,2006,28(4):604-606.
[10] 贵州省药品监督管理局.贵州省中药材、民族药材质量标准[S].2003年版.贵阳:贵州科技出版社,2003:363.
[11] 尹雪,苏新云,王秀华,等.原儿茶酸对帕金森病模型小鼠中脑和纹状体D2DR、iNOS和TH表达的影响[J].中草药,2015,46(6):866-870.
[12] 魏苗苗.原儿茶酸对过敏性哮喘模型小鼠的保护作用及相关机制的研究[D].长春:吉林大学,2013.
[13] 赵立春,刘琦,王佳菲,等.HPLC测定扶芳藤中原儿茶酸的含量[J].中国实验方剂学杂志,2014,20(16):83-85.
[14] 刘海涛,雷鹏,刘英慧,等.双波长HPLC法同时测定败酱草中原儿茶酸、绿原酸及咖啡酸的含量[J].药物分析杂志,2013,33(4):611-615.
[15] 朱粉霞,贾晓斌,李秀峰,等.UPLC法同时测定胆木注射液中原儿茶酸、新绿原酸、绿原酸和隐绿原酸[J].中草药,2013,44(5):571-573.
[16] 张琳,汪轩,邢婧,等.HPLC-DAD同时测定左归丸药液中没食子酸、原儿茶酸、绿原酸、马钱苷、阿魏酸含量[J].药物分析杂志,2016,36(8):1364-1369.
Study on Quality Standard ofTrachycarpusFruitΔ
YANG Yankun1, WANG Ke1, YAO Jing2,YANG Liu2,BAI Guanya2, NI Yan2, HAO Xuliang2
(1.School of Chinese Materia Medica, Shanxi University of Traditional Chinese Medicine, Shanxi Taiyuan 030619, China; 2.Institute of Chinese Medicinal Formulae, Traditional Chinese Medicine Institute of Shanxi Province, Shanxi Taiyuan 030045, China)
OBJECTIVE:To study and establish the quality standard method ofTrachycarpusFruit, and improve its quality control. METHODS: The control medicinal materials were adopted for TLC identification ofTrachycarpusFruitand HPLC was conducted to determine the contents of protocatechuic acid ofTrachycarpusFruit. The column was Hypersil Sino Chrom ODS-BP C18(250 mm×4.6 mm,5 μm), with mobile phase of acetonitrile-0.1% phosphoric acid water(V∶V=15 ∶85), flow rate of 0.8 ml/min, detection wavelength of 260 nm, column temperature of 25 ℃ and injection volume of 10 μl. RESULTS: TLC showed clear spots and good separation. The linear range of protocatechuic acid was 0.025 8 μg-0.309 6 μg(r=0.999 7). TheRSDvalues of precision, stability, reproducibility were 0.9%, 1.6% and 2.3% conformed to the requirements. The average recovery rate was 97.4% withRSDof 2.8%(n=9). CONCLUSIONS: The TLC identification method is simple and feasible, the method of content determination is rapid, accurate, specific and can be used in the quality control ofTachycarpusFruit.
TrachycarpusFruit; Quality standard; TLC; Protocatechuic acid; HPLC
山西省科技攻关项目(山西省中药现代化关键技术研究振东专项)(No.2014ZD0203)
R917
A
1672-2124(2017)01-0018-04
2016-11-01)
*硕士研究生。研究方向:中药学。E-mail:792029497@qq.com
#通信作者:副主任药师,博士,硕士生导师。研究方向:中药作用物质基础及作用机制。E-mail:hxliang-01@163.com
DOI 10.14009/j.issn.1672-2124.2017.01.016
