单唾液酸四己糖神经节苷脂联合头部亚低温治疗对新生儿缺氧缺血性脑病的疗效观察
2017-02-14陈茜娜徐棉林振浪黄雨茅金伟敏
陈茜娜 徐棉 林振浪 黄雨茅 金伟敏
单唾液酸四己糖神经节苷脂联合头部亚低温治疗对新生儿缺氧缺血性脑病的疗效观察
陈茜娜 徐棉 林振浪 黄雨茅 金伟敏
目的探讨单唾液酸四己糖神经节苷脂(GM1)联合头部亚低温治疗对新生儿缺氧缺血性脑病(HIE)的疗效。方法将87例中重度HIE患儿采用抽签法随机分为常规治疗组30例、亚低温治疗组27例和GM1联合亚低温治疗组30例,3组患儿分别在出生6h内予以常规对症支持治疗、加用头部亚低温治疗及GM1联合亚低温治疗,观察3组患儿的临床治疗有效率。患儿出生后1~3d、4~6d、7~10d进行新生儿行为神经评分(NBNA)测定。治疗7d后抽血检测亚硝酸盐(NO2-)、硝基酪氨酸(NT)及超氧化物歧化酶(SOD)浓度。结果GM1联合亚低温治疗组治疗总体有效率(73.3%)明显高于常规治疗组(53.3%)和亚低温治疗组(55.5%)(P<0.01)。3组患儿出生后1~3d NBNA评分比较差异无统计学意义(P>0.05),GM1联合亚低温治疗组出生后4~6d和7~10d NBNA评分明显高于常规治疗组及亚低温治疗组(均P<0.05)。与常规治疗组比较,GM1联合亚低温治疗组患儿血浆NO2-、NT水平明显下降,而SOD水平明显升高(均P<0.05)。结论GM1联合亚低温治疗可以通过降低脂质过氧化和氮化应激反应,增强抗氧化酶活性,促进HIE患儿神经功能恢复。
单唾液酸四己糖神经节苷脂头部亚低温缺氧缺血性脑病
新生儿缺氧缺血性脑病(hypoxie-ischemic encephalopathy,HIE)是由于围生期窒息导致脑缺氧缺血性损害,是导致新生儿死亡和慢性中枢神经系统损害的重要原因之一。中重度HIE严重影响脑功能和智力发育。目前,国际上对于HIE并没有确切的治疗措施,临床上常采用对症支持治疗和头部亚低温治疗轻中度HIE[1-2]。单唾液酸四己糖神经节苷脂(GM1)是哺乳动物脑内富含的一类酸性鞘糖脂类物质,是最重要的神经节苷脂之一,对神经元的生长、分化、再生和轴浆转运起重要作用[3]。由于头部亚低温治疗HIE受到时间窗、产儿是否足月等限制[4],笔者对87例中重度HIE新生儿分别进行常规对症支持治疗、加用头部亚低温治疗和GM1联合头部亚低温治疗,并进行了比较研究,现将结果报道如下。
1 对象和方法
1.1 对象2013年1月至2016年1月温州市中心医院收治的中重度HIE患儿87例,采用抽签法随机分成常规治疗组、亚低温治疗组和GM1联合亚低温治疗组。诊断标准依据早期生物标志物和《实用新生儿学》新生儿HIE诊断标准[5]。常规治疗组30例,男19例,女11例;亚低温治疗组27例,男15例,女12例;GM1联合
亚低温治疗组30例,男17例,女13例;3组患儿性别、胎龄、日龄、5min Apgar评分、出生体重及窒息程度(窒息评分标准参考文献[6])比较,差异均无统计学意义(均P>0.05),见表1。本研究经医院伦理委员会批准和患儿家属知情同意。
1.2 治疗方法常规治疗组患儿给予对症支持治疗,包括维持适当的通气和氧和,以维持血气。pH值和血糖在正常范围内。及时控制脑水肿和惊厥,降低颅内高压和对症应用脑内激活剂。3组患儿均在出生后6h内接受常规对症治疗,亚低温治疗组同时进行选择性头部亚低温治疗;GM1联合亚低温治疗组同时进行选择性头部亚低温治疗及GM1静脉滴注(20mg溶于10%葡萄糖注射液20ml中,1次/d)。3组患儿的治疗均以7~10d为1个疗程,共治疗2~3个疗程。

表1 3组患儿基本情况比较
1.3 标本采集和检测患儿入院24h内及药物治疗7d后,晨起空腹抽静脉血,加入抗凝剂肝素,静置10min,3 000r/min离心10min,取上清血浆,-80℃冰箱保存。采用黄嘌呤氧化酶法测定血浆SOD浓度(A001-1,南京建成生物研究所),气象化学发光法监测血浆中释放的NO以检测NO代谢产物NO2-(亚硝酸盐)水平[7-8],采用比色法检测血浆硝基酪氨酸(NT)水平(MAK219-1KT,美国西格玛奥德里奇生物公司)。
1.4 疗效评定由专人每天检查患儿的生命体征、意识状态、原始反射、肌张力、前囟张力和惊厥发作,并在患儿出生后1~3d、4~6d及7~10d分别进行新生儿行为神经评分(NBNA)检测。治疗5d内NBNA评分≥38分,意识转清、呼吸平稳、原始反射引出、肌张力恢复正常、惊厥减轻或停止为显效。NBNA评分36~<38分,意识转清、呼吸平稳、原始反射部分引出、肌张力改善、惊厥减轻为有效。各项指标均无明显好转,且NBNA评分2次<36分、死亡或放弃治疗视为无效。所有HIE患儿在治疗7d后均行头部MRI检查,对治疗有效的但头部MRI显示有中重度脑损伤患儿进行出院后的随访。
1.5 统计学处理应用SPSS 19.0统计软件。计量资料以表示,多组间比较采用方差分析,两两比较采用LSD-t检验;计数资料组间比较采用χ2检验。
2 结果
2.1 3组患儿临床疗效比较常规治疗组总体有效率53.3%,亚低温治疗组总体有效率55.5%,GM1联合亚低温治疗组总体有效率73.3%,3组总体有效率比较差异有统计学意义(χ2=17.89,P<0.01),见表2。
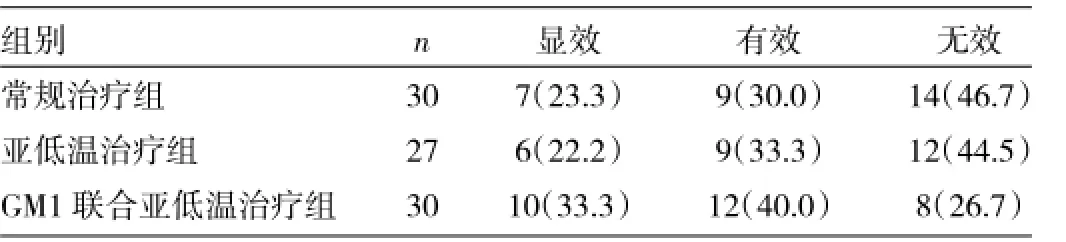
表2 3组患儿临床疗效比较[例(%)]
2.2 3组患儿NBNA评分3组患儿出生后1~3d NBNA评分比较差异无统计学意义(P>0.05)。3组患儿出生后4~6d、7~10d NBNA评分比较差异均有统计学意义(均P<0.05),两两比较显示4~6d、7~10d GM1联合亚低温治疗组NBNA评分明显高于常规治疗组和亚低温治疗组(均P<0.05),见表3。
2.3 3组患儿治疗前后血浆SOD、NO2-、NT水平比较治疗后,3组患儿SOD、NO2-、NT总体比较差异均有统计学意义(均P<0.01)。两两比较显示,与常规治疗组比较,GM1联合亚低温治疗组治疗后血浆NO2-和NT水平明显下降(均P<0.05),血浆SOD水平明显升高(P<0.05),见表4。

表3 3组患儿NBNA评分比较
3 讨论
HIE是新生儿常见的中枢神经系统疾病之一,中重度HIE存活患儿多遗留脑瘫、智力障碍和癫痫等神经系统后遗症。大量流行病学、基础研究发现,兴奋性氨基酸毒性、细胞内钙离子聚集、谷氨酸受体激活、钙离子介导的活性氧(ROS)和氮化应激均参与了HIE的发生[9]。研究发现轻中度HIE的足月产儿在出生后6h给予亚低温治疗可以显著降低18月龄时的病死率和神经功能损伤[1-2]。但是亚低温治疗无法有效改善中重度早产HIE患儿的脑损伤。接受亚低温治疗后,仍有超过40%的中重度HIE新生儿出现严重残疾,表现为脑性瘫痪、智力损害和癫痫,亚低温治疗狭窄的时间窗也限制了它的应用[10]。因此选择何种治疗方案一直是临床关心的问题。GM1是一类鞘糖脂,广泛存在于脊椎动物的细胞膜中,其在神经系统中的含量尤为丰富,在离子转运、神经元的生长分化和分泌中起着极其重要的作用[3]。Schnaar等[11]首次发现GM1可以增加猫去神经后瞬膜作用,从而可以治疗周围神经系统萎缩性病变。此后GM1被作为一种治疗神经退行性病变的药物广为研究。外源性GM1以及临床上常用的GM1衍生物可通过血脑屏障,嵌入细胞膜,促进损伤神经元再生、维持细胞内外离子平衡、防止细胞内钙离子聚集、抑制氧自由基。研究发现GM1可增加内源性神经营养因子(NTs)的释放,激活Trk受体,从而促进受损神经元的修复和再生[11-12]。同时GM1还可以减少兴奋性氨基酸引发的神经毒性,增加受损脑组织血流量,加强神经重构。新生儿血脑屏障发育不完善,因此外源性的GM1更易通过血脑屏障发挥生物学效应[6]。Zhu等[8]的临床试验显示GM1合并促红细胞生成素可显著改善HIE新生儿的病死率和致残率。笔者发现GM1联合头部亚低温治疗组患儿治疗后临床症状和体征明显优于常规治疗组和低温治疗组,总体有效率73.3%,提示GM1联合亚低温治疗可以显著减轻HIE患儿急性神经系统症状。
NBNA评分可以全面评价新生儿各种原始反射、主被动运动能力和各种行为能力,常用于新生儿疾病的监测与评价[13]。本研究结果显示常规治疗组、亚低温治疗组与GM1联合亚低温治疗组出生后1~3d NBNA评分无明显差异,出生后4~6d、7~10d NBNA评分明显高于常规治疗组和亚低温治疗组,表明GM1联合亚低温治疗可以有效改善HIE患儿神经功能恢复,逆转脑缺氧缺血造成的中枢神经系统损害的病理生理过程。
钙离子介导的氧化应激和氮化应激在HIE的发生、发展中具有重要作用,过度激活的ROS与细胞膜的脂质交互作用,引起脂质过氧化,导致细胞膜的脂质成分分解成极其不稳定的脂肪醛,这些脂肪醛可以结合和修饰蛋白,生成细胞毒性物质,体内ROS生成同时可使SOD活性下降,进一步导致脂质过氧化和细胞损伤[14]。氮化应激是由于小神经胶质细胞释放过量的NO与超氧阴离子作用生成的氧化亚硝酸盐,氧化亚硝酸盐可氧化含有酪氨酸蛋白质的巯基,生成硝基酪氨酸[8]。检测样本中硝基酪氨酸的含量是氮化应激的生物学标志之一[15]。本研究发现GM1联合亚低温治疗组治疗7d后血浆NT和NO2-水平明显低于常规治疗组和亚低温治疗组,SOD水平则明显升高,说明GM1联合亚低温可减少氮化应激、氧自由基产生和脂质过氧化造成的神经毒性和神经损伤,增强SOD活性,促进受损神经元功能恢复,有效保护神经元。笔者在该临床研究中
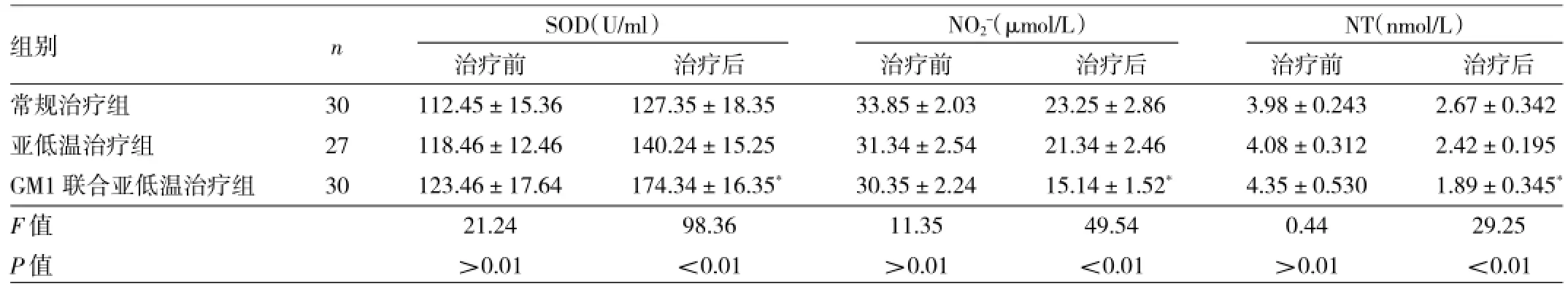
表4 3组患儿治疗前后SOD、NO2-、NT比较
并未发现精神运动兴奋性增高或皮疹反应等,因此GM1联合亚低温治疗可作为治疗HIE的有效策略在临床推广。
[1]Shankaran S,Laptook A R,Pappas A,et al.Effect of depth and duration of cooling on deaths in the NICU among neonates with hypoxic ischemic encephalopathy:a randomized clinical trial[J].JAMA,2014,312(24):2629-2639.doi:10.1001/jama.2014.16058.[2]Shankaran S.Therapeutic hypothermia for neonatal encephalopathy[J].Curr Opin Pediatr,2015,27(2):152-157.
[3]Ledeen R W,Wu G.The multi-tasked life of GM1 ganglioside,a true factotum of nature[J].Trends Biochem Sci,2015,40(7): 407-418.doi:10.1016/j.tibs.2015.04.005.
[4]Douglas-Escobar M,Weiss M D.Hypoxic-ischemic encephalopathy:a review for the clinician[J].JAMA Pediatr,2015,169(4): 397-403.doi:10.1001/jamapediatrics.2014.3269.
[5]孟卫霞,钱燕.高氧与新生儿脑损伤[J].浙江医学,2007,29(5):506-520.
[6]林峰,李桦,王春霄,等.新生儿窒息综合评分的临床研究[J].实用儿科临床杂志,1997,12(4):220-222.
[7]Gudino-Cabrera G,Urena-Guerrero M E,Rivera-Cervantes M C, et al.Excitotoxicity triggered by neonatal monosodium glutamate treatment and blood-brain barrier function[J].Arch Med Res, 2014,45(8):653-659.doi:10.1016/j.arcmed.2014.11.014.
[8]Zhu X Y,Ye M Y,Zhang A M,et al.Influence of one-year neurologic outcome of treatment on newborns with moderate and severe hypoxic-ischemic encephalopathy by rhuEP0 combined with ganglioside(GM1)[J].Eur Rev Med Pharmacol Sci,2015,19 (20):3955-3960.
[9]Bennet L,Booth L,Gunn A J.Potential biomarkers for hypoxic-ischemic encephalopathy[J].Semin Fetal Neonatal Med,2010,15 (5):253-260.
[10]Li Y,Gonzalez P,Zhang L,et al.Fetal stress and programming of hypoxic/ischemic-sensitive phenotype in the neonatal brain: mechanisms and possible interventions[J].Prog Neurobiol,2012, 98(2):145-165.doi:10.1016/j.pneurobio.2012.05.010.
[11]Schnaar R L,Gerardy-Schahn R,Hildebrandt H.Sialic acids in the brain:gangliosides and polysialic acid in nervous system development,stability,disease,and regeneration[J].Physiol Rev,2014,94(2):461-518.doi:10.1152/physrev.00033.2013.
[12]李豪侠.神经节苷酯GM1联合多奈哌齐治疗血管性痴呆临床观察[J].浙江医学,2007,29(7):765-767.
[13]Yu X D,Yan C H,Shen X M,et al.Prenatal exposure to multiple toxic heavy metals and neonatal neurobehavioral development in Shanghai,China[J].Neurotoxicol Teratol,2011,33(4):437-443.doi:10.1016/j.ntt.2011.05.010.
[14]Zhang J,Wang X,Vikash V,et al.ROS and ROS-Mediated Cellular Signaling[J].Oxid Med Cell Longev,2016,2016:4350965.doi: 10.1155/2016/4350965.
[15]Teixeira D,Fernandes R,Prudencio C,et al.3-Nitrotyrosine quantification methods:Current concepts and future challenges [J].Biochimie,2016,125:1-11.doi:10.1016/j.biochi.2016.02.011.
Monosialotetrahxosy1 ganglioside combined with head mild hypothermia for neonatal hypoxic-ischemic encephalopathy
ObjectiveTo evaluate the efficacy of monosialotetrahxosy1 ganglioside(GM1)combined with head mild hypothermia in treatment of neonatal hypoxic-ischemic encephalopathy(HIE).MethodsEighty seven newborns with moderate to severe HIE were randomly assigned into three groups to receive routine treatment(n=30),hypothermia treatments(n=27)or GM1 combined with hypothermia treatments(n=30).All patients received treatment within 6h after birth.Neonatal behavioral neurological assessment(NBNA)were conducted at postnatal age 1-3d,4-6d and 7-10d.The concentration of nitrite(NO2-), nitrotyrosine(NT)and superoxide dismutase(SOD)levels in plasma were assessed 7 days after treatment.ResultsThe overall efficacy in GM1 combined with hypothermia group(73.3%)was significantly higher than that in hypothermia(55.5%)and routine treatment(53.3%)group(P<0.01).No significant difference of NBNA scores at postnatal age 1-3d was observed among three groups(P>0.05).NBNA scores at 4-6 days and 7-10 days after birth in GM1 combined with hypothermia group were higher than those in routine and hypothermia treatment groups(all P<0.05).The level of NO2-and NT in GM1 combined with hypothermia group were lower and the level of SOD was higher than those in routine treatment group(all P<0.05).ConclusionGM1 combined with head mild hypothermia can effectively treat neonatal hypoxic-ischemic encephalopathy,which may be associated with the attenuation of nitrosative stress and lipid peroxidation by enhancing the activity of anti-oxidation enzyme.
GM1Head mild hypothermiaHypoxic-ischemic encephalopathy
2016-03-31)
(本文编辑:陈丽)
325000温州医科大学附属定理临床学院(陈茜娜,系在职研究生,现在温州市中心医院新生儿科工作);温州市中心医院新生儿科(徐棉);温州医科大学附属第二医院新生儿科(林振浪);瑞安市人民医院新生儿科(黄雨茅、金伟敏)
林振浪,E-mail:two66@21cn.com
