NLRP3炎症小体通路在慢性阻塞性肺病发展中的作用研究
2017-02-14王师王华英翁跃颂兰朋训姜昊俞万钧应可净
王师 王华英 翁跃颂 兰朋训 姜昊俞 万钧应 可净
NLRP3炎症小体通路在慢性阻塞性肺病发展中的作用研究
王师 王华英 翁跃颂 兰朋训 姜昊俞 万钧应 可净
目的探讨平常固有免疫中核苷酸结合寡聚化结构域样受体蛋白3(NLRP3)炎症小体通路在慢性阻塞性肺病(COPD)发展中的作用。方法选取94例COPD患者为研究对象,中度、重度、极重度分别31、33和30例。采集急性加重期和稳定期的外周血标本,采用荧光定量PCR检测外周血NLRP3、接头蛋白凋亡相关点样蛋白(ASC)、半胱天冬酶1(Caspase-1)、IL-1β、IL-18 mRNA表达水平,采用ELISA法测定血清细胞因子IL-1β、IL-18浓度;并在稳定期测定肺功能,分析稳定期外周血炎症小体成分及下游分子mRNA表达水平与肺功能指标的相关性。结果不论是稳定期或急性加重期,重度、极重度组外周血NLRP3、ASC、Caspase-1、IL-1β、IL-18 mRNA表达水平均明显高于中度组(均P<0.05),极重度组又明显高于重度组(均P<0.05);与稳定期比较,3组患者急性加重期均明显升高(均P<0.05)。不论是稳定期或急性加重期,重度、极重度组血清IL-1β、IL-18浓度均明显高于中度组(均P<0.05),极重度组又明显高于重度组(均P<0.05);与稳定期比较,3组患者急性加重期均明显升高(均P<0.05)。稳定期COPD患者外周血炎症小体成分及下游分子mRNA表达水平与FEV1占预计值、FEV1/FVC均呈负相关(均P<0.01)。结论NLRP3炎症小体通路可能参与COPD反复急性加重、肺功能进行性下降的过程,与COPD进展密切相关。
慢性阻塞性肺病炎症小体核苷酸结合寡聚化结构域样受体蛋白3接头蛋白凋亡相关点样蛋白半胱天冬酶1肺功能
慢性阻塞性肺病(COPD)是一种以不完全可逆的气流受限为特征的慢性气道炎症性疾病,患者存在进行性肺功能下降,并伴有肺组织对有毒颗粒或气体异常炎症反应。吸烟、感染、物理因素、化学因素、天气等与机体的免疫系统相互作用,可导致持续的慢性气道炎症,引起气道狭窄及不完全阻塞,肺组织弹性降低,支气管软骨被破坏,导致通气下降。其中慢性气道炎症反应是COPD发生发展的核心环节。“炎症小体”是由细胞内多种蛋白在内源性或外源性应激作用下组装形成的复合体[1]。目前报道通过形成炎症小体发挥功能的分子主要有4个,即平常固有免疫中核苷酸结合寡聚化结构域样受体蛋白1(NLRP1)、NLRP3、IPAF和黑素瘤缺乏因子2(AIM2)。其中的NLRP3炎症小体能被细菌、病毒等病原体激活,也能被体内自身产生的“危险信号”激活,是当前研究的热点。NLRP3可与接头蛋白凋亡相关点样蛋白(ASC)、半胱天冬酶1(Caspase-1)相互结合形成炎症小体,并对Caspase-1进行自身激活,最终使IL-1β、IL-18成熟与分泌,成熟的IL-1β和IL-18释放到细胞外会产生促炎作用[2]。NLRP3炎症小体可能在COPD发生、发展中发挥着重要作用。故本文以COPD患者为对象,检测并比较急性加重期与稳定期外周血炎症小体成分及下游分子mRNA表达水平,以及血清相关细胞因子IL-1β、IL-18浓度,以探讨NLRP3炎症小体通路在COPD发展中的作用。
1 对象和方法
1.1 对象选择2013年1月至2015年12月鄞州人民医院门诊和住院的94例COPD患者为研究对象,COPD符合中华医学会呼吸病学分会制定的诊断标准[3]。入选标准:(1)确诊为COPD全球策略Ⅱ期[中度,第1秒用力呼气容积占预计值百分比(FEV1占预计值)<80%且≥50%、第1秒用力呼气容积占肺活量比例(FEV1/FVC)≤70%]、Ⅲ期(重度,FEV1占预计值<50%且≥30%、FEV1/FVC≤70%)、Ⅳ期(极重度,FEV1占预计值<30%、FEV1/FVC≤70%);(2)沙丁胺醇支气管扩张试验阴性(改善率<15%、FEV1增加绝对值<0.2L);(3)能配合完成肺功能检查并签署知情同意书。排除标准:(1)合并其他肺部疾病(支气管扩张、肺纤维化、肺结核等);(2)合并支气管哮喘;(3)合并自身免疫性疾病;(4)心力衰竭。所有患者接受吸入型糖皮质激素+长效β受体激动剂(沙美特罗/氟替卡松粉吸入剂或布地奈德福莫特罗粉吸入剂)治疗。本研究经医院医学伦理委员会讨论并通过。中度、重度、极重度COPD患者年龄、性别、BIM、吸烟史等一般资料比较,差异均无统计学意义(均P>0.05),见表1。
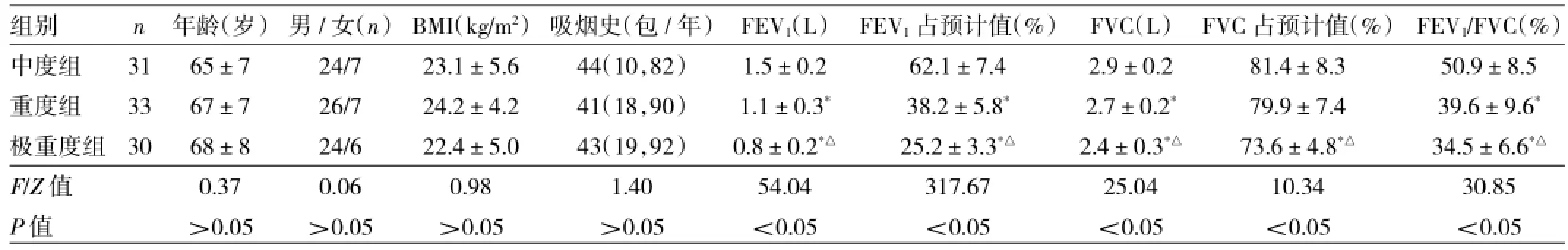
表1 中度、重度、极重度COPD患者临床资料比较
1.2 方法采集COPD患者急性加重期、稳定期的血液标本(抗凝血、不抗凝血各1份),并在稳定期进行肺功能检查。
1.2.1 主要材料、试剂和仪器设备荧光定量PCR所需试剂购自美国Invitrogen公司,所需引物由上海生工生物公司合成;ELISA试剂盒(IL-1β、IL-6、IL-17A、TGF-β、IL-10)购自美国eBiosicene/Bender公司;荧光定量PCR仪购自美国Applied Biosystems公司(ABI 7500 Sequence Detection System);酶标仪680购自美国BIO-RAD公司;低温高速离心机D-37520购自德国Legend RT公司。
1.2.2 实时荧光定量PCR检测转录因子用Trizol法提取外周血总RNA,取等量RNA进行逆转录为总DNA,以GAPDH作为内参照,采用实时荧光定量PCR法检测外周血炎症小体成分NLRP3、ASC、Caspase-1以及下游分子IL-1β、IL-18 mRNA表达水平。反应条件:50°C 2min预变性,按95°C 2min、95°C 15s、60°C 30s顺序做40个循环,最后72℃5min延伸。结果用NLRP3、ASC、Caspase-1、IL-1β、IL-18对GAPDH的校正CT值表示。PCR引物序列[4-5]见表2。

表2 PCR引物序列
1.2.3 细胞因子测定采用ELISA法检测患者血清中IL-1β、IL-18浓度,实验步骤按试剂盒说明书进行。
1.3 统计学处理应用SPSS 17.0统计软件。计量资料若不满足正态分布,用M(P25,P75)表示,多组间比较采用秩和检验;若满足正态分布,用表示,中度、重度、极重度组间比较采用方差分析,两两比较采用LSD-t检验,稳定期与急性加重期比较采用两独立样本t检验。计数资料用率表示,组间比较采用χ2检验。稳定期外周血炎症小体成分及下游分子mRNA表达水平与肺功能指标的相关性采用Pearson相关分析。
2 结果
2.1 3组患者外周血炎症小体成分及下游分子mRNA表达水平比较不论是稳定期或急性加重期,重度、极重度组外周血炎症小体及下游分子mRNA表达水平均明显高于中度组(均P<0.05);极重度组又明显高于重度组(均P<0.05)。与稳定期比较,3组患者急性加重期外周血炎症小体及下游分子mRNA表达水平均明显升高(均P<0.05),见表3。
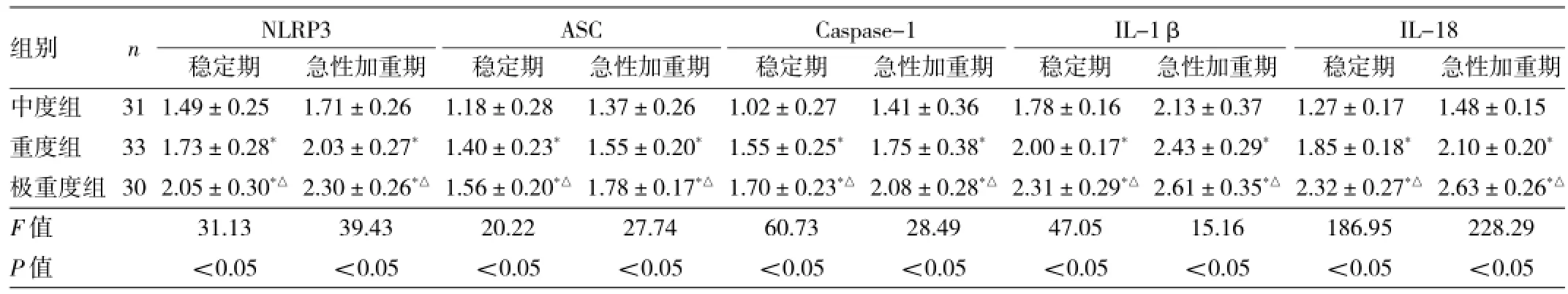
表3 3组患者外周血炎症小体成分及下游分子mRNA表达水平比较
2.2 3组患者血清IL-1β、IL-18浓度比较不论是稳定期或急性加重期,重度、极重度组血清IL-1β、IL-18浓度均明显高于中度组(均P<0.05);极重度组又明显高于重度组(均P<0.05)。与稳定期比较,中度、重度和极重度患者急性加重期血清IL-1β、IL-18浓度均明显升高(均P<0.05),见表4。
2.3 稳定期外周血炎症小体成分及下游分子mRNA表达水平与肺功能指标的相关性稳定期外周血炎症小体成分及下游分子mRNA表达水平与FEV1占预计值、FEV1/FVC均呈负相关(均P<0.01);IL-1β、IL-18 mRNA表达水平与FVC占预计值亦呈负相关(均P<0.01);NLRP3、ASC、Caspase-1 mRNA表达水平与FVC占预计值均未见相关性(均P>0.05),见表5。
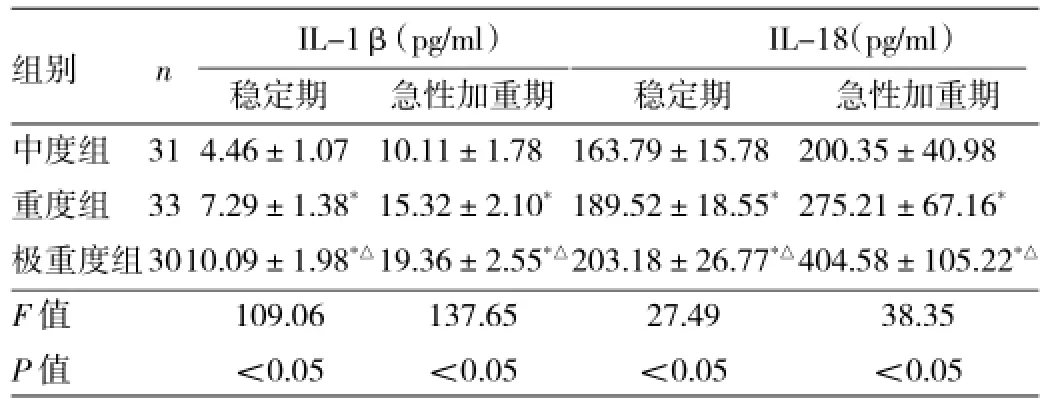
表4 3组患者血清IL-1β、IL-18浓度比较
3 讨论
肺功能下降程度是COPD严重程度分级的标准,因此,研究COPD患者肺功能下降的可能机制对延缓疾病进展、改善疾病预后具有积极意义。吸烟、烟雾及环境中有害物质的刺激是引起气道炎症和损伤的重要原因,而固有免疫作为机体第一道屏障系统,对外源性有害物质及病原体的清除并引导机体产生有效的适应性免疫应答的作用至关重要。固有免疫通过模式识别受体(PRR)来识别病原体的保守结构即病原体相关分子模式(PAMP)。常见的PAMP包括脂多糖、肽聚糖、鞭毛蛋白和一些微生物的核酸分子,它们能被PRR识别进而激活下游信号通路,引起炎症反应或者抗菌应答[6]。目前已发现3类PRR:(1)Toll样受体:一类主要定位于细胞膜或内体膜的跨膜分子,其胞外区识别配体分子、胞内区传递信号,进而激活下游NF-κB等信号通路;(2)RIG-I样受体:一类胞内的螺旋酶,主要参与病毒的识别并激活I型干扰素,从而抵抗病毒感染;(3)NOD样受体:一类细胞内感应分子[7]。部分NOD样受体被激活后,可形成巨大的蛋白复合体即“炎症小体”[8],进而激活Caspase-1,并对IL-1β和IL-18等炎症因子的前体形式进行切割,使其成熟并释放到胞外,引起炎症反应。
目前关于NLRP3炎症小体与COPD肺功能下降间的关系未见报道。本研究选取中度、重度和极重度COPD患者为研究对象,分别在稳定期与急性加重期测定了外周血炎症小体成分及下游分子mRNA表达水平和血清IL-1β、IL-18浓度,结果发现随着COPD严重程度的加重,外周血炎症小体成分及下游分子mRNA表达水平和血清IL-1β、IL-18浓度逐渐升高。相关性分析表明COPD患者外周血炎症小体成分及下游分子mRNA表达水平均与肺功能指标呈负相关。既往关于NLRP3炎症小体在COPD发生、发展中作用的报道,多局限于动物研究,其中对炎症小体成分NLRP3、ASC的作用研究较少。Eltom等[9]研究发现香烟烟雾暴露小鼠肺组织Caspase-1、IL-1β、IL-18 mRNA表达水平增加,应用P2X7受体拮抗剂或P2X7基因敲除小鼠肺组织Caspase-1、IL-1β mRNA表达水平降低。Churg等[10]发现应用Caspase-1抑制剂后,香烟烟雾暴露小鼠肺泡灌洗液炎性细胞(中性粒细胞、巨噬细胞)减少,IL-1β mRNA表达水平降低。Mortaz等[11]研究发现应用Caspase-1抑制剂后,香烟烟雾暴露小鼠气道上皮细胞分泌的炎性细胞因子明显减少。Eltom等[12]在2011年研究的基础上,采用基因敲除小鼠研究发现香烟烟雾暴露后IL-1β、IL-18 mRNA表达水平增加依赖于炎症小体蛋白成分NLRP3、ACS。Pauwels等[13]研究发现NLRP3、Caspase-1基因敲除小鼠香烟烟雾暴露后,肺泡灌洗液炎性细胞并未明显减少。但Yang等[14]发现,与野生鼠相比,NLRP3基因敲除小鼠在烟雾攻击后气道慢性炎症程度明显减轻,表明NLRP3炎症小体对COPD的发展至关重要,阻断该炎症小体可能是治疗靶点之一。
本研究不仅探讨了炎症小体下游分子在COPD发展中的作用,也研究了炎症小体成分(NLRP3、ASC)在COPD发展及肺功能下降中的作用,结果发现NLRP3炎症小体通路可能参与COPD的发展。此外,本研究通过比较急性加重期与稳定期COPD患者NLRP3炎症小体成分及下游分子的变化,以探讨COPD反复急性加重的可能机制。各种病原体如细菌、病毒、支原体等反复感染是COPD反复急性加重的重要诱因。COPD的病原菌以肺炎链球菌、肺炎克雷伯菌、金黄色葡萄球菌、流感嗜血杆菌等最为常见。固有免疫系统对抑制和清除病原菌至关重要,且在清除病原菌的同时,不对机体内的共生菌产生免疫反应。细菌感染过程中,适度的炎症反应有利于病原菌的清除,但过度的炎症反应会对宿主造成不利影响[15]。研究发现NLRP3炎症小体参与机体对肺炎链球菌[16]、肺炎克雷伯菌[17]、流感嗜血杆菌[18]、金黄色葡萄球菌[19-20]等感染的初始免疫应答,可能与COPD患者呼吸道感染进而导致急性加重相关。本研究中发现COPD患者急性加重期外周血炎症小体成分以及下游分子mRNA表达水平和血清细胞因子IL-1β、IL-18浓度均明显高于稳定期,进一步证实NLRP3炎症小体通路参与COPD反复急性加重过程。
综上所述,NLRP3炎症小体通路可能参与COPD呼吸道慢性炎症的发展以及COPD反复急性加重的过程,可能逐步损害肺功能,与COPD疾病严重程度密切相关。本研究成果可能为揭示COPD疾病进展和反复急性加重的可能机制提供新视点,为研制COPD免疫治疗新药物提供一定的理论基础。
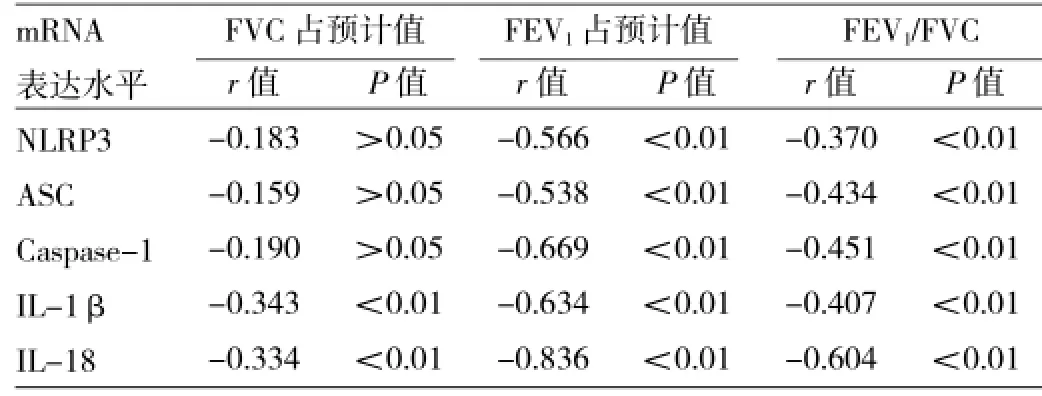
表5 稳定期各外周血炎症小体成分及下游分子mRNA表达水平与肺功能指标的相关性
[1]Martinon F,Burns K,Tschopp J.The inflammasome:a molecular platform triggering activation of inflammatory caspases and pro-cessing of proIL-beta[J].Mol Cell,2002,10:417-426.
[2]De Nardo D,De Nardo C M,Latz E.New insights into mechanisms controlling the NLRP3 inflammasome and its role in lung disease[J].Am J Pathol,2014,84:42-54.
[3]中华医学会呼吸病学分会慢性阻塞性肺疾病学组.慢性阻塞性肺疾病诊治指南(2013年修订版)[J].中华结核和呼吸杂志,2013,36(4): 255-264.
[4]Hussain S,Sangtian S,Anderson S M,et al.Inflammasome activation in airway epithelial cells after multi-walled carbon nanotube exposure mediates a profibrotic response in lung fibroblasts[J].Part Fibre Toxicol,2014,11:28.
[5]Dihlmann S,Erhart P,Mehrabi A,et al.Increased expression and activation of absent in melanoma 2 inflammasome components in lymphocytic infiltrates of abdominal aortic aneurysms[J].Mol Med,2014,19(20):230-237.
[6]Janew ay C A J r,Medzhit ov R.Innate immune recognition[J].Annu Rev Immunol,2002,20:197-216.
[7]Chen G,Shaw M H,Kim Y G,et al.NOD-like receptors:role in innate immunity and inflammatory disease[J].Annu Rev Pathol, 2009,4:365-398.
[8]Martinon F,Burns K,Tschopp J.The inflammasome:a molecular platform triggering activation of inflammatory caspases and processing of pro-IL-beta[J].Mol Cell,2002,10:417-426.
[9]Eltom S,Stevenson C S,Rastrick J,et al.P2X7 receptor and caspase 1 activation are central to airway inflammation observed after exposure to tobacco smoke[J].PLoS One,2011,6(9):e24097.[10]Churg A,Zhou S,Wang X,et al.The role of interleukin-1beta in murine cigarette smoke-induced emphysema and small airway remodeling[J].Am J Respir Cell Mol Biol,2009,40:482-490.
[11]Mortaz E,Henricks P A,Kraneveld A D,et al.Cigarette smoke induces the release of CXCL-8 from human bronchial epithelial cells via TLRs and induction of the inflammasome[J].Brochim Biophys Acta,2011,1812:1104-1110.
[12]Eltom S,Belvisi M G,Stevenson C S,et al.Role of the inflammasome-caspase1/11-IL-1/18 Axis in Cigarette Smoke Driven Airway Inflammation:An Insight into the Pathogenesis of COPD [J].PLoS One,2014,9(11):e112829.
[13]Pauwels N S,Brackes K R,Dupont L L,et al.Role of IL-1α and the NLRP3/caspase-1/IL-1β axis in cigarette smoke-induced pulmonary inflammation and COPD[J].Eur Respir J,2011,38: 1019-1028.
[14]Yang W,Ni H,Wang H,Gu H.NLRP3 inflammasome is essential for the development of chronic obstructive pulmonary disease [J].Int J Clin Exp Pathol,2015,8(10):13209-13216.
[15]Cascales E,Christie P J.The versatile bacterial type IV secretion systems[J].Nat Rev Microbiol,2003,1(2):137-149.
[16]Witzenrath M,Pache F,Lorenz D,et al.The NLRP3 inflammasome is differentially activated by pneumolysin variants and contributes to host defense in pneumococcal pneumonia[J].J Immunol,2011,187(1):434-440.
[17]Willingham S B,Allen I C,Bergstralh D T,et al.NLRP3(NALP3, Cryopyrin)facilitates in vivo caspase-1 activation,necrosis and HMGB1 release via inlammasome-dependent and-independent pathways[J].J Immunol,2009,183(3):2008-2015.
[18]Rotta Detto Loria J,Rohmann K,Droemann D,et al.Nontypeable Haemophilus Influenzae infection upregulates the NLRP3 inflammasome and leads to caspase-1-dependent secretion of interleukin-1β-a possible pathway of exacerbations in COPD[J].LoS One,2013,26,8(6):e66818.
[19]Mariathasan S,Weiss D S,Newton K,et al.Cryopyrin activates the inlammasome in response to toxins and ATP[J].Nature,2006, 440(7081):228-332.
[20]Craven R R,Gao X,Allen I C,et al.Staphylococcus aureus alpha-hemolysin activates the NLRP3-inflammasome in human and mouse monocytic cells[J].PLoS One,2009,4(10):e7446.
Association of NLRP3 inflammasome signaling pathway with progression of chronic obstructive pulmonary disease
ObjectiveTo study the association of NLR pyrin domain-containing protein 3(NLRP3)inflammasome signaling pathway with the progression of chronic obstructive pulmonary disease(COPD).MethodsNinety four COPD patients, including 31 cases of stageⅡ(moderate),33 cases of stageⅢ(severe)and 30 cases of stageⅣ(extremely severe),were enrolled in the study.The pulmonary function was examined in patients both with stable and acute exacerbation stages.The expression of NLRP3,ASC,Casp-1,IL-1β,IL-18 mRNA in peripheral blood mononuclear cells(PBMCs)were determined by real-time PCR.The concentrations of cytokines IL-1β and IL-18 in serum were measured by ELISA.The correlation between the levels of NLRP3,ASC,Casp-1,IL-1β,IL-18 mRNA and pulmonary function was evaluated.ResultsSignificantly higher levels of NLRP3,ASC,Casp-1,IL-1β,IL-18 mRNA transcripts in PBMC from severe and extremely severe COPD groups were found both in the stable and acute exacerbation stage COPD patients,compared with moderate COPD group(all P<0.05).And the above indexes in extremely severe COPD group were higher than those in severe COPD patients(all P<0.05).Significantly higher levels of NLRP3,ASC,Casp-1,IL-1β,IL-18 mRNA transcripts in PBMC from acute exacerbation stage COPD patients were also found in moderate,severe and extremely Severe COPD groups compared with stable stages COPD group patients(all P<0.05).Higher serum IL-1β and IL-18 levels in severe and extremely severe COPD groups were found both in the stable and acute exacerbation stage COPD patients compared with moderate COPD group(all P<0.05).And the IL-1β and IL-18 levels in extremely severe COPD group were higher than those in severe COPD group(both P<0.05).Higher serum levels of IL-1β and IL-18 levels from acute exacerbation stage COPD patients were also found in moderate,severe and extremely Severe COPD groups compared with stable stages COPD group patients(all P<0.05).The increased levels of NLRP3,ASC,Casp-1,IL-1β, IL-18 mRNA transcripts in PBMC were negatively correlated with the values of FEV1,and FEV1/FVC in stable stages COPD grouppatients(all P<0.01).Conclusion NLRP3 inflammasome activation is associated with the acute exacerbation and deterioration of pulmonary function and involved in the progression of COPD.
Chronic obstructive pulmonary diseaseInflammasomeNLRP3ASCCaspase-1Pulmonary function

2016-08-22)
(本文编辑:陈丹)
宁波市自然科学基金项目(2013A610237)
310029杭州,浙江大学医学院(王师,系在职研究生,现在宁波市鄞州人民医院呼吸与危重症医学科工作);宁波市鄞州人民医院呼吸与危重症医学科(王华英、兰朋训、姜昊、俞万钧);宁波市第一医院检验科(翁跃颂);浙江大学医学院附属邵逸夫医院呼吸内科(应可净)
应可净,E-mail:yingsrrsh@163.com
