Shh信号通路相关基因表达调控甲状腺功能减退的机制
2017-02-13汪蓓蕾王大玮
姚 远 汪蓓蕾 王大玮 陈 皓 郭 刚
(天津医科大学内分泌研究所,天津 300070)
Shh信号通路相关基因表达调控甲状腺功能减退的机制
姚 远 汪蓓蕾 王大玮 陈 皓 郭 刚
(天津医科大学内分泌研究所,天津 300070)
目的 探讨甲状腺功能减退(甲减)大鼠海马组织中Shh信号通路信号肽Shh、膜受体Patched-1和核转录因子Gli-1的表达及甲减对脑发育及功能调控影响的分子机制。方法 12只SPF级健康Wistar大鼠按照随机字数表法分为对照组和甲减组,每组6只,甲减组经腹腔注射丙基硫氧嘧啶建模,对照组经腹腔注射生理盐水,测定两组三碘甲状腺原氨酸(T3)、T4及促甲状腺激素(TSH)水平,对比两组Shh、Patched-1和Gli-1蛋白水平及 mRNA表达。结果 与对照组比较,甲减组大鼠血清T3、T4水平明显降低,TSH水平明显升高(P<0.05)。甲减组Shh,Patched-1及 Gli-1蛋白及mRNA表达相比对照组均明显降低(P<0.05)。结论 甲减脑组织Shh、Patched-1和Gli-1 蛋白水平及mRNA表达明显降低,导致甲状腺激素生物学效应降低,为甲状腺功能减退的临床治疗打下坚实基础。
甲状腺功能减退;Shh;Patched;Gli
早期胚胎发育过程中,Hedgehog信号通路能够确定胚体极性和影响多种成体附属物的形成〔1,2〕。脊椎动物的Hedgehog家族包括三个成员Shh、Ihh、Dhh,其中Shh蛋白可以通过Shh信号通路发挥信号传递作用,从而影响细胞分化、器官形成和胚胎发育〔3,4〕。Shh与其跨膜受体Patched结合后,使细胞膜跨膜蛋白Smo游离和激活;Smo下游分子Gli因子水平升高,然后同DNA结合,从而诱导目的基因的转录〔5〕。所以Shh信号通路在机体生长发育过程中起重要作用。Fagman等〔6〕通过检测Shh基因缺陷的小鼠,结果发现甲状腺发育和移位的时间延迟,并且形成大部分位于左侧的单侧甲状腺,其与同龄对照组一侧的甲状腺大致相等。此结果显示Shh基因能够控制甲状腺后期发育的对称性。由此推测Shh信号通路与甲减的发生有关系。甲减作为一种以基础代谢率降低为特征的内分泌疾病,心率减慢、精神萎靡、肌肉无力和血压降低等病理变化可能与大脑海马结构功能改变或者发育相关〔7〕。旨在探讨甲状腺功能减退与Shh信号通路的关系。
1 材料与方法
1.1 动物模型建立 清洁SPF级健康Wistar大鼠12只,雌雄各半,体重(200.1±20.2)g,北京维通利华实验动物有限公司购买。买回后的大鼠常规喂养1 w,并且没有怀孕等不良反应,将12只大鼠按照随机字数表法分为对照组和甲减组,每组6只。甲减组按1 mg/100 g体重经腹腔注射丙基硫氧嘧啶(Sigma,美国),连续4 w;对照组腹腔注射生理盐水(500 μl/只)。
1.2 标本的采集和制备 将两组大鼠动脉采血以后做甲状腺功能检测。处死大鼠后,将冰上获得的海马脑组织放到4℃生理盐水中,置于-80℃冰箱备用,用于Shh、Patched-1、Gli-1 mRNA的检测。
1.3 甲状腺激素水平测定 将采集的血液经过10 000 r/min离心5 min,然后取血清,-80℃保存,备用。三碘甲状腺原氨酸(T3)、T4、促甲状腺激素(TSH)水平采用放免法检测,放免试剂盒购自德国Bayer CLIA试剂盒,具体操作按照说明书进行。
1.4 Shh、Patched-1、Gli-1 mRNA表达的测定 海马组织总RNA提取:根据说明书每100 mg大鼠海马组织加入1 ml Trizol(购自Takara),通过匀浆仪破碎后37℃孵育5 min。然后再加入0.2 ml氯仿,涡旋振荡器振荡15 s后,接着孵育3 min。4℃ 12 000 r/min离心15 min,取上清液加入0.2 ml异丙醇,室温下孵育10 min。4℃ 12 000 r/min离心10 min,弃上清,加入1 ml 75%乙醇冲洗3次。4℃ 7 500 r/min离心5 min,弃上清,37℃烘箱中干燥10 min。最后将RNA沉淀溶于焦碳酸乙二酯(DEPC)水处理过的去离子水中,-80℃冰箱中保存备用。通过逆转录反应最后获得cDNA。
PCR扩增:将样品预变性5 min,然后进入以下循环:94℃变性1 min,56℃退火45 s,72℃延伸1.5 min。经过37℃个循环以后,72℃延伸10 min。利用SYBR Green(Taraka,美国)荧光染料进行实时定量PCR反应,最终获得各组样本标准曲线,分析Ct值。北京生工生物工程有限公司合成各目的基因的引物序列,Shh(156 bp)引物:正义5′-GAACTCCGTGGCGGCCAAATC-3′,反义5′-GTCCAGGAAGGTGAGGAAGTC-3′;Gli-1(110 bp)引物:正义5′-TATGTCAGGGTCCCAGGGTTATG-3′,反义5′-GAGCCCGCTTCTTAGTCAGTTTG-3′;Patched-1(80 bp)引物:正义5′-CCATTTCTTGCCCTTGGTGTTG-3′,反义5′-CCTCTTATTCTGTCCCGTTTCAC-3′。
1.5 Shh,Patched-1,Gli-1分子的测定 通过组织匀浆器将加入RIPA裂解液(购自索莱宝)(含蛋白酶抑制剂PMSF)的海马脑组织磨匀。4℃将匀浆液12 000 r/min离心15 min,取上清液。利用BCA法(Thermo,美国)测定海马脑组织总蛋白含量。用微量加样器加入样品,保证每孔总蛋白量在20 μg。上层浓缩胶的电泳电压(80 V),分离胶电泳电压(110 V)。当溴酚蓝染料前沿到凝胶末端处停止电泳。将海绵、滤纸、激活的聚偏氟乙烯(PVDF)膜、分离胶按照既定的顺序排列,PVDF膜与胶、滤纸之间不能出现气泡。在冰盒中80 V电转2 h。Tris盐酸缓冲液(TBST)室温漂洗。洗涤过后加入5%胎牛血清(BSA)封闭2 h。然后加入三种分子对应的一抗(羊抗大鼠Shh,羊抗大鼠Patched-1,兔抗大鼠Gli-1,1∶200;购自Santa),4℃摇床孵育过夜。加相应辣根过氧化物酶(HRP)标记的二抗(中杉金桥,中国)室温孵育1 h(1∶5 000),洗膜后,混合好的化学增强发光法(ECL)显色试剂覆盖印迹膜。利用Image图像分析系统进行光密度分析。
1.6 统计学方法 应用SPSS19.0软件行t检验。
2 结 果
2.1 两组血清甲状腺激素水平比较 与对照组比较,甲减组大鼠血清T3、T4水平明显降低,TSH水平明显升高(P<0.05),说明建模成功。见表1。
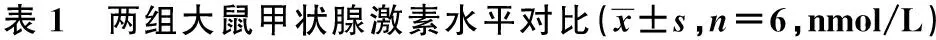

组别T3T4TSH对照组0.04±0.01598.38±7.260.45±0.04甲减组0.01±0.01218.37±4.780.96±0.03t/P值31.512/0.00184.624/0.00118.543/0.002
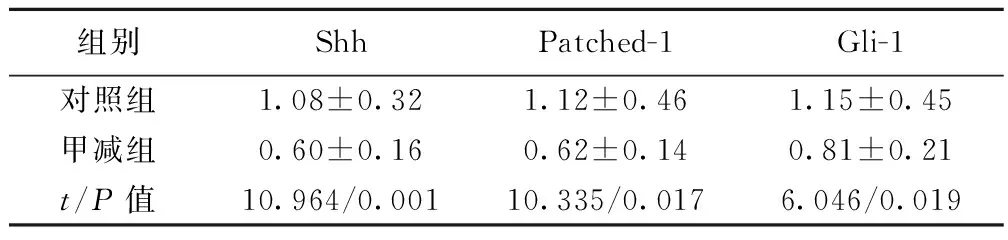
2.2 两组Shh,Patched-1及Gli-1 mRNA及蛋白含量 甲减组Shh,Patched-1及 Gli-1 mRNA及蛋白表达比对照组明显降低(P<0.05),见表2,表3。
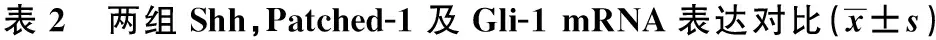
组别ShhPatched-1Gli-1对照组1.08±0.321.12±0.461.15±0.45甲减组0.60±0.160.62±0.140.81±0.21t/P值10.964/0.00110.335/0.0176.046/0.019


组别ShhPatched-1Gli-1对照组1.08±0.081.04±0.071.09±0.09甲减组0.34±0.060.32±0.040.41±0.01t/P值20.911/0.00120.339/0.01220.045/0.017
3 讨 论
甲减最为有效的治疗方法是甲状腺激素终身替代疗法。遵循的基本原则是由低量开始,然后慢慢增加剂量,最后达到有效量后长期维持。但是这需要较长时间才能达到体内激素水平的动态平衡,而且达平衡以后,部分患者仍然需要终身激素替代治疗。所以长时间服药导致的多种副作用是不可忽视的,严重者可能诱发心绞痛甚至心力衰竭等严重症状〔8〕。T3是生物界中生物活性最强的甲状腺激素,T4是T3的主要来源和甲状腺激素库的主要存在形式,因此测定血清中T3和T4 的浓度能够反映出甲状腺功能的状态。作为调节甲状腺功能的主要激素,TSH作用于碘代谢的所有环节,它可以促进碘的转运、甲状腺球蛋白水解、酪氨酸碘化和碘泵活性等。最重要的是TSH能够调节T3和T4合成与分泌。当甲状腺功能改变时,TSH浓度的变化、合成和分泌比 T3和T4 更快,并且更加明显。所以血清中TSH含量变化是诊断甲减的最主要指标。
本实验结果显示,甲减组Shh、Patched-1及 Gli-1的蛋白水平比对照组明显降低,提示甲减能够影响Shh信号通路。Farmer等〔5〕指出Shh与其跨膜受体 Patched结合后,使细胞膜跨膜蛋白Smo游离并被激活,Smo下游锌指家族转录因子Gli水平升高,成为转录激活因子,与DNA结合,从而诱导目的基因的转录。这有助于加深对甲减脑损害分子机制的理解,提示Shh信号通路在甲减脑损害的发病过程中起到特殊作用。Hasebe等〔9〕发现大鼠甲减时,这三个基因只有Shh基因的相对表达量具有统计学意义的降低,与本次研究一致。进一步研究提示Shh信号通路在甲减脑损害的发病过程中起到特殊作用。
综上所述,甲减时脑组织Shh信号通路mRNA表达水平下调,直接导致了甲状腺激素的生物学效应降低,造成神经细胞损伤。甲减脑组织Shh mRNA表达水平降低的现象,有助于进一步加深对甲减性脑损伤病理机制的认识,推测可以利用某些激活剂激活Shh信号通路,为甲减的临床提供新思路。
1 Marada S,Truong A,Ogden SK.Dataset for phenotypic classification of genetic modifiers of smoothened and Hedgehog〔J〕.Data Brief,2016;7(5):485-9.
2 Gurdziel K,Vogt KR,Schneider G,etal.Computational prediction and experimental validation of novel Hedgehog-responsive enhancers linked to genes of the Hedgehog pathway〔J〕.BMC Dev Biol,2016;16(1):4.
3 Dugum M,Hanouneh I,McIntyre T,etal.Sonic hedgehog signaling in hepatocellular carcinoma:a pilot study〔J〕.Mol Clin Oncol,2016;4(3):369-74.
4 Li C,Du Y,Yang Z,etal.GALNT1-mediated glycosylation and activation of sonic hedgehog signaling maintains the self-renewal and tumor-initiating capacity of bladder cancer stem cells〔J〕.Cancer Res,2016;76(5):1273-83.
5 Farmer WT,Abrahamsson T,Chierzi S,etal.Neurons diversify astrocytes in the adult brain through sonic hedgehog signaling〔J〕.Science,2016;351(6275):849-54.
6 Fagman H,Grände M,Gritli-Linde A,etal.Genetic deletion of sonic hedgehog causes hemiagenesis and ectopic development of the thyroid in mouse〔J〕.Am J Pathol,2004;164(5):1865-72.
7 张 晶,彭 伟,左建新,等.青岛地区妊娠前半期妇女甲状腺功能减退症的筛查〔J〕.现代生物医学进展,2013;13(11):2126-30.
8 罗 嘉,黄 佳,叶 茂,等.亚临床甲状腺功能减退症对于糖尿病及其并发症的影响分析〔J〕.标记免疫分析与临床,2015;22(12):1268-70.
9 Hasebe M,Ohta E,Imagawa T,etal.Expression of sonic hedgehog regulates morphological changes of rat developing cerebellum in hypothyroidism〔J〕.J Toxicol Sci,2008;33(4):473-7.
〔2016-04-18修回〕
(编辑 袁左鸣)
郭 刚(1963-),男,硕士,研究员,主要从事甲状腺疾病和糖尿病的分子机制研究。
姚 远(1990-),女,在读硕士,主要从事生物化学与分子生物学方面的研究。
R581.2
A
1005-9202(2017)01-0049-03;
10.3969/j.issn.1005-9202.2017.01.022
