磁共振波谱检测肌萎缩侧索硬化的上运动神经元损害
2017-02-13翦凡崔丽英潘华邢岩李晓光刘明生
翦凡 崔丽英 潘华 邢岩 李晓光 刘明生
磁共振波谱检测肌萎缩侧索硬化的上运动神经元损害
翦凡 崔丽英 潘华 邢岩 李晓光 刘明生
目的 探讨质子磁共振波谱(proton magnetic resonance spectroscopy,1H-MRS)检测肌萎缩侧索硬化(amyotrophic lateral sclerosis,ALS)的上运动神经元损害(upper motor neuron,UMN)的特点和诊断准确性。方法 收集ALS患者31例和健康对照32名,采用1H-MRS检测脑中央前回皮质下、内囊后肢和大脑脚感兴趣区代谢产物N-乙酰天冬氨酸(NAA)、胆碱(Cho)、肌酸(Cr)的水平,计算NAA/Cr、NAA/(Cho+Cr)、Cho/Cr比值,采用受试者工作特征(receiver operating characteristic,ROC)曲线分析1H-MRS对ALS患者UMN损害的诊断价值。结果 ALS患者各锥体束走行部位和部位组合的NAA/Cr和NAA/(Cho+Cr)较对照组显著降低(P<0.05)。NAA比值预测ALS的 UMN损害的ROC曲线下面积(area under the curve,AUC)为0.67~0.91,其中内囊后肢、大脑脚两部位的平均NAA/(Cho+Cr)和三部位的平均NAA/(Cho+Cr)的AUC、灵敏度、特异度分别为0.91、0.828、0.906和0.90、0.769、0.875。结论1H-MRS可检出ALS患者锥体束走行的生化代谢异常,是评估ALS的UMN损害的客观影像学指标,其诊断准确性中等,多水平检测和综合指标的选择有助于提高其诊断效力。
肌萎缩侧索硬化;锥体束;磁共振波谱;ROC曲线
肌萎缩侧索硬化(amyotrophic lateral sclerosis,ALS)是一种进行性神经系统变性病,以上、下运动神经元损害和锥体束变性为特征。常规肌电图检查即可证实下运动神经元的临床病损和临床下病变。而上运动神经元(upper motor neuron,UMN)损害,除查体外,尚缺乏客观有效的检测指标。质子磁共振波谱(proton magnetic resonance spectroscopy,1H-MRS)利用磁共振现象和化学位移作用,能无创性检测活体组织中的N-乙酰天冬氨酸(N-acetylaspartate,NAA)、胆碱(Choline,Cho)、肌酸(Creatine,Cr)等代谢物浓度,通过测量神经组织的生化代谢改变有可能揭示疾病的病理生理过程,将其应用于评估ALS患者的UMN损害已成为国内外的研究热点。本文对ALS患者和对照组在锥体束走行多部位行1H-MRS检测,分析MRS指标与临床的相关性,应用受试者工作特征(receiver operating characteristic,ROC)曲线评估MRS检出UMN损害的准确性,以期对MRS指标的选择和在ALS中的临床应用价值进行探讨。
1 对象和方法
1.1 对象 收集2004-06—2006-03在北京协和医院和北京天坛医院就诊的散发型ALS患者31例,根据修订的El Escorial诊断标准[1],符合确诊或拟诊的ALS患者。其中男24例,女7例,年龄27~74岁,平均(48.7±11.1)岁,病程3~59个月,平均18个月;延髓起病者4例,肢体起病者27例。排除标准:脑血管病或其他中枢神经系统疾病史,颅脑手术或精神药物服用史。对照组为健康志愿者32名,男21名,女11名,年龄31~68岁,平均(50.0±10.4)岁,排除标准同前,无脑干及以上部位UMN受损的症状体征。两组间年龄、性别比较无统计学差异(P>0.05)。
1.2 方法
1.2.1 临床评分:ALS患者均有UMN受损体征,采用Ellis反射评分[2]评估UMN受累情况,双侧上下肢腱反射、Hoffmann征、足跖反射及下颌反射总分55分,评分越高提示UMN损害越重。以ALS功能评分量表(ALS functional rating scale,ALSFRS)[3]评价疾病的严重程度,总分40分,分值越低,神经功能损害越严重。
1.2.2 MRI检查:所有研究对象在知情同意前提下行颅脑MRI检查(GE Signa Excite 3.0T磁共振系统)。影像学检测医师不了解受检者的临床情况。常规MRI包括轴位及矢状位T1WI、轴位T2WI和T2 FLAIR。2D1H-MRS采用点分辨自旋回波波谱(point-resolved echo spin spectro-scopy,PRESS)序列,自动匀场和水抑制,TR 1000 ms,TE 144 ms,矩阵16×16,视野16 cm,多体素扫描,体素厚10 mm。将大小为7.5 mm×7.5 mm×10 mm的感兴趣区分别置于双侧中央前回皮质下、内囊后肢和大脑脚等锥体束走行部位[4],MRS谱线上主要观察的代谢物NAA、Cho、Cr的化学位移分别为2.02×10-6、3.22×10-6、3.03×10-6,机器软件自动完成基线校正、信号平均、代谢物识别及峰下面积的计算,结果以NAA/Cr、NAA/(Cho+ Cr)、Cho/Cr比值表示。中央前回、内囊后肢和大脑脚双侧测量值的平均值构成各部位的MRS指标,三个部位的平均值和任两个部位的平均值构成锥体束走行的综合MRS指标。
1.3 统计学处理 采用SPSS 16.0软件进行统计学分析,符合正态分布的计量资料以均数±标准差表示,组间比较采用独立样本t检验;MRS指标与病程、临床评分之间的相关性采用Pearson相关分析;采用ROC曲线下面积(area under the curve,AUC)比较各MRS指标预测ALS的 UMN损害的效能,计算AUC及95%CI、灵敏度和特异度,在兼顾灵敏度和特异度并优先保证较高特异度的原则下获取最佳截断点。以P<0.05为差异有统计学意义。
2 结果
2.11H-MRS检查结果比较 ALS组与对照组各部位Cho/Cr比较差异均无统计学意义(P>0.05),结果见表1。而ALS患者锥体束走行各部位和各部位组合的NAA/Cr和NAA/(Cho+Cr)均较对照组显著降低(P<0.05),结果见表2、表3。
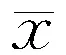
表1 两组脑1H-MRS检查不同部位Cho/Cr比较(±s)
注:1H-MRS:质子磁共振波谱,ALS:肌萎缩侧索硬化,Cr:肌酸,Cho:胆碱;下表同
2.2 相关性分析 ALS患者锥体束走行各部位和各部位组合的NAA/Cr和NAA/(Cho+Cr)与病程无相关性(均P>0.05)。ALS患者的Ellis反射评分为(35.10±11.46)分,ALSFRS评分为(31.06±6.86)分,ALS患者中央前回的NAA/Cr和NAA/(Cho+Cr)与Ellis评分呈负相关(r=-0.544,P=0.005;r=-0.412,P=0.037)。各部位和各部位组合的NAA/Cr和NAA/(Cho+Cr)与ALSFRS评分无相关性(均P>0.05)。
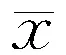
表2 两组1H-MRS检查脑锥体束走行各部位和部位组合的NAA/Cr比较(±s)
注:NAA:N-乙酰天冬氨酸,a包括中央前回、内囊后肢和大脑脚;下表同
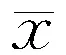
表3 两组1H-MRS检查脑锥体束走行各部位和部位组合的NAA/(Cho+Cr)比较(±s)

表4 各部位及部位组合的NAA/Cr和NAA/(Cho+Cr)的AUC和相应统计学参数
注:AUC:ROC曲线下面积

图1 1H-MRS检测脑锥体束走行各部位(A)和各部位组合(B)的NAA/Cr诊断ALS的ROC曲线
2.3 ROC曲线分析 锥体束走行各部位和部位组合的NAA/Cr和NAA/(Cho+Cr)的ROC曲线分析结果见表4和图1、2。内囊后肢的AUC较高,各部位组合的AUC较单部位提高,3部位的平均NAA/(Cho+Cr)和内囊后肢、大脑脚两部位的平均NAA/(Cho+Cr)的AUC超过0.9,特异度和灵敏度较高。

图2 1H-MRS检测脑锥体束走行各部位(A)和各部位组合(B)的NAA/(Cho+Cr)诊断ALS的ROC曲线
3 讨论
上、下运动神经元同时受累和进行性病程是ALS的特征和诊断要点[1,5]。下运动神经元损害通过肌电图检查很容易确认,而UMN受累的评定依靠临床症状体征并不可靠,ALS患者下运动神经元损害突出可以掩盖UMN体征,而颈椎间盘突出、颈椎管狭窄引起的上下肢病理征和下肢腱反射增高又易误判为ALS征象。因此,寻找客观准确的UMN评价指标成为临床的迫切需要,有利于明确诊治及鉴别下运动神经元综合征、颈椎病等易混淆疾病,有利于筛选早期病例进入新药临床试验,有利于建立客观敏感的疗效评价指标。经颅磁刺激运动诱发电位可以检测中枢运动传导通路锥体束的功能,但用于早期发现ALS患者的UMN损害的敏感性不高[6]。新的神经影像技术MRS和弥散张量成像(diffusion tensor imaging,DTI)的出现,给ALS的UMN损害的生物标记物的研究注入了新的活力。
DTI通过测量水分子的弥散及其各向异性来反映微观组织结构的完整性。研究结果显示,采用DTI 技术可发现ALS患者中央前回皮质下白质、内囊后肢、大脑脚等锥体束走行部位的部分各向异性值显著降低[4,7],提示ALS患者的锥体束存在组织结构异常;部分各向异性值用于辅助诊断ALS的UMN损害的准确性较高[7-8]。利用MRS检测NAA、Cho、Cr等代谢物浓度可揭示神经组织的生化代谢改变。NAA仅存在于成熟神经元及其突起中,是神经元的标志物,其降低提示神经元缺失或功能障碍;Cho是细胞膜磷脂代谢的成分并反映膜的更新,其升高见于胶质增生、损伤修复和脱髓鞘等情况;Cr是高能磷酸键的储备以及三磷酸腺苷和二磷酸腺苷的缓冲剂,存在于星形胶质细胞、少突胶质细胞和神经元中,普遍均匀地分布于脑组织,其在疾病中维持一定的稳定性,常作为参照峰,计算其他代谢物与Cr的比值。本研究结果显示,ALS患者中央前回皮质下、内囊后肢、大脑脚等沿锥体束走行部位的NAA/Cr和NAA/(Cho+Cr)较对照组显著降低,这与国内外报道[9-10]结果一致;另外中央前回的NAA比值与Ellis评分呈负相关,提示ALS患者的运动皮质和锥体束纤维存在UMN缺失或功能障碍,这与DTI检查发现ALS患者锥体束微观结构异常的结果相符,表明MRS是评估ALS的UMN损害的有效方法。NAA/Cr和NAA/(Cho+Cr)两种NAA比值中,从组间差异和ROC曲线来看NAA/(Cho+Cr)可能更有效。ALS患者的组织病理中除运动神经元及其轴索变性缺失外还存在胶质增生、细胞膜破坏和继发性脱髓鞘[11],NAA/(Cho+Cr)改变不仅来源于NAA的降低,还来源于Cho的增高[12-13],从而NAA/(Cho+Cr)显示出更高的锥体束损害检测效力,尤其在内囊后肢和大脑脚等纤维束集中部位。ALSFRS评分主要受下运动神经元损害导致的功能障碍影响[14],NAA比值与ALSFRS评分无相关性与以往的研究结果[9-10]一致,其直接来源于对脑内锥体束的检测,不受下运动神经元的干扰,是监测UMN微观生化代谢改变的指标。
通过利用MRS对ALS患者和对照组的研究,促进了人们对ALS的UMN损害的病理生理机制的理解,其可能是有临床应用前景的影像学标记物。但在将其应用于个体患者的诊治前,尚需对其检测效力进行评估[14],但目前这方面的研究非常少[10]。ROC曲线通过计算AUC,可将灵敏度和特异度结合起来全面准确地评估诊断试验的诊断价值[15]。本研究结果显示:锥体束走行的各部位和各部位组合的NAA/Cr和NAA/(Cho+Cr)的AUC为0.67~0.91,MRS指标辅助诊断ALS的准确性中等,其AUC数值未能超越作者既往有关DTI的研究[8]。综合ROC曲线和AUC分析,内囊后肢NAA比值降低辅助诊断UMN损害的价值较好。分析其原因之一为:本研究采用多体素MRS扫描,空间分辨率好,可以将较小的感兴趣区放置于内囊后肢锥体束走行位置而不受周围组织的干扰,而在中央前回皮质下测量时,却因为体素小而存在信息获取不足的问题。多部位组合的AUC和诊断效力优于单部位,其中内囊后肢、大脑脚两部位的平均NAA/(Cho+Cr)和三部位的平均NAA/(Cho+Cr)的AUC超过0.9,显示较高的诊断准确性。ALS的病损特征即是广泛性UMN损害和锥体束变性,在锥体束走行进行多水平检测和综合评估,更易排除其他病引起的局灶性的NAA比值降低,将ALS广泛而全程的锥体束损害鉴别出来。最近报道的全脑MRS研究[13,16]支持这一观点,全锥体束的代谢物和代谢物比值与对照组间差异大。全脑MRS将由双侧运动皮层至脑干的颅内锥体束全程进行整体测量,避免了体素放置的主观性和测量评估的不连续性,个体内和个体间的变异小,稳定性高,还可以检测代谢物的绝对浓度,是ALS的MRS研究的新方向。
综上所述,1H-MRS检查可发现ALS患者锥体束走行的功能代谢异常,是评估ALS的UMN损害的客观影像学指标,但其诊断准确性中等。进行多水平检测、综合指标的选择以及检测方法、评估方法的改进,将促使其向临床应用方向更近一步。
[1]Brooks BR, Miller RG, Swash M, et al.El Escorial revisited: revised criteria for the diagnosis of amyotrophic lateral sclerosis [J].Amyotroph Lateral Scler Other Motor Neuron Disord, 2000, 1(5):293-299.
[2]Ellis CM, Simmons A, Jones DK, et al.Diffusion tensor MRI assesses corticospinal tract damage in ALS [J].Neurology, 1999, 53(5):1051-1058.
[3]The ALS CNTF treatment study (ACTS) phase Ⅰ-Ⅱ study group.The amyotrophic lateral sclerosis functional rating scale.Assessment of activities of daily living in patients with amyotrophic lateral sclerosis[J].Arch Neurol, 1996, 53(2):141-147.
[4]翦凡, 崔丽英, 管宇宙, 等.肌萎缩侧索硬化38例弥散张量成像及磁共振波谱表现[J].中华神经科杂志, 2008, 41(5): 294-298.
[5]中华医学会神经病学分会肌电图与临床神经电生理学组, 中华医学会神经病学分会神经肌肉病学组.中国肌萎缩侧索硬化诊断和治疗指南[J].中华神经科杂志, 2012, 45(7):531-533.
[6]翦凡, 崔丽英, 刘明生, 等.肌萎缩侧索硬化症的经颅磁刺激运动诱发电位研究[J].脑与神经疾病杂志, 2006, 14(5): 345-349, 393.
[7]Prokscha T, Guo J, Hirsch S, et al.Diffusion tensor imaging in amyotrophic lateral sclerosis - Increased sensitivity with optimized region-of-interest delineation [J].Clin Neuroradiol, 2014, 24(1):37-42.
[8]翦凡, 崔丽英, 潘华, 等.弥散张量成像对肌萎缩侧索硬化的诊断价值[J].中华神经科杂志, 2015, 48(2):99-102.
[9]Liu C, Jiang R, Yi X, et al.Role of diffusion tensor imaging or magnetic resonance spectroscopy in the diagnosis and disability assessment of amyotrophic lateral sclerosis [J].J Neurol Sci, 2015, 348(1-2):206-210.
[10]Cervo A, Cocozza S, Saccà F, et al.The combined use of conventional MRI and MR spectroscopic imaging increases the diagnostic accuracy in amyotrophic lateral sclerosis [J].Eur J Radiol, 2015, 84(1):151-157.
[11]Abe K, Fujimura H, Kobayashi Y, et al.Degeneration of the pyramidal tracts in patients with amyotrophic lateral sclerosis.A premortem and postmortem magnetic resonance imaging study [J].J Neuroimaging, 1997, 7(4): 208-211.
[12]Schuff N, Rooney WD, Miller R, et al.Reanalysis of multislice (1)H MRSI in amyotrophic lateral sclerosis [J].Magn Reson Med, 2001, 45(3):513-516.
[13]Govind V, Sharma KR, Maudsley AA, et al.Comprehensive evaluation of corticospinal tract metabolites in amyotrophic lateral sclerosis using whole-brain 1H MR spectroscopy[J].PLoS One, 2012, 7(4):e35607.
[14]Bede P, Hardiman O.Lessons of ALS imaging: Pitfalls and future directions - A critical review [J].Neuroimage Clin, 2014, 4:436-443.
[15]宇传华, 徐勇勇.ROC分析的基本原理[J].中华流行病学杂志, 1998, 19(2):413-415.
[16]Stagg CJ, Knight S, Talbot K, et al.Whole-brain magnetic resonance spectroscopic imaging measures are related to disability in ALS [J].Neurology, 2013, 80(7):610-615.
(本文编辑:时秋宽)
Magnetic resonance spectroscopy in the diagnosis of upper motor neuron involvement in amyotrophic lateral sclerosis
JIANFan,CUILiying*,PANHua,XINGYan,LIXiaoguang,LIUMingsheng.
*DepartmentofNeurology,PekingUnionMedicalCollegeHospital,ChineseAcademyofMedicalScience,Beijing100730,China
CUI Liying, Email: pumchcuily@sina.com
Objective To evaluate the feature and diagnostic accuracy of proton magnetic resonance spectroscopy (1H-MRS) in detecting upper motor neuron (UMN) involvement in amyotrophic lateral sclerosis (ALS).Methods The study included 31 ALS patients and 32 healthy controls and measured the concentration of N-acetylaspartate(NAA), choline(Cho) and creatine(Cr) by1H-MRS in subcortical white matter of precentral gyrus, posterior limb of internal capsule (PLIC) and cerebral peduncle (CP).Ratios of NAA/Cr, NAA/(Cho+Cr) and Cho/Cr were calculated from these measurements.The diagnostic value of NAA ratios for ALS lesions was analyzed by receiver operating characteristic (ROC) curves. Results Compared with the controls, ALS group had significantly decreased NAA/Cr and NAA/(Cho+Cr) ratios at the three levels along the corticospinal tract (CST) (P<0.05).In ROC analysis, areas under the curves (AUC) ranged from 0.67 to 0.91.The average NAA/(Cho+Cr) ratio of PLIC and CP showed the best performance with an AUC of 0.91, a sensitivity of 0.828 and a specificity of 0.906, followed by the average NAA/(Cho+Cr) ratio of all the three levels, with the corresponding data as 0.90, 0.769 and 0.875.Conclusions1H-MRS can reveal metabolite abnormalities in the intracranial CTS of ALS patients and serve as a neuroimaging biomarker for UMN involvement.Regarding its moderate diagnostic accuracy, multilevel measurements and synthetically using parameters will help to improve its efficacy.
amyotrophic lateral sclerosis; corticospinal tract; magnetic resonance spectroscopy; ROC curve
10.3969/j.issn.1006-2963.2017.01-008
100050首都医科大学附属北京天坛医院神经病学中心(翦凡、潘华);100730 中国医学科学院 北京协和医院神经内科(崔丽英、李晓光、刘明生);100012 航空总医院神经内科(邢岩)
崔丽英,Email: pumchcuily@sina.com
R744.8
A
1006-2963(2017)01-0029-05
2016-11-30)
