错位:当代人类慢性病发病率飙升的病理生理学基础
——基于人类进化过程中饮食-体力活动-基因的交互作用
2017-02-13乔玉成
乔玉成

错位:当代人类慢性病发病率飙升的病理生理学基础
——基于人类进化过程中饮食-体力活动-基因的交互作用
乔玉成
有证据表明,当代人类慢性病的高发与基因和环境的交互作用有关,但关于两者的关系机制尚未完全明晰。基于人类进化过程中饮食-体力活动-基因间的交互作用以及表观遗传学的研究证据,从“匹配”的视角梳理和探讨了当代人类慢性病发病率飙升的原因与机制。人类生物进化与文化进化的不同步,基因型与饮食、体力活动、物质能量代谢方面的不匹配、不适应、不兼容等造成的基因与环境之间的错位,是导致当代人类慢性病高发的原因。过度饮食和体力活动不足通过影响基因的表观遗传修饰,进而影响到相关基因的表达,是导致慢性病高发的机制。在此基础上,提出了限制热量摄入,增加体力活动消耗,促使生活方式与基因型相匹配的慢性病防治策略。
慢性病;基因;饮食;体力活动;交互作用;节俭基因;表观遗传学Abstract:Substantial evidences showed that the high incidence of chronic diseases in human was related to interactions between genes and environment,but mechanisms of the relationship between them were not fully understood.Based on interactions between diet-physical activity-genes and epigenetic evidences in the process of human evolution,this paper expounded reasons and mechanisms of the soaring incidence of chronic diseases in human from the "matching" view.The results showed that the high incidence of chronic diseases in human resulted from mismatches between biological evolution and cultural evolution of human and dislocations between gene and environment because of mismatch,maladjustment and incompatibility between genotype and diet,physical activity,energy metabolism.Excessive diet and lack of physical activity could contribute to the development of chronic diseases by affecting epigenetic modifications and expression of related genes.Consequently,this paper suggested that restricting caloric intake,increasing physical activities,and matching between lifestyle and genotype could be a strategy to prevent and controll chronic diseases.
1 问题的提出
或许我们当中有许多人会提出这样的问题:当今我们这个世界究竟怎么了?为什么我们生活在太平盛世,却有许多事情让我们感到迷惘、焦虑和不安,极大的物质满足并未给我们带来应有的幸福感;为什么我们在享受现代科技带来的安逸、舒适、便利生活的同时,50年前一些发病率很低的慢性非传染性疾病(以下简称慢性病,NCDs),如肥胖、糖尿病、心血管疾病、恶性肿瘤、慢性呼吸系统疾病、高血压、代谢综合征等病症的发病率却呈现出“井喷”态势,而这一切来得又是如此突然;为什么我们通过自然选择进化过来的身体在应对工业化社会以后的环境时会面临如此大的困难,以致我们不得不刻意地进行饮食控制和身体锻炼。笔者认为,要回答这些问题从进化的角度看就两个字——错位,即我们的基因型与我们现在的生存环境发生了错位。众多的研究表明,人是自然的产物,人与环境应当是相互适应、相互匹配的。如果人和环境中的任何一方变化太快,就会产生错位,其结果要么导致人类疾病的发生,要么引发环境的破坏。基于此,本研究将以人类进化过程中饮食、体力活动与基因的交互作用为主线,对当前慢性病肆虐的原因以及人类进化过程中饮食结构和体力活动水平衍变如何引发慢性病的机制进行探讨,旨在阐明人类进化过程中基因-环境-慢性病之间的关系,明确不合理饮食和久坐不动等不良生活方式对人体健康的危害,为慢性病防控策略的制定提供依据。
2 现状与趋势:近50年来全球人口慢性病发病率呈“井喷”态势,因慢性病导致的死亡率居高不下
2.1 全球人口因慢性病导致的死亡
据世界卫生组织发布的《2014年全球非传染性疾病现状报告》[169]显示,自20世纪70年代以来,慢性病已成为导致全球人口致死、致残的首要原因,其中,心血管疾病(包括脑卒中)、恶性肿瘤、慢性呼吸系统疾病(包括哮喘和慢性阻塞性肺部疾病)和糖尿病位居人类死亡谱的前4位。2008年,全球有3 600万人死于慢性病,约占所有死亡人数的63 %。2012年,全球总死亡人数为5 600万人,其中3 800万人死于非传染性疾病,约占死亡总数的68%,1 600万人属于70岁以下由于慢性病导致的过早死亡,约占总死亡人数的29%(图1)。如不加以控制,预计到2030年全世界死于慢性非传染性疾病总人数将突破5 200万/年[170]。在中国,2012年全国人口慢性病死亡率为533/10万,占总死亡人数的86.6%。心脑血管病、癌症和慢性呼吸系统疾病为其主要死因,占总死亡人数的79.4%,其中,心脑血管病死亡率为271.8/10万,癌症死亡率为144.3/10万,慢性呼吸系统疾病死亡率为68/10万。45%的慢性病患者死于70岁之前,全国因慢性病过早死亡者占早死总人数的75%,其中1/3归因于心血管疾病[26]。
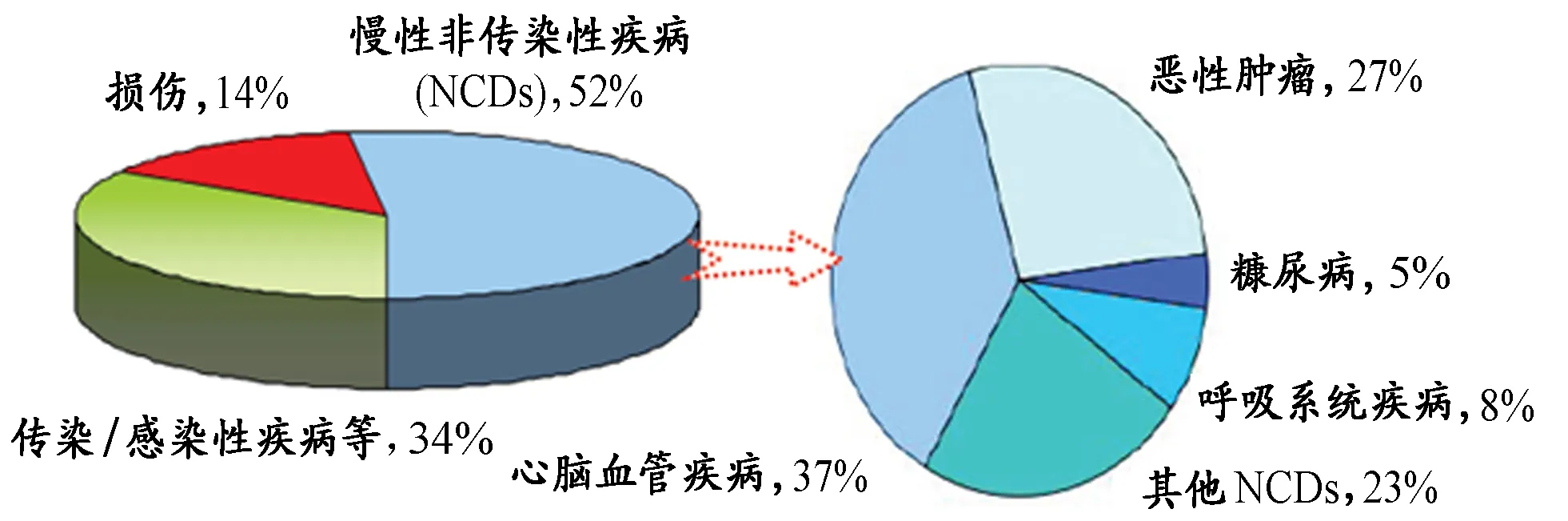
图 1 2012年全球70岁以下人口死亡原因Figure 1. Causes of Death Worldwide under the Age of 70 in 2012注:图由本文作者依WHO数据[169]绘制。
2.2 全球人口慢性病患病率变化趋势
随着世界各国社会经济的快速发展和医疗技术的进步,全球人口的疾病谱已经发生重大变化。50年前位居患病率前2位的传染/感染性疾病和营养不良性疾病已被慢性非传染性疾病逐步取代,慢性病不但成为西方发达国家社会的头号杀手,在发展中国家也日益猖獗,而中国经历从传染性疾病到慢性病的流行病学过渡时间比许多发达国家更短,升级更快[174]。以糖尿病为例,1980年中国成年人糖尿病发病率还不足1%[52],到2008年已达9.8%,且有近1.5亿前糖尿病的高危个体,居全球第一[175]。有人预计,如果没有有效的控制措施,至2030年全球20~79岁人口中糖尿病患者将上升到4.39亿人,将占到世界总人口的7.7%。《中国居民营养与慢性病状况报告(2015)》[26]显示,2012年中国确诊的慢性病患者已超过2.6亿人,约占全国总人口的19%。全国18岁及以上成人糖尿病患病率已达9.7%,40岁及以上人群慢性阻塞性肺病患病率达到9.9%,癌症发病率为235/10万。与20世纪90年代相比,4种主要慢性病总人口患病率均呈现出较大幅度的上升趋势。另据世界银行《中国走向健康和谐生活》报告:“慢性病已成为中国的第一大健康威胁,每年导致约1 030 万人死亡,占全国总死亡率的 80% 和约 70% 的整体疾病负担。如果在 2010—2040年间,心血管疾病死亡率能够下降 1%,将为中国节省10.7万亿美元的医疗开支。”[175]而就目前而言,中国每年用于心血管和糖尿病治疗相关费用已达GDP的4%,预计到2025年将达到8%左右,这无疑给城乡居民家庭和社会经济发展带来巨大的经济负担[10]。可以预见,随着今后一段时期中国进一步的工业化、城市化和人口老龄化以及相关生活方式的改变,中国将面临更为严峻的慢性病挑战,而能否迅速遏制慢性病病在中国的进一步的流行,将直接关系到中国13亿人口的健康以及健康中国建设目标的实现。
3 风险因素:不合理的饮食和缺乏体力活动已被WHO列为引发慢性病的高危因素
现有的证据证实,吸烟、过量饮酒、高盐、高脂、高糖等不健康饮食和缺乏体力活动是导致慢性病发生、发展的主要危险因素,其中,以不合理饮食和体力活动不足为基础的不良生活方式已经成为慢性病的最大“宿敌”,而与此相关的肥胖、高血压、高血脂、高血糖等已被明确为导致慢性病发生发展最直接的原因[73]。
肥胖、高血压等慢性病高危因素与膳食营养和体力活动密切关联。《2014年全球非传染性疾病现状报告》[169]和《中国居民营养与慢性病状况报告(2015年)》[26]提供的数据显示,全球人口高盐、高脂、高糖饮食和体力活动不足问题十分突出。2010—2014年间,全球15岁及以上人口年人均纯酒精消费约为6.2 L(相当于每人每天饮用13.5 g纯酒精),平均食盐摄入量每天约为10 g(世界卫生组织建议的食盐摄入量为<5 g/天),谷类食物消费明显下降,肉类油脂等动物性食物消费快速上升。全球18岁及以上成人体力活动不足发生率约为23%,11~17岁青少年体力活动不足发生率高达81%。与此同时,全球高血压发病率和肥胖者比例不断攀升。2003—2008年5年间全球人口高血压发病率增长了一倍,1980—2014年间肥胖者比例翻了一番。2012年,全球18岁及以上成人高血压患病率已达22%,有19亿人超重,其中,男性比例为38%,女性为40%,有6亿人肥胖,其中,男性比例为10%,女性为14%。慢性病发病率的飙升给家庭生活、卫生服务系统和公共财政带来了巨大压力,对低收入人群的影响尤为严重,已经成为全球最严重的公共卫生问题和社会问题,尤其是在中国,近30年来前所未有的经济发展速度和规模,促使了如过度饮食、久坐不动等慢性病高风险行为快速提升,呈现出慢性病高危因素的中国特色。
4 致病原因:“石器时代”的身体,“太空时代”的环境,我们的身体与生存环境存在着明显的错位
4.1 保守的基因进化节奏,高速的社会文化发展步伐,现代人类的生物进化与文化进化存在着明显的不同步
人类的进化包括生物进化和文化进化两个方面。
生物进化的本质是基因进化,进化的速度主要取决于基因突变的频率。对不同动物的同源基因测序结果表明,人与许多动物的基因序列差别不大。例如,尽管在进化树上人与同属于灵长类的红毛猩猩在1400万年前分离,但与红毛猩猩的基因组相似度达97%,与大猩猩在约1000万年前分离,基因相似度达98%,与黑猩猩的分离时间约在600万年前,基因组相似度高达99%,且有29%的共同基因编码生成同样的蛋白质[46]。人类生物进化的速度是十分缓慢的,虽经过数千代、甚至数万代的进化,其基因组变化仍然不大。
解剖学上的现代人大约在20万年前起源于非洲,在大约 5~10万年前,这些“人”走出非洲,迁往世界各地繁衍生息[6,116,156]。在迁徙过程中,自然气候、食物来源及生活方式等生存环境的改变都给人类的表型带来了强大的选择压力,使基因组中数以百计的区域再次受到“天择”的强力拣选,演变为新的基因组合。而在此后相当长的一段时期内,基因组合再没有发生太大的变化[8]。人类基因组测序结果表明,目前维持人体基本形态结构、生理功能、物质代谢以及对某些疾病易感性的基因,在过去的4万年间虽然受到了不同程度的选择性压力,但仍保持着相对的稳定[123],即使进化到现代智人阶段,其能量摄入、消耗以及对身体活动要求之间的复杂关系与过去的1万年前相比也仍然非常相似[59,70,142]。但人类的生存环境,尤其是社会文化环境却早已变得面目全非[68]。
与人类的生物进化进程相比,人类文化进化最大的特点是迅猛异常,令人“无暇应对”。目前,公认地球上出现真正意义上的“人”约在500万年前。如果以农业文明为发端,人类的文化进化时间则不过1万年,仅相当于人类全部进化时间的1/500;如果从公认的5000年人类文明史算起,人类的文化进化时间也仅相当于人类全部进化时间的1/1 000;如果从进入工业文明以来算起,人类的文化进化时间更短到还不到人类进化史的万分之一[4]。人类不仅彻底摆脱了狩猎采集生活,还通过定居、发展农业以及复杂的社会文化,操纵了自身的营养环境、社会环境以及自然环境,实现了从“寻找”食物到“创造”食物、“控制”食物的过程,结束了依赖天然食物而生存的状态,进入到了物质极大丰富的时代。人类通过发展科技,尽可能地降低了社会生产和家庭劳动中需要付出的体力,以致形成了当今“久坐不动”的“沙发土豆”式的生活。同时,人类实现了社会分工、私有制、国家产生、金属冶炼和科学与工业革命等一系列“文化突变”,使人类从“茹毛饮血,衣其羽皮”的漫长狩猎采集时代迅速走到了今天“上九天揽月,下五洋捉鳖”的信息时代。
人类的生物进化和社会文化进化是相伴而行、相互促进、相互协调,密不可分的,但这两种进化在人类不同的进化阶段中并非处于同等的地位(图2)。人类在进化的早期,主要是以自然选择为驱动力带来基因组改变,特别是涉及语言和脑部发育等重要基因上的改变,使人类的生物学表型特征从猿类中独立出来。进化至现代智人以后,那些塑造“人”生物特性的自然选择动力和人类所面临的生存压力在一步步减轻,“天择”逐步变为“人择”,基因发生突变的几率大大降低,使人类基因库保持着相对稳定。有研究显示,现代人类与旧石器时期的人类基因组相比,其差异仅为万分之二[69],而这些微小的差异,也仅限于农耕时代以后不断适应人类饮食结构变化、应对灾难性饥荒发生、抵御新的传染性疾病以及影响智力水平的一些基因,如乳糖酶基因、Foxp2基因、达菲抗原因子、ASPM基因、Mi-crocephalin基因等。而在另一方面,现代人类生存的社会环境和生活方式却发生了翻天覆地的变化,人类不再只是通过自己的身体被动地适应环境,而是通过制造工具、借助工具从事生产实践活动,对环境加以改造。同时,文化进化又促使人类迅速从旧石器时代相继跨进了新石器时代、金属器时代,继而又飞跃进入机器时代、电器时代、原子能与计算机时代以及信息时代,且每个时代的变迁又从几千年缩短到几百年、几十年[14](表1)。人类在科学技术发展上的突飞猛进,使人类认识世界和改造世界的能力不断加强,不但在获取物质财富方面取得了巨大的成功,而且逐步从繁重的体力劳动中解脱出来。在食物极为丰富的条件下,体力劳动就不再是社会的主流,以个人体力活动为特征的生产生活方式逐渐地被机械化和自动化的非体力方式所取代。极大地减少了必要体力消耗的现实,与人类永远不会“摆脱”自身基因“约束”的矛盾,致使人与环境的不匹配程度越来越大,迫使人类进入了一个“慢性病易感环境”的时代,导致肥胖(超重)、高血压、糖尿病、心脑血管疾病等“富贵病”、“文明病”逐步成为现代文明社会的流行病[17,124]。而这种现象,在以美国为代表的西方国家也就70、80年的事情,而在中国则只有30来年的时间。
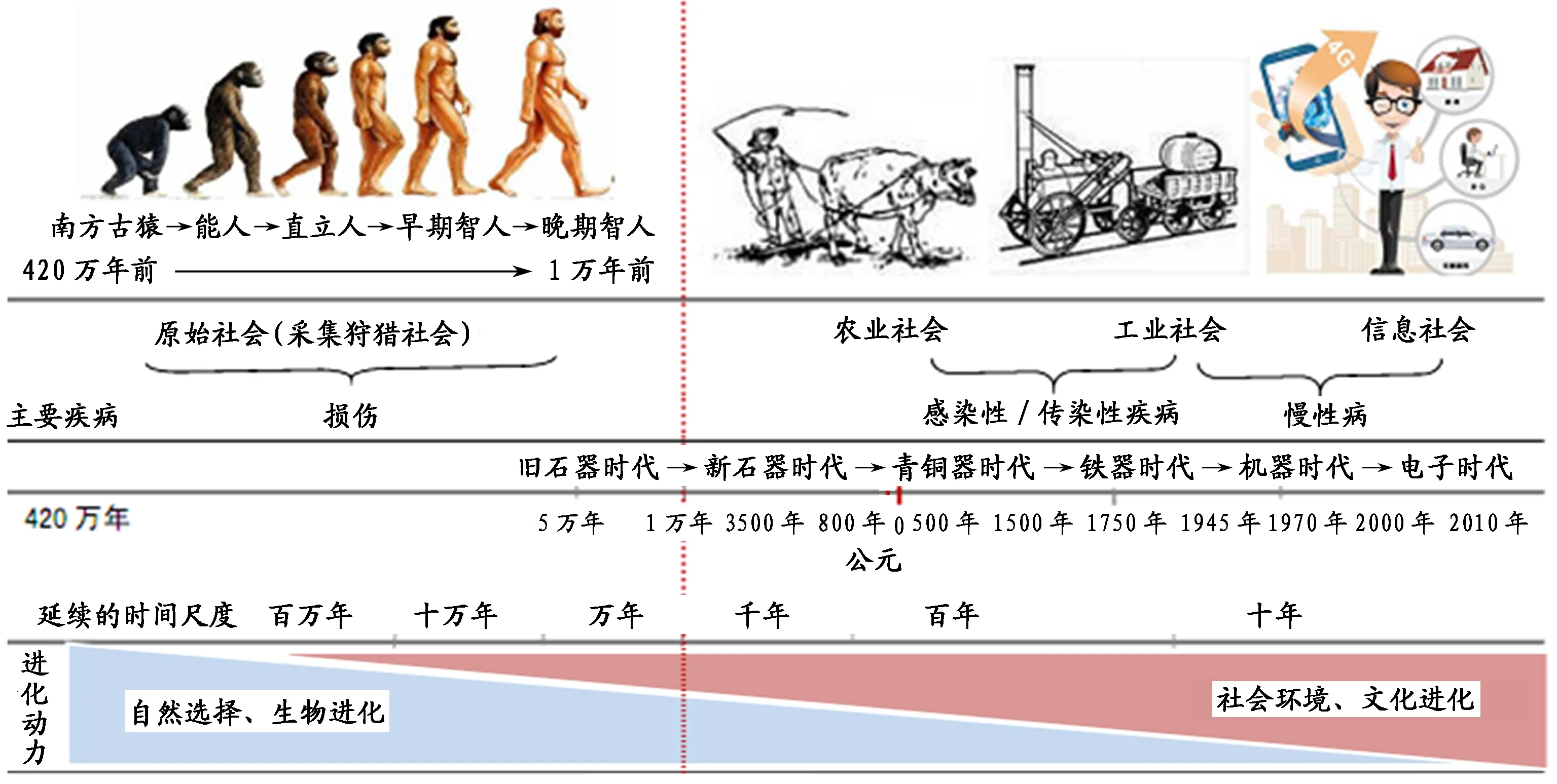
图 2 人类生物进化与社会文化进化Figure 2. Schematic Diagram on Human Biological Evolution and Social Cultural Evolution
注:本图为作者基于相关文献绘制。1)旧石器时代在考古学上是指以打制石器为标志的人类文明发展阶段,为距今约250万年—1万年间。2)人类自进化至南方古猿以来,后续的进化阶段所用的时间越来越短,且不同阶段进化的动力不同。
表 1 人类不同进化阶段所经历的代数[50]
Table 1 Generation Numbers in Different Evolutionary Stages of Human
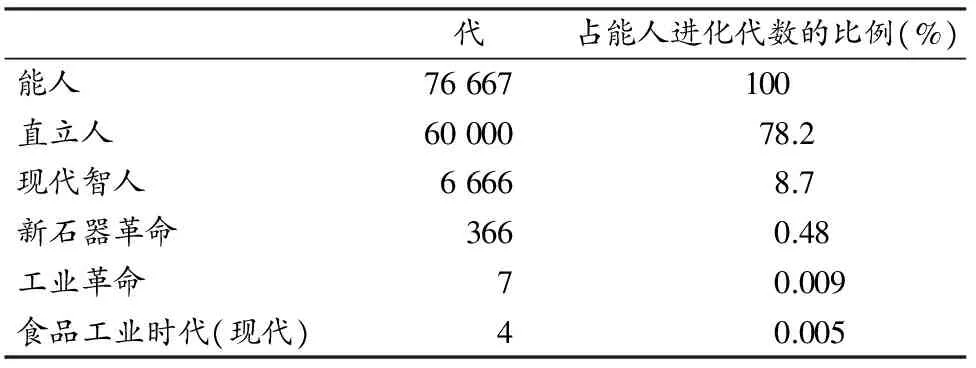
代占能人进化代数的比例(%)能人76667100直立人6000078.2现代智人66668.7新石器革命3660.48工业革命70.009食品工业时代(现代)40.005
综上,目前人类的基因组合仍基本停留在“石器时代”,但人类所处的社会生存环境已经发展到了“太空时代”,人类的“文化进化”与“生物进化”速率之间存在着巨大的“时空反差”[4]。已经适应古老环境和生活方式基因组合的身体,还没有足够时间来改变基因频率以适应当代社会文化发展的步伐[98]。或者说,还来不及适应当今人类文化变革的节奏和生活方式,进而导致两者之间发生错位,而这种错位的程度在近50年的时间里越来越突出[87],这可能就是引发当代人类慢性病发病率飙升的根源所在[70],也是当代人类社会文化快速发展所付出的一种代价。
4.2 节俭的身体,盛宴般的生活,当代人类的基因型与其所处的饮食环境存在着明显的不匹配
饮食是人类生存和繁衍最基本的条件,也是人类进化的主要动力,因此,从某种意义上说,人类是食物环境进化的产物。史前考古和现代田野考察证实,人类饮食大致经过了由本草为主肉食为辅的饮食,到肉食为主本草为辅,到肉食为主谷物为辅,再到谷物为主肉类为辅,最后发展到现在的高蛋白、高脂肪、高热量饮食的变迁[22]。不同进化时期,吃的方式、吃的内容、吃的观念在不断地发生着变换,并直接影响着人类的体质和健康水平[79]。起源于1.2万年前的农业革命,则使人类产生了从狩猎采集社会“寻找”食物到农耕社会“创造”食物的巨变,进而引发了人类饮食结构整体上的改变。
农耕乃衣食之源,人类文明之根。在距今1.2万年前后的新石器时代,人类学会了谷物栽培和家禽、家畜的培育、驯化,开始由食物的采集者转变为食物的生产者。食物获取方式的转变改变了人与自然的关系,改变了人对自然的单纯适应和简单依赖,为人类能够获得较为富足和稳定的食物来源,进入文明时代奠定了基础。引种栽培技术的发明,使人类过上了以淀粉类食物为主的定居生活,摆脱了“饥则求食,饱则弃余”的状态,结束了因寻找食物而游走的生活方式;金属工具的发明以及畜力和天然肥料的利用,使粮食产量不断上升,促使人类饮食结构和行为发生了根本性的改变;动物驯化以及肉乳类加工技术的发明,大大满足了人类对蛋白质、脂肪和热能的需求,使人的体力和智力不断提升[7]。但此时期对农产品的加工仍然比较原始简单,先民们吃的食物仍然非常“天然”。
自18世纪下半叶进入工业时代以降,随着科学技术突飞猛进和食品工业技术的不断革新,人类持续近万年的农业社会饮食结构和饮食行为再次发生了巨变,人类食物的种类和数量更加丰富[23]。农业机械的发明与应用引发了农业生产方式的根本变革[25];生物育种技术的发明和各种类型的化肥、农药、杀虫剂及除草剂的应用,促使农作物达到了空前的增产和增收[11],带来了糖、盐、脂肪(油)供应量和人均消费量的持续上升[33,91,157],人类仅用了其进化史上极为短暂的一段时间使自己膳食中的糖、盐、脂肪等营养素成分提高了数十倍[91],食物的加工方式也由农业社会的煮、蒸、炖、焖迅速演变为工业化社会的“炸、熏、烧、烤”。发达国家人口食物营养成分由旧石器时代低-中等密度能量、高蛋白、高纤维素、低碳水化合物、高维生素、高钙、高钾、低钠向高糖、高脂、高钠、高密度能量、低纤维素、低维生素的营养结构模式转换[58,79,91],而这种转换在以中国为代表的发展中国家也就30来年的时间,其转换的速率远远超过西方发达国家[66,134]。虽然这种“瞬间”发生的“营养转换”让人类摆脱了饥饿或饥荒的进化压力,但并没有让人类就此脱离自身基因的羁绊,反而使人类与营养有关的基因严重偏离了适应环境的最优条件,继而引发一系列人体生理病理的变化[161,177]。
大量的研究发现,在漫长的史前进化阶段,食物匮乏一直是人类进化面临的最大压力。那么,人类又是如何应对和适应的呢?美国密歇根大学人类遗传学家 James V.Neel 教授在1962年提出的“节俭基因型”学说[121]很好地解释了这个问题。该学说认为,在采集狩猎型社会和农业社会初期,人类会经常受到饥饿或饥荒的威胁。为应对环境中不可预知的食物供给压力,人类一些能够控制能量储存和消耗的基因在经过反复的饥荒选择后,逐渐演变为在食物充足时能有效储存能量,在食物短缺时尽可能减少消耗的“节俭基因”[166],以应对生命过程中难以预测的能源“赤字”,避免或减少食物短缺对身体的影响,提高人类自身的生存机会和种族繁衍[94]。从进化的角度看,“节俭基因”既是原始社会人类基因自然选择的结果,也是人类基因组强制性改造的结局[45],具有高度保守的能量感知机制,而通过遗传被保留下来的“节俭基因”则成为人类应对饥饿和饥荒的一种优势基因,并代代相传[176]。但是,随着社会经济的发展,当代人类的生存环境已经发生了根本的变化,经历几百万年自然选择进化而来的“近乎完美的基因组”以及身体结构和代谢机制根本无法迅速适应从贫瘠到富饶的饮食环境,由节俭基因控制的以脂肪组织形式储存的能量,却变成了人类的负担,成为了慢性病的元凶[43],而自然选择又没有充分的时间去改变在石器时代就已定型的“节俭基因”设计[98],致使人类的“节俭基因”在高能量摄入和低能量消耗的环境中不断被激活和表达[147],进而导致慢性病的发生[38,58]。
目前,关于“节俭”基因与环境不匹配理论对慢性病发病基础的解释不只限于肥胖、2型糖尿病、代谢综合征等与能量代谢有关的疾病,同样适用于其他多种慢性病。因为在人类进化的过程中,“节俭”的形式是多种多样的[9]。我们的祖先在没有走出非洲之前(约5~10万年前),当地炎热的气候条件和过度体力活动迫使其以大量出汗的形式维持体温恒定,而出汗会引起大量的水盐流失,致使血容量下降,血压下降,对人类的生存造成严重的威胁[6,179];另一方面,生活在这个时期的人类祖先,靠天然食物生存,每天摄入的盐量不到0.5 g,且多为被动摄入[35]。盐的透支和摄入不足造就了我们的祖先对它有特殊的亲和力,保护肾钠,便成为了人类生存的必要条件,“节钠”密码由此被写入人类的相关基因[165]。走出非洲后,离开了干旱高温的环境,人类的出汗量和钠盐的丢失大大减少,而进入农耕文明之后,盐的供应越来越充足,人主动食盐的欲望大增,至当代我们每天人均食盐量已平均达到10.0 g以上,与此同时,通过体力活动出汗丢失的盐量大大减少,而通过肾脏排钠的能力并未增强。适应了古老“低钠”环境的“节钠”基因很难在进化尺度如此短的时间内快速适应新的“高盐”环境,致使“节钠”的优势基因对“高盐”的饮食环境出现严重的不适应,进而成为“盐敏感性高血压”的发病基础[165](图3)。再比如,“好吃懒动”历来被认为是一种不良的生活习惯和行为,但它却能够在漫长的进化岁月中不被淘汰,且还会在今后一段相当长的时期内存在,其根本原因在于这种不良生活习惯和行为也是由几百万年进化而来的“节俭基因”所控制的,是过去几百万年中一种有利于人类生存的策略。从进化生理学上看,“好吃”是为了应对食物短缺时期的能量摄入不足,为身体储备能量;“懒动”则是为了尽可能地降低身体能量消耗,也是为了身体的能量储备[19]。因此,在当代人类生存的环境不再需要“好吃”为身体积攒能量,不再需要“懒动”为身体节省能量的时期,“好吃懒动”必然导致身体的能量过剩,引起肥胖等慢性病的发生。
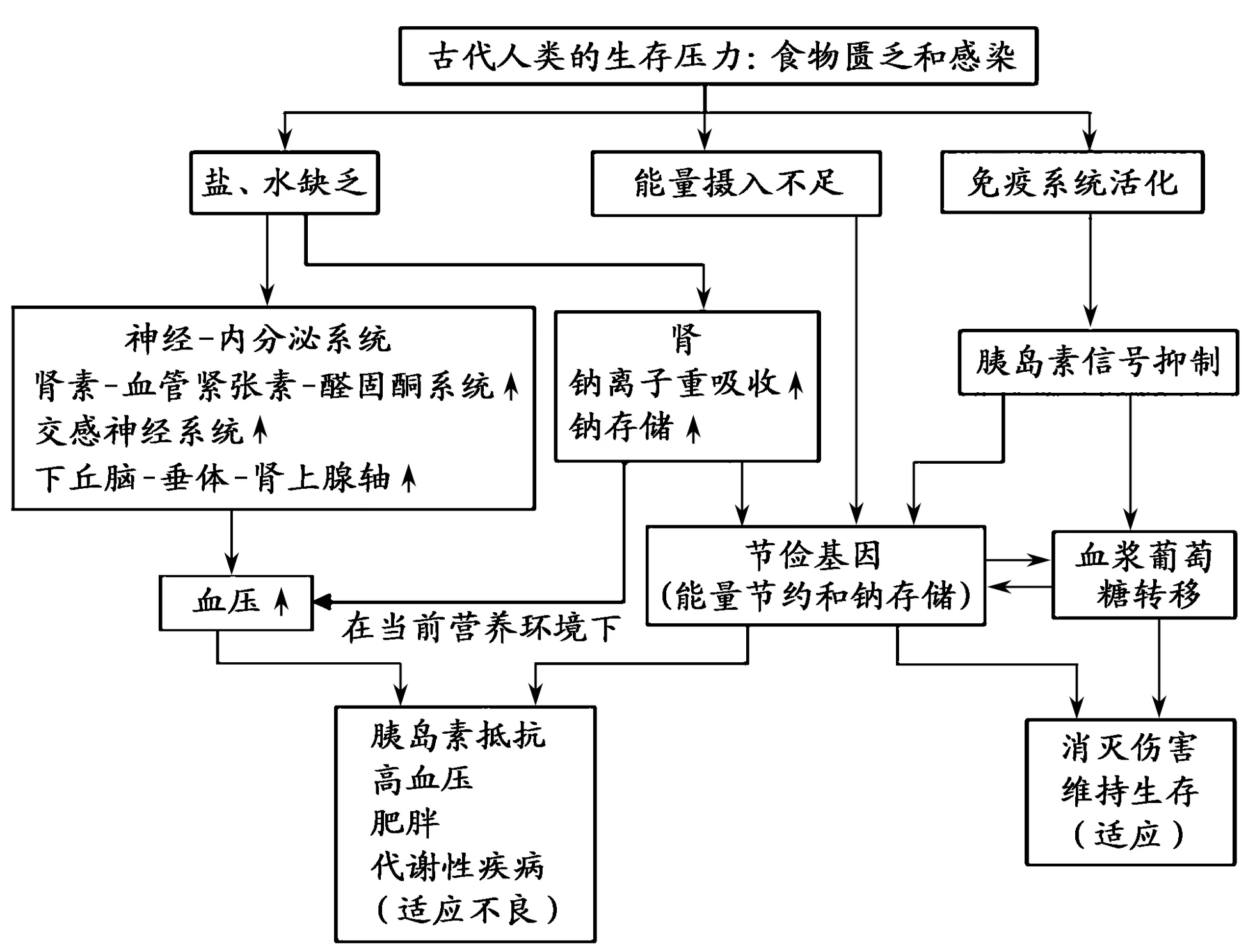
图 3 “节俭基因”作用框架图[178]Figure 3. Schematic Diagram on Roles of“Thrifty Genes”
4.3 “勤劳”的身体,久坐不动的生活,当代人类的基因型对其低能耗的体力活动存在着明显的不适应
在人类漫长的进化历程中,饮食和体力活动是人类生存的两个最基本的条件。离开饮食,人类将无法得到生命过程中所需要的能量;离开体力活动,人类就不可能得到食物[67]。有研究指出,无论是狩猎者、采集者,还是农业人口,食物供应和体力活动水平之间始终存在一种负相关关系[106]。还有研究指出,我们的原始祖先体力活动十分活跃,其缘由不是因为他们喜欢体力活动,而是因为他们不得不从事体力活动[135]。因为,在人类“寻找”和“创造”食物的自给自足自适应的时代,体力活动是一种不得已而为之的强制性行为,是个人和部落成员的一种生存需求[44]和选择性压力的需要[103],其动机是饥饿、干渴和危险[96]。
有研究发现,人类在旧石器时期就已经进化到高水平的能量消耗阶段[40],到晚期智人时代,体力活动已达相当高的水平[111,128],尤其是依赖于耐力的徒步行走,已演变成我们先祖生活中的重要组成部分[105]。例如,我们生活在非洲热带环境中的祖先,每天为寻找食物行走的路程平均要达到9~15 km,有时为了用棍棒挖到一些“根茎或块茎”,不得不花费2~3 h[114]。另外,对妇女来说,她们还不得不携带他们年幼的孩子去采集。有研究发现,一名母亲在她孩子4岁前的这段时期内,背着或者抱着孩子行走或奔跑的距离往往要超过3 500 km[67]。生存需要赋予了我们祖先最基本的走、跑、跳、投、悬垂、支撑、承载、攀登、爬越等身体活动能力[136],高水平的体力活动造就了我们祖先强壮、结实的身体。与此同时,“饥饿”需要“体力活动”来化解的进化力量,经过自然选择也早在旧石器时代就编入了我们祖先的基因组[40],而且在近万年的进化历程中并没有发生太大的变化[60]。
在人类由旧石器时代过渡到新石器时代(农耕社会)几千年的时间里,虽然获取食物的方式由狩猎采集变为谷物栽培和家禽、家畜的培育与驯化,过上了定居生活,但食物获取与强制性体力活动之间仍存在着密切的联系,由此建立的体力活动模式仍然比较稳定[159],每天因体力劳动消耗的能量并没有降低[106]。摄入的热量除维持人的基本生理需求外,基本被耕种、除草、收割、采摘、搬运、动物饲养、房屋和马厩建造等体力活动所消耗[111],能量代谢基本保持平衡状态,直到工业革命开始的18世纪末[67]。从18世纪后期到整个19世纪,随着蒸气机、纺织机、电动机等以“省力”为核心的工业革命出现,以个人体力活动为特征的生产生活方式逐渐地被机械化和自动化的非体力方式所取代,这大大降低了人类体力劳动的强度,促使职业性体力活动水平不断降低。进入20世纪,特别是第二次世界大战后,随着工业化、机械化、城市化的进一步发展,人类的劳动工具、劳动对象、劳动方式再次发生改变,从事久坐不动和低劳动强度工作的人口比例节节攀升[56],单纯依靠人力来完成的工种变得越来越少,劳动人口中平均每日用于工作的能量支出越来越低[56]。以美国为例,20世纪60年代初期美国私营行业的工作岗位中,约50%需要中等以上强度的体力活动,而2010年该比例已不足20%;与1960—1962年间相比,2003—2006年男性职业活动的能量消耗平均每日下降了142 kcal[56]。进入21世纪,随着“指尖”劳动时代的来临以及网上购物、上门服务、移动电话等“指尖消费”便利生活方式的出现,体力活动能量消耗占人体总能量消耗的比例进一步降低。与此同时,电视、互联网又进一步占用和剥夺了现代人大部分的户外运动时间,使得久坐群体不断扩大[116]。有研究显示,与2万年前的旧石器时代相比,当代人类每天行走的步数越来越少,仅使用动力机械以来,就下降了约50%~70%[44],平均每日总能量消耗仅相当于旧石器时代晚期智人的65%[48],而归咎于体力活动的能量消耗也由旧石器时代狩猎采集者的19.6~24.7 kcal/kg/d(男)、14.6 kcal/kg/d(女)分别下降到今天久坐不动者的4.4 kcal/kg/d(男)和4.2 kcal/kg/d(女)[101]。在中国,这些数据变化更加明显。仅在1991—2006年15年间,成年人每周体力活动水平就下降了32%,其中,职业性体力活动量下降了40%,每日锻炼、骑自行车、走路时间超过30 min的人群比例从1997年的46%~51%下降到2006年的28%~33%[146]。人类第一次进入体力活动不再是日常生活所必需的时代,大多数人离开体力活动仍能生存[78],“因食而动”的强制性体力活动基础逐渐被消除,能量消耗和热量摄入之间的进化联系被斩断,食物获取与体力活动之间的关系被终结[67]。
如上所述,久坐不动的生活方式破坏了我们“离不开体力活动”的遗传天性,加之现代社会竞争日益激烈,工作压力过大,生活节奏过快,使人无暇顾及身体锻炼,造成需要一定体力活动量才能表达的基因与其所处的能量支出环境出现严重的错位,进而引起古老复杂的身体代谢系统的破坏,尤其是能量代谢系统的失衡[49],最终导致慢性病发病率和死亡率的急剧增加[84](图4、图5),体力活动不足也因此成为了许多慢性病流行的根源[44]。

图 4 体力活动不足引发慢性病的的生物学基础[40]Figure 4. Biological Basis of Chronic Diseases Resulted from Physical Inactivity
4.4 “古老”的代谢方式,现代的“摄入”“消耗”,当代人类能量代谢的收支关系与基因型要求之间存在着明显的不兼容
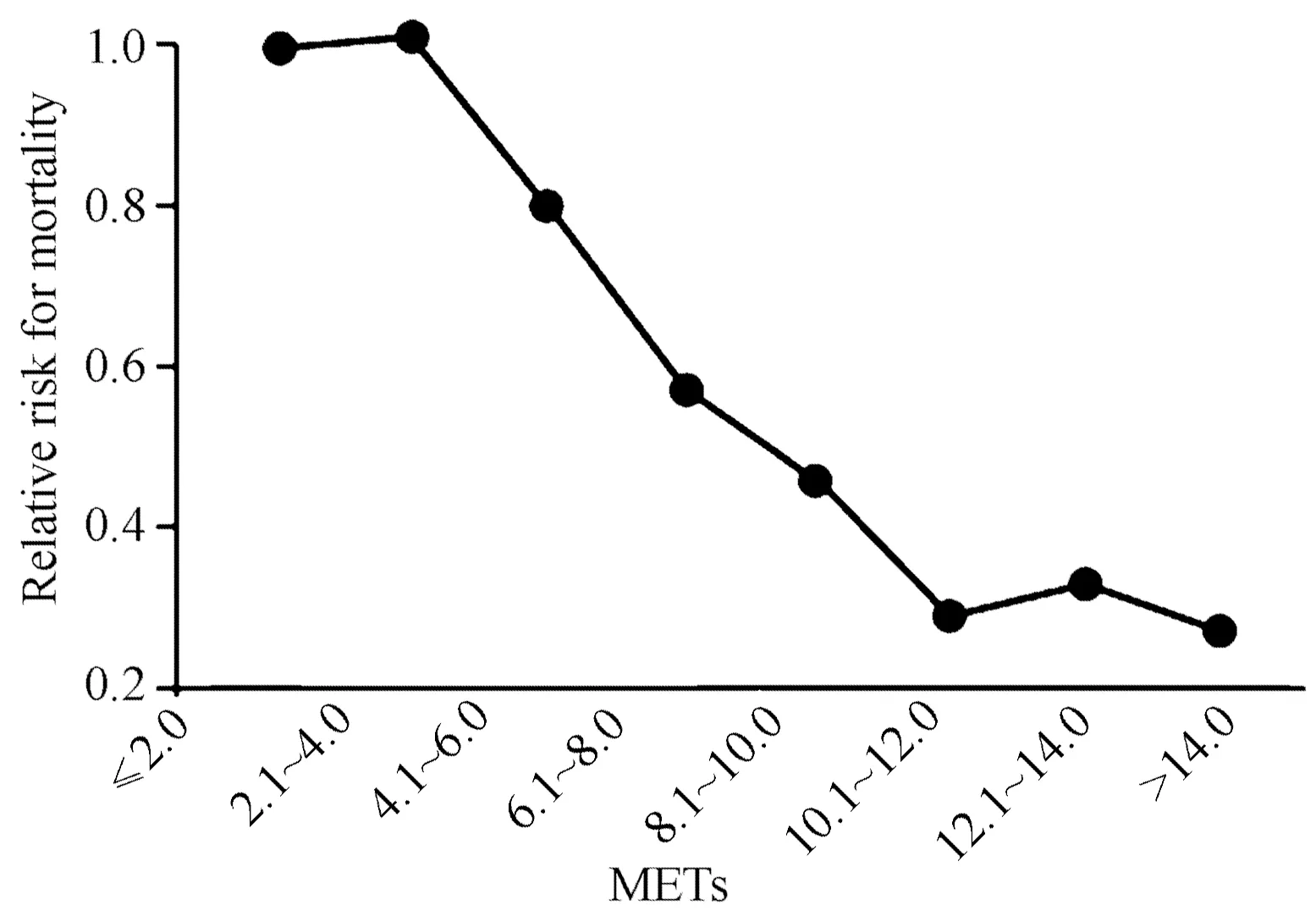
图 5 体力活动水平与慢性病死亡风险的关系[92]Figure 5. Relationships between Physical Activity Level and Death Risk of Chronic Diseases
人类的进化史从某种意义上说其实就是一部饥饿史[18],而人类的任何进化又无法逃离食物链中营养物质种类和代谢规律的制约[24]。在漫长的人类进化和迁徙过程中,总是伴随着在不断变化的外界环境选择下的适应。为解决饥饿和饥荒问题,人类通过自然选择进化出微妙的能控制物质和能量代谢的“节俭基因”组合[42],如过氧化物酶体增殖物激活受体(PPARs)家族、瘦素(1eptin)、胃饥饿素(Ghrelin)、LPL、UCP2、载脂蛋白E4(ApoE4)等[1,39],并由此使处于洪荒时代的人类祖先获得了显著的生存优势,即使是在近万年的食物供应稳定以后,这种基因也未被淘汰,仍在发挥着作用。因此,当代人类物质能量代谢方式仍然沿用着旧石器时代人类进化配置好的程序,而这种“程序”适合于“低热量摄入和高水平体力活动消耗”的能量代谢环境[144]。“富足的生活来得如此突然,饥饿的记忆仍存留在我们的基因里。”当人类快速进入随时可以获得丰富食物而消耗不足的当今社会时,“节俭”基因难以或来不及适应营养充足的环境,仍在不断地堆积脂肪,而与此相关的体力活动能量消耗却在不断下降,以脂肪形式储存的能量缺少被消耗的机会,肥胖便由此而生。
从消化系统的结构、功能来看,当代人类与其近亲黑猩猩相差无几,都是经过数百万年时间进化对饮食适应和磨合的结果[18],但从其饮食结构和营养成分上来看却存在着天壤之别。黑猩猩食物中有94%是植物性成分,纤维成分相对较多,种子所占比例较大,可吸收的营养成分较少。反观当代人类,其日常膳食中的纤维性成分很少,而高营养性的成分却很多,正好与黑猩猩的食物结构成分比例发生了颠倒。从进化史上看,人类虽然与黑猩猩在600 万年前就已发生分离,但进化到现在,其消化系统结构和灵长类动物的“食性”并没有太大改变,消化系统仍然对旧石器时代的“低-中等密度能量、高蛋白、高纤维素、低碳水化合物”的饮食结构“情有独钟”,而当代人类摄入的“高糖、高脂、高密度能量、低纤维素”的饮食成分,犹如“把汽油加注到柴油机里”,造成“机器”(身体)与“燃料”(能量物质)之间的不兼容,很容易引起身体的“发动机”提前报废,为代谢性疾病的流行提供了温床。
从能量供给方式上看,碳水化合物是人类能量供给最主要、最直接、最经济的来源,也是机体维持正常生理活动、生长发育和体力活动时的主要能量来源,尤其是脑对血液中的葡萄糖含量有特定的要求[31]。因为,在人类进化过程中,自然选择帮助我们祖先进化出了一个硕大的大脑,而脑组织本身并不具有能源物质储存的能力,需要随时从循环血液中摄取葡萄糖以供代谢之用[130],另外,脑组织的代谢“成本”相当高,重量仅占体重的2%,但能量需求却占到了基础代谢率的20%~25%[126]。在农业出现之前,远古人类能量的主要来源是通过猎取动物和采集野果及一些根茎类食物获得的,与现代人类的饮食结构相比,碳水化合物严重不足(<125 g/日)[12]。在生存压力胁迫下,机体能量代谢系统的首要任务是确保脑组织的能量供应[152](图6)和防止肌肉蛋白分解生糖(糖异生)[126]。因此,远古人类基因组中有经“自然选择”在饱餐后尽可能促使胰岛素大量分泌,将餐后升高的血糖转化为糖原和脂肪贮存起来,而在饥饿或低碳水化合物环境下,通过降低血胰岛素水平和抑制胰岛素的敏感性(即产生胰岛素抵抗),从而维持血糖含量相对恒定的“节糖”基因,如肾上腺素能受体、激素敏感脂酶、脂蛋白脂酶、PC-1和糖原合酶等[113、143],以保证机体的代谢机制始终处于“节糖”状态,并成为人类一种生存和繁殖优势。进入农耕社会,尤其是工业时代以后,虽然人类的营养环境被彻底改善,胰岛素抵抗的压力被逐渐解除,自然选择下的“节糖”基因被逐渐淡化,但并没被彻底淘汰,致其成为了糖尿病发生的遗传学基础[47]。高密度热量食物的摄入,可使餐后血糖负荷持续升高,迫使拥有“节俭基因型”的个体在饱餐后大量分泌胰岛素,并将信号传递给体内的胰岛素感应组织(如肌肉与脂肪),促使细胞膜表面葡萄糖转运蛋白4 (GLUT4)吸收葡萄糖,迫使血糖含量降低到正常范围(大约5 mmol/L)[148],以避免葡萄糖从尿中流失。但是,长期的餐后高血糖状态又会造成骨骼肌等组织对胰岛素的敏感性下降,代偿性引起胰岛β细胞胰岛素分泌量增加,进而产生高胰岛素血症,导致葡萄糖稳态破坏,出现葡萄糖耐量减低,最终引起2型糖尿病的发生[176]。因此,从某种程度上说,胰岛素抵抗机制犹如“达摩克利斯之剑”,对身体究竟起保护作用,还是破坏作用,完全取决于人类的能量供给和消耗环境[160]。
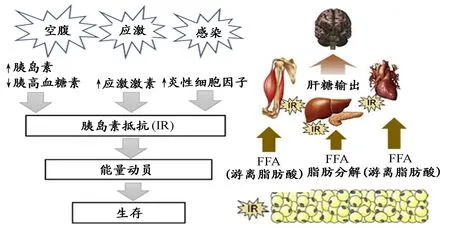
图 6 胰岛素抵抗的适应性作用[154]Figure 6. Adaptive Effect of Insulin Resistance
说明:在饥饿、应激、炎症等引起机体低血糖的状态下,身体通常通过两种途径发挥“节糖”作用,以保证脑组织对能量的需求。一是降低外围组织,尤其是骨骼肌对葡萄糖敏感度,减少外周组织对葡萄糖的摄取和利用,以确保脑组织的葡萄糖供应。二是通过脂肪组织将存储的甘油三酯分解成游离脂肪酸(FFA)和甘油,甘油进入肝脏通过糖异生作用,增加血液中葡萄糖含量;游离脂肪酸进入肝脏被转化为酮体,作为大脑的替代能源的底物。此外,游离脂肪酸还可以诱导肝脏和肌肉产生胰岛素抵抗,进而为大脑节省葡萄糖。
从能量的储存形式看,脂肪是人类能量储存最经济最合理的形式,这是因为:1)脂肪的热值最高,比糖或蛋白质高出1倍左右;2)脂肪是高度浓缩的高密度能量物质,单位体积储存的能量为糖原的6倍以上[13]。这就意味着,储存脂肪比储存糖更能节省“空间”。在漫长的人类进化过程中,人类不但需要大量的体力活动来获取食物,而且必须适应不断出现的食物短缺环境。因此,在应对频频出现的饥荒、战争、感染等环境压力下,人类通过“节俭”机制逐步衍变出一种能够将剩余能量转化为脂肪而储存的能力,即在食物丰盛时,尽可能地将摄入的多余能量以脂肪的形式储存于体内,以保证人类即使在没有食物的饥饿状态下,也能够通过储存的脂肪分解供能使其生存下去[103]。从进化论的观点看,这是人类对食物供应不稳定环境所产生的自适应反应[72],同时也是一种确保自身生存的策略。 但是,“进化的脚步往往追不上生产力提高的翅膀”,当人类快速暴露于食物供应相对稳定、过度饮食、体力活动消耗很少的现代生活环境下时,这种促使脂肪堆积的适应机制仍然继续发挥作用,其结果必然导致脂肪在身体中的堆积过多,多余的脂肪不但会储存在脂肪组织引起肥胖,而且也会溢出,沉积于内脏器官和血管、血液中,并通过一系列信号传导通路引起身体的物质能量代谢系统、免疫系统和生殖系统功能发生紊乱,导致糖尿病、高血压、代谢综合征等慢性病的发生(图7)。
从能量消耗的角度看,体力活动消耗是能量平衡方程中的一个关键变量[61],而经过自然选择与代谢有关的基因也不可避免地与体力活动联系在一起[43]。对一般成人而言,人体的能量消耗主要用于维持基础代谢、体力活动和食物热效应3方面的需要。在长期的进化过程中,人类不得不靠体力活动来生存,每天需要耗费巨大能量支出的体力活动来获取食物和水,同时还要应对随时而来的饥饿和危险。数百万年的自然选择和适应过程,造就了人类相当完善的能量摄入与消耗平衡的调节机制、代谢基因组合以及信号传导机制[43]。因此,至旧石器时期末期时,人类已经演变成非常“能干”的猎人和采集者。如前所述,当代人类的基因组型仍滞留于旧石器时代,但对体力活动的需求却发生了根本变化,与生俱来对体力活动就有要求的身体,由于久坐不动,既丧失了体力活动过程中超基础代谢几倍或十几倍的能量消耗,又丧失了以“运动后过量氧耗”为标志的额外能量消耗,致使能量摄入与支出之间出现明显的不匹配,留下了基因适应久坐不动生活方式的“艰辛”[123],导致大量消耗不掉的能量转化为脂肪堆积于体内,进而触发代谢功能障碍[115],影响到能量代谢的灵活性[95],并进一步诱发胰岛素抵抗,造成脂肪组织与肌肉能量物质转运障碍,肌肉脂肪酸氧化能力下降,脂肪异位储存等病理生理学变化[37],最终导致一系列代谢性疾病的发生(图8)。
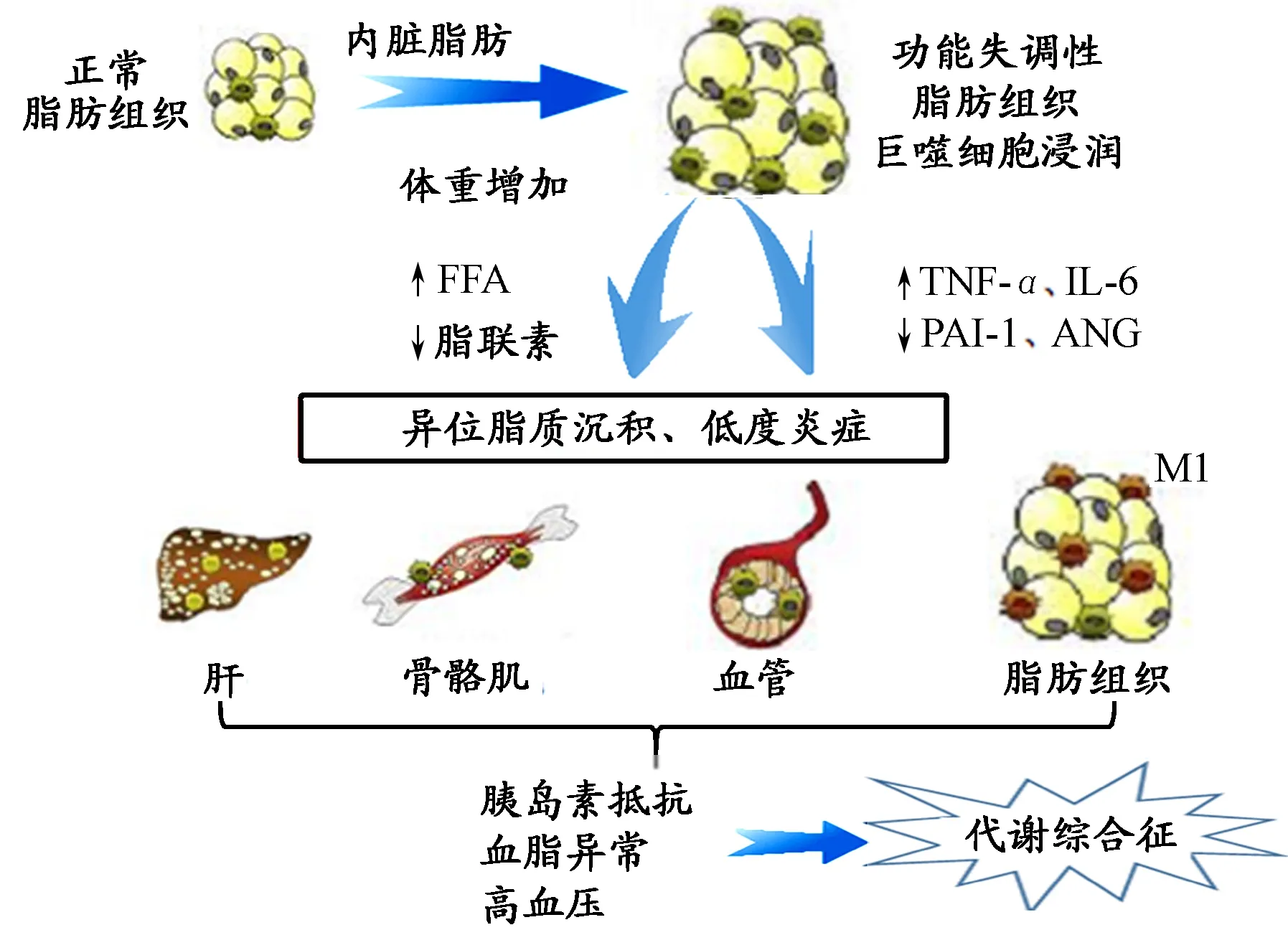
图 7 脂肪组织扩张、胰岛素抵抗和代谢综合征之间的关系Figure 7. Relationships between Adipose Tissue Dilatation,Insulin Resistance and Metabolic Syndrome
说明:在能量物质摄入过多的条件下,可引起脂肪组织扩张和体重增加,进而引起游离脂肪酸释放入血增多,脂联素分泌减少,炎性细胞因子、PAI-1和ANG分泌增加,巨噬细胞浸润,促使机体进入炎症状态,进一步激活胰岛素靶组织的胰岛素抵抗机制,引起胰岛素抵抗、血脂异常和高血压,导致代谢综合征的发生。
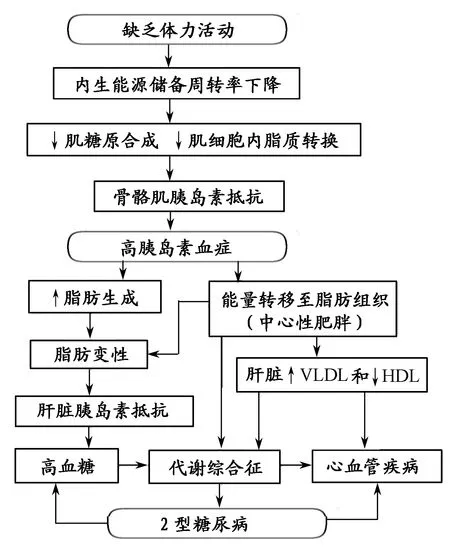
图 8 体力活动不足引发代谢性疾病的病理学基础[42]Figure 8. Pathological Basis of Metabolic Diseases Resulted from Physical Inactivity
5 发病机制:过度饮食和体力活动不足可通过基因的表观遗传修饰影响基因的表达,进而导致慢性病的发生
现代遗传学研究证实,人类的生命过程和健康状态受DNA编码信息、表观遗传学信息和环境因素的共同调控。DNA编码信息提供了合成生命所必需蛋白质的模板或蓝图,决定着人类的生命历程、健康状态和疾病易感性,而表观遗传学信息则提供了何时、何地以及如何应用DNA编码信息的指令[15]。因此,从遗传学角度看,基因表达离不开表观遗传学调控,而这种调控又极易受到诸如食物、药物、体力活动、压力、吸烟、酗酒、环境污染等环境因素变化的影响[51](图9),并通过表观遗传学机制影响到人体多种生理、病理过程[92]。由此看来,人体的性状、健康状态和疾病易感性都是基因与环境因素交互作用的结果,而表观遗传修饰则起到连接两者之间的纽带作用[163]。从进化角度说,当代许多疾病的发生,特别是一些所谓“现代病”“富贵病”,正是因为人类祖先在几万年生命过程中形成的表观遗传标记不能够适应近20、30年饮食结构与生活方式的巨大变化造成的[16]。
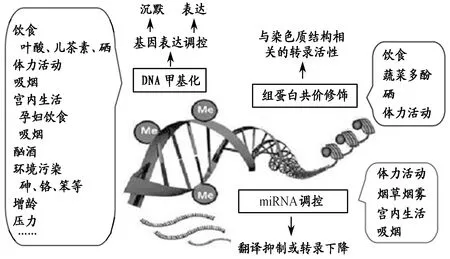
图 9 生活方式因素对基因表观遗传学的影响[29]Figure 9. Effect of Lifestyle Factors on Gene Epigenetics
作为日常生活中人与自然最亲密而又频繁的接触,饮食已被证明与表观遗传修饰密切相关[91]。食物中的蛋氨酸、丝氨酸、叶酸、胆碱、维生素B12等可直接作为甲基供体,参与脂肪代谢、氨基酸的转移和再生成、嘌呤和嘧啶的生物合成等多种生化过程,长期缺乏可导致基因甲基化水平降低,直接引起基因的稳定性和表达方面的改变[29,158]。食物中的染料木黄酮和儿茶素可以作用于DNA 甲基转移酶,白藜芦醇、丁酸、萝卜硫素和大蒜二丙烯硫醚可以抑制组蛋白去乙酰化酶,姜黄素可以抑制组蛋白酰基转移酶[126],这些生物活性成分的不足,可直接影响到基因的表观遗传修饰过程,进而影响基因的表达程度。此外,近年来越来越多的证据表明,饮食结构和量的变化也可通过表观遗传修饰机制影响某些基因的表达,导致慢性病的发生。Plagemann等[132,133]发现,能量物质过剩可提高实验动物下丘脑胰岛素受体基因启动子的甲基化过程,诱导下丘脑胰岛素抵抗,促使代谢性疾病的发生。Ng等[121]发现,父代高脂饮食能“编码”雌性子代胰岛β细胞基因表达,使其出现功能失调,致使雌性后裔过早地发生胰岛素分泌障碍和糖耐量受损。Plagemann等[132]发现,婴幼儿期过量进食会导致POMC(黑皮素原基因,被认为在食欲调节中起重要作用[149])启动子Spl和NF-kB结合序列附近超甲基化,致POMC表达下降,并与肥胖、高血糖现象的发生有关。Milagro等[119]发现,高能量饮食能诱导瘦素启动子超甲基化,致瘦素表达水平降低,并通过表观遗传学修饰影响瘦素转录表达而参与肥胖的形成。Garnås[79]认为,西方膳食中的高糖、高脂、高精制食品,具有上调炎性因子表达,增加慢性疾病风险的作用。综观目前的研究结论,先天与后天的营养结构等代谢因素均会对人体的表观遗传修饰产生强烈影响,进而引发代谢紊乱[80],包括:1)肥胖或超重;2)高血压;3)血脂异常;4)胰岛素抗性及(或)葡萄糖耐量异常等,而这些因素都是慢性病的诱发因素。
体力活动作为人类重要的生活方式之一,其水平高低不仅会影响到人的健康状态,也会影响到人对某些疾病的易感性,其机制也与基因的表观遗传修饰有关。如前所述,目前人类的基因型与1万年前的人类祖先差别不大,基因表达所需要的体力活动条件也相差不多。大量研究表明,机体某些基因的表达,需要体力活动量达到一定的阈值[41]。因此,适度的体力活动既是人的生理需要,也是身体某些基因表达的先决条件[96]。但是,当今久坐不动的生活方式难以满足旧石器时代晚期基因正常表达所需要的体力活动条件,结果导致某些基因异常表达,进而引发某些疾病[43](图10)。Alibegovic等[30]观察了20名健康年轻男子9天卧床休息后过氧化物酶体增殖物激活受体共激活因子1αγ(PPARgC1α)基因启动子区DNA甲基化状况,结果发现,9天的卧床休息在诱导胰岛素抵抗的同时,有4 500多个基因表达发生变化。4周身体有氧再训练后复查,并未能完全缓解卧床休息诱导的DNA甲基化,提示保持最低日常体力活动水平的重要性。White等[168]在分析647名非西班牙裔白人妇女身体活动水平与外周血白细胞DNA甲基化之间关系时发现,身体活动水平与白细胞DNA甲基化呈现正相关关系,推测DNA甲基化变化可能是生活方式和环境因素影响疾病的机制。Kirchner等[96]研究发现,久坐不动的生活方式可通过影响骨骼肌中的表观遗传修饰损害葡萄糖耐量。Fang等[74]发现,全基因组DNA甲基化随着身体活动水平的增加而增加,每天参加26~30 min体力活动的人群与每天体力活动不足10 min的人群相比,具有更高水平的全基因组DNA甲基化(95%CI:0.70,4.35)。Booth等[41]认为,体力活动不足对机体的影响类似于多个基因沉默造成的功能缺失,说明体力活动不足引发的慢性病与表观遗传修饰引发的基因异常表达有关。
6 应对策略:限制热量摄入,增加热量消耗,促使我们的生活方式与基因型相匹配
如上所述,当代人类慢性病高发的原因是基因型与环境发生了错位,这是当代人类社会快速发展所带来的附加问题。要彻底解决这个问题:一是通过进化机制,让那些“曾经近乎完美的人类基因组”中的“节俭基因”逐渐被自然选择所淘汰;二是改变“石器时代”的基因型,让我们的基因来适应当代的环境;三是改变当今的环境,让“石器时代”的基因型重新暴露在“石器时代”的环境中。然而,通过进化机制,淘汰“节俭基因”需要的时间太长,或许需要几千年,或许需要几万年,也可能需要几十万年,人类不可能被动地去等待。改变“石器时代”的“节俭基因型”,对人类的DNA重新进行编码,通过现代生物技术完全可以做得到,但许多伦理道德和法律方面的问题目前仍无法解决。而重新复制所有史前生活条件,营造“健康”的“石器时代”环境,让我们去过原始社会生活,既不可能,也不现实,并且我们没有理由去阻止科学发展、技术进步带来的环境变化和益处[43]。当代慢性病发病率的飙升,不是由于DNA编码序列发生改变所引起的,而是因为我们生活方式改变人为造成的错位导致基因表观遗传修饰发生变化影响到基因表达所造成的。我们无法在短的时间内改变我们的基因,也无法对我们基因组中的“节俭”基因进行改造,但我们可以通过改变生活方式和行为来影响基因表达。可以将石器时代人类生活环境特征作为一个模板,设计出相应的干预措施,模拟出包括饮食营养、体力活动水平在内的保持人类健康水平最适宜的环境,促使基因与环境匹配,以减少慢性病的发病率。
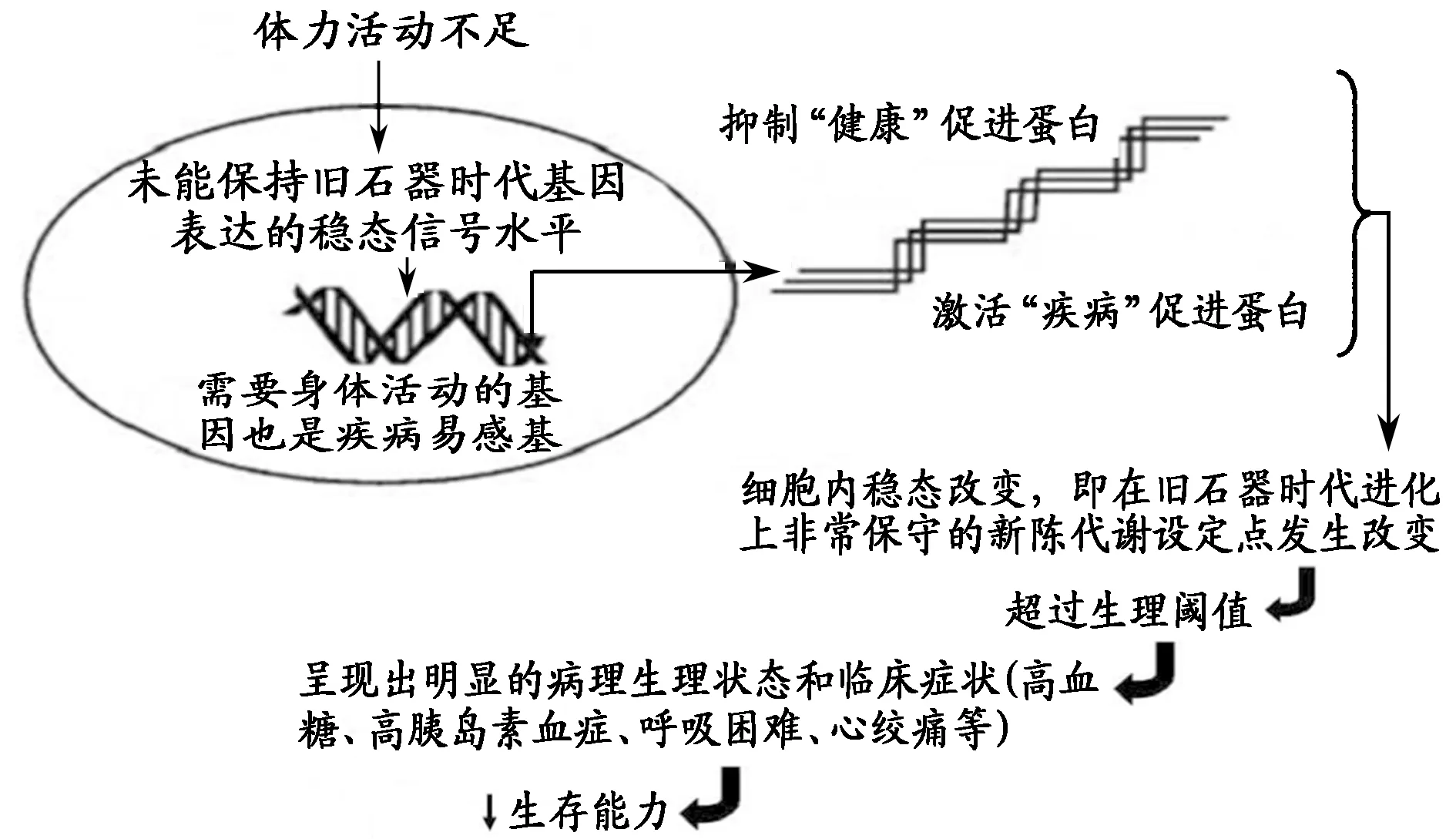
图 10 体力活动不足影响基因表达进而引发慢性病的机制[41]Figure 10. Mechanisms of Chronic Diseases Resulted from Effects of Physical Inactivity on Gene Expression
6.1 限制热量摄入,降低饮食与基因型错位带来的消极影响
热量限制是指在保证机体不发生营养不良的情况下,通过减少能源物质的摄入,限制每日总热量摄入的饮食方式。从目前的研究报道看,热量限制的程度不一,形式多样。大多数研究将每日所需热量减少15%~40%,部分研究采用400~800 kcal/d甚至更低的极低热量进食。从热量限制的形式看,包括短期限食(一般为7~10天)和长期限食(>10天);从热量限制的频率上看可分为间断限食(每周2天限食,余正常饮食)、隔日限食、连续限食等[2,20];从热量限制的内容看,可分为低蛋白饮食、低脂饮食、低碳水化合物饮食、低酮饮食及限食模拟剂的应用等[28]。
越来越多的研究证实,热量限制可增强胰岛素敏感性[36],降低空腹血糖、空腹胰岛素、血脂水平[124],改善炎症状态,减少动脉粥样硬化和冠心病发生风险[32],具有延缓衰老进程,抵御肥胖、2型糖尿病、高血压、心血管疾病、癌症等慢性病发生发展的作用[54,81,108,141,155]。Harvie等[83]曾对107名超重或肥胖的绝经期前女性进行为期6个月的热量限制干预,结果显示,无论是间断热量限制还是连续热量限制,均可减轻受试者的体重,降低甘油三醋、总胆固醇及低密度脂蛋白胆固醇水平,降低空腹胰岛素水平,改善胰岛素抵抗。Malandrucco等[109]对14例重度肥胖(BMI>40)的2型糖尿病患者进行极低热量饮食干预(400 kcal/d ) 7天后,患者体重、空腹血糖及甘油三醋显著下降,与此同时,机体葡萄糖处置指数由59.0±6.3 ml/min/m2增加到75.5±6.3 ml/min/m2。Barzilai等[34]研究发现,大鼠限食18个月后,肝脏胰岛素敏感性可恢复至年轻大鼠(4月龄)水平。Fontana等[75]观察了为期6年的热量限制对冠状动脉粥样硬化危险因子的影响,结果显示,与对照组比较,热量限制组血清总胆固醇、低密度脂蛋白胆固醇、甘油三醋、空腹血糖、胰岛素、超敏C反应蛋白、血小板衍化生长因子-AB、收缩压及舒张压均显著下降,高密度脂蛋白胆固醇水平升高,颈动脉内膜中层厚度减少约40%,提示,长期热量限制能有效降低动脉粥样硬化的风险。Mattison等[114]研究显示,热量限制能显著减少猕猴衰老相关疾病的发生率。Lefevre等[101]研究发现,短期的热量限制可改善人胰岛素敏感性,降低心血管疾病风险。杨玉彬等[21]观察了不同热量限制方法对胰岛素抵抗肥胖大鼠糖脂代谢和脂肪细胞分化的作用,结果显示,CR50%(CR,热量限制)和IF(间接禁食)可通过调节脂肪细胞分化的作用,改善胰岛素抵抗肥胖大鼠的糖脂代谢,其中,IF对胰岛素抵抗有更好的改善作用。Lillycrop等[106]发现,热量限制能影响或逆转甲基化状态,具有延迟与年龄有关疾病发生和增寿的作用。
目前,关于热量限制防治慢性病的机制尚未完全明了。从进化论角度看,热量限制能给当代人类仍停留在“石器时代”的、已经适应了能量缺乏的基因一个良好的营养环境,有利于纠正“节俭基因型”与能量供给之间的错位[162]。从表观遗传学角度看,热量限制可通过修饰表观遗传特征,调控与衰老相关疾病的信号通路(mTOR、AMPK、p53、FOXO、 Sirtuins)以及调节细胞间相互作用的因子如脂联素、肿瘤坏死因子-α等发挥作用[138]。SIRT1作为能量和代谢动态平衡中一个重要调节因子,参与胰岛素信号通路的调节,与调控机体的衰老、应激、代谢、凋亡、多种关键生理过程密切相关。SIRT1水平的降低可导致炎症 、心血管疾病 、糖尿病 、神经系统退行性变等许多疾病的发生。大量的动物实验和人体试验证实,热量限制具有强烈诱导SIRT1蛋白表达的作用,可使许多与代谢有关的组织器官,如心、脑、肾、肠、肌肉和脂肪组织中的SIRTl表达上调[53,63,118],并通过作用于PGC-lα和PPAR-γ等蛋白调节糖脂代谢,降低胰岛素抵抗者空腹血糖和胰岛素水平,逆转胰岛素抵抗。此外,Shimazu等[145]认为,长期低热量饮食有助于保护细胞免受“氧化应激”损害,使细胞免于老化。Quintas等[137]研究发现,热量限制能对空腹血清瘦素产生显著影响。Westerheide等[167]发现,热量限制可通过去乙酰化作用增强热休克转录因子1(HSFl)的活性,有助于防止蛋白质损伤和错误折叠。Widiker等[173]发现,热量限制能引起大鼠体重调节基因Mc4r甲基化水平降低。这些研究结论说明,热量限制在防止慢性病发生发展方面具有多途径、多靶点的作用。
当代人类许多慢性病的发生与高糖、高脂等高密度能量食物摄入过多和低纤维素类食物摄入不足有关。因此,热量控制应成为慢性病饮食防治的首要原则。从进化角度看,这也是一种对石器时代热量摄入的回归,其目的是促使我们摄入的能量与我们的基因型需求更加匹配。但是,在控制总热量摄入的同时,要掌握好三大热能营养素的比例,达到“平衡膳食”“食谱广泛”,同时,要保证机体必需营养素的供给,防止营养缺乏,否则,也会对身体产生不良影响。近年来在欧洲和美国兴起了一股崇尚旧石器时代饮食的热潮。越来越多的人意识到,多吃季节性的水果、蔬菜、坚果、瘦肉、贝类、鱼类和谷类食物,不吃或少吃精加工食品,如糖类、面包及奶油,保持微量元素均衡,有利于维持DNA的甲基化和组蛋白修饰酶的活性,对降低糖尿病、高血压、肥胖、癌症等慢性病的发生率具有良好效果,值得我们借鉴。
6.2 加强身体锻炼,满足基因表达所需要的体力活动水平条件
生活在当今的人类,职业性、交通性、家务性体力活动水平呈明显降低已成为不争的事实。因此,增加体力活动水平唯一的机会就是在休闲时间里进行体育锻炼。大量研究表明,体力活动既是能量消耗的关键决定因素,也是维持能量平衡和控制体重的基础,还是慢性病非药物治疗的重要手段[171,172]。Coker等[57]发现,热量限制与体育运动干预引起的体重减轻均可使内脏脂肪减少及肝脏胰岛素抵抗降低,但体育运动的作用要比热量限制大2倍以上,且体育运动引起的体重下降能更好地保留瘦组织,既能减少内脏脂肪组织及肝脏胰岛素抵抗,也能显著降低外周胰岛素抵抗。Lee等[99]研究显示,无热量摄入限制的有氧运动或抗阻运动均可减少中度肥胖青少年腹部脂肪和肝内脂肪含量,且抗阻运动对改善其胰岛素敏感性的效果更好。Davis等[62]研究发现,13周的每天20 min或40 min的有氧运动训练均可降低糖尿病的发生风险。 Phielix等[131]研究发现,长期运动可降低脂质引起的胰岛素抵抗,具有削弱脂质降低葡萄糖非氧化处理水平的作用。Hu等[85,86,111]发现,每周参加2.5~3.0 h中等强度的运动锻炼,可减少30%的中风、2型糖尿病和心脏病的发病风险。Hall[82]根据能量消耗、体重和脂肪含量的变化,利用计算机模拟单纯限食或运动的减重效果,发现单纯饮食干预30周减重34 kg,其中,65%来自脂肪减少;单纯运动30周减重27 kg,102%来自脂肪的减少。虽然单纯饮食减重更显著,但约35%减的是去脂体重;相反,运动主要减少的是体脂含量,而去脂体重(瘦组织)轻度增加。为此,研究者提出,20%的热量限制联合20 min/d的运动最适宜作为控制体重的长期策略。Sofien等[153]发现,有氧运动不仅能够有效降低肥胖儿童的脂肪量,还能够使内分泌环境中各种代谢传导通路恢复稳定,改善机体的炎症反应和瘦素抵抗。Sinha等[150]认为,进行运动干预的目的是促使“节俭”基因更加适应当代人类盛宴般的生活,抑制能量物质病理性存储,恢复代谢的灵活性。
越来越多的证据表明,运动通过对表观遗传修饰产生良性影响,进而影响到与代谢有关基因的表达可能是运动防治慢性病发生发展的一个重要机制[5]。Ntanasisstathopoulos等[122]研究发现,运动可通过诱导适应各种代谢压力的表观遗传变化,在预防和对抗代谢综合征中扮演着重要的角色。Pareja-Galean等[129]发现,运动可引起表观遗传修饰和许多表观遗传酶可能依赖的代谢物的变化,如氧、三羧酸循环中间体、2-酮戊二酸、2-羟戊二酸、β-羟基丁酸。Ling等[107]认为,运动锻炼能改变多种组织的基因表达模式,影响糖、脂代谢以及线粒体功能[55,88,94]。Ren等[138]发现,经常参加太极拳练习可改善增龄引起的相关基因甲基化状况,包括与DNA合成和修复有关的RAD50、ERCC1,与氧化相关的NADPH、G6PD和基因转录(ESR1)。Dos Santos等[65]研究发现,规律运动可通过腺苷酸活化蛋白激酶(AMPK)和钙调蛋白激酶激活抑制组蛋白去乙酰化酶(HDAC)影响GLUT4启动子甲基化,促进2型糖尿病患者骨骼肌GLUT4的表达增加,提高肌肉对葡萄糖的摄取。Denham等[64]发现,4周的冲刺间隔训练可显著降低健康男性低密度脂蛋白胆固醇浓度和白细胞全基因组DNA甲基化变化。Ronn等[140]发现,2型糖尿病患者进行6个月的有氧运动训练,可显著改变脂肪细胞全基因组DNA甲基化状态,包括18个肥胖候选基因和21个2型糖尿病候选基因。Wardle等[164]研究表明,由FTO基因变异诱导的2型糖尿病、肥胖可以通过增加体力活动来得到缓解。Elsner等[71]发现,长期规律的有氧运动可通过增加大鼠海马组蛋白乙酰化酶(HAT)活性和降低组蛋白去乙酰化酶(HDAC)活性诱导组蛋白乙酰化。Smith等[151]发现,游泳训练可增加葡萄糖转运体4 (GLUT4)基因与心肌细胞增强因子2结合部位的组蛋白H3的乙酰化水平。Fu等[77]研究发现,有氧运动可引起小鼠骨骼肌基因表达谱发生改变,其中40个基因与运动改善高脂饮食诱导的IR有关。Freitas等[76]研究发现,有氧运动可增加糖尿病大鼠瘦素受体的基因表达水平和蛋白表达水平,从而影响瘦素水平,改善糖尿病大鼠胰岛素分泌,并缓解瘦素抵抗现象。陈平等[3]研究表明,运动可能通过影响大鼠血清瘦素、下丘脑瘦素受体DNA启动子区DNA甲基化修饰,从而通过降低血清瘦素mRNA的表达水平以及提高下丘脑瘦素受体mRNA的表达水平,导致血清瘦素浓度降低,缓解瘦素抵抗。Abu-Farha等[27]对48名男性健康非糖尿病成人和37例肥胖患者进行为期3个月的体育运动干预,发现在肥胖患者脂肪组织中上调的凝血酶敏感蛋白1(TSPI)经体育运动后出现显著下降,而下调的组蛋白脱乙酰基酶4(HDAC4)经体育运动干预3个月后出现显著增加。为此,许多运动医学研究者提出,参与休闲性体力活动是一种基于人类进化进程的需要,如果能在保证足够热量消耗的基础上,选择一些“返祖”式运动,如匍爬行走、踏石运动、赤足行走、负重行走、倒走、倒立等,可能效果会更好一些。
7 结束语
当今人类肥胖、2型糖尿病等慢性病高发的原因是基因与饮食、体力活动等多种环境因素之间的错位造成的。从进化角度看,随着人工智能、生物技术、虚拟技术、遗传工程和电子人技术在未来的进一步发展,低能量消耗、久坐不动的生活方式还会继续下去,并将促使人类自身由纯粹的自然人、肉体人快速向机器-自然人、电子-自然人方向进化,但人的基因组合在短时期内仍不会有太大的改变。因此,要想防止慢性病发生发展,促使我们的基因与环境相匹配,改变环境和生活方式是关键。从病因学以及饮食与体力活动的关系上看,以肥胖、胰岛素抵抗为代表的引发慢性病高危因素持续存在,与其说是“盛宴”般的生活促使身体能量堆积导致的,倒不如说是工业化社会的人以“节俭体力的生活方式节省了能量”引起的。因为,在体力活动水平较高的情况下,即使有较高的能量摄入,由于同时伴有较高的能量消耗,也不会引起能量的堆积,造成肥胖等慢性病的发生。重体力劳动者、运动员等,虽然摄入的能量要比一般人大得多,却很少患有肥胖、2型糖尿病等慢性病。因此,在慢性病的病因学中,体力活动不足要比热量摄入过多更为重要。从干预的角度看,体力活动水平越高,控制能量摄入的回旋余地就越大,干预的效果就越好。因为,在以久坐不动生活方式为主,体力消耗量到了少之又少的情况下,要使摄入的能量不超过消耗,就要对膳食能量的摄入总量提出极为苛刻的要求。但在实际操作中又会由于各种原因,如认识上的误区、享受口福的愿望、饮食习惯、饱腹感的要求以及精细调整能量摄入操作上的难度,难以将膳食能量摄入相应地减下来与极低的代谢率相匹配。也就是说,在缺乏体力活动的情况下,控制能量的摄入已经没有太大的空间。因此,预防慢性病的发生与发展,增大“消耗”比控制“摄入”更重要,“迈开腿”比“管住嘴”效果更好。本文反复强调体力活动不足作为慢性病发生的病理学基础,不仅是基于体力活动不足导致当代人类慢性病高发这个基本事实,更重要的还在于“增加体力活动”,尤其是闲暇时间中的体育活动,可迅速扭转当代人类基因与环境间的错位,并成为慢性病三级预防的强大力量,护佑当今世界庞大的“久坐不动”人群的健康。
[1]常永生,方福德.PPARγ——节俭基因的主控基因[J].中国医学科学院学报,2002,24:315-320.
[2]陈国芳,刘超.对限食疗法的新认识[J].中华内分泌代谢杂志,2013,29(4):269-272.
[3]陈平,孙剑.运动联合膳食干预改善肥胖大鼠瘦素抵抗的可能机制——基于食欲调节因子基因启动子区DNA甲基化的探讨[J].沈阳体育学院学报,2016,35(3):66-73.
[4]程焉平.从“双重进化”的视域辨析人类社会[J].吉林师范大学学报:人文社会科学版,2013,41(1):30-33.
[5]杜明斗.代谢综合征体力活动不足病因论[M].杭州:浙江大学出版社,2015:207.
[6]季林丹,钱海霞,徐进.高血压易感基因的分子进化[J].遗传,2014,36(12):1195-1203.
[7]赖来展,张奇志.人类食物营养改善的若干阶段及其发展趋势[J].中国食物与营养,2007(7):55-57.
[8]黎群武.评人类的新进化[J].医学与哲学,2011,32(17):1-4.
[9]李骁.全球人群肾素—血管紧张素—醛固酮通路内关键基因的空间遗传学研究[D].济南:山东大学,2011.
[10]林旭,黎怀星,叶兴旺,等.环境和遗传因素与慢性代谢性疾病的人群研究[J].生命科学,2012,(7):614-625.
[11]刘雯,徐飞.从天然到人工:科技进步对人类食品的影响[J].自然杂志,2006,28(3):167-171.
[12]楼秀余.从人类进化角度剖析肥胖症和Ⅱ型糖尿病[J].中国保健营养月刊,2012,22(10):4694-4695.
[13]欧伶.应用生物化学[M].北京:化学工业出版社,2001:217-218.
[14]乔玉成.进化·退化:人类体质的演变及其成因分析——体质人类学视角[J].体育科学,2011,31(6):87-96.
[15]乔玉成,王卫军.规律运动干预人类衰老过程的表观遗传学机制研究进展[J].北京体育大学学报,2016(1):61-67.
[16]师明磊,赵志虎.表观遗传、环境与疾病[J].中国医药生物技术,2013,8(5):362-367.
[17]吴静,王宏伟,温宇.从人类能量代谢进化视角理解肥胖发生机制[J].中华内分泌代谢杂志,2007,23(4):375-378.
[18]武延生.进化与进食[J].科技资讯,2012,(31):229-229.
[19]杨建伟,孙玉春,李泽兵,等.进化论在心血管病康复领域中的应用[J].上海预防医学,2002,14(12):565-567.
[20]杨婉薇,张家明,刘超.限食疗法的研究进展[J].中华内分泌代谢杂志,2014,30(11):1005-1008.
[21]杨玉彬,柯斌,秦鉴.不同热量限制方法对胰岛素抵抗肥胖大鼠糖脂代谢及脂肪细胞分化的作用研究[J].中国全科医学,2016,19(18):2156-2160.
[22]于冬梅,翟凤英.人类进化与饮食变迁[J].营养健康新观察,2004,(1):9-11.
[23]张箭.人类食物结构演变初论[J].经济社会史评论,2016(1):102-110.
[24]张双船.再议物种起源:一本物种以及物种起源与进化无关的书[M].深圳:海天出版社,2014:291.
[25]赵岩,张莹,朱风涛,等.从人类食物变迁探讨科技的理性回归[J].中国科技信息,2012(1):50-51.
[26]中华人民共和国国家卫生和计划生育委员会.中国居民营养与慢性病状况报告(2015年)[EB/OL].http://health.sohu.com/20150705/n416207470.shtml.
[27]ABU-FARHA M,TISS A,ABUBAKER J,etal.Proteomics analysis of human obesity reveals the epigenetic factor HDAC4 as a potential target for obesity[J].Plos One,2013,8(9):854-858.
[28]AJALA O,ENGLISH P,PINKNEY J.Systematic review and meta-analysis of different dietary approaches to the management of type 2 diabetes[J].Am J Clin Nutr,2013,97(3):505-516.
[30]ALIBEGOVIC A C,SONNE M P,HØJBJERRE L,etal.Insulin resistance induced by physical inactivity is associated with multiple transcriptional changes in skeletal muscle in young men[J].Am J Physiol Endoc M,2010,299(5):E752-E763.
[31]ARMSTRONG E.Relative brain size and metabolism in mammals[J].Sci,1983,220(4603):1302-1304.
[32]BALES C W,KRAUS W E.Caloric restriction:implications for human cardiometabolic health[J].J Cardiopulm Rehabil,2013,33(4):201-208.
[33]BARNARD N D.Trends in food availability,1909—2007[J].Am J Clin Nutr,2010,91(5):1530S-1536S.
[34]BARZILAI N,BANERJEE S,HAWKINS M,etal.Caloric restriction reverses hepatic insulin resistance in aging rats by decreasing visceral fat[J].J Clin Invest,1998,101(7):1353-1361.
[35]BATUMAN V.Salt and hypertension:why is there still a debate?[J].Kidney Int Suppl,2013,3(4):316-320.
[36]BAUMEIER C,KAISER D,HEEREN J,etal.Caloric restriction and intermittent fasting alter hepatic lipid droplet proteome and diacylglycerol species and prevent diabetes in NZO mice[J].Biochim Biophys Acta,2015,1851(5):566-576.
[37]BERGOUIGNAN A,RUDWILL F,SIMON C,etal.Physical inactivity as the culprit of metabolic inflexibility:evidence from bed-rest studies[J].J Appl Physiol,2011,111(4):1201-1210.
[38]BERTELLI M,ALUSHI B,VEICSTEINAS A.Physical exercise to prevent multifactorial diseases:a warning written in our genes?[J].Sport Sci Health,2008,4(1-2):33-35.
[39]BERTELLI M,ALUSHI B,VEICSTEINAS A.Physical exercise to prevent multifactorial diseases:a warning written in our genes?[J].Sport Sci Health,2008,4(1-2):33-35.
[40]BOOTH F W,CHAKRAVARTHY M V,GORDON S E,etal.Waging war on physical inactivity:using modern molecular ammunition against an ancient enemy[J].J Appl Physiol,2002,93(1):3-30.
[41]BOOTH F W,CHAKRAVARTHY M V,SPANGENBURG E E.Exercise and gene expression:physiological regulation of the human genome through physical activity[J].J Physiol,2002,543(2):399-411.
[42]BOOTH F W,LAYE M J,LEES S J,etal.Reduced physical activity and risk of chronic disease:the biology behind the consequences[J].Arbeitsphysiologie,2008,102(4):381-390.
[43]BOOTH F W,LEES S J.Fundamental questions about genes,inactivity,and chronic diseases[J].Physiol Genomics,2007,28(2):146-157.
[44]BOOTH F W,ROBERTS C K,LAYE M J.Lack of exercise is a major cause of chronic diseases[J].Compr Physiol,2012,2(2):1143-1211.
[45]BOULLOSA D A,ABREU L,VARELA-SANZ A,etal.Do olympic athletes train as in the Paleolithic era?[J].Sports Med,2013,43(10):909-917.
[46]BRADLEY A.Mining the mouse genome[J].Nature,2002,420(6915):512-514.
[47]BRAND-MILLER J C,GRIFFIN H J,COLAGIURI S.The carnivore connection hypothesis:revisited[J].J Obesity,2012,2012(1):1-9.
[48]BROWN J,SMITH J M.The cost of physical inactivity to a nation:the role of sports medicine and its allied health professionals in preventing a crisis[J].South African J Sports Med,2009,21(3):102-103.
[49]BRÜNE M,HOCHBERG Z.Secular trends in new childhood epidemics:insights from evolutionary,medicine[J].Bmc Medi,2013,11(1):1-5.
[50]CARRERABASTOS P,FONTESVILLALBA M,O’KEEFE J H,etal.The western diet and lifestyle and diseases of civilization[J].Res Rep Clin Cardiol,2011,2(2):2-15.
[51]CHAKRAVARTHY M V,JOYNER M J,BOOTH F W.An obligation for primary care physicians to prescribe physical activity to sedentary patients to reduce the risk of chronic health conditions[J].Mayo Clin Proc,2002,77(2):165-173.
[52]CHAN J C,MALIK V,JIA W,etal.Diabetes in Asia:epidemiology,risk factors,and pathophysiology[J].Jama,2009,301(20):2129-2140.
[53]CHEN D,BRUNO J,EASLON E,etal.Tissue-specific regulation of SIRT1 by calorie restriction[J].Genes Dev,2008,22(13):1753-1757.
[54]CHOULIARAS L,HOVE D L A V D,KENIS G,etal.Prevention of age-related changes in hippocampal levels of 5-methylcytidine by caloric restriction[J].Neurobiol Aging,2012,33(8):1672-1681.
[55]CHRISTENSEN B,NELLEMANN B,LARSEN M S,etal.Whole body metabolic effects of prolonged endurance training in combination with erythropoietin treatment in humans:a randomized placebo controlled trial[J].Am J Physiol Endocrinol Metab,2013,305(7):E879-E889.
[56]CHURCH T S,THOMAS D M,TUDORLOCKE C,etal.Trends over 5 decades in U.S.occupation-related physical activity and their associations with obesity[J].Plos One,2011,6(5):1573-1574.
[57]COKER R H,WILLIAMS R H,YEO S E,etal.The impact of exercise training compared to caloric restriction on hepatic and peripheral insulin resistance in obesity[J].J Clin Endocrinol Metab,2009,94(11):4258-4266.
[58]CORDAIN L,EATON S B,SEBASTIAN A,etal.Origins and evolution of the Western diet:health implications for the 21st century[J].Am J Clin Nutr,2005,81(2):341-354.
[59]CORDAIN L,GOTSHALL R W,EATON S B,etal.Physical activity,energy expenditure and fitness:an evolutionary perspective[J].Int J Sports Med,1998,19(5):328-335.
[60]CORDAIN L,GOTSHALL R W,EATON S B.Physical activity,energy expenditure and fitness:an evolutionary perspective[J].Int J Sports Med,1998,19(5):328-335.
[61]DAVIS C D,MILNER J A.Diet,Physical Activity,and Cancer Prevention[M]// Nutrition Guide for Physicians.Humana Press,2010:379-393.
[62]DAVIS C L,POLLOCK N K,WALLER J L,etal.Exercise dose and diabetes risk in overweight and obese children a randomized controlled trial exercise and diabetes risk in overweight children[J].Jama,2012,308(11):1103-1112.
[63]DENG X,CHEN L,LI N.The expression of SIRT1 in nonalcoholic fatty liver disease induced by high-fat diet in rats[J].Liver Int,2007,27(5):708-715.
[64]DENHAM J,O'BRIEN B J,MARQUES F Z,etal.Changes in the leukocyte methylome and its effect on cardiovascular-related genes after exercise[J].J Appl Physiol,2014,118(4):475-488.
[65]DOS SANTOS J M,MORELI M L,TEWARI S,etal.The effect of exercise on skeletal muscle glucose uptake in type 2 diabetes:An epigenetic perspective[J].Metabolism,2015,64(12):1619-1628.
[66]DU S,MROZ T A,ZHAI F,etal.Rapid income growth adversely affects diet quality in China—particularly for the poor![J].Soc Sci Med,2004,59(7):1505-1515.
[67]EATON S B,III S B E.An evolutionary perspective on human physical activity:implications for health[J].Comp Biochem Physiol A Mol Integr Physiol,2003,136(1):153-159.
[68]EATON S B,KONNER M,SHOSTAK M.Stone agers in the fast lane:chronic degenerative diseases in evolutionary perspective[J].Am J Med,1988,84(4):739-749.
[69]EATON S B,RD E S.PALEOLITHIC V S.modern diets-selected pathophysiological implications[J].Eur J Nutr,2000,39(2):67-70.
[70]EATON S B.Complex chronic diseases in evolutionary perspective[M]//Human Evolutionary Biology,2010:491-501.
[71]ELSNER V R,LOVATEL G A,BERTOLDI K,etal.Effect of different exercise protocols on histone acetyltransferases and histone deacetylases activities in rat hippocampus[J].Neurosci,2011,192(192):580-587.
[72]ESTEVE E,RICART W,FERNNDEZ-REAL J M.Dyslipidemia and inflammation:an evolutionary conserved mechanism[J].Clin Nutr,2005,24(1):16-31.
[73]EYRE H,KAHN R,ROBERTSON R M,etal.Preventing cancer,cardiovascular disease,and diabetes:A common agenda for the american cancer society,the american diabetes association,and the american heart association[J].Ca A Cancer J Clin,2004,54(4):190-207.
[74]FANG F Z,CARDARELLI R,CARROLL J,etal.Physical activity and global genomic DNA methylation in a cancer-free population[J].Epigenetics,2011,6(6):293-299.
[75]FONTANA L,MEYER T E,KLEIN S,etal.Long-term calorie restriction is highly effective in reducing the risk for atherosclerosis in humans[J].P Nat Acad Sci,2004,101(17):6659-6663.
[76]FREITAS S CF,NGELA D’AVILA HARTHMANN,RODRIGUES B,etal.Effect of aerobic exercise training on regional blood flow and vascular resistance in diabetic rats[J].Diabetol Metab Syndr,2014,7(1):1-8.
[77]FU L,LIU X,NIU Y,etal.Effects of high-fat diet and regular aerobic exercise on global gene expression in skeletal muscle of C57BL/6 mice[J].Metabolism,2012,61(2):146-152.
[78]GALLUP J R G G,REYNOLDS C J,BAK P A,etal.Evolutionary medicine:the impact of evolutionary theory on research,prevention,and practice[J].EvoS J,2014,6(1):69-79.
[79]GARNÅS,E.The evolution of the human diet:From wild meat,fruits,and tubers to candy,donuts,and pizza[D].Oslo and Akershus University College of Applied Sci,2015:21.
[80]GLUCKMAN P D.Epigenetics and metabolism in 2011:Epigenetics,the life-course and metabolic disease[J].Nat Rev Endocrinol,2011,8(2):74-76.
[82]HALL K D.Diet versus exercise in “the biggest loser” weight loss competition[J].Obesity,2013,21(5):957-959.
[83]HARVIE M N,PEGINGTON M,MATTSON M P,etal.The effects of intermittent or continuous energy restriction on weight loss and metabolic disease risk markers:a randomised trial in young overweight women[J].Int J Obesity,2011,35(5):714-727.
[84]HEATH G W.Physical activity transitions and chronic disease[J].Am J Lifestyle Med,2009,3(1):27S-31S.
[85]HU F B,MANSON J A E,STAMPFER M J,etal.Diet,lifestyle,and the risk of type 2 diabetes mellitus in women[J].New Engl J Med,2001,345(11):790-797.
[86]HU F B,SIGAL R J,RICHEDWARDS J W,etal.Walking compared with vigorous physical activity and risk of type 2 diabetes in women:a prospective study[J].J Cardiopul Rehabil,2000,282(15):1433-1439.
[87]IRONS W.Adaptively relevant environments versus the environment of evolutionary adaptedness[J].Evolutionary Anthropol Issues News Rev,1998,6(6):194-204.
[88]JEPPESEN J,JORDY A B,SJØBERG K A,etal.Enhanced Fatty Acid Oxidation and FATP4 Protein Expression after Endurance Exercise Training in Human Skeletal Muscle[J].Plos One,2012,7(1):e29391.
[89]JEW S,ABUMWEIS S S,JONES P J.Evolution of the human diet:linking our ancestral diet to modern functional foods as a means of chronic disease prevention[J].J Med Food,2009,12(5):925-934.
[90]JOHNSON R J,SEGAL M Y,NAKAGAWA T,etal.Potential role of sugar (fructose) in the epidemic of hypertension,obesity and the metabolic syndrome,diabetes,kidney disease,and cardiovascular disease[J].Am J Clin Nutr,2007,86(86):899-906.
[91]JR K W,MCKNIGHT S L.Influence of metabolism on epigenetics and disease[J].Cell,2013,153(1):56-69.
[92]KALIMAN P,PRRIZAS M,LALANZA J F,etal.Neurophysiological and epigenetic effects of physical exercise on the aging process[J].Ageing Res Rev,2011,10(4):475-486.
[93]KARDUM I,GRAANIN A,HUDEK-KNEŽEVIC J.Evolutionary explanations of eating disorders[J].Psihologijske teme,2008,17(2):247-263.
[94]KELLER P,VOLLAARD N B J,GUSTAFSSON T,etal.A transcriptional map of the impact of endurance exercise training on skeletal muscle phenotype[J].J Appl Physiol,2011,110(1):46-59.
[95]KIRCHENGAST S.Physical inactivity from the viewpoint of evolutionary medicine[J].Sports,2014,2(2):34-50.
[96]KIRCHNER H,OSLER M E,KROOK A,etal.Epigenetic flexibility in metabolic regulation:disease cause and prevention?[J].Trends Cell Biol,2012,23(5):203-209.
[98]KUZAWA C W.Beyond feast-famine:Brain evolution,human life history,and the metabolic syndrome[M]//Human Evolutionary Biology,2010:518-527.
[99]LEE S J,BACHA F,HANNON T,etal.Effects of aerobic versus resistance exercise without caloric restriction on abdominal fat,intrahepatic lipid,and insulin sensitivity in obese adolescent boys:A randomized,controlled trial[J].Diabetes,2012,61(11):2787-2795.
[100]LEES S J,BOOTH F W.Sedentary death syndrome[J].Can J Appl Physiol,2004,29(4):447-460.
[101]LEFEVRE M,REDMAN L M,HEILBRONN L K,etal.Caloric restriction alone and with exercise improves CVD risk in healthy non-obese individuals[J].Atherosclerosis,2009,203(1):206-213.
[102]PRUIMBOOM L.Physical inactivity is a disease synonymous for a non-permissive brain disorder[J].Med Hypotheses,2011,77(5):708-713.
[103]LEV-RAN A.Human obesity:an evolutionary approach to understanding our bulging waistline[J].Diabetes/Metabolism Res Rev,2001,17(17):347-362.
[104]LIEBERMAN D E.Is exercise really medicine? An evolutionary perspective[J].Curr Sports Med Rep,2015,14(4):313-319.
[105]LIGHTFOOT J T.Why control activity? Evolutionary selection pressures affecting the development of physical activity genetic and biological regulation[J].Biomed Res Int,2013,2013(4):821678-821678.
[106]LILLYCROP K A,HOILE S P,GRENFELL L,etal.DNA methylation,ageing and the influence of early life nutrition[J].Proc Nutr Soc,2014,73(3):413-421.
[107]LING C,RÖNN T.Epigenetic adaptation to regular exercise in humans[J].Drug Discov Today,2014,19(7):1015-1018.
[108]LORENZO M S D,BALJINNYAM E,VATNER D E,etal.Caloric restriction reduces growth of mammary tumors and metastases[J].Carcinogenesis,2011,32(9):1381-1387.
[109]MALANDRUCCO I,PASQUALETTI P,GIORDANI I,etal.Very-low-calorie diet:a quick therapeutic tool to improve β cell function in morbidly obese patients with type 2 diabetes[J].Am J Clin Nutr,2012,95(3):609-613.
[110]MALINA R M,LITTLE B B.Physical activity:The present in the context of the past[J].Am J Human Biol,2008,20(4):373-391.
[111]MANSON J A E,HU F B,RICH-EDWARDS J W,etal.A prospective study of walking as compared with vigorous exercise in the prevention of coronary heart disease in women[J].New Engl J Med,1999,341(9):650-658.
[112]MARKUS S,DINESH G,DAVID S,etal.Role for neuronal insulin resistance in neurodegenerative diseases[J].Proc Nat Acad Sci,2004,101(9):3100-3105.
[113]MARLOWE F W.The Hadza:Hunter-Gatherers of Tanzania[M].Berkeley (CA):University of California Press,2010,325.
[114]MATTISON J A,ROTH G S,BEASLEY T M.Impact of caloric restriction on health and survival in rhesus monkeys from the NIA study[J].Nature,2012,489(7415):318-321.
[115]MATTSON M P.Evolutionary aspects of human exercise—Born to run purposefully[J].Ageing Res Rev,2012,11(3):347-352.
[116]MCEVOY B P,POWELL J E,GODDARD M E,etal.Human population dispersal “Out of Africa” estimated from linkage disequilibrium and allele frequencies of SNPs[J].Genome Res,2011,21:821-829.
[117]MCMICHAEL A J.Human Frontiers,Environments and Disease:Past Patterns,Uncertain Futures[M].Cambridge University Press,2001,134.
[118]MICHAN S,SINCLAIR D.Sirtuins in mammals:Insights into their biological function.Biochemical Journal[J].Biochem J,2007,404(1):1-13.
[119]MILAGRO F I,CAMPIN J,GARCADAZ D F,etal.High fat diet-induced obesity modifies the methylation pattern of leptin promoter in rats[J].J Physiol Biochem,2009,65(1):1-9.
[120]NEEL J V.Diabetes mellitus:a “thrifty” genotype rendered detrimental by “progres”?[J].Bull World Health Organ,1962,14(4):353-362.
[121]NG S F,LIN R C,LAYBUTT D R,etal.Chronic high-fat diet in fathers programs β-cell dysfunction in female rat offspring[J].Nature,2010,467(7318):963-966.
[122]NTANASISSTATHOPOULOS J,TZANNINIS J G,PHILIPPOU A,etal.Epigenetic regulation on gene expression induced by physical exercise[J].J Musculoskelet Neuronal Int,2013,13(13):133-146.
[123]O'KEEFE J H,CORDAIN L.Cardiovascular disease resulting from a diet and lifestyle at odds with our paleolithic genome:How to become a 21st-century hunter-gatherer[C]//Mayo Clinic Proceedings.Elsevier,2004,79(1):101-108.
[124]O'KEEFE J H,VOGEL R,LAVIE C Jetal.Achieving hunter-gatherer fitness in the 21 st,century:Back to the future[J].Am J Med,2010,123(12):1082-1086.
[125]OMODEI D,FONTANA L.Calorie restriction and prevention of age-associated chronic disease[J].Febs Letters,2011,585(11):1537-1542.
[126]ÖZ G,SEAQUIST E R,KUMAR A,etal.Human brain glycogen content and metabolism:implications on its role in brain energy metabolism[J].Am J Physiol Endocrinol Metab,2007,292(3):E946-E951.
[127]PANG G C,CHEN Q S,ZHI-HE H U,etal.Overview and prospect of food and nutritional epigenetics[J].Food Sci,2011,32(17):1-21.
[128]PANTER-BRICK C.Sexual division of labor:Energetic and evolutionary scenarios[J].Am J Human Biol,2002,14(5):627-640.
[129]PAREJA-GALEANO H,SANCHIS-GOMAR F,GARCA-GIMÉNEZ J L.Physical exercise and epigenetic modulation:Elucidating intricate mechanisms[J].Sports Med,2014,44(4):429-436.
[130]PETERS A,SCHWEIGER U,PELLERIN L,etal.The selfish brain:competition for energy resources[J].Neurosci Biobehav Rev,2004,28(2):143-180.
[131]PHIELIXE,MEEX R,QUWENS D M,etal.High oxidative capacity due to chronic exercise training attenuates lipid-induced insulin resistance[J].Diabetes,2012,61(10):2472-2478.
[132]PLAGEMANN A,HARDER T,BRUNN M,etal.Hypothalamic proopiomelanocortin promoter methylation becomes altered by early overfeeding:an epigenetic model of obesity and the metabolic syndrome[J].J Physiol,2009,587(20):4963-4976.
[133]PLAGEMANN A,ROEPKE K,HARDER T,etal.Epigenetic malprogramming of the insulin receptor promoter due to developmental overfeeding[J].J Perinatal Med,2010,38(4):393-400.
[134]POPKIN B M.Will China's nutrition transition overwhelm its health care system and slow economic growth?[J].Health Aff,2008,27(4):1064-1076.
[135]POWER M L.The human obesity epidemic,the mismatch paradigm,and our modern “captive” environment[J].Am J Human Biol,2012,24(2):116-122.
[136]PRUIMBOOM L.Physical inactivity is a disease synonymous for a non-permissive brain disorder[J].Med Hypotheses,2011,77(5):708-713.
[137]QUINTAS A,DE SOLS A J,DEZ-GUERRA F J,etal.Age-associated decrease of SIRT1 expression in rat hippocampus:prevention by late onset caloric restriction[J].Exp Gerontol,2012,47(2):198-201.
[138]REN H,COLLINS V,CLARKE S J,etal.Epigenetic changes in response to tai chi practice:A pilot investigation of DNA methylation marks[J].Evid-based Compl Alt Med,2012,2012(5):440-448.
[139]RIBARIC S.Diet and aging[J].Oxid Med Cell Longev,2012,(1):741468.
[140]RÖNN T,VOLKOV P,DAVEGÅRDH C,etal.A six months exercise intervention influences the genome-wide DNA methylation pattern in human adipose tissue[J].Plos Genet,2013,9(6):388-393.
[141]RYDER J R,VEGA-LPEZ S,DJEDJOS C S,etal.Abdominal adiposity,insulin resistance,and oxidized low-density lipoproteins in Latino adolescents[J].Diabetol Metab Syndr,2013,5(1):1-4.
[142]SANIOTIS A,HENNEBERG M.Evolutionary medicine and future of humanity:Will evolution have the final word?[J].Humanities,2013,2(2):278-291.
[143]SCHENK S,SABERI M,OLEFSKY J M.Insulin sensitivity:modulation by nutrients and inflammation[J].J Clin Invest 2008,118(9):2992-3002.
[144]SELLAYAH D,CAGAMPANG F R,COX R D.On the evolutionary origins of obesity:a new hypothesis[J].Endocrinology,2014,155(5):1573-1588.
[145]SHIMAZU T,HIRSCHEY M D,NEWMAN J,etal.Suppression of oxidative stress by β-hydroxybutyrate,an endogenous histone deacetylase inhibitor[J].Sci,2013,339(6116):211-214.
[146]SHU W N,NORTON E C,POPKIN B M.Why have physical activity levels declined among Chinese adults? Findings from the 1991-2006 China health and nutrition surveys[J].Soc Sci Med,2009,68(7):1305-1314.
[147]SIERVO M,WELLS J C K,CIZZA G.The contribution of psychosocial stress to the obesity epidemic:an evolutionary approach[J].Horm Metab Res,2009,41(4):261-270.
[148]SILANDER K,MOHLKE K L,SCOTT L J,etal.Genetic variation near the hepatocyte nuclear factor-4 alpha gene predicts susceptibility to type 2 diabetes[J].Diabetes,2004,53(4):1141-1149.
[149]SIMPSON K A,MARTIN N M,BLOOM S R,etal.Hypothalamic regulation of food intake and clinical therapeutic applications[J].Arq Bras Endocrinol,2009,53(2):120-128.
[150]SINHA R,DUFOUR S,PETERSEN KF,etal.Assessment of skeletal muscle triglyceride content by 1H nuclear magnetic resonance spectroscopy in lean and obese adolescents[J].Diabetes,2002,51(4):1022-1027.
[151]SMITH J A,COLLINS M,GROBLER L A,etal.Exercise and CaMK activation both increase the binding of MEF2A to the Glut4 promoter in skeletal muscle in vivo[J].Ajp Endocrinol Metab,2007,292(2):E413-E420.
[152]SOETERS M R,SOETERS P B.The evolutionary benefit of insulin resistance[J].Clin Nutr,2012,31(6):1002-1007.
[153]SOFIEN R,NADIA C,MAHDI K,etal.The effects of an exercise training program on body composition and aerobic capacity parameters in Tunisian obese children[J].Indian J Endocrinol Metab,2013,17(6):1040-1045.
[154]SPEAKMAN JR.Body size,energy metabolism and lifespan[J].J Exp Biol,2005,208(9):1717-1730.
[155]SUNG M M Y,DYCK J R B.Age-related cardiovascular disease and the beneficial effects of calorie restriction[J].Heart Fail Rev,2012,17(4-5):707-719.
[156]TATTERSALL I.Human origins:Out of africa[J].Proc Natl Acad Sci USA,2009,106:16018-16021.
[157]THALER J P,YI C X,SCHUR E A,etal.Obesity is associated with hypothalamic injury in rodents and humans[J].J Clin Invest,2012,122(1):153-162.
[158]THUNDERS M,MANGAI S,COOPER R.Nutrigenetics,nutrigenomics,and the future of dietary advice[J].Food Nutr Sci,2013,4(10):999-1003.
[159]TREMBLAY M S,ESLIGER D W,COPELAND J L,etal.Moving forward by looking back:lessons learned from long-lost lifestyles[J].2008,33(4):836-842.
[160]TSATSOULIS A,MANTZARIS M D,BELLOU S,etal.Insulin resistance:An adaptive mechanism becomes maladaptive in the current environment — An evolutionary perspective[J].Metab Clin Exp,2013,62(5):622-633.
[161]TURNER B L,THOMPSON A L.Beyond the Paleolithic prescription:incorporating diversity and flexibility in the study of human diet evolution[J].Nutr Rev,2013,71(8):501-510.
[162]VARADY K A,HELLERSTEIN M K.Alternate-day fasting and chronic disease prevention:a review of human and animal trials[J].Am J Clin Nutr,2007,86(1):7-13.
[163]WAGGONER M R,ULLER T.Epigenetic determinism in science and society[J].New Genet Soc,2015,34(2):177-195.
[164]WARDLE J,LLEWELLYN C,SANDERSON S,etal.The FTO gene and measured food intake in children[J].Int J Obesity,2008,33(1):42-45.
[165]WEDER A B.Evolution and hypertension[J].Hypertension,2007,49(2):260-265.
[166]WELLS J C.Ethnic variability in adiposity,thrifty phenotypes and cardiometabolic risk:addressing the full range of ethnicity,including those of mixed ethnicity[J].Obes Rev,2012,13(2):14-29.
[167]WESTERHEIDE S D.Stress-inducible regulation of heat shock factor 1 by the deacetylase SIRT1[J].Sci,2009,323(5917):1063-1066.
[168]WHITE A J,SANDLER D P,BOLICK S C E,etal.Recreational and household physical activity at different time points and DNA global methylation[J].Eur J Cancer,2013,49(9):2199-2206.
[169]WHO.Global Status Report on noncommunicable diseases 2014[EB/OL].http://apps.who.int/iris/bitstream/10665/148114/5/WHO_NMH_NVI_15.1_chi.pdf?ua=1.
[170]WHO.Projections of mortalityand causes of death,2015 and 2030[EB/OL].http://www.who.int/gho/ncd/mortality_morbidity/en/,accessed 4 November 2014.
[171]WHO.Global health risks:progress and challenges[J].Bull World Health Organ,2009,87(9):646.
[172]WHO.The global burden of disease:2004 update[J].Global Burden Disease Update,2010,13(12):1-146.
[173]WIDIKER S,KRST S,WAGENER A,etal.High-fat diet leads to a decreased methylation of the Mc4r,gene in the obese BFMI and the lean B6 mouse lines[J].J Appl Genet,2010,51(2):193-197.
[174]YANG G,KONG L,ZHAO W,etal.Emergence of chronic non-communicable diseases in China[J].Lancet,2008,372(9650):1697-1705.
[175]YANG W,LU J,WENG J,etal.Prevalence of diabetes among men and women in China[J].N Engl J Med,2010,362(12):1090-1101.[176]YE K,GU Z.Recent advances in understanding the role of nutrition in human genome evolution[J].Adv Nutr,2011,2(6):486-496.[177]ZHAI F,WANG H,DU S,etal.Lifespan nutrition and changing socio-economic conditions in China[J].Asia Pac J Clin Nutr,2007,16 Suppl 1(16 Suppl 1):374-382.
[178]ZHOU M S,WANG A,YU H.Link between insulin resistance and hypertension:What is the evidence from evolutionary biology?[J].Diabetol Metab Syndr,2014,6(1):1-12.
[179]ZHOU M S,WANG A,YU H.Link between insulin resistance and hypertension:What is the evidence from evolutionary biology?[J].Diabetol Metab Syndr,2014,6(2):217-224.
Dislocation:Pathophysiological State of the Soaring Incidence of Chronic Diseases in Human—Interactions between Diet-Physical Activity-Genes in the Process of Human Evolution
QIAO Yu-cheng
chronicdiseases;gene;diet;physicalactivity;interaction;thriftygene;epigenetics
1000-677X(2017)01-0028-17
10.16469/j.css.201701003
体育科学
2016-11-22;
2017-01-05
国家社会科学基金资助项目(16BTY003)。
乔玉成,男,教授,硕士研究生导师,主要从事运动人体科学研究,Tel:(0357) 2051149,E-mail:lfqyc@163.com。
山西师范大学 体育学院,山西 临汾 041000 Shanxi Normal University,Linfen 041000,China.
G804.2
A
