有氧运动抑制高血压脑动脉平滑肌RyR-BKCa通道功能耦联上调
2017-02-11张严焱刘雨佳石丽君
张严焱,刘雨佳,柏 平,吴 迎,石丽君

有氧运动抑制高血压脑动脉平滑肌RyR-BKCa通道功能耦联上调
张严焱1,2,刘雨佳1,2,柏 平1,2,吴 迎2,石丽君1,2
目的:探讨有氧运动对自发性高血压大鼠脑动脉平滑肌RyR-BKCa耦联的影响。方法:12周龄雄性自发性高血压大鼠(Spontaneous hypertension rat,SHR)以及正常血压对照组(Wistar-Kyoto,WKY),随机分为正常血压安静组(WKY-SED),正常血压运动组(WKY-EX),高血压安静组(SHR-SED)和高血压运动组(SHR-EX);运动组进行8周中等强度跑台运动训练。8周后,取脑动脉,酶消化法急性分离脑动脉平滑肌细胞,分别采用穿孔膜片钳和单通道内面向外模式记录瞬时外向电流(STOC)以及BKCa通道门控特性;钙离子成像技术观察胞内钙离子浓度变化;免疫荧光成像观察平滑肌细胞BKCa通道α、β1亚基表达及分布情况。结果:1)经8周有氧运动,WKY和SHR运动组收缩压都显著低于各自安静组;2)穿孔膜片钳结果显示,SHR-SED组STOC幅值显著高于WKY-SED组,SHR-EX组STOC幅值显著低于SHR-SED组,而各组STOC频率无显著性改变;3)与WKY-SED组相比,SHR-SED组BKCa通道开放概率(Po)显著增加,SHR-EX组开放概率显著低于SHR-SED组,但WKY-EX组开放概率却高于WKY-SED组;4)在他莫昔芬激活下,WKY-SED和SHR-SED组BKCa通道开放概率分别增加3.4倍和8.9倍,WKY-EX组开放概率显著高于WKY-SED组,但与SHR-SED组相比,运动显著抑制SHR-EX组他莫昔芬诱发的开放概率增加;5)STOC可被RyR激动剂咖啡因激活;咖啡因能够引起肌质网钙库释放,诱发全胞钙瞬变,各组钙释放幅值无显著性差异;6)BKCa通道α、β1亚基存在于平滑肌细胞质膜上,β1亚基在胞内也有散在分布,α亚基在各组表达无显著性差异,β1亚基在WKY-EX和SHR-SED组中表达均显著高于WKY-SED组,有氧运动显著降低了SHR-EX组β1亚基表达量。结论:高血压引起RyR-BKCa功能耦联的增强是为了缓冲血管压力增高诱发的脑动脉收缩,而BKCa通道β1亚基功能上调是其重要因素之一;长期规律有氧运动能有效地抑制这种病理性的代偿,恢复脑血管功能。关键词:高血压;运动;雷诺丁受体;大电导钙激活钾通道Abstract:Objective:The purpose of this study was to investigate the effects of aerobic exercise on the functional coupling of RyR-BKCachannel in cerebral arterial smooth muscle cells from spontaneously hypertensive rats.Methods:12-week-old male SHR and WKY rats were randomly assigned to sedentary groups(SHR-SED,WKY-SED) and exercise training groups(SHR-EX,WKY-EX).Exercise groups were performed an 8-week moderate-intensity treadmill running.After 8 weeks,cerebral arterial smooth muscle cells were enzymatically isolated.Spontaneous transient outward currents(STOC) and BKCasingle channel currents were measured using whole-cell and inside-out patch,respectively.Cytosolic Ca2+response was acquired using Ca2+image;Immunofluorescence was performed to study the expression of BKCachannel α and β1protein.Results:1) After 8 weeks of exercise,SBP in both WKY-EX and SHR-EX were significantly lower than that of their sedentary counterparts.2) The amplitude of STOC in SHR-SED was significantly higher than that in WKY-SED;After exercise,it was significantly lower in the SHR-EX than in SHR-SED;There was no significant difference of the frequency among four groups.3) The Po of BKCachannels from SHR-SED was larger than that of WKY-SED;The Po in SHR-EX became lower than in SHR-SED;in normotensive rats,the Po after exercise training(WKY-EX) was significantly higher than WKY-SED.4) Tamoxifen evoked a 3.4-fold and 8.9-fold increase in the Po of BKCachannels in WKY-SED and SHR-SED patches,respectively;In WKY-EX,tamoxifen-evoked Po was significantly higher than in WKY-SED ones;However,in hypertensive rats,exercise training inhibited tamoxifen-evoked effects.5) The RyR agonist caffeine activated STOC effectively;Caffeine could lead to the release of SR Ca2+store,inducing cytosolic Ca2+transients,rapid application of caffeine evoked similar Ca2+transients in four groups.6) BKCachannel α and β1subunits were plasma membrane-localized in arterial myocytes,besides a large fraction of β1subunits were intracellular;The expression of α subunits was similar in four groups;Compared with WKY-SED,β1expression was significantly increased in WKY-EX and SHR-SED,exercise training markedly inhibited the upregulation of β1subunits in SHR-EX.Conclusions:These data indicate that hypertension leads to enhanced functional coupling of RyR-BKCato buffer pressure-induced constriction of cerebral arteries,which attributes to an upregulation of BKCaβ1subunit function.Regular aerobic exercise efficiently prevents the augmented functional coupling of RyR-BKCain hypertension,so alleviates the pathological compensation and restores cerebral arterial function.
高血压是中风、心肌梗死、血管病变和慢性肾病等疾病的主要危险因素。长期规律有氧运动,作为一种低成本且副作用相对较小的非药物治疗方法,在预防和控制心血管疾病上受到越来越多的关注[32]。流行病学上的很多研究都表明,运动能够带来系统的影响以及诸多的益处,包括降低慢性疾病危险因素,如高血压[14]。但目前,有关运动促进体质健康的潜在机制尚不清楚,运动预防高血压的作用机理也尚未完全阐明。
持续性高血压时,小动脉和微动脉会发生结构和功能上的改变,从而适应血管腔内升高的压力[18]。诸多研究发现,血管平滑肌细胞(vascular smooth muscle cell,VSMC)膜上的离子通道也会发生电学重塑从而维持较高的血管张力[18]。大电导钙激活钾通道(large-conductance Ca2+-activated K+channel,BKCa)广泛分布于VSMC上,在膜去极化和局部[Ca2+]i升高条件下激活[26,27]。细胞膜去极化减弱引起血管腔内压升高从而产生肌源性收缩,而BKCa通道能够抵消这种肌源性收缩,促进血管稳态[27]。大多数研究证明,在高血压时,VSMCs上BKCa通道功能表达增多[12,20,30]。这个重要的局部保护性机制使得在慢性高血压时,脑血管血流能够保持正常或者接近正常水平[8,16]。在脑动脉平滑肌细胞(cerebral artery smooth muscle cell,CASMC)中,肌质网(sarcoplasmic reticulum,SR)上一个或者若干个雷诺丁受体(rynodine receptor,RyR)随机开放引起内钙局部升高,即钙火花(Ca2+spark)产生,由于RyR与BKCa通道非常接近(<20 nm),从而活化附近的大电导钙激活钾通道,同时产生了瞬时外向钾电流(spontaneous transient outward current,STOC)而使膜超极化。因此,本实验提出假设,高血压时BKCa通道功能的上调,同时RyR-BKCa功能耦联的增强,也许是脑动脉限制血压过度升高的代偿机制。
运动,尤其是长期规律的有氧运动,能够有效预防控制高血压,给脑血管带来益处[5]。运动引起脑血管保护的可能机制是通过改变脑动脉平滑肌细胞的钙调控实现的,钙调控在脑动脉的收缩-舒张中扮演着重要角色;同时,长期耐力运动能够影响到钙离子的动态平衡[9,22,31]。钙离子、钙电流以及钾通道之间的功能联系引起钾通道,如BKCa通道、电压门控钾通道(Kv)活动的改变,也可能是运动引起脑血管保护的因素。
本研究旨在观察原发性高血压时,脑动脉平滑肌细胞的BKCa功能,RyR-BKCa耦联是否发生改变,以及有氧运动能否抑制这些病理性改变,重塑脑血管功能。
1 材料与方法
1.1 实验动物分组及运动方案
12周龄雄性自发性高血压大鼠(Spontaneous hypertension rat,SHR)以及正常血压对照组(Wistar-Kyoto,WKY),购自北京维通利华实验动物技术有限公司;随机分为正常血压安静组(WKY-SED),正常血压运动组(WKY-EX),高血压安静组(SHR-SED)和高血压运动组(SHR-EX),各组24只。保持动物饲养房内室温22℃~24℃,湿度为40%~60%,自然光照,各组大鼠每天自由进食饮水,按国家标准固定混合饲料喂养。
每周测定大鼠体重(BW)、安静收缩压(SBP)。SBP采用尾动脉无创血压测试仪监测(BP-2010A,Softron Biotechnology,Beijing)。
1.2 脑动脉平滑肌细胞急性分离
大鼠腹腔注射戊巴比妥钠(50 mg/kg),麻醉后,取脑基底动脉及willis环周围附属组织,剥离干净后置于分离液中;之后将基底动脉及willis环剪成1 mm的小段,室温平衡5 min后,置于酶消化液中,37℃恒温水浴箱中消化20~25 min。待消化完全后,置于室温下分离液漂洗3次终止消化,每次5 min。然后用抛光后的玻璃吸管轻轻吹打,吸取细胞悬液经滤网过滤至细胞浴槽内,置于4℃贴壁待用。酶消化液组成:2 mg/ml牛血清白蛋白(BSA)、4 mg/ml木瓜蛋白酶(Papain)、1 mg/ml二硫苏糖醇(DDT)、0.6 mg/ml F型胶原酶溶于分离液中;分离液组成(mmol/L):137 NaCl,5.6 KCl,1 MgCl2,10 Hepes,10 Glucose,0.42 Na2HPO4,0.44 NaH2PO4,4.2 NaHCO3,NaOH调pH至7.3。
1.3 穿孔膜片钳纪录
STOC电流采用穿孔膜片钳记录模式,浴液成分(mmol/L):135 NaCl,5 KCl,1 MgCl2,1.8 CaCl2,10 Glucose,10 Hepes,NaOH调pH至7.4;电极内液(mmol/L):110 K-aspartate,30 KCl,10 NaCl,1 MgCl2,10 Hepes,0.05 EGTA,0.2 两性霉素B,KOH调pH至7.4。记录电极选用玻璃毛细管(OD 1.5 mm,ID 0.86 mm,Sutter Instrument,USA)于电极拉制仪(PC10,Narishige,Tokyo)上两步拉制,充灌电极液后电极阻抗为4~5 MΩ。
STOC的幅值与频率采用Mini-Analysis程序(Synaptosoft Software,Leonia,NJ)分析处理。
1.4 单通道纪录
BKCa单通道电流采用膜片钳内面向外记录模式,细胞内、外液采用对称性高K+(145 mmol/L)方式,电极电阻10~15 MΩ,电极内液成分(mmol/L):100 KCl,45 K-aspartate,1 EGTA,10 Hepes,5 Glucose,KOH调pH至7.4。浴液中的游离Ca2+浓度([Ca2+]free)通过加入适量CaCl2和EGTA控制,所有CaCl2和EGTA的量利用WinMax C软件(http://maxchelator.stanford.edu/webmaxc/webmaxcS.htm)计算得到。
1.5 钙成像
急性分离的脑动脉平滑肌细胞种于玻底培养皿,室温贴壁30 min。钙离子染料Fluo-4 AM按比例溶于无钙分离液中,制成Fluo-4 AM工作液(5 μmol/L)。分离液成分(mmol/L):137 NaCl,5.6 KCl,1 MgCl2,10 Hepes,10 Glucose,0.03 硝普钠,NaOH调pH至7.4。细胞室温负载Fluo-4 AM工作液约30 min后,用含1.5 mmol/L CaCl2的分离液清洗3遍,每次10 min。负载上Fluo-4 AM的平滑肌细胞将基于Leica荧光显微镜系统(DM6000,Leica,Germany)捕捉全细胞钙振荡(Cytosolic Ca2+Oscillation)信号,采样参数为3 s/page,图片1 024×1 024像素,采集200张图片,采集时间约为10 min。
钙振荡数据采用Image J图像处理软件(NIH,USA)和Matlab数学软件(MathWorks,USA)自编程序进行分析。采集图片导入Image J后,沿细胞边缘圈出所需ROI(region of interest),得到ROI的平均灰度值(mean intensity);之后导入Matlab,经自编程序运行,得到每个ROI对应的钙振荡曲线。钙振荡分析为F/F0=(F-Fbaseline)/(F0-Fbaseline),其中,Fbaseline为图片背景荧光强度,F为每张图片的ROI的平均荧光强度,F0为开始采集信号但无钙响应发生时ROI的平均荧光强度值。本工作中钙振荡的认定标准是ROI荧光强度(F)的升高>ROI无钙响应时荧光强度(F0)的1.2倍。
1.6 免疫荧光
急性分离的脑动脉平滑肌细胞4℃贴壁60 min后,4%多聚甲醛固定30 min,PBS洗3遍,加入0.2% Triton X-100膜打孔10 min,10%山羊血清封闭后,分别滴加一抗Rabbit Polyclonal to Anti-KCa1.1(浓度为1∶200,Alomone,Israel),Rabbit Polyclonal to Anti-sloβ1(浓度为1∶200,Alomone,Israel),4℃过夜;次日避光加入荧光二抗Alexa Fluor488 goat anti-rabbit IgG antibody(浓度为1∶1 000)室温孵育1 h后,用抗淬灭封片剂ProLong Gold Antifade Mountant封片,室温避光干燥保存,24 h后可用激光共聚焦系统(SP5 TCS,Leica,Germany)采集信号。
1.7 数据分析处理
2 结果
2.1 体重以及血压
12周龄SHR与WKY在体重上无显著性差异,SHR组的收缩压为192.6±2.2 mmHg,显著高于WKY组(134.2±2.5 mmHg,P<0.01)。经8周有氧运动后,运动组体重(WKY-EX:338.2±2.2 g;SHR-EX:301.7±3.0 g)显著低于所对应安静组(WKY-SED:349.1±4.1 g;SHR-SED:318.1±4.7 g;P<0.05)。同时,运动组的收缩压,无论是WKY-EX(132.9±2.5 mmHg),还是SHR-EX(181.3±2.2 mmHg)都分别显著低于WKY-SED(137.5±2.0 mmHg,P<0.05)和SHR-SED(197.8±2.2 mmHg,P<0.05)。
2.2 运动抑制SHR脑动脉平滑肌STOC上调
采用全细胞穿孔记录模式,脑动脉平滑肌细胞在去极化状态下STOC更容易被激活。不同钳制电压下记录到的STOC电流如图1A所示。随着去极化电压增大,各组STOC幅值和频率都显著增加。在相同钳制电位(-40 mV,-20 mV,0 mV)下,SHR-SED组STOC幅值显著高于WKY-SED组(P<0.05,图1B)。经有氧运动后,WKY-EX组的幅值在-20 mV和0 mV钳制电压下,显著高于WKY-SED组;但在-40 mV、-20 mV和0 mV钳制电压下,SHR-EX组的幅值却显著低于SHR-SED组(P<0.05)。提示,高血压时,脑动脉STOC的幅值较正常血压对照组有显著增加,但有氧运动能够缓解高血压时STOC的增加。而在-20 mV和0 mV钳制电压下,各组STOC频率无显著性差异。在-40 mV钳制电压下,SHR-SED组STOC频率显著高于WKY-SED组;但经有氧运动,WKY-EX与WKY-SED组,SHR-EX与SHR-SED组之间STOC频率均未观察到显著性差异。
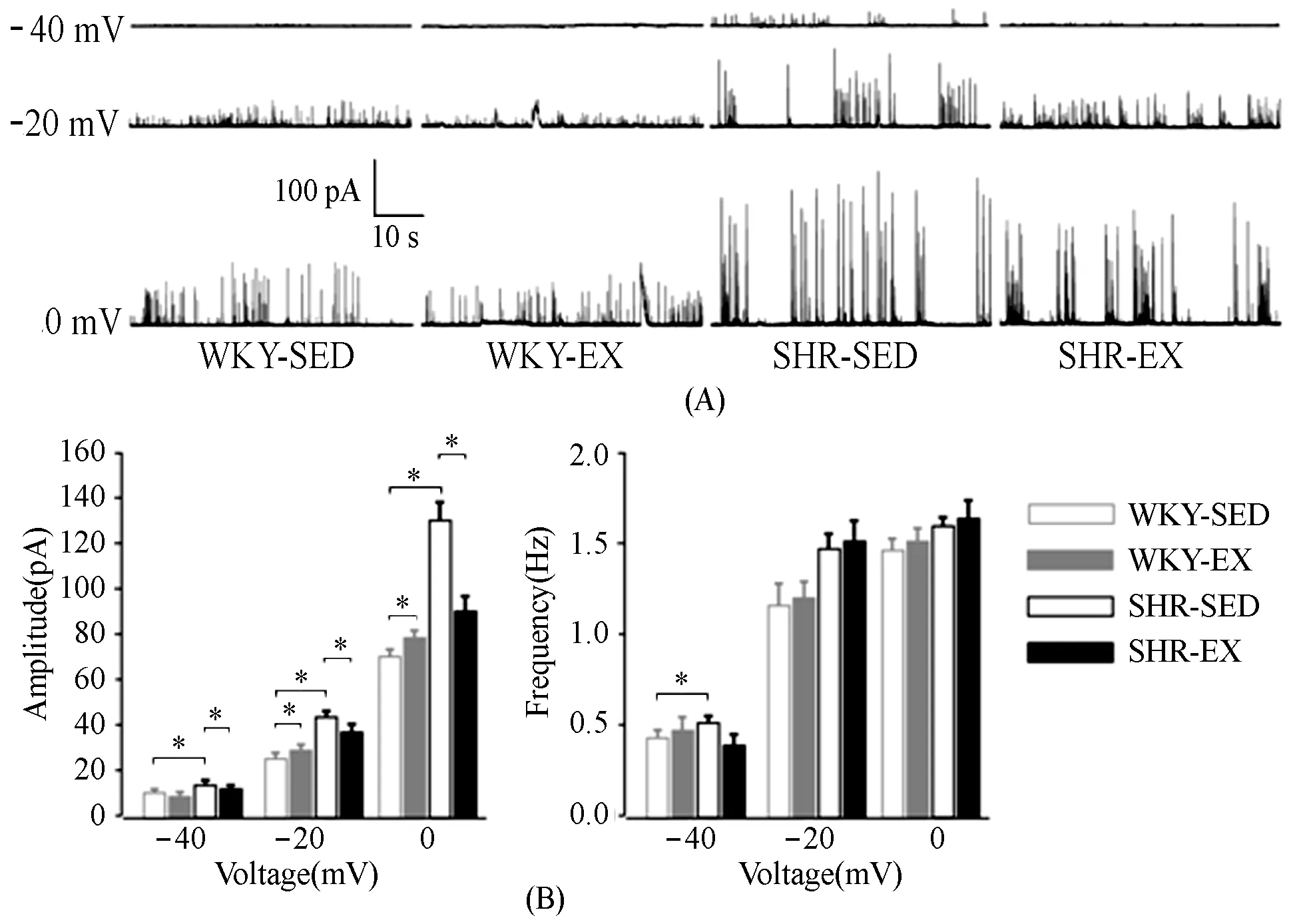
图 1 各组大鼠脑动脉平滑肌细胞STOC电压依赖性Figure 1. Voltage Dependence of STOC in Cerebral Artery Smooth Muscle Cells from Four Groups
注:A,各组不同钳制电位下STOC电流代表图;B,各组不同钳制电位下STOC幅值和频率统计图(各组n=6);*P< 0.05,有显著性差异,下同。
2.3 运动抑制SHR脑动脉平滑肌BKCa通道功能增强
采用单通道内面向外记录模式对各组大鼠脑动脉平滑肌细胞BKCa通道的单通道功能及门控特性进行鉴定。
如图2所示,在[Ca2+]free为0.3 μmol/L,钳制电压为+40 mV下,SHR-SED组BKCa通道开放概率(Po)显著大于WKY-SED组(P<0.01);8周有氧运动后,SHR-EX组的Po显著低于SHR-SED组(P<0.01),然而,运动却增强了正常血压组BKCa通道活动,WKY-EX组的Po明显增加,高于WKY-SED组(P<0.01)。
2.4 运动对SHR脑动脉平滑肌BKCa通道药理学特性的影响
他莫昔芬(tamoxifen),BKCa通道β1亚基特异性激动剂,是一种雌激素受体拮抗剂,可与β1亚基相结合,通过非基因组效应明显激活平滑肌BKCa通道[10],因此,tamoxifen具有检测β1亚基对BKCa通道调控的作用。
从图3可知,在[Ca2+]free为100 nmol/L,膜钳制电位为+40 mV下,1 μmol/L tamoxifen能增加各组大鼠BKCa通道的开放概率,使WKY-SED组开放概率增加3.4倍,SHR-SED组增加8.9倍;有氧运动后,tamoxifen增加了WKY-EX组BKCa通道开放概率4.3倍,显著高于WKY-SED组(P<0.01);然而,在高血压组,SHR-EX组增加4.6倍,与SHR-SED相比,运动显著抑制了tamoxifen引起的BKCa通道开放概率的增加(P<0.01)。
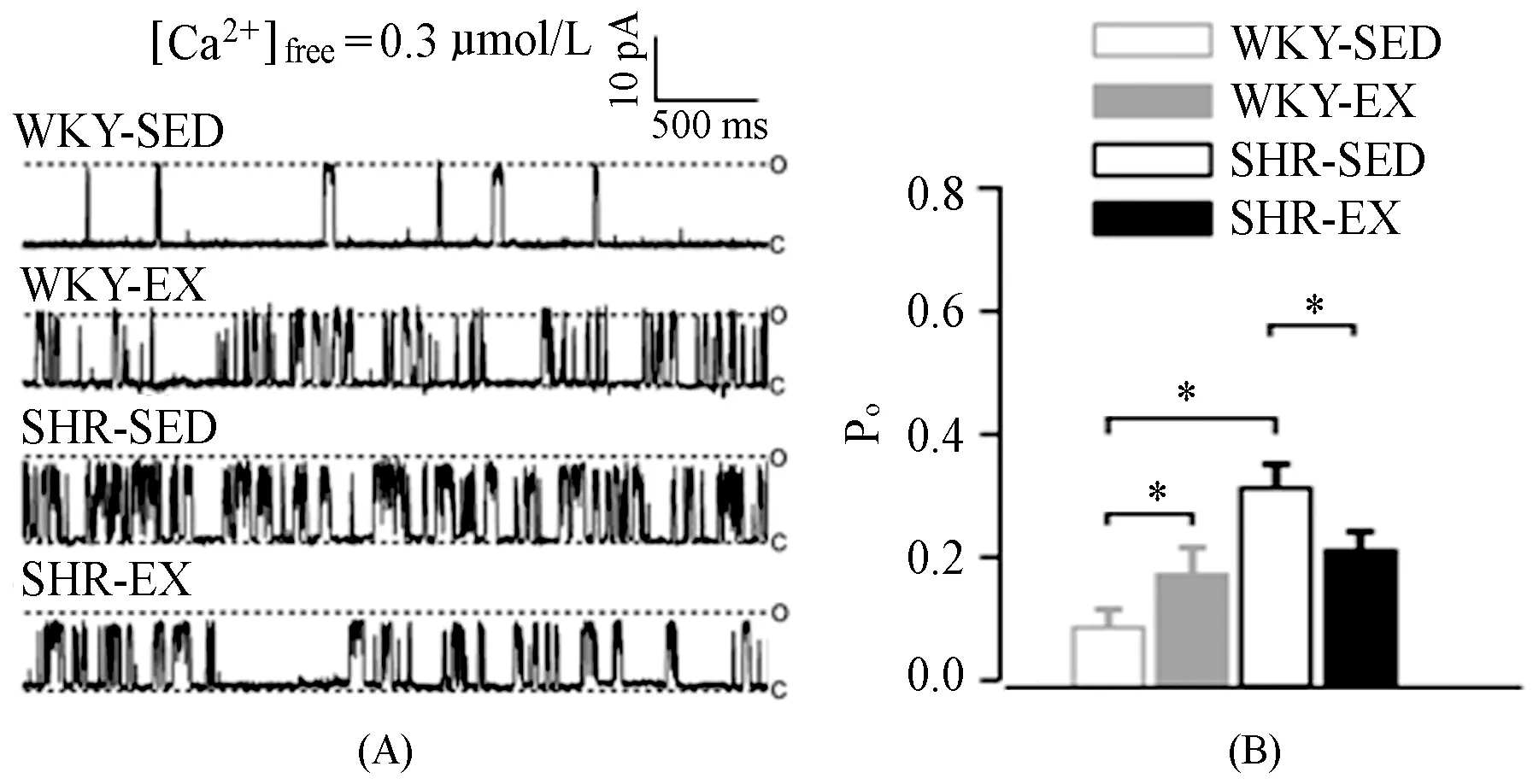
图 2 大鼠脑动脉平滑肌细胞BKCa单通道电流Figure 2. Recording of Single BKCa Channel Current of Cerebral Arterial Myocytes
注:A,膜钳制电位(HP)为 +40 mV,浴液游离钙浓度([Ca2+]free)为300 nmol/L,各组BKCa单通道电流代表图;B,300 nmol/L [Ca2+]free时,BKCa通道开放概率(Po)统计图(各组n=6)。
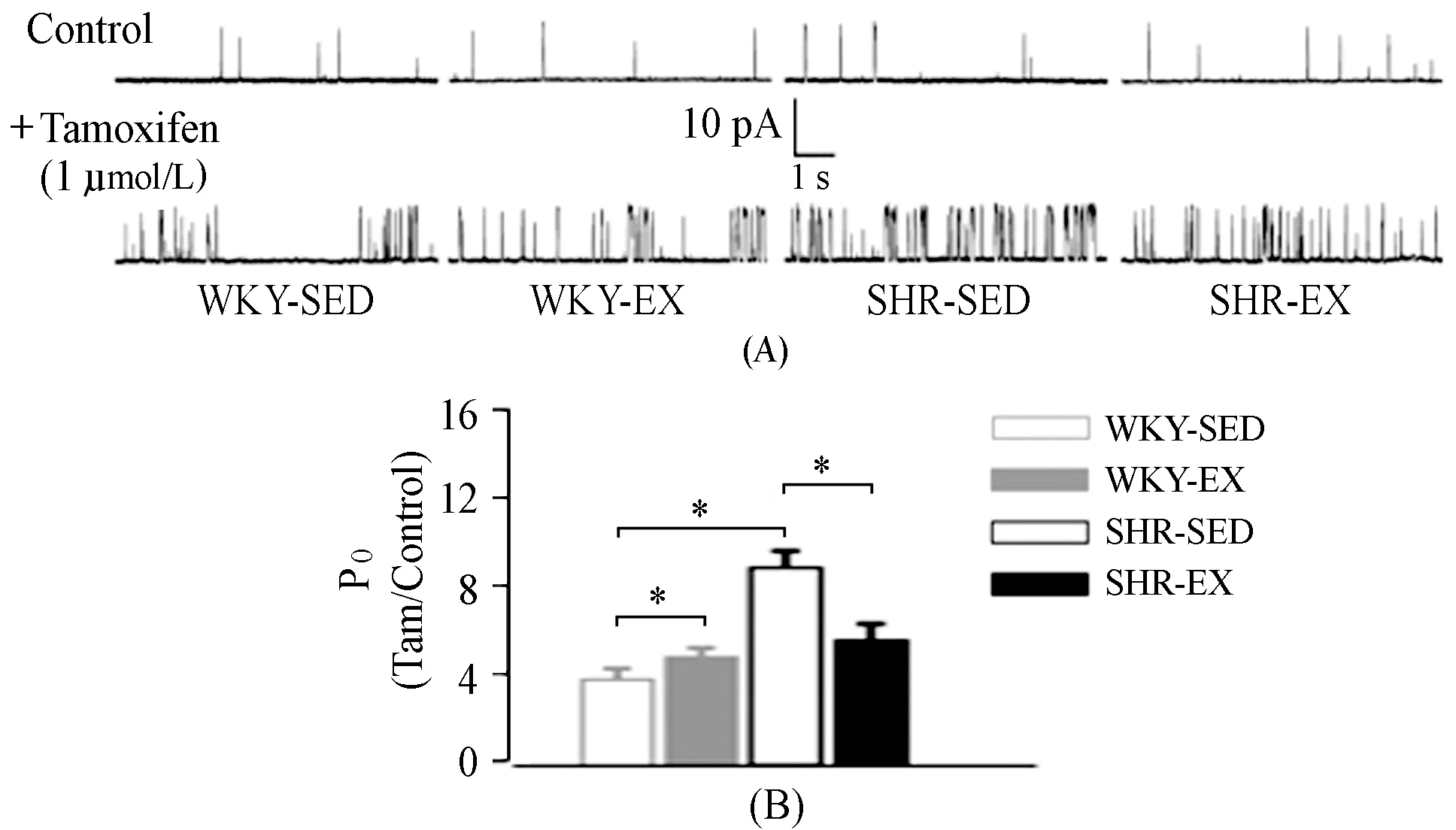
图 3 Tamoxifen对BKCa通道活动的影响Figure 3. Effects of Tamoxifen on BKCa Channel Activity
注:A,HP= +40 mV,[Ca2+]free=100 nmol/L,1 μmol/L tamoxifen诱发BKCa通道开放示意图;B,tamoxifen诱发BKCa通道开放概率(Po)改变统计图,各组n=6。
提示,SHR脑动脉平滑肌β1亚基的功能上调,导致了BKCa通道活性增强,而有氧运动在一定程度上能够改变BKCa通道β1亚基的功能,来抑制SHR脑动脉平滑肌BKCa通道功能的上调。
2.5 Caffeine对RyR功能及STOC的影响
RyR的特异性激动剂咖啡因(caffeine)能够引起全胞钙瞬变(Ca2+transients),活细胞实时成像结果可见图4A-a。钙振荡对应时间点分为0 s、15 s、21 s、33 s、60 s;细胞在0 s时存在一定浓度的静息水平钙,加入10 mmol/L caffeine后,15 s时胞内钙离子浓度开始升高,荧光强度增强;到达21 s时荧光强度最强,胞内钙离子浓度达到峰值,RyR Ca2+释放完全,引起全胞钙浓度迅速上升;33 s胞内钙离子浓度下降,至60 s时逐渐恢复至开始静息水平,此时肌质网SR对胞内钙离子回收,胞内钙离子恢复静息水平。但各组之间由caffeine诱发的钙振荡幅值无显著性差异(P>0.05,图4A-b)。提示,各组大鼠平滑肌细胞肌质网雷诺丁受体(RyR)钙库储量(Ca2+store)未发生变化。
如图4B所示,caffeine同时能够有效地激活STOC,当钳制电压在-30 mV时,浴液中加入1 mmol/L caffeine后,STOC幅值和频率分别增加了32.9%±2.3%和438.1%±51.8%。
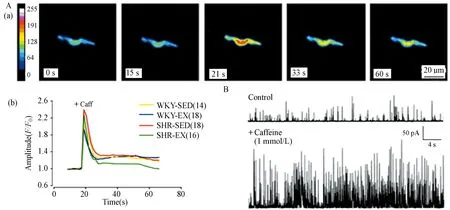
图 4 Caffeine对RyR功能及STOC的影响Figure 4. Effects of Caffeine on RyR and STOC
注:A-a,10 mmol/L caffeine诱发的全胞钙瞬变代表图;A-b,各组平滑肌细胞由caffeine诱发的钙瞬变曲线图,n为各组细胞个数。B,HP=-30 mV时,1 mmol/L caffeine增强STOC活动代表图。
2.6 运动对SHR脑动脉平滑肌细胞BKCa通道α、β1亚基表达及分布的影响
免疫荧光技术及激光共聚焦成像观察各组大鼠脑动脉单个平滑肌细胞BKCa通道α、β1亚基表达及分布。如图5Aa~d所示,BKCa通道α亚基主要分布于平滑肌细胞质膜表面,而胞内无明显阳性信号;各组平滑肌细胞α亚基表达量无显著性差异(P>0.05,图5B)。如图5Ae~h,BKCa通道β1亚基除在平滑肌细胞膜表面有较多表达外,在细胞质中也有散在分布;SHR-SED组β1亚基表达较WKY-SED组显著上调(P<0.05);经有氧运动后,WKY-EX组β1亚基表达发生上调(P<0.05),而SHR-EX组较SHR-SED组β1亚基表达发生显著下调(P<0.01,图5B)。
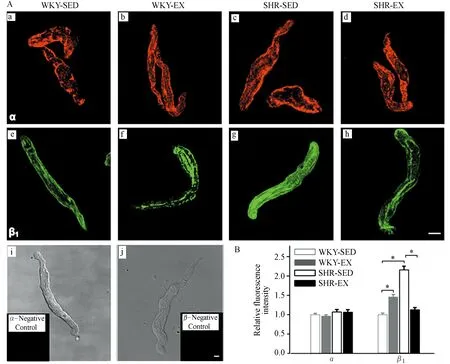
图 5 脑动脉平滑肌细胞BKCa通道α、β1亚基表达及分布Figure 5. Fluorescent Microphotographs of Confocal Microscopy Images and Quantitative Analysis of BKCa α and β1 Subunits on Arterial Myocytes
注:A,a~d:各组荧光标记BKCa通道α亚基脑动脉平滑肌细胞代表图;e~h:各组荧光标记BKCa通道β1亚基脑动脉平滑肌细胞代表图;i~j:脑动脉平滑肌细胞明场图,以及未加入α、β1亚基抗体阴性对照代表图;标尺:20 μmol/L;B,各组细胞相对荧光强度统计图,n=6。
3 讨论
本研究结果表明,在原发性高血压时,RyR与BKCa通道功能耦联的上调是一种适应性机制,为了对抗压力诱发的收缩,从而预防脑缺血;BKCa通道β1亚基上调是RyR-BKCa功能耦联增强的重要因素之一。长期规律的有氧运动能有效逆转这种病理性代偿,重塑脑血管功能。
瞬时外向钾电流(STOC)由钙火花,即SR上RyR开放,从而激活邻近的BKCa通道产生。STOC不仅反映SR上RyR开放情况,也反映了膜上BKCa通道的活动[15]。有研究表明,当脑动脉的钙火花被阻断后,BKCa通道在血管张力调节中的负反馈调节作用无法发挥[19]。因此,STOC可作为评价RyR与BKCa耦联的重要指标,在血管张力、平滑肌收缩和兴奋性调节中起到重要作用[23]。
本研究中,穿孔膜片钳记录证明,在相同钳制电位下,SHR脑动脉平滑肌细胞STOC的幅值显著增加。提示,在高血压时,细胞膜上的BKCa通道与SR钙释放耦联显著增强。这种增强可能的原因:1)SR上RyR钙释放增多;2)钙火花与BKCa通道之间耦联效率增强;3)膜上BKCa通道表达增多。免疫荧光结果分析BKCa通道α亚基表达量在4组中无显著性差异,但β1亚基在高血压大鼠中的表达却显著增多。因此,β1亚基表达上调,BKCa单通道开放时间和电压敏感性的改变,或许可以解释高血压时脑动脉平滑肌细胞STOC活动的增强。本研究单通道记录结果显示,高血压时BKCa通道的开放概率显著增加,这与高血压动脉BKCa通道β1亚基表达上调是一致的。Tamoxifen能够直接与β1亚基相结合通过非基因组效应显著激活平滑肌BKCa通道[10],因此,tamoxifen具有检测β1亚基对BKCa通道调控的作用。本实验结果显示,与WKY-SED组相比,tamoxifen诱导的BKCa单通道活动在SHR-SED组显著增强,但运动抑制了高血压大鼠中的BKCa单通道活动的上调。同时,高血压脑动脉BKCa通道β1亚基表达的上调经有氧运动后也显著下降。综上,SHR脑动脉平滑肌STOC幅值的增加,首先归因于BKCa单通道活动增强导致,其次,BKCa通道β1亚基表达上调也是其重要原因。
除去BKCa通道固有生物物理特性的改变,SHR脑动脉平滑肌细胞STOC增强也可能与SR上RyR钙释放增强有关。胞内Ca2+是无处不在的信号分子,往往同一种钙离子在同一细胞中介导多种多样,甚至截然相反的生物学功能,钙信号分子在时间与空间上多样的存在形式,赋予了Ca2+独特的高效性、特异性以及多功能性[7]。而VSMC中亦存在众多钙信号分子,如钙瞬变、钙火花、钙星(Ca2+sparklet)等,这些钙信号转导在决定和调控VSMC功能上起着重要重用[6]。因此,本研究中,采用活细胞实时钙离子成像技术检测了肌质网上钙库储量情况。RyR特异性的激动剂caffeine能够引起SR钙库耗竭,导致全胞钙瞬变。各组之间由caffeine诱发的钙振荡幅值无显著性差异,提示,各组大鼠平滑肌细胞肌质网RyR钙库储量未发生变化。钙火花是肌质网上成簇分布的RyR自发或者协同开放所产生的钙释放事件[17,29]。在一些血管病变中,钙火花与BKCa通道耦联发生了改变,因此,钙火花是重要的治疗靶点。但本研究中未检测脑动脉平滑肌细胞自发性钙火花情况,只通过穿孔膜片钳得到SHR脑动脉平滑肌STOC的幅值显著增加,在一定程度上说明细胞膜上的BKCa通道与SR上钙释放耦联增强,但高血压时钙火花幅值与频率的具体变化情况还需在今后的实验中通过激光共聚焦系统加以检测。
综上,在正常血压组,有氧运动能够引起BKCa通道β1亚基的上调,从而增强BKCa通道的活动,调节血管张力。然而,在高血压时,为代偿脑动脉平滑肌细胞内升高的Ca2+浓度,RyR-BKCa通道耦联增强,BKCa通道β1亚基的上调是这种耦联增强的重要因素之一,有氧运动抑制了高血压时β1亚基的上调,改善了高血压引起的血管病理性重构。其潜在机制之一可能是运动直接重塑高血压引起的BKCa通道病理变化,β1亚基的上调抑制;其次,也可能与运动有效降低了血压有关,血压与膜上Cav1.2通道活动有着密切关系,运动有效降低血压,随后Cav1.2通道活动下调,钙内流减少[1],RyR钙火花活动减弱,BKCa通道β1亚基呈现下调,BKCa通道活动在血管张力调节中的负反馈作用减弱,具体机制还需后续进一步研究。Mokelke等[25]发现,糖尿病血脂异常时,冠状动脉平滑肌细胞钙激活钾通道(KCa)与钙释放功能耦联增强,而耐力运动抑制了钙释放与KCa耦联的上调;但是在另一个研究中,他们同时又发现,在冠状动脉的微血管中,钙火花与STOC贡献发生了下调,运动同样抑制了这种下调[24]。提示,STOC与钙火花在血管调节中的机制是非常复杂的,但运动似乎都能够抑制这些病理性的改变。
国内、外大量研究证明,BKCa在血管调节方面的重要作用,但对其在高血压的发病机制中所起的作用仍有较大争论。目前,多数研究证实,BKCa通道的功能和表达在高血压时是上调的,但也有相反的报道[3,4,18,28]。Amberg等[3,4]报道,无论是在血管紧张素Ⅱ诱导的高血压还是遗传性高血压中,BKCa通道β1亚基呈现下调,此变化减弱了BKCa通道对钙火花的敏感性,即在高血压时RyR与BKCa耦联减弱。但本研究的结果与Amberg的报道并不一致,具体原因仍需更多的研究加以阐明。Liu等[20,21]研究证明,SHR和WKY大鼠静息时脑动脉直径未有显著差异,说明高血压时BKCa通道上调并非产生主动扩张,而是缓冲脑部阻力血管收缩时所增加的张力,即高血压时,BKCa上调可能作为一种代偿性机制缓冲血管兴奋性,以便调节慢性高血压脑动脉的静息张力,这与本研究结果是一致的。
越来越多的研究表明,长期规律的有氧运动能够降低血压,改善血管功能[13]。运动能够引起血管平滑肌离子通道发生良性重构。以往研究发现,运动能够增加平滑肌细胞BKCa通道电流和蛋白表达[2,11,33],中等强度运动能够抑制高血压引起的肠系膜动脉Cav1.2通道功能和蛋白表达的上调,有效逆转高血压Cav1.2通道重构,改善血管功能[1]。本研究通过膜片钳技术、钙离子成像、免疫荧光技术,分别从BKCa通道宏观活动STOC,单通道电流,RyR钙库储量,BKCa通道亚基表达,证明了有氧运动可以有效抑制高血压导致的脑动脉平滑肌RyR-BKCa通道耦联上调,为运动维持高血压脑血管稳态和重塑研究提供了相关证据。
4 结论
高血压引起RyR-BKCa功能耦联的增强是为了缓冲血管压力增高诱发的脑动脉收缩,而BKCa通道β1亚基功能上调是其重要因素之一,长期规律有氧运动能有效地抑制这种病理性代偿,恢复脑血管功能。
[1]鲁妮,陈渝,邱方,等.不同强度运动对自发性高血压大鼠肠系膜动脉Cav1.2通道重构的影响[J].体育科学,2015,35(6):57-63.
[2]ALBARWANI S,AL-SIYABI S,BAOMAR H,etal.Exercise training attenuates ageing-induced BKCachannel downregulation in rat coronary arteries[J].Exp Physiol,2010,95(6):746-755.
[3]AMBERG G C,BONEV A D,ROSSOW C F,etal.Modulation of the molecular composition of large conductance Ca2+activated K+channels in vascular smooth muscle during hypertension[J].J Clin Invest,2003,112(5):717-724.
[4]AMBERG G C,SANTANA L F.Downregulation of the BK channel beta1 subunit in genetic hypertension[J].Circ Res,2003,93(10):965-971.
[5]BARNES J N.Exercise,cognitive function,and aging[J].Adv Physiol Edu,2015,39(2):55-62.
[6]BERRIDGE M J.Smooth muscle cell calcium activation mechanisms[J].J Physiol,2008,586(21):5047-5061.
[7]BERRIDGE M J,LIPP P,BOOTMAN M D.The versatility and universality of calcium signalling[J].Nat Rev Mol Cell Biol,2000,1(1):11-21.
[8]BOHLEN H G.The microcirculation in hypertension[J].J Hypertens Suppl,1989,7(4):S117-124.
[9]BOWLES D K,HU Q,LAUGHLIN M H,etal.Exercise training increases L-type calcium current density in coronary smooth muscle[J].Am J Physiol,1998,275(6):H2159-2169.
[10]DICK G M,ROSSOW C F,SMIRNOV S,etal.Tamoxifen activates smooth muscle BK channels through the regulatory β1subunit[J].J Biol Chem,2001,276(37):34594-34599.
[11]DUNCKER D J,BACHE R J.Regulation of coronary blood flow during exercise[J].Physiol Rev,2008,88(3):1009-1086.
[12]ENGLAND S K,WOOLDRIDGE T A,STEKIEL W J,etal.Enhanced single-channel K+current in arterial membranes from genetically hypertensive rats[J].Am J Physiol,1993,264(5):H1337-1345.
[13]ESENWA C,GUTIERREZ J.Secondary stroke prevention:challenges and solutions[J].Vasc Health Risk Manag,2014,11:437-450.
[14]FIUZA-LUCES C,GARATACHEA N,BERGER N A,etal.Exercise is the real polypill[J].Physiology(Bethesda),2013,28(5):330-358.
[15]FLYNN E R,BRADLEY K N,MUIR T C,etal.Functionally separate intracellular Ca2+stores in smooth muscle[J].J Biol Chem,2001,276(39):36411-36418.
[16]HARPER S L,BOHLEN H G.Microvascular adaptation in the cerebral cortex of adult spontaneously hypertensive rats[J].Hypertension,1984,6(3):408-419.
[17]JAGGAR J,WELLMAN G,HEPPNER T,etal.Ca2+channels,ryanodine receptors and Ca2+-activated K+channels:A functional unit for regulating arterial tone[J].Acta Physiol Scand,1998,164(4):577-587.
[18]JOSEPH B K,THAKALI K M,MOORE C L,etal.Ion channel remodeling in vascular smooth muscle during hypertension:Implications for novel therapeutic approaches[J].Pharmacol Res,2013,70(1):126-138.
[19]LIU Q H,SAVOIA C,WANG Y X,etal.Local Calcium Signaling in Airway Smooth Muscle Cells[M].Springer International Publishing,2014:107-124.
[20]LIU Y,HUDETZ A G,KNAUS H G,etal.Increased expression of Ca2+-sensitive K+channels in the cerebral microcirculation of genetically hypertensive rats:evidence for their protection against cerebral vasospasm[J].Circ Res,1998,82(6):729-737.
[21]LIU Y,JONES A W,STUREK M.Ca2+-dependent K+current in arterial smooth muscle cells from aldosterone-salt hypertensive rats[J].Am J Physiol,1995,269(4):H1246-1257.
[22]LOCATELLI J,ASSIS L V M D,ISOLDI M C.Calcium handling proteins:Structure,function,and modulation by exercise[J].Heart Fail Rev,2014,19(2):207-225.
[23]MCCARRON J G,BRADLEY K N,MUIR T C.Ca2+signalling and Ca2+-activated K+channels in smooth muscle[J].Novart Found Symp,2002,246:52-64.
[24]MOKELKE E A,DIETZ N J,ECKMAN D M,etal.Diabetic dyslipidemia and exercise affect coronary tone and differential regulation of conduit and microvessel K+current[J].Am J Physiol Heart Circ Physiol,2005,288(3):H1233-1241.
[25]MOKELKE E A,HU Q,SONG M,etal.Altered functional coupling of coronary K+channels in diabetic dyslipidemic pigs is prevented by exercise[J].J Appl Physiol,2003,95(3):1179-1193.
[26]NELSON M T,CHENG H,RUBART M,etal.Relaxation of arterial smooth muscle by calcium sparks[J].Sci,1995,270(5236):633-637.
[27]NELSON M T,QUAYLE J M.Physiological roles and properties of potassium channels in arterial smooth muscle[J].Am J Physiol,1995,268(4):C799-822.
[28]NIEVESCINTRON M,AMBERG G C,NICHOLS C B,etal.Activation of NFATc3 down-regulates the beta1 subunit of large conductance calcium-activated K+channels in arterial smooth muscle and contributes to hypertension[J].J Biol Chem,2007,282(5):3231-3240.[29]PÉREZ G J,BONEV A D,PATLAK J B,etal.Functional coupling of ryanodine receptors to KCachannels in smooth muscle cells from rat cerebral arteries[J].J Gen Physiol,1999,113(2):229-238.[30]RUSCH N J.BK channels in cardiovascular disease:a complex story of channel dysregulation[J].Am J Physiol Heart Circ Physiol,2009,297(5):H1580-1582.
[31]STUREK M.Ca2+regulatory mechanisms of exercise protection against coronary artery disease in metabolic syndrome and diabetes[J].J Appl Physiol,2011,111(2):573-586.
[32]VINA J,SANCHIS G F,MARTINEZ B V,etal.Exercise acts as a drug:The pharmacological benefits of exercise[J].Br J Pharmacol,2012,167(1):1-12.
[33]YANG Y,JONES A W,THOMAS T R,etal.Influence of sex,high-fat diet,and exercise training on potassium currents of swine coronary smooth muscle[J].Am J Physiol Heart Circ Physiol,2007,293(3):H1553-1563.
Inhibition of Aerobic Exercise on Enhanced Functional Coupling of RyR-BKCaChannel in Hypertension Cerebral Arterial Smooth Muscle Cells
ZHANG Yan-yan1,2,LIU Yu-jia1,2,BAI Ping1,2,WU ying2,SHI Li-jun1,2
hypertension;exercise;ryanodinereceptor;BKCachannel
1000-677X(2017)01-0055-07
10.16469/j.css.201701005
体育科学
2016-10-19;
2017-01-03
国家自然科学基金资助项目(31371201);国家体育总局全民健身领域课题(2015B035)。
张严焱,女,在读博士研究生,主要研究方向为运动和心血管生理学,E-mail:15210574247@163.com;石丽君,女,教授,博士,博士研究生导师,主要研究方向为运动和心血管生理学,E-mail:l_j_shi72@163.com。
1.北京体育大学 运动与体质健康教育部重点实验室,北京 100084;2.北京体育大学 运动生理教研室,北京 100084 1.Key Laboratory of Physical Fitness and Exercise,Ministry of Education,Beijing Sport University,Beijing 100084,China;2.Beijing Sport University,Beijing 100084,China.
G804.2
A
