盐酸氨溴索对慢性阻塞性肺疾病大鼠肺组织细胞凋亡和血清炎症因子的影响
2017-02-11陈晓明张伟兵田晓彦刘长萍张慧赵春雨
陈晓明 张伟兵 田晓彦 刘长萍 张慧 赵春雨
盐酸氨溴索对慢性阻塞性肺疾病大鼠肺组织细胞凋亡和血清炎症因子的影响
陈晓明1张伟兵1田晓彦1刘长萍2张慧1赵春雨1
目的 研究细胞凋亡在大鼠慢性阻塞性肺疾病(简称慢阻肺)形成过程中的作用机制,并探讨盐酸氨溴索对慢阻肺大鼠肺组织细胞凋亡和血清炎症因子的影响。方法 34只健康SD大鼠随机分为3组:A正常对照组、B盐酸氨溴索组、C模型组。采用免疫组化法检测Bcl-2(b cell lymphoma/lewkmia-2)蛋白、Bax(Bcl-2 associated x protein)蛋白及Caspase-3蛋白的表达;采用血清酶联免疫吸附测定法测定各组血清中炎症因子(LTB4、IL-8、SP-D)的浓度。结果 与A组比较,C组中Bax蛋白、Caspase-3蛋白以及炎症因子表达增多,Bcl-2蛋白的表达及Bcl-2/Bax减少,差异均显著(P<0.05);与C组比较,B组Bax蛋白、Caspase-3蛋白以及炎症因子表达减少,Bcl-2蛋白的表达及Bcl-2/Bax增高,差异均显著(P<0.05)。结论 慢阻肺的发病机制可能与细胞凋亡有关,盐酸氨溴索在慢阻肺肺组织中发挥抗细胞凋亡和抗炎作用,其机制可能在于调控死亡信号通路中Bax、Bcl-2、Caspase-3蛋白的表达以及抑制炎症因子的表达,起到肺保护的作用。
慢性阻塞性肺疾病;细胞凋亡;炎症因子;盐酸氨溴索
目前,慢性阻塞性肺疾病(简称慢阻肺)的发病机制尚不十分清楚,除了肺部的慢性炎症、蛋白酶失衡、氧化与抗氧化失衡等在慢阻肺发病中起重要作用以外,越来越多的研究表明,细胞凋亡是慢阻肺形成与发展的重要机制,并且与Bcl-2、Bax、Caspase-3等细胞凋亡相关因子有关[1-2]。盐酸氨溴索有促进肺泡表面活性物质生成、促进排痰和抑制炎症反应的作用,并广泛应用于临床治疗中,近期有少量研究显示盐酸氨溴索可调节凋亡蛋白的表达[3-5],但尚需大量实验验证。
本实验意在探究细胞凋亡在大鼠慢阻肺形成过程中的作用,并初步探讨盐酸氨溴索对慢阻肺大鼠肺组织细胞凋亡和血清炎症因子的影响,指导其在临床应用。
资料与方法
一、实验动物和主要试剂
34只雄性、清洁级SD大鼠作为本实验研究对象,鼠龄8周,体重(200±10)g,购于青岛市实验动物和动物实验中心;盐酸氨溴索购于德国勃林格殷格翰公司;LTB4、IL-8、SP-D试剂盒购自北京诚林生物科技有限公司;Bcl-2、Bax、Caspase-3单克隆抗体均购自武汉博士德公司。
二、方法
1 大鼠慢阻肺模型的建立及分组:SD大鼠34只,随机分为3组,A组10只,B组12只,C组12只。常规饲养1周,同时将各组大鼠按随机数字表法标号,A组为正常对照组,B组为盐酸氨溴索组,C组为模型组。大鼠正常饲养1周后开始建模。A组室温下正常饲养,将B、C组大鼠从第8天到第63天(共8周)用哈尔滨烟(焦油10mg,CO 12mg,烟气烟碱量0.8mg)烟熏,建立慢阻肺模型。C组大鼠于烟熏第8周开始皮下注射盐酸氨溴索(沐舒坦),30mg/次,2次/天,持续7天,第64天实验停止,处死大鼠并取材。B、C组大鼠中分别有1只在实验开始第10、11天死亡,B组中有1只大鼠在采血过程中出现差错,血样本不合格,故弃用。所以,最终进入实验用于研究的大鼠分别为A组10只,B组10只,C组11只。
2 HE染色
① 经4%多聚甲醛固定的肺组织,常规脱水、石蜡包埋,4μm切片,每块肺组织切5片。②肺组织的脱蜡使用二甲苯,经水化处理,各放置在二甲苯I液体中10min、二甲苯II溶液中10min;再分别放入无水乙醇I、II液体中浸泡10min,最后,染色前分别经95%、90%乙醇溶液浸泡5min后取出。③把经切片、脱蜡处理完毕后组织放置在苏木素中先染色5min,之后,反复自来水冲洗5min。④ 1%盐酸乙醇分别浸泡5秒。⑤ 于伊红溶液中染色约20秒,水洗5min。⑥ 常规脱水,透明,封片:80%乙醇反应2min→95%乙醇I、II反应各5min→无水乙醇I、II反应各5min→二甲苯I、II反应各5min透明;经上述处理完毕后进行封片,使用中性树胶,自然烘干待用于观察和图片采集。⑦ 由病理科进行图片采集和分析。
3 免疫组化法检测Bcl-2、Bax、Caspase-3蛋白表达:将石蜡切片常规脱蜡至水,3%H2O2去离子水孵育10min,阻断内源性过氧化物酶,PBS冲洗三次,每次2min。将切片浸入柠檬酸盐缓冲液中,一同放入微波炉内加热4min,关闭电源10min,再加热4min,取出,自然冷却至室温。滴加按1 ∶100比例稀释的兔抗鼠Bcl-2单克隆抗体,4℃冰箱中过夜,PBS冲洗三次,每次2min。滴加二抗,37℃孵育30min,PBS冲洗三次,每次2min。应用DAB显色10min,蒸馏水充分冲洗。复染,将这组玻片浸入苏木素染液中1min。脱水及透明处理。封片,将中性树胶滴到玻片上,盖上盖玻片,稍待干,显微镜下观察。Bax、Caspase-3检测操作步骤同Bcl-2。结果分析:Motic3000显微摄影系统于400倍下摄片,采用Image-pro plus6.0病理图像分析系统对阳性表达进行定量分析,以积分光密度(IOD)代表基因和蛋白相对表达量,积分光密度(IOD)=阳性面积×平均光密度,每例随机分析3个高倍镜视野,取其均值代表该例的相对表达量。染色结果细胞核呈蓝色,阳性为黄色或黄棕色。
4 ELISA检测LTB4、IL-8和SP-D浓度:应用酶联免疫吸附法(ELISA)检测血清中LTB4、IL-8和SP-D的浓度。

IL-8和SP-D检测操作步骤同LTB4。
三、统计学处理
结 果
一、各组大鼠肺组织病理学变化
所有标本经制片后在光学显微镜下(×100倍)显示:A组大鼠肺泡大小一致,结构完整,未见气肿样改变,无炎症细胞浸润(图1A);B组肺组织镜下特点为:局部肺泡扩张、融合,纤毛上皮细胞部分脱落,可见纤毛粘连、倒伏、甚至坏死,可见少量炎性细胞浸入,但是肺泡融合程度、炎性细胞浸润和肺泡间隔断裂等方面较C组减轻,但与A组比较,仍呈慢阻肺的肺组织病理学特点(图1B);C组肺泡结构明显扩张,肺泡间隔融合、断裂,肺大疱形成,伴随有大量炎性细胞入侵,使纤毛上皮破坏、脱落,说明已成功建立慢阻肺(图1C)
二、各组大鼠肺组织Bcl-2、Bax、Caspase-3蛋白表达的变化
Bcl-2、Bax、Caspase-3蛋白均表达于胞质,在各组肺组织中都有少量表达,但C组Bax、Caspase-3蛋白的表达均明显高于A组,Bcl-2蛋白的表达及Bcl-2/Bax值均明显低于A组(均P<0.05)。进一步比较B、C两组,C组Bax、Caspase-3蛋白的表达均明显高于B组,Bcl-2蛋白的表达及Bcl-2/Bax值均明显低于B组,均P<0.05(见表1,图2)。
三、各组大鼠血清炎症因子浓度比较
比较各组大鼠血清中炎症因子,三组间LTB4、IL-8、SP-D血清浓度具有显著差异,进一步比较A、C两组,C组LTB4、IL-8、SP-D血清浓度明显高于A组,比较B、C两组,B组LTB4、IL-8、SP-D血清浓度明显低于C组。表明慢阻肺大鼠血清中炎症因子增多,经盐酸氨溴索治疗后,血清炎症因子降低。(见表2)。
讨 论
慢阻肺在全球范围内发病率和病死率均较高,其死亡率呈逐年升高的趋势,然而慢阻肺的早期症状轻微,不易引起重视,此外患者缺乏主动就诊意识,导致其诊断率及治疗率远低于患病率[6]。实际上慢阻肺也是一种可防、可治的疾病,对慢阻肺患者早期发现并干预,有利于提高长期生存率。而早期发现依赖于早期正确的诊断,对其发病机制进行研究,有望做到早期诊断、合理治疗,进而提高患者的生活质量,减轻社会经济负担。
目前,慢阻肺发病机制复杂,炎症反应、蛋白酶与抗蛋白酶失衡、氧化应激、细胞凋亡在慢阻肺发病机制中起重要作用,其中炎症因子增加及炎症细胞凋亡减少是慢阻肺急性加重和病情进展的诱因,加之肺组织自身细胞的凋亡增加作为慢阻肺的致病因素越来越受重视。细胞凋亡与炎症反应相互影响,相互促进,共同促进慢阻肺进展。
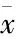
表1 各组大鼠肺组织Bcl-2、Bax、Caspase-3蛋白相对表达量的积分光密度比较(IOD值,±s)
注:*与A组比较,P<0.05;#与C组比较,P<0.05

图1 三组大鼠肺组织光镜下病理学观察(×100倍)

图2 三组大鼠肺组织免疫组化染色情况(×400倍)

组别nLTB4IL⁃8SP⁃DA102343.21±120.98272.73±18.177.84±2.19B103216.40±270.59#519.77±17.20#10.89±1.74#C113747.89±153.13∗665.24±21.25∗14.02±1.28∗
注:*与A组比较P<0.05,#与C组比较,P<0.05
Bcl-2蛋白家族是细胞凋亡过程的重要成员,包括抗凋亡基因Bcl-2和促凋亡基因Bax等[7-8]。Bax与Bcl-2基因含有三个同源区域,即BH1、BH2、BH3,但两者作用相反。Bcl-2、Bax等定位于线粒体膜上,Bcl-2阻止细胞色素C从线粒体释放,从而抑制凋亡;Bax则相反,通过与线粒体膜结合,促进细胞色素C的释放,进而促进细胞凋亡[9]。还有研究显示,细胞对凋亡信号的敏感性取决于胞内Bcl-2/Bax竞争性的二聚体化过程。当Bcl-2基因高表达时,可形成Bcl-2/Bcl-2同源二聚体,也可形成Bcl-2/Bax异源二聚体,均抑制凋亡;而Bax表达升高时,则形成Bax/Bax同源二聚体,促进细胞凋亡[10-14]。
Caspase蛋白家族是细胞凋亡的核心成员,不同的凋亡刺激信号激活的Caspase不同,但Caspase-3是多种凋亡途径的必经之路,是细胞凋亡的执行者。细胞凋亡通路主要有三个,即线粒体途径、死亡受体途径、内质网通路。线粒体途径和死亡受体介导的信号转导通路起关键作用。线粒体途径又称内源性途径,经国内外不断研究,目前认为该通路如下。凋亡信号如DNA损伤、氧化剂等可以引起线粒体损伤以及线粒体膜的渗透性改变,Bcl-2/Bax信号通路被启动,进而刺激线粒体内膜间隙将细胞色素C释放入胞浆。在此,细胞色素C结合apaf-1和Caspase-9的前体,使Caspase-9活化,后者激活Caspase-3,最终使DNA断裂、破坏细胞骨架结构,最终导致细胞调亡[15]。位于细胞外的一些信号分子刺激细胞,与细胞表面的死亡受体结合,继而激活细胞凋亡信号通路,导致细胞凋亡。哺乳动物细胞的死亡受体主要包括神经生长因子受体和肿瘤坏死因子受体超家族,主要成员有Fas/Apo-l/CD95,DR-4/TRAIL-R1等。当死亡受体Fas与配体FasL相结合后,Fas胞质区内的死亡结构域(death domain,DD)与Fas结合蛋白(FADD)结合,随后,FADD以其氨基端的死亡效应结构域结合Caspase-8的前体,形成Fas-FADD-Caspase-8前体组成的死亡诱导复合物,激活Caspase-8,活化的Caspase-8可以进一步激活执行死亡功能的效应蛋白Caspase-3,导致细胞调亡[16]。Aoshiba[17]等人发现慢阻肺患者肺组织的Ⅰ、Ⅱ型肺泡上皮细胞和血管内皮细胞中的DNA断裂灶增多,并伴有活化的Caspase-3表达增多。与汪利华[18]、梁宪梅[19]等人的研究一致,同样证实了Caspase-3是细胞凋亡的关键。所有这些表明,慢阻肺细胞通过各种途径激活Caspase家族成员,引起DNA酶活化,诱发细胞凋亡。宋国栋[20]等人之后再次证实了Caspase-3是细胞凋亡过程的重要成员。
在本实验研究中,经过烟雾处理后,B、C两组HE染色均有不同程度的肺气肿改变,表明慢阻肺造模成功。C组Bcl-2蛋白的表达明显低于A组,而Bax、Caspase-3蛋白的表达明显高于A组,尤其是Bcl-2/Bax下降,提示烟雾诱导的慢阻肺大鼠肺组织中已经发生了细胞凋亡,若及时阻止此过程,就会防止肺泡腔进一步扩大和肺组织重构进行性发展。所以,研究慢阻肺中凋亡机制具有较为重要的意义。
经盐酸氨溴索干预后,B组Bax、Caspase-3蛋白的表达明显少于C组,而Bcl-2蛋白的表达以及Bcl-2/Bax升高,差异具有统计学意义。表明B组大鼠肺组织的凋亡细胞少于C组,证实了盐酸氨溴索有抗细胞凋亡的作用。加之Bcl-2保护蛋白的增多,进一步说明了盐酸氨溴索具有肺保护的作用,延缓了慢阻肺的进展。
本实验研究还发现血清LTB4、IL-8、SP-D炎症因子在A组大鼠肺组织中升高,表明血清LTB4、IL-8、SP-D与香烟烟雾暴露下慢阻肺关系密切,炎症因子是慢阻肺发生的重要因素。经盐酸氨溴索治疗1周后上述炎症因子的表达有所下降,即B组小于C组,差异有统计学意义,说明盐酸氨溴索在本实验中亦发挥抗炎作用。
多年来,盐酸氨溴索用于呼吸道疾病,如慢阻肺、肺感染、急性呼吸窘迫综合征等,其药理作用主要在于化痰。经多年研究显示,盐酸氨溴索还具有抗氧化、肺保护以及与抗生素的协同作用。有少量文献报道盐酸氨溴索有抗细胞凋亡作用,但研究多集中于肿瘤、急性肺损伤、缺血再灌注损伤等方面[3-5],但是盐酸氨溴索治疗慢阻肺的作用是否也与抗细胞凋亡有关,尚未见文献报道,本实验证实了盐酸氨溴索在慢阻肺的治疗中与细胞凋亡有关,其机制可能在于调控Bcl-2、Bax、Caspase-3蛋白的表达。本实验还证实了单独使用盐酸氨溴索也有抗炎的作用,而不是必需要与抗生素联合,为盐酸氨溴索的临床应用开拓了新思路。但是盐酸氨溴索的众多药理作用,在慢阻肺治疗中的作用程度有多大,哪一方面为主,尚需进行大量实验研究。另外本实验样本量相对较小,结果可能具有局限性,需要大样本实验来证明结论、探讨其具体机制。
[1] Zhao G, Zhu Y, Eno CO, et al. Activation of the proapoptotic Bcl-2 protein Bax by a small molecule induces tumor cell apoptosis[J]. Mol Cell Biol, 2014, 34(7): 1198-1207.
[2] 苏斌涛, 崔天盆, 罗光伟, 等. 慢阻肺患者血清中VEGF的表达及与细胞凋亡的相关性研究[J]. 临床肺科杂志, 2014, 19(11): 1951-1953.
[3] 王琳, 贾晓民, 赵杰, 等. 氨溴索对大鼠胃内容物吸入性肺损伤细胞凋亡的影响[J]. 临床肺科杂志, 2013, 18(9): 1572-1574.
[4] 郑纪阳, 戴新建, 王万铁, 等. 盐酸氨溴索对急性肺损伤兔模型中肺组织细胞凋亡的影响[J]. 中国呼吸与危重监护杂志, 2009, 8(3): 238-241.
[5] Jiang K, Wang X, Mao X, et al. Ambroxol alleviates hepatic ischemia reperfusion injury by antioxidant and antiapoptotic pathways[J]. Transplant Proc, 2013, 45(6): 2439-2445.
[6] 钟南山. 早发现、早诊断和早干预应是我国慢性阻塞性肺疾病防治的主要研究方向[J]. 中华结核和呼吸杂志, 2012, 35(4): 243-245.
[7] Zhao J, Wang LP, Nie JS, et al. Effects of benzo(a)pyrene on apoptosis of neuronal cells and expression of Bcl-2 and Bax proteins in rat brain tissue[J]. Zhonghua Lao Dong Wei Sheng Zhi Ye Bing Za Zhi, 2011, 29(11): 820-824.
[8] 刘郁东, 郑启新, 吴宏斌, 等. 雷帕霉素对不同肿瘤细胞Bax/Bcl-2和活性caspase-3表达的影响[J]. 肿瘤,2013, 33(2):138-143.
[9] Morishita N, Tsukahara H, Chayama K, et al. Activation of Akt is associated with poor prognosis and chemotherapeutic resistance in pediatric B-Precursor acute lymphoblastic leukemia[J]. Pediatr Blood Cancer,2012,59(1):83-89.
[10] 闫海军, 陈明伟. Bcl-2在肺癌中的表达及意义[J]. 临床肺科杂志,2013,18(1):14-15.
[11] Youle RJ, Strasser A. The BCL-2 protein family: opposing activities that mediate cell death[J]. Nat Rev Mol Cell Biol,2008,9(1):47-59.
[12] Denisov AY, Madiraju MS, Chen G, et al. Solution structure of human BCL-w: modulation of ligand binding by the C-terminal helix[J]. J Biol Chem,2003,278(23):21124-21128.
[13] 王蒙, 张程达, 李真, 等. 乳腺浸润性导管癌中拓扑异构酶Ⅱ等相关因素表达与腋窝淋巴结转移的关系研究[J]. 中国全科医学,2013,16(6):615-617.
[14] 李晓凤, 巴彩霞, 袁海清, 等. B7-H1和Bcl-2在人结直肠癌中表达及其临床意义[J]. 肿瘤,2012,32(7):555-558.
[15] Jia G, Wang Q,Wang R,et al. Tubeimoside-1 induces glioma apoptosis through regulation of Bax/Bcl-2 and the ROS/Cytochrome C/Caspase-3 pathway[J]. Oncotargets Ther,2015,8:303-311.
[16] Fulda S. Targeting apoptosis for anticancer therapy[J]. Semin Cancer Biol,2015, 31:84-88.
[17] Aoshiba K, Zhou F, Tsuji T, et al. DNA damage as a molecular link in the pathogenesis of COPD in smokers[J]. Eur Respir J,2012,39(6):1368-1376.
[18] 汪利华, 何玉萍, 黎海东. 肺炎克雷伯菌肺炎对大鼠胸腺细胞凋亡的影响及机制[J]. 临床肺科杂志,2016,21(3): 411-414.
[19] 梁宪梅, 曾锦荣, 夏春波. 慢性阻塞性肺疾病患者细胞凋亡和caspase-3的表达[J]. 实用临床医药杂志,2011,15(17):30-32.
[20] 宋国栋, 丁启翠, 吴倩, 等. 辛伐他汀对老年慢阻肺大鼠肺泡上皮细胞凋亡的干预作用[J]. 新医学,2014,45(1):12-16.
Influence of ambroxol on cell apoptosis in lung tissue and serum inflammatory factor in rats with chronic obstructive pulmonary disease
CHENXiao-ming,ZHANGWei-bing,TIANXiao-yan,LIUChang-ping,ZHANGHui,ZHAOChun-yu
theFourthAffiliatedHospitalofHarbinMedicalUniversity,Harbin,Heilongjiang150001,China
Objective To study the mechanism of action of cell apoptosis in rats with chronic obstructive pulmonary disease (COPD) and to discuss the influence of ambroxol on cell apoptosis in lung tissue and serum inflammatory factors in rats with chronic obstructive pulmonary disease. Methods 34 healthy SD rats were randomly divided into three groups. The normal control group was named A, the ambroxol group was named B, and the COPD model group named C. The expressions of apoptosis markers (Bcl-2, Bax, Caspase-3) in each group were tested by immunohistochemistry, and the contents of the inflammatory factors (LTB4, IL-8, SP-D) in each group were tested by ELISA. Results Compared with the group A, the group C had higher expression of Bax, Caspase-3 and inflammatory factors, and lower expression of Bcl-2 and Bcl-2/Bax (P<0.05). Compared with the group C, the group B had lower expression of Bax, Caspase-3 and inflammatory factors, and higher expression of Bcl-2 and Bcl-2/Bax (P<0.05). Conclusion The mechanism of COPD may associate with cell apoptosis. The ambroxol has the effect of anti-apoptosis and anti-inflammatory, and it is probably that the ambroxol could regulate the expression of Bcl-2, Bax and Caspase-3 and inhibit the expression of inflammatory factors, and the protect lung.
chronic obstructive pulmonary disease; apoptosis; inflammatory factors; ambroxol
10.3969/j.issn.1009-6663.2017.03.040
1.150001 黑龙江 哈尔滨,哈尔滨医科大学附属第四医院老年病二科 2. 150001 黑龙江 哈尔滨,哈尔滨汽轮机厂职工医院内一科
张伟兵,E-mail:weibingzhang6688@163.com
2016-06-16]
