血细胞分离术对溃疡性结肠炎诱导应答、缓解和维持缓解的meta分析
2017-02-11顾雪香黄光明
虞 艳 顾雪香 向 杰 黄光明
南京医科大学第二临床医学院 南京医科大学第二附属医院消化医学中心(210011)
血细胞分离术对溃疡性结肠炎诱导应答、缓解和维持缓解的meta分析
虞 艳 顾雪香 向 杰 黄光明*
南京医科大学第二临床医学院 南京医科大学第二附属医院消化医学中心(210011)
背景:血细胞分离术(CAP)逐渐用于溃疡性结肠炎(UC)的治疗,但其疗效尚无统一定论。目的:系统性评价CAP对UC患者的有效性和安全性。方法:计算机检索PubMed、Embase、Web of Science、Cochrane Library、中国知网、万方和维普数据库,纳入所有关于CAP治疗UC的临床随机对照试验(RCTs)。由2名研究者独立选择文献、提取资料和文献质量评价后,采用RevMan 5.3软件进行meta分析。结果:共纳入20项研究1 354例UC患者。Meta分析结果显示,CAP诱导UC临床应答(RR=1.36, 95% CI: 1.20~1.55,P<0.000 01)、临床缓解(RR=1.38, 95% CI: 1.15~1.66,P=0.000 5)以及维持缓解(RR=2.92, 95% CI: 1.40~6.08,P=0.004)均明显优于传统治疗或假手术,而不良事件发生率无明显差异(RR=0.37, 95% CI: 0.11~1.24,P=0.110)。结论:CAP对诱导UC临床应答、缓解以及维持缓解具有较好的疗效,且安全性良好,但仍需大规模、多中心RCTs证实。
血细胞去除术; 结肠炎,溃疡性; 治疗; 随机对照试验; Meta分析
溃疡性结肠炎(UC)是一种慢性非特异性肠道炎性疾病,与克罗恩病(CD)同属于炎症性肠病(IBD)的范畴。UC的发病机制尚不明确,普遍认为与遗传易感性、环境、免疫等因素有关。目前UC的治疗主要为5-氨基水杨酸制剂、糖皮质激素和免疫抑制剂等传统治疗,必要时辅以手术[1]。近年随着肠道菌群失调在IBD发病机制中作用的研究,肠道微生态调整成为治疗的新靶点,研究显示益生菌、益生元和粪菌移植[2]等治疗IBD已取得一定疗效。但有相当一部分患者存在药物抵抗、依赖以及不能耐受等情况,且粪菌移植治疗IBD的机制、疗效和安全性等仍有待进一步评估。因此,对IBD新型治疗方法的研究尤为迫切。
研究发现UC患者常伴有循环中活化粒细胞、单核巨噬细胞以及相关促炎细胞因子增加,体内循环免疫复合物水平升高[3]。去除血液中这些增加的白细胞等成分对UC或许有治疗作用。基于这一理论,血细胞分离术(cytapheresis, CAP)逐渐用于IBD的治疗,根据设备装置不同,CAP主要分为滤过型血细胞分离术(LCAP)和选择性粒单核细胞吸附分离术(GMA)。日本已批准GMA和LCAP用于难治性UC患者的治疗[4-5]。但目前CAP对UC的疗效结果不一。本研究通过检索相关随机对照试验(RCTs)并行meta分析,旨在系统性评价CAP对UC患者诱导临床应答、缓解以及维持缓解的价值。
资料与方法
一、文献检索
检索PubMed(1966年1月—2016年3月)、Embase(1980年1月—2016年3月)、Web of Science(1950年1月—2016年3月)、Cochrane Library(1995年第一季度—2016年第一季度)和中文数据库(如中国知网、万方、维普)。英文主题词或关键词:IBD, inflammatory bowel disease, UC, ulcerative colitis和leukocytapheresis, leukapheresis, cytapheresis, apheresis, Adacolumn, Cellsorba;中文主题词或关键词:炎症性肠病、溃疡性结肠炎和血细胞分离、白细胞分离、安德康。对所得文献进一步检索其参考文献,以查全相关研究。
二、文献纳入和排除标准
1. 纳入标准:①仅纳入基于人群的临床RCTs;②试验组必须包含CAP治疗,对照组可采用传统治疗、假手术、空白对照或其他干预;③具有明确的被广泛接受的诊断标准,原始文献需明确阐述疗效的评判标准,且提供各治疗组人数和结局变量;④纳入的研究不受语种限制。
2. 排除标准:①试验设计为非RCTs或动物实验;②数据不完整;③无对照组,或将不同时期的患者作为对照组或为自我对照;④未表明终点结局。
三、数据提取
绘制资料提取表格,包括第一作者、发表时间、国家、研究对象、干预方法、主要结局(包括临床应答率、缓解率、不良反应发生率等)和试验质量。由两名研究者独立纳入数据,存在分歧时由第三名研究者决定是否纳入。质量评价采用改良Jadad评分,由两名研究者根据随机化、盲法、随访标准对文献进行独立评分,产生分歧时由三名研究者商议后最终确定评分,低于4分为低质量文献。对重复的会议简报和文献,核对信息后仅提取文献信息。
四、统计学分析
采用RevMan 5.3统计软件,评估CAP对UC疗效的统计指标为二分类变量,如文献数据以发生率表示,则将数据换算为原始数据(即例数)。计数资料以相对危险度(relative risk, RR)及其95% CI表示。纳入研究间异质性的分析采用χ2检验,若P>0.10且I2≤50%认为同质性较好,采用固定效应模型分析,否则采用随机效应模型进行合并,行亚组分析和敏感性分析探索异质性来源。根据改良Jadad评分行分层分析。以漏斗图检验发表偏倚。
结 果
一、检索结果
共检索到1 472篇文献,其中PubMed 476篇,Web of Science 460篇,Embase 413篇,Cochrane Library 42篇,中国知网8篇,万方25篇,维普48篇。通过阅读文题和摘要,剔除重复文献566篇,排除不相关研究、非随机对照研究、回顾性研究、综述等不符合纳入标准的文献791篇,对剩余115篇可能合格的文献进一步阅读全文,排除非随机对照研究和结局指标等不符合纳入标准的文献95篇,最终纳入文献20篇[6-25]。
二、纳入文献基本情况分析
20项RCTs共纳入2003—2013年的1 354例UC患者,其中4项研究[17,21-23]采用LCAP(Cellsorba装置),14项研究[6-8,10-16,18-20,24]采用GMA(Adacolumn装置),其余2项研究[9,25]同时运用LCAP和GMA并比较了两者的疗效差异;15项评估了CAP对UC诱导临床应答和缓解的作用,5项评估了CAP对UC维持缓解的作用。所有纳入文献的基本特征见表1。
三、CAP对诱导UC应答和缓解的作用
1. 诱导应答:共纳入9项研究[6-8,11,14,21-24],结果显示CAP对UC的临床应答率显著高于对照组(66.0%对50.8%; RR=1.36, 95% CI: 1.20~1.55,P<0.000 01)。进一步根据改良Jadad评分行分层分析发现,6项研究[6,8,11,21-23],为高质量文献,其临床应答率显著高于对照组(RR=1.32, 95% CI: 1.12~1.56,P=0.000 8)。3项研究[7,14,24]为低质量文献,其临床应答率显著高于对照组(RR=1.47, 95% CI: 1.20~1.79,P=0.000 2)。
2. 诱导缓解:共纳入6项研究[6-8,11,14,23],结果显示CAP对UC患者的诱导缓解率明显高于对照组(46.6%对38.2%,RR=1.38, 95% CI: 1.15~1.66,P=0.000 5)(图1)。
①装置不同:分为GMA和LCAP。5项研究[6-8,11,14]采用GMA,其临床缓解率显著高于对照组(RR=1.38, 95% CI: 1.14~1.68,P=0.001)。2项研究[21,23]采用 LCAP,其临床缓解率显著高于对照组(RR=2.04, 95% CI: 1.36~3.08,P=0.000 6)。此外,2项研究[9,25]比较了LCAP和GMA的有效性,发现两者疗效相当(RR=0.94, 95% CI: 0.76~1.16,
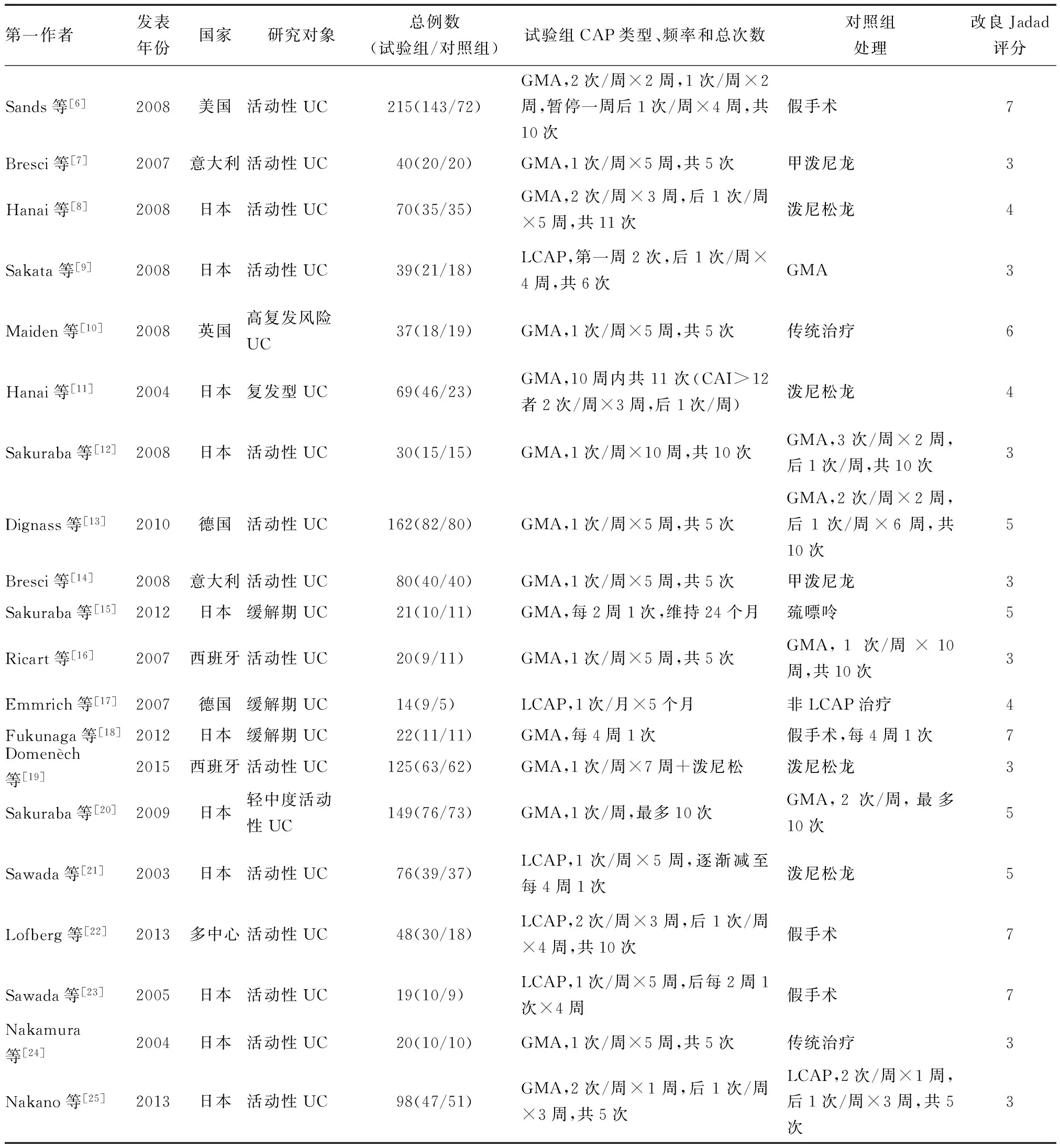
表1 纳入文献的基本特征
P=0.57)。
②治疗次数不同:分为5(7)次和10(11)次治疗组,其中3项研究[7,14,23]采用5(7)次CAP治疗,其诱导临床缓解的效果优于对照组(RR=1.36, 95% CI: 1.02~1.81,P=0.04)。3项研究[6,8,11]采用10(11)次CAP治疗,其诱导临床缓解的疗效优于对照组(RR=1.41, 95% CI: 1.08~1.83,P=0.01)。此外,2项研究[13,16]比较了5(7)次组和10(11)次组的疗效,结果发现两者疗效相当(RR=1.07, 95% CI: 0.76~1.51,P=0.72)。
③文献质量不同:分为高质量组和低质量组,其中4项研究[6,8,11,23]为高质量文献,其缓解率显著高于对照组(RR=1.41, 95% CI: 1.09~1.84,P=0.009)。2项研究[7,14]为低质量文献,其缓解率显著高于对照组(RR=1.34, 95% CI: 1.05~1.72,P=0.020)。
3. 治疗频率不同:分为常规和高频治疗组,3项研究[12-13,20]比较了常规与高频CAP诱导UC临床缓解的疗效,发现两者疗效相当(RR=0.88, 95% CI: 0.73~1.07,P=0.190)。
4. 对激素用量的影响:共6项研究[8,11,18-19,21,23]评估了CAP对患者激素用量的影响,其中3项研究[8,11,19]统计了免于激素治疗的情况,发现CAP较对照组更能诱导患者免于激素治疗(RR=3.56, 95% CI: 1.91~6.64,P<0.000 1)。
四、CAP维持UC缓解的作用
共6项研究[8,10,14-15,17-18]评估了CAP对UC患者维持缓解的情况,结局指标为临床复发率,其中2项研究[10,17]随访时间均为6个月,结果显示对照组的UC患者复发率为75.0%,CAP为29.6%,CAP维持UC缓解的疗效优于传统治疗(RR=2.92, 95% CI: 1.40~6.08,P=0.004)。
五、敏感性分析
1. 诱导应答:2项研究[6,22]采用Mayo评分进行评估,一项研究[21]综合采用实验室指标、临床表现和内镜下表现等进行评估,其余研究均采用CAI评分,剔除这三项研究后,敏感性分析显示总体应答率仍显著高于对照组(RR=1.38, 95% CI: 1.20~1.58,P<0.000 01)。
2. 诱导缓解:剔除采用Mayo评分的研究[6]后,敏感性分析显示CAP对UC诱导缓解的疗效仍显著高于对照组(RR=1.39, 95% CI: 1.16~1.67,P=0.000 3)。
六、不良反应
13项研究统计了不良反应,主要为头晕、头痛、恶心、呕吐、乏力、畏寒等,症状轻微且短时间内可恢复。其中7项RCTs[6-8,14,18,21,23]统计了不良事件的例数,采用随机效应模型分析发现,CAP和对照组的不良事件发生率无明显差异(54.4%对69.8%,RR=0.37, 95% CI: 0.11~1.24,P=0.110)。
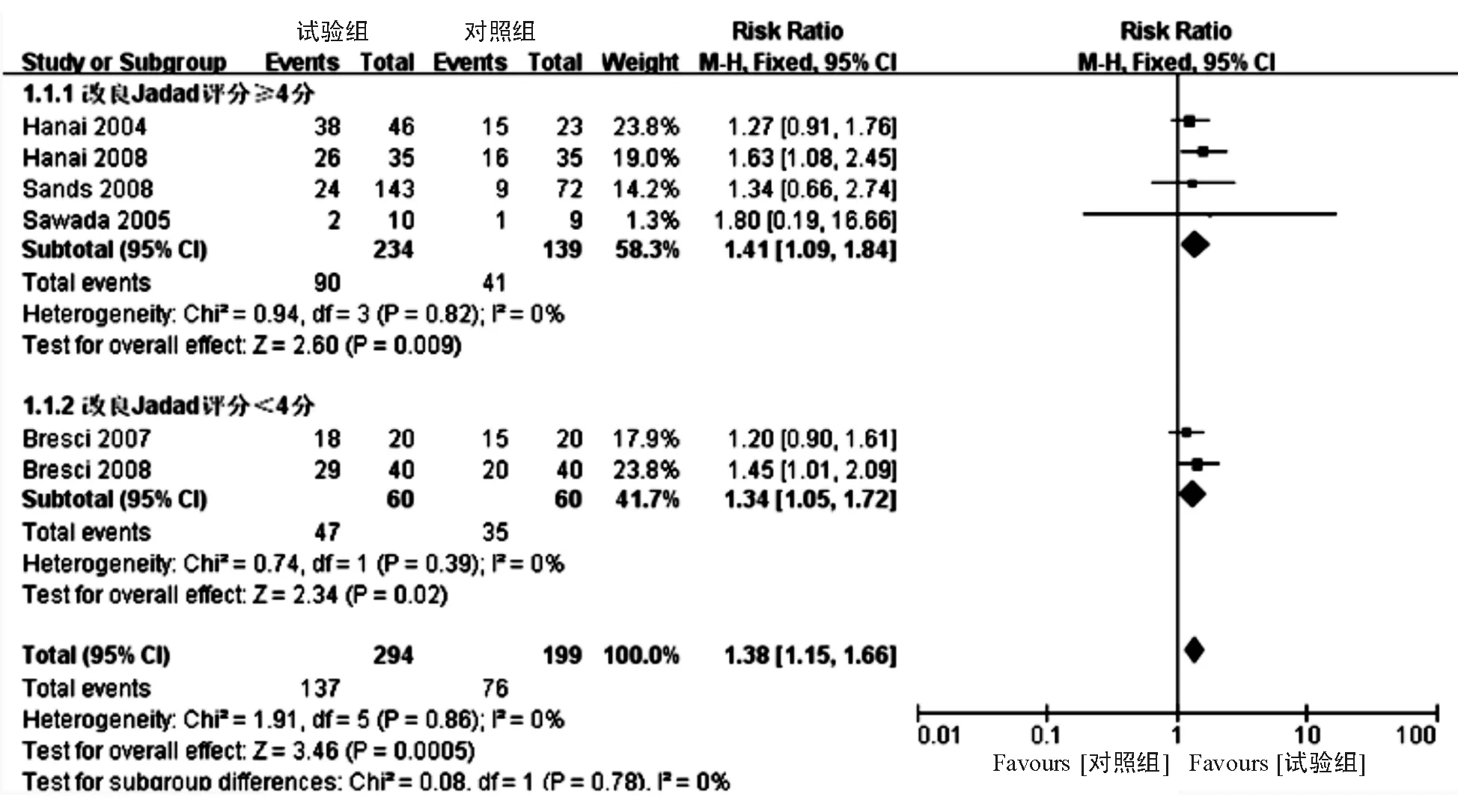
图1 CAP对UC诱导缓解的作用
七、发表偏倚
对CAP诱导UC患者临床应答作漏斗图分析,显示存在一定的不对称性,提示可能存在发表偏倚。而CAP诱导UC临床缓解的漏斗图示左右基本对称,提示发表偏倚较小。而CAP维持UC缓解的纳入文献较少,故未行发表偏倚分析。
讨 论
本研究显示,与对照组相比,CAP治疗UC不仅能取得更高的临床应答率和临床缓解率,还能很大程度地减少激素用量,甚至使患者免于激素治疗。此外,CAP能减少UC的复发,且其不良事件发生情况与对照组相当。
与其他纳入的研究不同,Sands等[6]的研究发现,CAP诱导的临床应答率和缓解率高于对照组,但差异并无统计学意义。这可能与研究对象的选择以及对照组的干预措施有关,Sands等[6]的试验组为中重度UC患者,对照组给予假手术处理,但同时仍伴随口服激素治疗。而其余研究的试验组多为激素依赖或抵抗型UC患者,且对照组处理方式主要为传统激素治疗。但本meta分析发现CAP诱导UC临床应答和缓解的疗效更佳。
CAP根据分离装置不同分为两种:①GMA:主要装置为吸附性血液净化器Adacolumn,流速为30 mL/min,一次循环可滤过约65%的粒细胞、55%的单核巨噬细胞以及一小部分淋巴细胞。②LCAP:主要采用滤过型分离装置Cellsorba,其吸附介质为亲水性高分子微纤维无纺布制备的滤过柱,流速为50 mL/min,每次循环可滤过约35%的血小板和64%的淋巴细胞,而粒细胞和单核细胞几乎可被完全滤去。尽管两种分离装置不同,但均能通过去除活化的白细胞和免疫复合物,减少白细胞介素(IL)-1、IL-6和肿瘤坏死因子(TNF)-α等炎性细胞因子等,起到减轻组织炎性损伤的作用[26]。本研究两种分离装置的疗效均优于对照组且两者疗效相当。目前两种CAP的基本疗程均为每周1次,每次1 h,共5周。现有研究[20,27]认为CAP疗效与治疗次数和频率有关。本meta分析发现,5(7)次治疗组和10(11)次治疗组,以及常规治疗组和高频治疗组的疗效均优于对照组,而不同治疗次数以及不同频率组之间均无明显差异。
本研究的不足之处在于所纳入的研究多来源于欧美和日本,我国对此研究甚少且暂无RCTs,导致了一定的局限性,未能分析CAP对国人的临床疗效和安全性。
目前CAP在UC的治疗中展现了良好的应用前景,特别是对于难治性UC患者,起效较快,安全性较高,患者依从性较好,但由于治疗费用较高、缺乏CAP治疗的成本效益分析,CAP的推广与临床研究受到了限制。故近年CAP治疗UC的研究较少见。
综上所述,本meta分析显示CAP对于UC患者的疗效和安全性可观,有较大的临床应用前景。但考虑到人种和基因差异,本研究结果是否可完全推广到国人仍有待国内大样本多中心临床RCTs证实。
1 中华医学会消化病学分会炎症性肠病学组. 炎症性肠病诊断与治疗的共识意见(2012年·广州)[J]. 胃肠病学, 2012, 17 (12): 763-781.
2 Moayyedi P, Surette MG, Kim PT, et al. Fecal microbiota transplantation induces remission in patients with active ulcerative colitis in a randomized controlled trial[J]. Gastroenterology, 2015, 149 (1): 102-109.e6.
3 Xavier RJ, Podolsky DK. Unravelling the pathogenesis of inflammatory bowel disease[J]. Nature, 2007, 448 (7152): 427-434.
4 Shimoyama T, Sawada K, Hiwatashi N, et al. Safety and efficacy of granulocyte and monocyte adsorption apheresis in patients with active ulcerative colitis: a multicenter study[J]. J Clin Apher, 2001, 16 (1): 1-9.
5 Sawada K, Muto T, Shimoyama T, et al. Multicenter randomized controlled trial for the treatment of ulcerative colitis with a leukocytapheresis column[J]. Curr Pharm Des, 2003, 9 (4): 307-321.
6 Sands BE, Sandborn WJ, Feagan B, et al; Adacolumn Study Group. A randomized, double-blind, sham-controlled study of granulocyte/monocyte apheresis for active ulcerative colitis[J]. Gastroenterology, 2008, 135 (2): 400-409.
7 Bresci G, Parisi G, Mazzoni A, et al. Treatment of patients with acute ulcerative colitis: conventional corticosteroid therapy (MP) versus granulocytapheresis (GMA): a pilot study[J]. Dig Liver Dis, 2007, 39 (5): 430-434.
8 Hanai H, Iida T, Takeuchi K, et al. Intensive granulocyte and monocyte adsorption versus intravenous prednisolone in patients with severe ulcerative colitis: an unblinded randomised multi-centre controlled study[J]. Dig Liver Dis, 2008, 40 (6): 433-440.
9 Sakata Y, Iwakiri R, Amemori S, et al. Comparison of the efficacy of granulocyte and monocyte/macrophage adsorptive apheresis and leukocytapheresis in active ulcerative colitis patients: a prospective randomized study[J]. Eur J Gastroenterol Hepatol, 2008, 20 (7): 629-633.
10 Maiden L, Takeuchi K, Baur R, et al. Selective white cell apheresis reduces relapse rates in patients with IBD at significant risk of clinical relapse[J]. Inflamm Bowel Dis, 2008, 14 (10): 1413-1418.
11 Hanai H, Watanabe F, Yamada M, et al. Adsorptive granulocyte and monocyte apheresis versus prednisolone in patients with corticosteroid-dependent moderately severe ulcerative colitis[J]. Digestion, 2004, 70 (1): 36-44.
12 Sakuraba A, Sato T, Naganuma M, et al. A pilot open-labeled prospective randomized study between weekly and intensive treatment of granulocyte and monocyte adsorption apheresis for active ulcerative colitis[J]. J Gastroenterol, 2008, 43 (1): 51-56.
13 Dignass AU, Eriksson A, Kilander A, et al. Clinical trial: five or ten cycles of granulocyte-monocyte apheresis show equivalent efficacy and safety in ulcerative colitis[J]. Aliment Pharmacol Ther, 2010, 31 (12): 1286-1295.
14 Bresci G, Parisi G, Mazzoni A, et al. Granulocytapheresis versus methylprednisolone in patients with acute ulcerative colitis: 12-month follow up[J]. J Gastroenterol Hepatol, 2008, 23 (11): 1678-1682.
15 Sakuraba A, Sato T, Morohoshi Y, et al. Intermittent granulocyte and monocyte apheresis versus mercaptopurine for maintaining remission of ulcerative colitis: a pilot study[J]. Ther Apher Dial, 2012, 16 (3): 213-218.
16 Ricart E, Esteve M, Andreu M, et al. Evaluation of 5 versus 10 granulocyteaphaeresis sessions in steroid-dependent ulcerative colitis: a pilot, prospective, multicenter, randomized study[J]. World J Gastroenterol, 2007, 13 (15): 2193-2197.
17 Emmrich J, Petermann S, Nowak D, et al. Leukocy-tapheresis (LCAP) in the management of chronic active ulcerative colitis -- results of a randomized pilot trial[J]. Dig Dis Sci, 2007, 52 (9): 2044-2053.
18 Fukunaga K, Yokoyama Y, Kamokozuru K, et al. Adsorptive granulocyte/monocyte apheresis for the maintenance of remission in patients with ulcerative colitis: a prospective randomized, double blind, sham-controlled clinical trial[J]. Gut Liver, 2012, 6 (4): 427-433.
19 Domenèch E, Panés J, Hinojosa J, et al. A randomized, multicentre, clinical trial to compare prednisone plus granulocyte and monocyte apheresis (GMA) versus prednisone alone for inducing steroid-free remission in patients with steroid dependent ulcerative colitis (UC)[J]. J Crohns Colitis, 2015, 9: S358.
20 Sakuraba A, Motoya S, Watanabe K, et al. An open-label prospective randomized multicenter study shows very rapid remission of ulcerative colitis by intensive granulocyte and monocyte adsorptive apheresis as compared with routine weekly treatment[J]. Am J Gastroenterol, 2009, 104 (12): 2990-2995.
21 Sawada K, Muto T, Shimoyama T, et al. Multicenter randomized controlled trial for the treatment of ulcerative colitis with a leukocytapheresis column[J]. Curr Pharm Des, 2003, 9 (4): 307-321.
22 Lofberg R, Rachmilewitz D, Drastich P, et al. Prospective, randomized, double-blind, sham-treatment controlled multi-center study to evaluate efficacy and safety of leukocytapheresis (LCAP) using ACD-a as anticoagulant in patients with steroid-free, active ulcerative colitis[J]. Gastroenterology, 2013, 144 (5 suppl 1): S226.
23 Sawada K, Kusugami K, Suzuki Y, et al. Leukocytapheresis in ulcerative colitis: results of a multicenter double-blind prospective case-control study with sham apheresis as placebo treatment[J]. Am J Gastroenterol, 2005, 100 (6): 1362-1369.
24 Nakamura T, Kawagoe Y, Matsuda T, et al. Effect of granulocyte and monocyte adsorption apheresis on urinary albumin excretion and plasma endothelin-1 concentration in patients with active ulcerative colitis[J]. Blood Purif, 2004, 22 (6): 499-504.
25 Nakano R, Iwakiri R, Ikeda Y, et al. Factors affecting short- and long-term effects of leukocyte removal therapy in active ulcerative colitis[J]. J Gastroenterol Hepatol, 2013, 28 (2): 303-308.
26 Toya Y, Chiba T, Mizutani T, et al. The effect of granulocyte and monocyte adsorptive apheresis on serum cytokine levels in patients with ulcerative colitis[J]. Cytokine, 2013, 62 (1): 146-150.
27 Schultheiβ C, Weischenberg R, Herrmann A, et al. Dose-intensified granulocyte-monocyte apheresis in therapy refractory ulcerative colitis[J]. Artif Organs, 2015, 39 (2): 187-192.
(2016-06-12收稿;2016-07-06修回)
Cytapheresis for Induction of Response, Remission and Maintenance of Remission in Ulcerative Colitis: A Meta-analysis
YUYan,GUXuexiang,XIANGJie,HUANGGuangming.
theSecondClinicalMedicalSchoolofNanjingMedicalUniversity,MedicalCenterforDigestiveDiseases,theSecondAffiliatedHospitalofNanjingMedicalUniversity,Nanjing(210011)
HUANG Guangming, Email: hgming681@163.com
Cytapheresis; Colitis, Ulcerative; Therapy; Rrandomized Controlled Trial; Meta-Analysis
10.3969/j.issn.1008-7125.2017.01.008
*本文通信作者,Email: hgming681@163.com
Background: Cytapheresis has been used gradually in the treatment of ulcerative colitis (UC), however, its efficacy is still controversial. Aims: To systematically evaluate the efficacy and safety of cytapheresis on UC. Methods: PubMed, Embase, Web of Science, Cochrane Library, CNKI, Wanfang and VIP database were retrieved to collect the randomized controlled trials (RCTs) using cytapheresis for UC. Article selection, data extraction and quality evaluation were conducted independently by two reviewers. Meta-analysis was conducted by using RevMan 5.3 software. Results: A total of 20 RCTs involving 1 354 UC patients were included. The results of the meta-analysis showed that cytapheresis was superior to conventional therapy or sham procedure in inducing clinical response (RR=1.36, 95% CI: 1.20-1.55,P<0.000 01), clinical remission (RR=1.38, 95% CI: 1.15-1.66,P=0.000 5) and maintenance of remission (RR=2.92, 95% CI: 1.40-6.08,P=0.004), and no differences in adverse events were found (RR=0.37, 95% CI: 0.11-1.24,P=0.110). Conclusions: Cytapheresis has porfound effect on induction of clinical response, clinical remission and maintenance of remission, and is safe as well. However, the conclusion should be verified by more large-scale and multi-center RCTs.
