辛伐他汀对人脐静脉内皮细胞黏附分子及NF-κB通路表达的影响
2017-02-10林思思夏宇轩陈彤丹
罗 丹,郝 刚,林思思,夏宇轩,陈彤丹
(1.浙江省人民医院药学部,杭州 310014;2.江苏省苏州市食品药品检验所 215104)
辛伐他汀对人脐静脉内皮细胞黏附分子及NF-κB通路表达的影响
罗 丹1,郝 刚2,林思思1,夏宇轩1,陈彤丹1
(1.浙江省人民医院药学部,杭州 310014;2.江苏省苏州市食品药品检验所 215104)
目的 探讨辛伐他汀对脂多糖(LPS)诱导的人脐静脉内皮(HUVEC)损伤的保护作用及机制。方法 体外培养原代HUVEC,将细胞分为3组:空白组、LPS组及辛伐他汀组。空白组无任何处理,LPS组用LPS刺激,辛伐他汀组先用辛伐他汀(处理浓度也分别为5、25、50 μmol/L)处理24 h,然后再用LPS处理。用荧光定量PCR的方法测定血管细胞黏附分子-1(VCAM-1)、细胞间黏附分子(ICAM-1)和E选择素(E-Selectin)的mRNA表达,用免疫印迹的方法测定VCAM-1及磷酸化p-105(p-p105)的蛋白表达。结果 LPS对HUVEC有明显的损伤作用,导致VCAM-1、ICAM-1及E-Selectin表达显著上升。辛伐他汀可以明显减弱LPS对HUVEC的损伤作用,且效果呈剂量相关性。结论 辛伐他汀通过NF-κB途径减弱LPS对HUVEC的损伤,起到保护内皮细胞的作用。
动脉硬化;内皮,血管;血管黏附分子;人脐静脉内皮细胞;辛伐他汀;NF-κB通路
动脉粥样硬化(arteriosclerosis,AS)是冠心病、中风等严重威胁人类健康疾病的共同病理基础,已经成为我国主要死亡原因之一。目前普遍认为,AS是多种因素导致的复杂慢性炎症过程,起始环节为动脉内皮的损伤、黏附分子的高表达,然后是白细胞与内皮黏附、脂质沉积、板块形成等过程[1]。他汀类药物在降低血脂、预防AS等方面的作用已被大量循证医学证据证实。近年有研究发现,他汀类药物还可以保护内皮细胞、降低黏附分子的表达,这些研究发现阐明了他汀类药物预防AS的其他途径。本实验研究旨在探讨辛伐他汀对人脐静脉内皮细胞(HUVEC)的保护作用,以及核转录因子kappa B(NF-κB)通路是否参与了该保护作用。
1 材料与方法
1.1 材料 原代HUVEC购自Allcell公司;培养基(ECM,包含牛血清、双抗、原代HUVEC生长所需的细胞因子)购自Sciencell公司。实验用脂多糖(LPS)购自Sigma公司;辛伐他汀购自Merck公司。总RNA提取试剂盒UNIQ-10购自生工公司;mRNA逆转录试剂盒(FSQ101)购自TOYOBO公司;qPCR检测试剂盒SYBR购自TAKARA公司;qPCR引物由生工合成。蛋白提取RIPA+PIC及蛋白质定量试剂盒(BCA)试剂盒购自Thermo公司;血管细胞黏附分子-1(VCAM-1)抗体购自Abcam公司;磷酸化p-105(p-p105)抗体购自CST公司。
1.2 方法
1.2.1 HUVEC培养、分组及干预 采用Thermo培养箱,于37 ℃、5%CO2条件下培养HUVEC,实验时采用第2~5代细胞。细胞处理时分为3组:空白组、LPS组及辛伐他汀组。空白组无任何处理,LPS组用0.2 μg/mL的LPS刺激6 h(用于mRNA检测)或24 h(用于蛋白检测);辛伐他汀组先用辛伐他汀处理24 h(处理浓度分别为5、25、50 μmol/L),然后再用LPS处理6 h或24 h。HUVEC的损伤反应采用黏附分子的表达进行判断,在mRNA层面检测VCAM-1、细胞间黏附分子-1(ICAM-1)和E选择素(E-Selectin),在蛋白层面检测VCAM-1,进一步确认该分子的表达。NF-κB通路的活化采用p105磷酸化水平进行判断,LPS刺激HUVEC 30 min后即提取细胞蛋白,用以检测p-p105水平。
1.2.2 荧光定量PCR 采用生工公司的试剂盒提取总RNA,逆转录后用SYBR进行荧光定量检测。检测指标为内皮细胞损伤后表达的黏附分子,包括VCAM-1、ICAM-1和E-Selectin,内参为GAPDH。检测仪器为ABI 7500 Real-Time仪,反应条件为:95 ℃ 30 s,(95 ℃ 5 s、60 ℃ 34 s)×40个循环。引物由生工合成,序列为:VCAM-1 F 5′-GCT GCT CAG ATT GGA GAC TCA-3′,R 5′-CGC TCA GAG GGC TGT CTA TC-3′;ICAM-1 F 5′-TCT GTG TCC CCC TCA AAA GTC-3′,R 5′-GGG GTC TCT ATG CCC AAC AA-3′;E-selectin F 5′-AAT CCA GCC AAT GGG TTC G-3′,R 5′-GCT CCC ATT AGT TCA AAT CCT TCT-3′;GAPDH F 5′-ATG GGG AAG GTG AAG GTC G-3′,R 5′-GGG GTC ATT GAT GGC AAC AAT A-3′。
1.2.3 蛋白印迹分析 采用RIPA+PIC提取细胞总蛋白,BCA法测定蛋白浓度。检测指标为VCAM-1蛋白和NF-κB通路的p-p105蛋白。上样时,每孔加30 μg蛋白,经十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)电泳,转至硝酸纤维膜上,BSA封闭,按照1∶1 000比例稀释后加入VCAM-1抗体,4 ℃孵育过夜,次日TBST洗涤3次,每次10 min,然后按照1∶5 000稀释加入二抗,室温孵育1.5 h,再以TBST洗涤3次,每次10 min。曝光后用ImageJ分析条带强度。
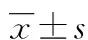
2 结 果
2.1LPS对HUVEC的损伤作用 实验发现LPS组中VCAM-1、ICAM-1及E-Selectin的mRNA和VCAM-1蛋白的表达水平均显著上升,与空白组相比差异有统计学意义(P<0.01),见图1、2。
2.2 辛伐他汀对HUVEC的保护作用 辛伐他丁组中的3个亚组的黏附分子的mRNA和VCAM-1蛋白的表达水平均较LPS组降低,且差异有统计学意义(P<0.05)(图1、2)。同时3个不同辛伐他丁浓度的亚组间比较也差异有统计学意义(P<0.05)。辛伐他汀可抑制VCAM-1、ICAM-1及E-Selectin的mRNA和VCAM-1蛋白的表达,且抑制效果呈剂量相关性。
2.3 辛伐他汀对HUVEC保护作用的可能机制p-p105水平的蛋白印迹分析发现LPS组表达水平较空白组上升,而辛伐他丁组的3个亚组均较LPS组降低,且3个亚组间比较差异有统计学意义(P<0.05)(图3)。LPS损伤HUVEC的信号通路可能为NF-κB途径,辛伐他汀可抑制NF-κB通路保护HUVEC,且抑制效果呈剂量相关性。
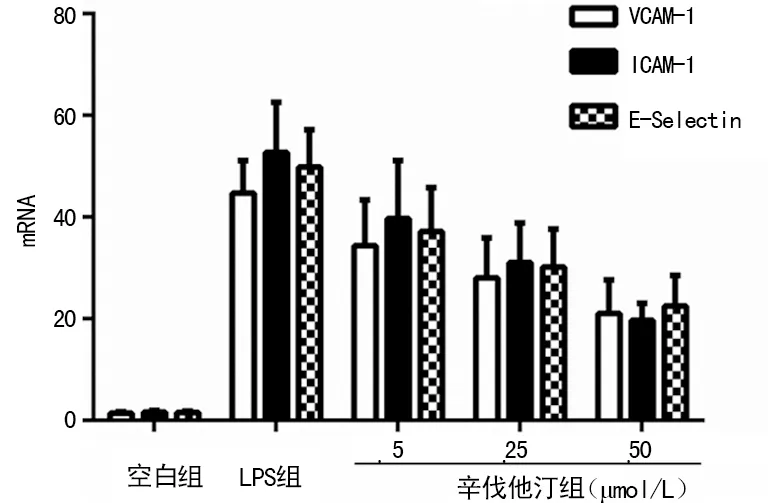
图1 各组黏附分子的mRNA水平表达
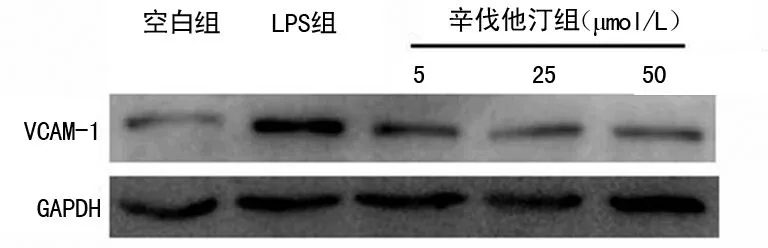
图2 各组VCAM-1蛋白水平表达
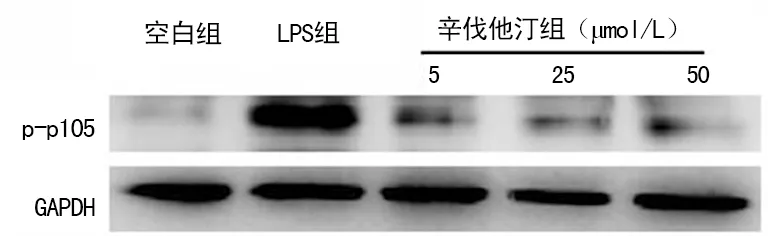
图3 各组HUVEC的p-p105表达
3 讨 论
AS是一种慢性进行性疾病,其形成涉及遗传、血脂紊乱、高血压、糖尿病、抽烟、细菌内毒素、免疫紊乱等多种危险因素。这些因素共同作用导致血管内皮损伤,单核细胞黏附结合于内皮细胞、进入内膜下,转化形成巨噬细胞,进而吞噬脂质,形成泡沫细胞,最终推动AS斑块的进展。因此内皮细胞损伤作为AS的始动环节,长期以来受到研究者的重视。
他汀类药物是3-羟基3-甲基戊二酰辅酶A还原酶抑制剂,具有显著降低胆固醇的作用,其对冠心病的治疗已得到国际指南的广泛认可与推荐[2]。近些年研究发现他汀类药物还可以保护内皮细胞,但这些研究大多以观察现象为主[3-6],证实阿托伐他汀、瑞舒伐他汀等药物可以减少黏附分子、肿瘤坏死因子α(TNF-α)、低密度脂蛋白受体1(LOX-1)等表达,而并未对作用机制做深入探讨。内皮细胞损伤有多种信号途径介导,包括受体酪氨酸激酶途径、NF-κB途径、丝裂原活化蛋白激酶途径、活性氧途径等[1],其中NF-κB途径最常见、也最被广泛研究[7]。LPS、oxLDL、TNF-α等均可以激活内皮细胞的NF-κB通路[8-9]。因此,阻断NF-κB通路成为治疗AS的新途径[10]。本研究首先证实LPS能够通过NF-κB途径损伤HUVEC,导致后者高表达黏附分子,然后发现辛伐他汀能减弱LPS对HUVEC的损伤,并且证实该机制是通过NF-κB途径完成的。
他汀类药物对NF-κB通路的作用,在其他细胞中已有研究者进行了报道[11],也有学者在小鼠缺血/复灌模型中证实他汀类药物可以通过NF-κB途径改善心脏功能[12]。本研究提示,他汀类药物也可以在内皮细胞中影响NF-κB通路,该发现有利于重新认识他汀在冠心病治疗中的作用。
[1]HopkinsPN.Molecularbiologyofatherosclerosis[J].PhysiolRev,2013,93(3):1317-1542.
[2]赵水平,黄贤圣,胡大一.比较ACC/AHA与ESC/EAS血脂指南[J].浙江医学,2015,42(1):5-6.
[3]XuQL,LuanTZ,FuSB,etal.EffectsofpitavastatinontheexpressionofVCAM-1anditstargetgenemiR-126inculturedhumanumbilicalveinendothelialcells[J].CardiovascTher,2014,32(5):193-197.
[4]YangJC,HuangFY,WuCJ,etal.SimvastatinreducesVCAM-1expressioninhumanumbilicalveinendothelialcellsexposedtolipopolysaccharide[J].InflamRes,2012,61(5):485-491.
[5]姜玉姬,姜华.阿托伐他汀对人脐静脉内皮细胞Lox-1、TNF-α及ICAM-1表达的影响[J].重庆医学,2012,41(17):1708-1709,1712.
[6]郝宝顺,刘雪莲,刘勇,等.瑞舒伐他汀对同型半胱氨酸损伤人脐静脉内皮细胞血管细胞间黏附分子-1表达的影响[J].广东医学,2015,36(11):1646-1648.
[7]SunX,HeS,WaraAK,etal.SystemicdeliveryofmicroRNA-181binhibitsnuclearfactor-κBactivation,vascularinflammation,andatherosclerosisinapolipoproteinE-deficientmice[J].CircRes,2014,114(1):32-40.
[8]EndeG,PoitzDM,WiedemannE,etal.TNF-α-mediatedadhesionofmonocytestoendothelialcells:theroleofephrinA1[J].JMolCellCardiol,2014(77):125-135.
[9]BaoMH,ZhangYW,ZhouHH.Paeonolsuppressesoxidizedlow-densitylipoproteininducedendothelialcellapoptosisviaactivationofLOX-1/p38MAPK/NF-κBpathway[J].JEthnopharmacol,2013,146(2):543-551.
[10]MadonnaR,DeCaterinaR.RelevanceofnewdrugdiscoverytoreduceNF-κBactivationincardiovasculardisease[J].VasculPharmacol,2012,57(1):41-47.
[11]KimY,LeeEJ,JangHK,etal.StatinpretreatmentinhibitstheLPS-inducedEMTviathedownregulationofTLR4andNF-κBinhumanbiliaryepithelialcells[J].JGastroenterolHepatol,2016,31(6):1220-1228.
[12]MalikS,SharmaAK,BhartiS,etal.Invivocardioprotectionbypitavastatinfromischemic-reperfusioninjurythroughsuppressionofIKK/NF-κBandupregulationofpAkt-e-NOS[J].JCardiovascPharmacol,2011,58(2):199-206.
罗丹(1986-),药剂师,硕士,主要从事临床药学方面研究。
�验交流·
10.3969/j.issn.1671-8348.2017.02.032
R541.4
B
1671-8348(2017)02-0243-03
2016-07-08
2016-10-18)
