蓝莓益生菌通过影响IL-22/JAK1/STAT3信号通路改善非酒精性脂肪肝的研究*
2017-02-10祝娟娟程明亮任婷婷周明玉
祝娟娟,程明亮,任婷婷,周明玉
(贵州医科大学附属医院感染科,贵阳 550001)
蓝莓益生菌通过影响IL-22/JAK1/STAT3信号通路改善非酒精性脂肪肝的研究*
祝娟娟,程明亮△,任婷婷,周明玉
(贵州医科大学附属医院感染科,贵阳 550001)
目的 研究蓝莓益生菌通过对白细胞介素-22(IL-22)调控的酪氨酸蛋白激酶-1(JAK1)/信号转导激活转录因子-3(STAT3)信号通路的影响,进一步探明其改善非酒精性脂肪肝病(NAFLD)的作用机制。方法 清洁级SD大鼠40只分为正常对照组(NG)、观察组(MG)、蓝莓组(BG)、益生菌组(PG)和蓝莓+益生菌组(BPG)。除NG(100%普通饮食)外,其余大鼠均采用复合高脂饲料制备脂肪肝模型共12周。确认造模成功后再将剩余MG大鼠分为BG、PG及BPG,共观察8周。结果BPG与MG、BG及PG比较:肝脏指数、血清丙氨酸氨基转移酶(ALT)、门冬氨酸氨基转移酶(AST)、三酰甘油(TG)、总胆固醇(TC)、低密度脂蛋白(LDL)显著下降(P<0.01),高密度脂蛋白(HDL)显著升高(P<0.01);酶联免疫吸附试验(ELISA)检测IL-22:BPG的蛋白水平较MG、BG、PG增高(P<0.01);定量反转录酶-聚合酶链锁反应(qRT-PCR):BPG的JAK1、STAT3的表达较MG、BG、PG显著升高(P<0.01),胆固醇调节元件蛋白-1c(SREBP-1c)表达显著降低(P<0.01);Westernblot:BPG的IL-22、JAK1、STAT3的表达较MG、BG、PG显著升高(P<0.01),SREBP-1c表达明显减少(P<0.01)。结论 蓝莓益生菌能有效改善NAFLD的病理组织结构,减轻肝细胞脂肪变性,其机制可能是蓝莓益生菌可增加肝脏IL-22的表达,激活下游的JAK1/STAT3信号通路,下调SREBP-1c的基因表达,抑制SREBP-1c的作用,增强胆固醇代谢,减少脂质沉积,是NAFLD的一个辅助治疗方案。
蓝莓;益生菌;白细胞介素-22;酪氨酸蛋白激酶-1;信号转导激活转录因子-3;非酒精性脂肪肝
非酒精性脂肪性肝病(non-alcholic fatty liver disease,NAFLD)已成为全世界最常见的肝脏疾病之一[1],且其发展呈上升趋势。白细胞介素(IL)-22是抗炎因子IL-10家族成员中的一员,与IL-10在结构上存在明确的相关性,是重要的护肝因子,在多种肝脏疾病中呈现保护作用[2]。酪氨酸蛋白激酶-1(JAK1)/信号转导激活转录因子-3(STAT3)信号通路是近年来发现的一条由细胞因子刺激的信号转导通路,参与细胞的增殖、分化、凋亡及免疫调节等许多重要的生物学过程。Bin等[3]发现JAK1/STAT3信号通路受IL-22调控,对酒精性脂肪肝病有潜在的保护作用。目前,临床尚缺乏治疗NAFLD的特效药物[4],益生菌作为肠道微生态调节剂能有效减轻内毒素血症,改善肠道屏障功能,在NAFLD的治疗中能起到一定的作用[5]。中医认为“上工治未病”,因此通过饮食调节是治疗NAFLD的重要手段。蓝莓营养成分丰富,富含花青素及多种多酚类物质,具有很好的抗氧化及抗炎作用,可增强机体免疫力。研究显示,蓝莓具有良好的护肝作用,可逆转肝纤维化[6],并且联合益生菌后能有效减轻肝脏炎症,改善肝细胞脂肪变性[7]。基于上述研究基础,本实验拟将蓝莓与益生菌联合运用,通过对IL-22调控的JAK1/STAT3信号通路的影响达到改善NAFLD的目的,从而探讨二者辅助治疗NAFLD的机制。
1 材料与方法
1.1 材料
1.1.1 实验动物与试剂 SD大鼠40只,雄性,清洁级,体质量(220±30)g,购自贵州医科大学动物实验中心,合格证号:SCXK-(黔)2012-0001,用于建立NAFLD动物模型[8]。实验动物NAFLD造模诱导饲料(江苏美迪森生物有限公司,批号:MD12051);选用贵州麻江兔眼园兰蓝莓,-20 ℃冻存,临用时解冻提取原浆,其成分包括花青素、微量元素、类黄酮、维生素等[9];益生菌干片(婴儿双歧杆菌、动物双歧杆菌、乳杆菌:中国微生物菌种保藏管理委员会普通微生物中心);IL-22酶联免疫吸附试验(ELISA)试剂盒(catalog number:M2200,Quantikine);Maxima SYBR Green/ROX qPCR预混液(美国Thermo Scientific,批号:00330632);β-actin、JAK1引物、STAT3引物、固醇调节元件结合蛋白-1c(SREBP-1c)引物(上海生工生物工程技术服务有限公司,批号:10441535);anti-IL22(英国Abcam,批号:ab98917);anti-JAK1(英国Abcam,批号:ab125051,Abcam);anti-STAT3(英国Abcam,批号:ab119352);anti-SREBP-1c (英国Abcam,批号:ab3259)。
1.1.2 主要实验仪器 ViiA7实时荧光定量PCR(Real-time PCR,Applied Biosystems,美国);NANO-drop 2000超微量分光光度计(Thermal scientific,美国);EPS-601电泳仪(Amersham,美国);SynergyH4多功能酶标仪(biotek,美国);显微镜图像采集系统Olympus BX41(Olympus,美国)。
1.2 方法
1.2.1 动物模型制备及分组 将40只SD大鼠分成5组:正常对照组(NG) 8只,观察组(MG)8只,蓝莓组(BG)8只,益生菌组(PG)8只和蓝莓+益生菌组(BPG) 8只。NG正常饮食,自由饮水;其余大鼠均用复合型高脂饲料(88.3%普通饲料+10.0%猪油+1.5%胆固醇+0.2%胆酸钠)喂养12周。造模结束后取部分MG大鼠,股动脉放血处死(处死前称体质量),留取血液及全部肝脏:每只大鼠取相同部位肝脏用10%中性甲醛固定,病理切片,苏木素-伊红(HE)染色及油红染色,剩余肝脏组织-80 ℃低温冰箱保存。确认造模成功后,将MG剩余大鼠分为BG(蓝莓原浆:每日1.5 mL/100 g灌胃,前期实验摸索出的最佳浓度及剂量)、PG(将益生菌干片磨至粉末状,加适量蒸馏水溶解,益生菌水平:1×108CFU/mL;益生菌溶液1.5 mL/d灌胃,前期实验摸索出的最佳剂量)、BPG(将益生菌干片磨至粉末状后加入蓝莓原浆中混匀,参照文献[10]混合液1.5 mL/100 g体质量灌胃,每日1次,益生菌水平:1×108CFU/mL),同时上述分组后给予正常饮食,观察8周,实验结束,禁食12 h后称大鼠体质量,股动脉放血,留取全部肝脏组织:称肝脏湿质量,每只大鼠取肝右叶置于10%中性甲醛固定后,石蜡包埋,用于制作组织切片。
1.2.2 肝脏指数 计算方法为:肝脏指数=(肝脏质量/体质量)×100%。
1.2.3 血清学检测 血清丙氨酸氨基转移酶(ALT)、门冬氨酸氨基转移酶(AST)、三酰甘油(TG)、总胆固醇(TC)、低密度脂蛋白(LDL)及高密度脂蛋白(HDL)。
1.2.4 肝组织病理检测 动物处死后,立即解剖,取相同部位1.0 cm×1.0 cm×0.5 cm大小的肝右叶置于10%中性甲醛缓冲液中固定1 周,常规石蜡包埋切片行HE 染色及油红染色。HE切片光镜下评估肝脏脂肪变性和炎症活动情况。病理诊断和疗效评估参照美国国立卫生研究院NASH临床研究网病理委员会所订指南[11],常规进行NAFLD活动度积分(NAFLD activity score,NAS)。
1.2.5 ELISA检测肝组织中IL-22水平 肝脏组织匀浆后,4 000 r/min 15 min、4 ℃离心取上清液备用。标准品按照说明书分别稀释成500.0、250.0、125.0、62.5、31.5、15.6 pg/mL的标准溶液;在酶标包被板上设置空白孔、标准品孔及待测样品孔后上样;封板膜封板后37 ℃温育30 min;用洗涤液反复洗板5次后加入酶标试剂,37 ℃温育30 min,洗涤液再次洗板5次;分别加入显色剂和终止液后上机检测吸光度(A,450 nm波长);根据标准品浓度和A值,采用CurveExpert 1.3软件绘制标准曲线(R=0.999 83),并根据曲线方程式计算出各组肝组织中IL-22水平。
1.2.6 定量反转录酶-聚合酶链式反应(qRT-PCR)测定JAK1、STAT3及SREBP-1c mRNA表达 称取50~100 mg肝组织用TRIzol 提取总RNA。琼脂糖凝胶电泳判断RNA完整性。超微量分光光度计检测总RNA纯度和浓度,测定值A260/A280>1.8,证明所提取的RNA纯度好。RNA逆转录合成cDNA按试剂盒说明书操作。所用引物按参考文献设计并在GenBank 进行核对。β-actin引物:正义链5′-CTG AAC CCT AAG GCC AAC CG-3′;反义链5′-GAC CAG AGG CAT ACA GGG ACA A-3′。JAK1引物:正义链5′-GGA GGA GCA GAA TCC AGA CAT-3′;反义链5′-TCA ACC TTC CCA AAG TGA CC-3′。STAT3引物:正义链5′-CTG AGT GAG CGT GGG TGA T-3′;反义链5′-ACA GGC GGA CAG AAC ATA GG-3′。SREBP-1c引物:正义链5′-CGC TAC CGT TCC TCT ATC AAT G-3′;反义链5′-CGT TTC TAC CAC TTC AGG TTT CA-3′。qRT-PCR 反应体系(20 μL):SYBR Green 10 μL,双蒸水(ddH2O)6 μL,Primer mix 2 μL,模板cDNA 2 μL。反应条件:第1阶段,50 ℃ 2 min;第2阶段,95 ℃ 10 min;第3 阶段,95 ℃ 15 s,60 ℃ 1 min,40个循环。结果判定:通过β-actin作为内参照,比较目的基因与内参基因的Ct值差异,从而对上述基因在各组中的表达进行相对定量。
1.2.7 Western blot测定IL-22、JAK1、STAT3和SREBP-1c蛋白表达 抗原蛋白提取后进行蛋白水平测定,取蛋白质样品30 μg,计算蛋白上样量,8%十二烷基硫酸钠-聚丙烯酰胺凝胶(SDS-PAGE)电泳,转膜(55 V,100 mA,90 min),封闭(5 g脱脂奶粉+TBST 100 mL),用IL-22抗体(1∶1 000)、JAK1抗体(1∶1 000)、STAT3抗体(1∶5 000)、SREBP-1c抗体(1∶1 000)4 ℃孵育过夜,二抗(1∶20 000)避光孵育2 h,电化学发光(ECL)曝光显影,Gel Doc EQ凝胶成像仪扫描,ImageJ软件分析结果。
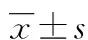
2 结 果
2.1 肝指数检测结果MG的肝指数较NG明显增加(P<0.01),经干预后BG、PG、BPG的肝指数较MG降低,且BPG的各指标变化更为显著(P<0.01),见表1。
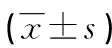
表1 各组大鼠肝脏指数比较
a:P<0.01,与NG比较;b:P<0.01,与MG比较;c:P<0.01,与BPG组比较。
2.2 血清酶学指标MG的ALT、AST较NG明显增加(P<0.01);BG、PG、BPG的转氨酶较MG降低,且BPG的各指标变化更为显著(P<0.01),见表2。
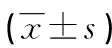
表2 各组大鼠血清酶学ALT、AST比较
a:P<0.01,与NG比较;b:P<0.01,与MG比较;c:P<0.01,与BPG组比较。
2.3 血清血脂指标MG的TG、TC及LDL较NG明显增加,HDL明显降低(P<0.01);而BG、PG、BPG的TG、TC及LDL较MG降低,HDL升高,且BPG的各指标变化更为显著(P<0.01),见表3。
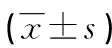
表3 各组大鼠TG、TC、LDL、HDL比较
a:P<0.01,与NG比较;b:P<0.01,与MG比较;c:P<0.01,与BPG组比较。
2.4 大鼠肝脏组织形态学改变 光镜下肝组织病理变化:HE染色提示NG大鼠肝小叶结构完整、清晰;中央静脉大而壁薄,肝细胞索布于其周,呈放射状,排列整齐,肝窦清晰可见,大小较一致,核结构清晰可见,无脂肪变性;MG可见肝细胞肿胀程度明显加重,呈中大泡性,微泡性脂肪变,肝细胞内有粉红色脂滴,伴气球样变,可见中性粒细胞和淋巴细胞浸润;PG和BG肝细胞脂肪变性较MG明显改善,但两组间无明显差别;BPG与BG、PG相比,肝细胞脂肪变明显减少,炎性细胞浸润明显减少,肝索结构基本恢复。油红染色:MG可见细胞质广泛染色,细胞内可见明显的红色脂滴大量累积,部分脂滴融合变大,细胞边缘模糊;PG和BG细胞质红染程度较MG减轻,但两组间无明显差别;BPG与BG、PG相比,细胞质内红色脂滴明显减少,见图1、2。
2.5NASH评价体系 根据美国国立卫生研究院NASH临床研究网病理委员会所订指南对各组进行NAS积分:MG的积分较NG明显升高(P<0.01);BG、PG和BPG的积分较MG明显下降,且BPG积分下降更为显著(P<0.01),见表4。
2.6 在光学显微镜下选取10个视野检测统计脂肪细胞数量及面积MG的细胞脂肪变性面积较NG增大(P<0.01),通过干预后,BG、PG、BPG的脂肪变性面积较MG明显缩小,且BPG更为明显(P<0.01),见表4。
2.7ELISA检测肝组织中IL-22水平MG的IL-22蛋白水平较NG明显降低(P<0.01);经蓝莓、益生菌干预后BG、PG、BPG的IL-22水平较MG升高,且BPG变化更为显著(P<0.01),见表4。
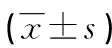
表4 各组大鼠NAS评分、脂肪细胞大小及IL-22水平比较
a:P<0.01,与NG比较;b:P<0.01,与MG比较;c:P<0.01,与BPG组比较。
2.8JAK1、STAT3及SREBP-1cmRNA表达 与NG相比,MG的JAK1、STAT3的mRNA表达明显降低,SREBP-1cmRNA明显升高;经干预后,与MG比较,BG、PG、BPG的JAK1、STAT3的mRNA升高,SREBP-1cmRNA降低,且BPG的各指标变化更为显著,见图3。
2.9Westernblot检测蛋白表达MG的IL-22、JAK1、STAT3蛋白表达较NG明显降低,SREBP-1c的表达水平较NG升高(P<0.01);BG、PG和BPG的IL-22、JAK1、STAT3表达较MG明显升高,SREBP-1c的表达水平较MG降低,且BPG的改变更为明显(P<0.01),见表5。
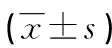
表5 各组大鼠肝组织中IL-22、JAK1、STAT3和SREBP-1c蛋白质相对表达量
a:P<0.01,与NG比较;b:P<0.01,与MG比较;c:P<0.01,与BPG组比较。

A:NG;B:MG;C:BG;D:PG;E:BPG。
图1 各组大鼠肝脏组织HE染色(×200)

A:NG;B:MG;C:BG;D:PG;E:BPG。
图2 各组大鼠肝脏组织油红染色(×200)

*:P<0.01,与NG比较;#:P<0.01,与MG比较;△:P<0.01,与BPG组比较。
图3 各组大鼠mRNA表达结果
3 讨 论
NAFLD被视为全球最常见的慢性肝病之一,并已成为危害公共健康的问题。随着疾病进展可发展至肝硬化、肝癌。近年来免疫炎症对NAFLD的影响逐渐受到重视,肝内多种具有免疫功能的细胞受到细菌、病毒、药物或其他一些代谢产物[如脂多糖(LPS)]刺激后,可通过LPS/Toll样受体4(TLR4)信号通路下游的衔接分子MyD88诱导促炎因子[如IL-21、趋化因子-10(CXCL-10)]和抗炎因子(如IL-10)的产生。促炎因子激活相关信号通路上调SREBP-1c等具有脂肪合成功能的基因表达,导致肝细胞内的TG和胆固醇聚集,而发生NAFLD。IL-22可由多种细胞分泌[如自然杀伤细胞(NK细胞)、辅助性T细胞淋巴细胞(Th)17、Th22等],在控制细菌感染、稳定内环境和组织修复中起到重要作用[12]。有学者发现,IL-22在多种肝脏疾病中起到保护作用,是重要的护肝因子,主要通过其受体IL-22发挥生物作用[13]。JAK1/STAT3信号通路参与细胞的增殖、分化、凋亡及免疫调节的功能已有较多发现,主要由3个成分组成,即酪氨酸激酶相关受体、酪氨酸激酶JAK和转录因子STAT。JAK即JanusKinase,是一种非受体的酪氨酸蛋白激酶,成员有7个同源区,其中JAK1区为激酶区,其下游的效应分子STAT3在整个信号通路中起到承上启下的作用。当JAK1激酶活化,可催化结合在受体上的STAT蛋白发生磷酸化修饰,并以二聚体形式进入细胞核内与靶基因结合,调控基因转录。同时,细胞因子对激活STAT具有一定的选择性,Yang等[14]的研究显示,IL-22可通过激活STAT3通路下调TG合成的相关基因改善因肥胖所致的脂肪肝;Xiao等[15]通过IL-22治疗乙醇诱导的肝损伤的研究发现,IL-22可通过其受体IL-22激活JAK1/STAT3信号通路,下调脂肪酸转运蛋白(FATP)的表达而达到治疗目的,从而改善肝细胞脂肪变性[15]。综上,IL-22对多种肝脏疾病有保护作用,本研究推测,由IL-22调控的JAK1/STAT3信号通路也参与了拮抗NAFLD。
通过饮食调节,从NAFLD的早期阶段介入预防,早期控制,避免其进展为终末期肝病具有重大意义。益生菌作为肠道微生态调节剂可用于NALFD的治疗,以改善肠道微生态环境,减轻内毒素血症,从而减轻肝细胞炎症,达到治疗NAFLD的目的[16]。蓝莓素有“浆果之王”的美称,不仅是一种果品,更是一种具有保健功能的食品。相关研究发现,蓝莓富含花青素、类黄酮及多酚类等物质,具有抗氧化、抗炎、抗肿瘤、调节免疫、降血脂等功效[17],且蓝莓中的花青素能激活免疫系统,使免疫球蛋白不受自由基的侵害,激活巨噬细胞,增强人体的免疫力。本团队在前期研究中发现:蓝莓对急性酒精性脂肪肝有保护作用[18],其机制可能是蓝莓能有效抑制肿瘤坏死因子α(TNF-α),下调SREBP-1c的表达,合理改善脂代谢,减少脂质沉积于肝脏。相关的报道也显示:蓝莓对益生菌的生长有促进作用[19];同时,益生菌能增强蓝莓的生物活性,二者有协调作用[20]。
基于上述研究,本实验将蓝莓与益生菌联合运用,观察二者的协同效应对IL-22调控的JAK1/STAT3信号通路的影响,从而探明蓝莓益生菌改善NAFLD的作用机制。研究发现:HE染色可见BPG的肝细胞脂肪变性程度较MG明显降低,油红染色可见细胞质内红色脂滴较MG明显减少,脂肪细胞面积测定值下降明显(P<0.01);肝脏指数、ALT、AST、TG、TC、LDL均较MG、BG、PG明显降低,HDL明显升高(P<0.01),但BG与PG差异无统计学意义(P>0.05);通过参照美国国立卫生研究院制订的NAFLD活动度积分表得出BPG的NAS评分较其余各组明显下降,说明蓝莓益生菌具有显著的拮抗肝细胞脂肪变性、改善脂质代谢、减轻肝细胞炎症的作用。通过对IL-22、JAK1、STAT3及SREBP-1c进行检测发现:BPG的IL-22、JAK1、STAT3的表达均明显高于MG、BG和PG(P<0.01),但单独使用蓝莓或益生菌的差异无统计学意义(P>0.05)。不难看出,JAK1、STAT3的变化与IL-22一致,呈正相关。SREBP-1c是影响肝脏脂质合成的重要转录调控因子,其活性调节与脂肪肝的发病相关,Radaeva等[21]发现,IL-22激活STAT3信号通路可上调抗凋亡基因、抗氧化应激基因的表达,下调脂肪生成基因表达(如SREBP-1c),以达到改善脂肪肝的目的。而本研究也发现,MG的SREBP-1c较NG明显升高,经蓝莓和益生菌干预以后,SREBP-1c的表达逐渐降低,BPG降低更为明显(P<0.01),说明蓝莓与益生菌联合改善脂代谢的作用较单独运用蓝莓或益生菌强,并且SREBP-1c表达随着IL-22、JAK1、STAT3的增加而减少,呈现负相关。
综上所述,实验证实了本研究推测是合理的,其改善NAFLD的作用机制可能是蓝莓与益生菌联合,增强了彼此的生物学活性,抑制炎性因子对肝细胞的损伤,同时增加肝脏IL-22的表达,IL-22选择性的激活JAK1/STAT3信号通路,下调SREBP-1c表达,减少TG及胆固醇沉积于肝脏,改善肝细胞炎症及脂肪变性。但二者对NAFLD更深层次的作用机制还有待进一步研究。
[1]LoombaR,SanyalAJ.TheglobalNAFLDepidemic[J].NatRevGastroenterolHepatol,2013,10(11):686-690.
[2]ChestovichPJ,UchidaY,ChangW,etal.Interleukin-22:implicationsforliverischemia-reperfusioninjury[J].Transplantation,2012,93(5):485-492.
[3]BinG,SungHK,OygiP,etal.Interleukin-22treatmentamelioratesalcoholicliverinjuryinamurinemodelofchronic-bingeethanolfeeding:roleofSTAT3[J].Hepatology,2010,52(4):1291-1300.
[4]ChalasaniN,YounossiZ,LavineJE,etal.Diagnosisandmanagementofnon-alcoholicfattyliverdisease:practiceGuidelinebytheAmericanAssociationfortheStudyofLiverDiseases,AmericanCollegeofGastroenterology,andtheAmericanGastroenterologicalAssociation[J].Hepatology,2012,55(6):2005-2023.
[5]EslamparastT,PoustchiH,ZamaniF,etal.Synbioticsupplementationinnonalcoholicfattyliverdisease:arandomized,double-blind,placebo-controlledpilotstudy[J].AmJClinNutr,2014,99(3):535-542.
[6]WangY,ChengM,ZhangB,etal.Dietarysupplementationofblueberryjuiceenhanceshepaticexpressionofmetallothioneinandattenuatesliverfibrosisinrats[J].PLoSOne,2013,8(3)e58659.
[7]RenT,HuangC,ChengM.DietaryblueberryandbifidobacteriaattenuatenonalcoholicfattyliverdiseaseinratsbyaffectingSIRT1-mediatedsignalingpathway[J].OxidMedCellLongev,2014:465059.
[8]CanoA,CiaffoniF,SafwatGM,etal.HepaticVLDLassemblyisdisturbedinaratmodelofnonalcoholicfattyliverdisease:istherearolefordietarycoenzymeQ[J].JApplPhysiol,2009,107(3):707-717.
[9]文光琴,聂飞,方品武.蓝莓果实理化成分含量比较分析与功能评价[J].北方园艺,2012,36(13):27-30.
[10]OsmanN,AdawiD,AhrnéS,etal.Endotoxin-andD-galactosamine-inducedliverinjuryimprovedbytheadministrationoflactobacillus,bifidobacteriumandblueberry[J].DigLiverDis,2007,39(9):849-856.
[11]ZengMD,FanJG,LuLG,etal.Guidelinesforthediagnosisandtreatmentofnonalcoholicfattyliverdiseases[J].JDigDis,2008,9(3):108-112.
[12]ChunXP,JieT,XiaoYW,etal.Roleofinterleukin-22inliverdiseases[J].InflammRes,2014,63(7):519-525.
[13]ChestovichPJ,UchidaY,ChangW,etal.Interleukin-22:implicationsforliverischemia-reperfusioninjury[J].Transplantation,2012,93(5):485-492.
[14]YangL,ZhangY,WangL,etal.Ameliorationofhighfatdietinducedliverlipogenesisandhepaticsteatosisbyinterleukin-22[J].JHepatol,2010,53(2):339-347.
[15]XiaoNK,DeCF,StephanieM,etal.Hepatoprotectiveandanti-fibroticfunctionsofinterleukin-22:therapeuticpotentialforthetreatmentofalcoholicliverdisease[J].JGastroenterolHepatol,2013,28(1):56-60.
[16]EslamparastT,PoustchiH,ZamaniF,etal.Synbioticsupplementationinnonalcoholicfattyliverdisease:arandomized,double-blind,placebo-controlledpilotstudy[J].AmJClinNutr,2014,99(3):535-542.
[17]FernandesI,MarquesF,FreitasVD,etal.Antioxidantandanti-proliferativepropertiesofmethylatedmetabolitesofanthocyanins[J].FoodChemistry,2013,141(3):2923-2933.
[18]赵雪珂,吴荣敏,姚玉梅,等.蓝莓对小鼠急性酒精性脂肪肝TNF-α-R1和SREBP-1c影响的初步研究[J].重庆医科大学学报,2015,20(3):43-46.
[19]刘奕炜,周方,郝建新,等.蓝莓汁及其提取物对嗜酸乳杆菌NCFM体外生长的影响[J].中国乳品工业,2013,41(2):13-16.
[20]BranningC,HakanssonA,AhrneS,etal.Blueberryhusksandmulti-strainprobioticsaffectclolnicfermentationinrats[J].BrJNutr,2009,101(6):859-870.
[21]RadaevaS,SunR,PanHN,etal.Interleukin22 (IL-22)playsaprotectiveroleinTcell-mediatedmurinehepatitis:IL-22isasurvivalfactorforhepatocytesviaSTAT3activation[J].Hepatology,2004,39(6):1332-1342.
Study on effect of blueberry probiotics for improving non-alcoholic fatty liver disease by influencing IL-22/JAK1/STAT3 signaling pathway*
ZhuJuanjuan,ChengMingliang△,RenTingting,ZhouMingyu
(DepartmentofInfection,AffiliatedHospitalofGuizhouMedicalUniversity,Guiyang,Guizhou550001,China)
Objective To study the effect of blueberry probiotics on interlukin-22(IL-22) mediated Janus kinase-1(JAK1)/ signal transducer and activator of transcription 3(STAT3) signaling pathway,and to further explore the potential mechanisms to improve non-alcoholic fatty liver disease(NAFLD).Methods Forty clean grade rats were divided into the normal control group(NG),model group(MG),blueberry group(BG),probiotics group(PG) and blueberry plus probiotics group(BPG).Except for the NG group(100% general diet),the fat liver model in the other groups was prepared by 12-week complex high fat diet.After the model establishment,the remained rats were divided into BG,PG and BPG groups for conducting 8-week observation.Results The liver index,alanine aminotransferase(ALT),aspartate aminotransferase(AST),triglyceride(TG),total cholesterol(TC) and low density lipoprotein(LDL) in the BPG group were significantly decreased compared with the MG,BG and PG groups(P<0.01)and high density lipoprotein (HDL)was significantly increased(P<0.01);in IL-22 detected by the enzyme-linked immunosorbent assay(ELISA):the protein level in the BPG group was significantly higher than that in the MG,BG and PG groups(P<0.01);in the quantificational reverse transcription-polymerase chain reaction(qRT-PCR):the expressions of JAK1 and STAT3 in the BPG group were significantly increased compared with the MG,BG and PG groups(P<0.01),while cholesterol regulatory element-binding protein-1c(SREBP-1c) expression in the BPG group was significantly decreased(P<0.01);in Western blot(WB):the expressions of IL-22,JAK1 and STAT3 in the BPG group were significantly higher than those in the MG,BG and PG groups,while the expression of SREBP-1c was significantly declined(P<0.01).Conclusion Blueberry probiotics could effectively ameliorate the pathological tissue structure of NAFLD,attenuates hepatocyte steatosis,its mechanism may be that blueberry probiotics could increase expression of IL-22,activates the downstream signaling pathway of JAK1/STAT3,down-regulates the SREBP-1c gene expression and inhibits SREBP-1c role,enhances cholesterol metabolism,attenuates lipid deposit in liver,which may be an adjuvant scheme to treat NAFLD.
blueberry;probiotics;interleukin-22;JAK1;STAT3;non-alcoholic fatty liver
��·基础研究
10.3969/j.issn.1671-8348.2017.02.004
贵州省科技厅社会攻关资助项目(黔科合SY[2010]3017号);黔东南苗族侗族自治州林业局科研基金资助项目(ZLYJZFCG-2012-7);贵州省卫计委科技项目(gzwjkj2016-1-02)。
祝娟娟(1983-),主治医师,硕士,主要从事肝脏代谢性疾病方面研究。△
E-mail:chengml@21cn.com。
R
A
1671-8348(2017)02-0156-05
2016-07-12
2016-09-12)
