WTX基因对结肠癌细胞增殖和凋亡的作用*
2017-02-10曹梦园
曹梦园,白 洋,许 颖
(1.吉林省医学期刊社,长春 130021;2.吉林大学第一医院超声科,长春 130021;3.吉林大学第一医院肾内科,长春 130021)
WTX基因对结肠癌细胞增殖和凋亡的作用*
曹梦园1,白 洋2,许 颖3△
(1.吉林省医学期刊社,长春 130021;2.吉林大学第一医院超声科,长春 130021;3.吉林大学第一医院肾内科,长春 130021)
目的 WTX基因转染结肠癌Lovo细胞株,分析WTX基因对结肠癌细胞增殖和凋亡的影响。方法 将结肠癌Lovo细胞株分为WTX基因转染组和对照组,WTX基因转染组给予WTX质粒转染,对照组给予空载质粒转染。观察WTX基因转染组和对照组WTX基因的表达情况,两组Lovo细胞株结肠癌细胞的增殖情况、凋亡情况及细胞周期变化。结果 WTX基因转染组结肠癌细胞WTX蛋白表达明显高于对照组(P<0.05);WTX基因转染组结肠癌转染后4、7 d光密度值均明显低于对照组(P<0.05);WTX基因转染组G1期细胞比例明显高于对照组(P<0.05),WTX基因转染组G2期和S期细胞比例明显低于对照组(P<0.05)。结论 WTX基因抑制结肠癌细胞的增殖,影响结肠癌细胞周期,对结肠癌细胞凋亡没有影响。
结肠肿瘤;基因;流式细胞术;细胞凋亡;WTX基因;结肠癌Lovo细胞株;细胞增殖
结肠癌的发生是一个多阶段、多步骤的比较复杂的过程,近年来其发病率和病死率有上升趋势[1],目前结肠癌的治疗效果欠佳,预后比较差,主要的治疗方法是手术切除、放化疗和生物治疗等的综合治疗[2]。结肠癌发生的分子机制主要有DNA损伤修复基因的功能异常,抑癌基因的缺失突变,癌基因激活,凋亡机制异常等,多种癌基因的激活和过度表达及多种抑癌基因的缺失和突变在结肠癌的发展过程中发挥重要作用[3]。WTX基因和肿瘤的发生、发展,以及肿瘤的增殖凋亡有一定关系,对肿瘤有抑制作用[4]。Wnt通路和结肠癌的发生、发展关系密切,WTX是Wnt通路的负向调节因子[5-6]。因此,WTX基因可能和结肠癌的发病有一定关系。本研究通过WTX基因转染结肠癌Lovo细胞株,探讨WTX基因对结肠癌细胞增殖和凋亡的影响。
1 材料与方法
1.1 材料
1.1.1 结肠癌细胞株 Lovo结肠癌细胞株购自昆明动物所细胞库。
1.1.2 主要试剂和仪器 质粒(美国Fermentas公司),质粒小提试剂盒(美国Fermentas公司),DMEM培养基(美国Fermentas公司),胎牛血清(四季青生物工程材料有限公司),胰酶(美国Fermentas公司),磷酸盐缓冲液(PBS,美国Fermentas公司)等;电泳仪(美国BD公司),流式细胞仪(美国BD公司),培养箱(美国BD公司)等。
1.2 方法
1.2.1 实验方法 (1)分组:分为WTX基因转染组和对照组,WTX基因转染组给予WTX质粒转染,对照组给予空载质粒转染。(2)质粒提取:将PLV.E3d.null-EF1A>IRES/eGFP空载质粒和PLV.E3d.null-EF1A>WTX>IRES/eGFP WTX质粒在培养皿中划线,过夜培养,挑选单克隆菌落移入离心管中,摇床摇菌,用EndoFree Plasmid Maxi Kit试剂盒提取质粒。(3)细胞转染:将转染前传代培养生长良好的结肠癌细胞株Lovo加入培养液重悬细胞,然后加入12孔板孔中(每孔含细胞3×105),细胞培养6 h,质粒DNA加入Attractene Transfction Reagent形成转染复合物,将转染复合物加入细胞中转染细胞2~3 d。(4)观察转染结果:空载质粒浓度2 100 μg/mL,WTX质粒浓度1 250 μg/mL,符合转染要求,空载质粒72 h后转染率68%,WTX质粒72 h后转染率37%。
1.2.2 观察指标 两组WTX基因的表达情况,两组Lovo细胞株结肠癌细胞的增殖情况、凋亡情况及细胞周期变化。(1)WTX蛋白表达的测定:采用Western blot法检测两组WTX蛋白的表达情况。(2)增殖情况:将转染细胞加入CCK-8溶液,孵育4 h染色,在酶标仪上测定第1、4、7天450 nm波长的光密度(optical density,OD)值。(3)凋亡情况测定:采用流式细胞仪测定转染后1、4、7 d 两组细胞的早期凋亡、晚期凋亡和总凋亡情况。(4)生长周期测定:采用流式细胞仪测定细胞生长周期情况,检测结果用细胞周期拟合软件进行分析。
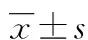
2 结 果
2.1 两组WTX基因的表达情况Westernblot结果显示:WTX基因转染组结肠癌细胞WTX蛋白表达明显高于对照组(P<0.05),过表达WTX基因结肠癌细胞株成功建立,见图1、表1。
2.2 两组结肠癌细胞的增殖情况CCK8染色检测结果:WTX基因转染组结肠癌转染后4、7dOD值均明显低于对照组(P<0.05),WTX基因转染组结肠癌转染后1dOD值和对照组比较差异无统计学意义(P>0.05),见表2。
2.3 两组结肠癌细胞的凋亡情况 流式细胞仪法检测结果:WTX基因转染组转染后1、4、7d结肠癌细胞的早期凋亡率、晚期凋亡率与总凋亡率和对照组比较差异均无统计学意义(P>0.05),见表3。

图1 两组WTX蛋白电泳图
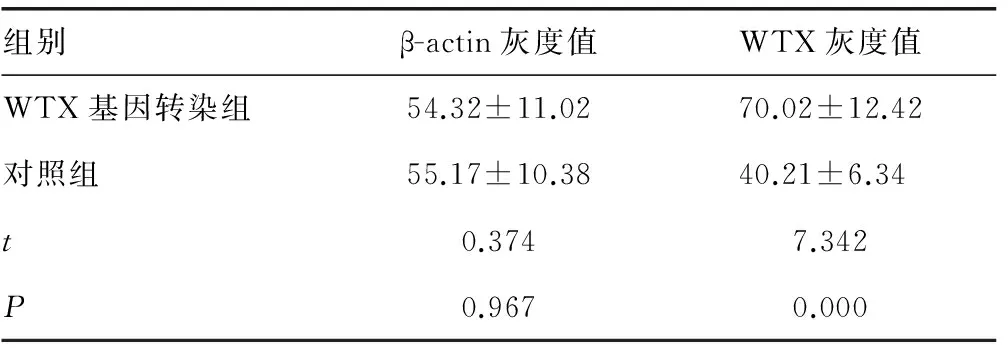
组别β-actin灰度值WTX灰度值WTX基因转染组54.32±11.0270.02±12.42对照组55.17±10.3840.21±6.34t0.3747.342P0.9670.000
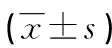
表2 两组结肠癌细胞的OD值
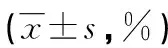
表3 转染后1、4、7 d 两组结肠癌细胞的凋亡情况
2.4 两组结肠癌细胞周期比较 流式细胞仪检测结果发现:WTX基因转染组G1期细胞比例明显高于对照组(P<0.05),WTX基因转染组G2期和S期细胞比例明显低于对照组(P<0.05),见表4、图2。
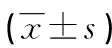
表4 两组结肠癌细胞周期比较
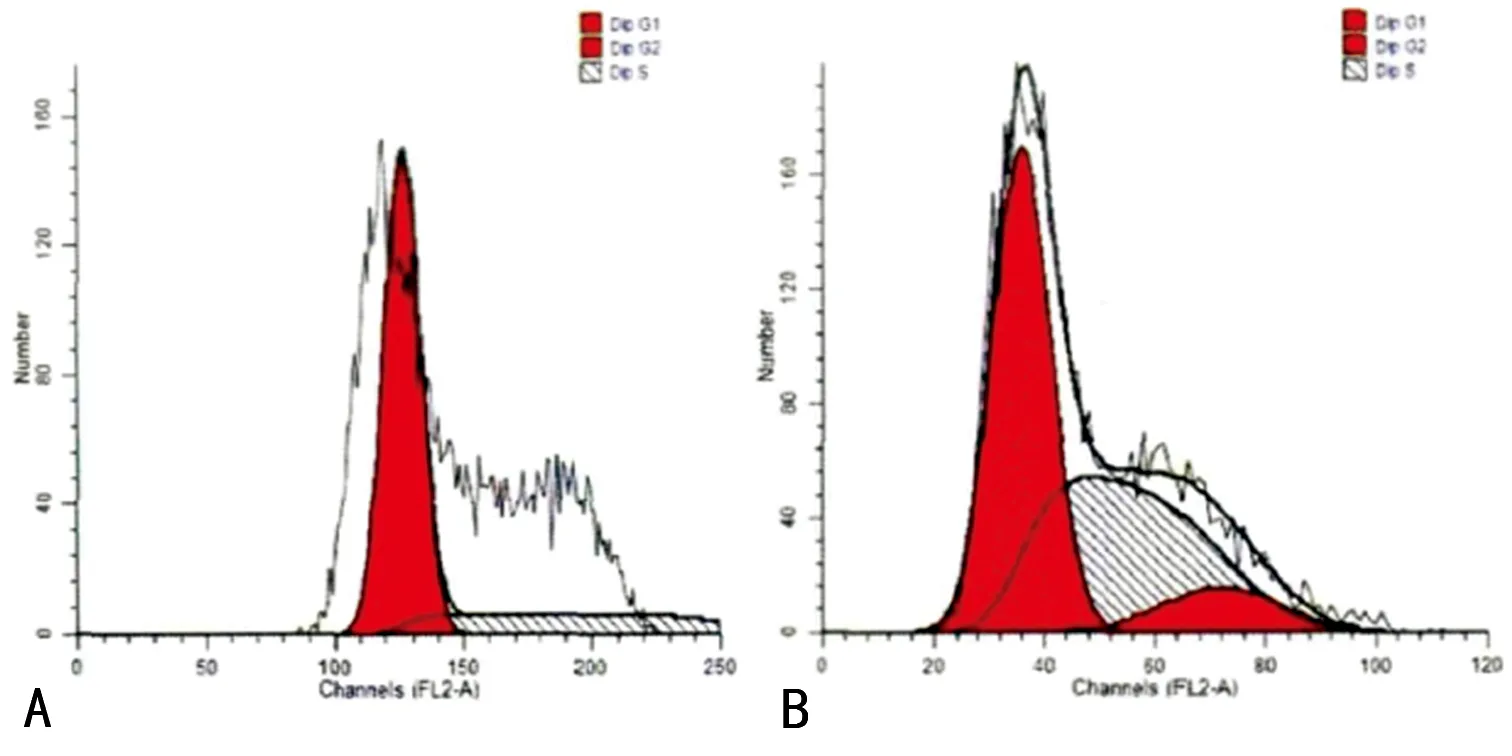
A:WTX基因转染组;B:对照组。
图2 两组细胞周期图
3 讨 论
WTX位于X染色体上,是一种对肿瘤具有抑制作用的基因,WTX基因蛋白存在于细胞质和细胞膜内。因WTX基因位置比较特殊,使其抑癌作用具有独特性。Wnt/β-catenin信号通路比较保守,能够调节细胞的分化增殖和凋亡,在细胞稳态、胚胎发育和多种疾病的发病过程中发挥重要作用[7]。β-catenin是Wnt信号通路的关键因子,是粘连素家族成员,位于细胞质、细胞膜和细胞核中,参与细胞之间的黏附,正向调节Wnt通路,β-catenin在细胞核内累积及在细胞质中降解失去平衡等会激活靶基因转录,引起肿瘤的发生[8]。WTX和β-catenin关系密切,能够与β-catenin形成复合物,形成的复合物对β-catenin蛋白降解和泛素化,对Wnt/β-catenin信号通路有负向调节作用[9-10]。WTX还可以抑制核因子E2相关因子2(NRF2)的泛素化,WTX缺失引起NRF2迅速降解和泛素化,降低其对细胞的毒性反应。WTX还影响P53的活性及其对癌症的抑制作用。因此WTX既可以影响P53的抑癌通路,又可以影响Wnt/β-catenin的致癌通路[11]。
在Willms瘤患者中存在有WTX基因突变,在胃癌、肝癌等其他恶性肿瘤中,很少发现WTX基因突变,考虑WTX和其他恶性肿瘤的关系可能与其表达缺失有关[12-13]。在结肠癌中,WTX基因突变对β-catenin降解复合物的功能有一定影响,同时与肿瘤的增殖凋亡和生长发育有关,对肿瘤有抑制作用。WTX缩短突变能够增加β-catenin的表达,Wnt/β-catenin信号通路在结肠癌的发生、发展过程中发挥重要作用,Wnt/β-catenin信号通路异常激活能够引起结肠癌的发生[14-15],WTX是Wnt/β-catenin信号通路的负向调节因子,在结肠癌的发生中可能也发挥重要作用。本研究通过WTX基因转染结肠癌Lovo细胞株,分析WTX基因对结肠癌细胞增殖和凋亡的影响。结果发现,WTX基因转染组结肠癌细胞与对照组细胞比较,WTX蛋白表达升高,细胞增殖OD值降低,G1期细胞比例升高,G2期和S期细胞比例降低。可见,WTX基因对结肠癌Lovo细胞的凋亡没有影响,WTX基因明显抑制结肠癌细胞的增殖,WTX基因对结肠癌细胞生长的影响可能是通过抑制结肠癌细胞的增殖实现的,WTX基因影响结肠癌细胞的生长周期,结肠癌细胞主要被WTX基因阻滞在G1期,很少有细胞进入S期 ,表明WTX基因通过将结肠癌细胞阻滞于DNA合成期,从而发挥其抑癌作用的。
[1]LiSK,MartinA.Mismatchrepairandcoloncancer:mechanismsandtherapiesexplored[J].TrendsMolMed,2016,22(4):274-289.
[2]BrownJC,TroxelAB,KyB,etal.ArandomizedphaseⅡdose-responseexercisetrialamongcoloncancersurvivors:purpose,studydesign,methods,andrecruitmentresults[J].ContempClinTrials,2016(47):366-375.
[3]MuoozdeEscalonaM,Sáez-FernándezE,PradosJC,etal.Magneticsolidlipidnanoparticlesinhyperthermiaagainstcoloncancer[J].IntJPharm,2016,504(1/2):11-19.
[4]LiuY,LiuS.BerberineinhibitsWilms′tumorcellprogressionthroughupregulationofWilms′tumorgeneontheXchromosome[J].MolMedRep,2013,8(5):1537-1541.
[5]LiuX,WangQ,NiuH,etal.PromotermethylationofWilms′tumorgeneontheX-chromosomeingastriccancer[J].NanFangYiKeDaXueXueBao,2013,33(3):318-321.
[6]CampND,JamesRG,DawsonDW,etal.WilmstumorgeneonXchromosome(WTX)inhibitsdegradationofNRF2proteinthroughcompetitivebindingtoKEAP1protein[J].JBiolChem,2012,287(9):6539-6550.
[7]ParkJ,JeongS.Wntactivatedβ-cateninandYAPproteinsenhancetheexpressionofnon-codingRNAcomponentofRNaseMRPincoloncancercells[J].Oncotarget, 2015,6(33):34658-34668.
[8]QiL,SongW,LiuZ,etal.Wnt3apromotesthevasculogenicmimicryformationofcoloncancerviaWnt/β-Cateninsignaling[J].IntJMolSci,2015,16(8):18564-18579.
[9]KimMK,MinDJ,RabinM,etal.FunctionalcharacterizationofWilmstumor-suppressorWTXandtumor-associatedmutants[J].Oncogene,2011,30(7):832-842.
[10]ScheelSK,PorznerM,PfeifferS,etal.MutationsintheWTX-genearefoundinsomehigh-grademicrosatelliteinstable(MSI-H)colorectalcancers[J].BMCCancer,2010(10):413.
[11]QingLingZ,LiNaY,LiL,etal.LMP1antagonizesWNT/β-cateninsignallingthroughinhibitionofWTXandpromotesnasopharyngealdysplasiabutnottumourigenesisinLMP1(B95-8)transgenicmice[J].JPathol,2011,223(5):574-583.
[12]覃创,陈嘉勇,梁道明.WTX基因在肿瘤中的研究进展[J].重庆医学,2012,41(5):502-504.
[13]覃创.WTX基因在胃癌组织中转录水平的表达[D].昆明:昆明医科大学,2012.
[14]LeemSH,LiXJ,ParkMH,etal.Genome-widetranscriptomeanalysisrevealsinactivationofWnt/β-cateninby3,3′-diindolylmethaneinhibitingproliferationofcoloncancercells[J].IntJOncol,2015,47(3):918-926.
[15]YunSI,KimHH,YoonJH,etal.Ubiquitinspecificprotease4positivelyregulatestheWNT/β-cateninsignalingincolorectalcancer[J].MolOncol,2015,9(9):1834-1851.
Effect of WTX gene on colon cancer cell proliferation and apoptosis*
CaoMengyuan1,BaiYang2,XuYing3△
(1.MedicalJournalofJilinProvince,Changchun,Jilin130021,China;2.DepartmentofUltrasound,FirstHospital,JilinUniversity,Changchun,Jilin130021,China;3.DepartmentofNephrology,FirstHospital,JilinUniversity,Changchun,Jilin130021,China)
Objective To use WTX gene for transfecting into Lovo colon cancer cell line,and to analyze the impact of WTX gene on colon cancer cell proliferation and apoptosis.Methods Lovo colon cancer cell line was divided into the WTX gene transfection group and control group.The WTX gene transfection group was given WTX plasmid transfection,while the control group received empty vector transfection.The expression of WTX gene in the WTX gene transfection group and control group was observed.The proliferation,apoptosis and cell cycle change of Lovo colon cancer cells in two groups were also observed.Results The WTX protein expression in the WTX gene transfection group was significantly higher than that in the control group(P<0.05);the OD values on 4,7 d after transfection in the WTX gene transfection group were significantly lower than those in the control group (P<0.05);the G1phase cells proportion in the WTX gene transfection group was significantly higher than that in the control group(P<0.05),the G2and S phase cells proportion in the WTX gene transfection group was significantly lower than that in the control group (P<0.05).Conclusion WTX gene inhibits the proliferation of colon cancer cells,affects colon cancer cells cycle,has no effect on apoptosis of colon cancer cells.
colonic neoplasms;genes;flow cytometry;apoptosis;WTX gene;colon cancer Lovo cell line;cell proliferation
� 著·
10.3969/j.issn.1671-8348.2017.02.001
吉林省科技发展计划项目(2013052218JH)。
曹梦园(1979-),副编审,硕士,主要从事老年病学方面研究。△
R656.9
A
1671-8348(2017)02-0145-03
2016-07-19
2016-09-18)
