两种水分条件下夏玉米叶片气孔行为对光质的瞬时响应*
2017-02-10李沅媛龚道枝严为光唐大华梅旭荣张文英
李沅媛,龚道枝**,严为光,唐大华,梅旭荣,张文英
两种水分条件下夏玉米叶片气孔行为对光质的瞬时响应*
李沅媛1,龚道枝1**,严为光1,唐大华1,梅旭荣1,张文英2
(1.中国农业科学院农业环境与可持续发展研究所/作物高效用水与抗灾减损国家工程实验室/农业部旱作节水农业重点实验室,北京 100081;2.河北省农林科学院旱作农业研究所,衡水 053000)
在灌水和不灌水(整个生长期不灌溉)两种水分条件下,利用LI-6400便携式光合测定仪,测定3个主要生育期(拔节期、抽雄期和灌浆期选择典型日)夏玉米(郑单958)第一个功能叶片的气孔导度(Gs)、净光合速率(Pn)和蒸腾速率(Tr)指标,据此计算叶片的瞬时水分利用效率(WUE),测定时设定了5种比例的红蓝光组合(即B/(R+B)分别为0、25%、50%、75%和100%),以对比分析不同红蓝光比对玉米叶片气孔行为的瞬时影响。结果表明:与不灌水相比,灌水处理的叶片平均Gs、Pn和Tr在抽雄期明显较高,但在拔节期和灌浆期差异不显著。不论何种水分处理,光合有效辐射为500µmol·m-2·s-1时,叶片Gs、Pn和Tr均表现为单色红光照射时最大,随着蓝光所占比例的增加,各指标均有不同程度的降低。从节水角度来看,高红光比例的光质有利于提高玉米叶片WUE。
水分胁迫;红蓝光比;玉米;光合作用;叶片水分利用效率
气孔是植物与外界环境进行水汽和CO2交换的重要通道,其开闭程度直接决定光合和蒸腾作用的强度[1]。气孔运动极易受环境因素影响,而光质是一个重要的调控因子[2],光质或光谱组分是光的重要属性,它不仅作为一种能源控制光合作用,还作为一种触发信号影响植物生长。根据叶绿素的吸收光谱和植物光谱[3]可知,对植物光合作用主要影响的波段在400-520nm的蓝光区和610-720nm的红光区,即光合有效辐射区。
关于环境因素对气孔行为影响的研究报道较多[4],如光(光质、光照强度)、CO2、温度、湿度等均可影响作物光合、蒸腾作用。就光质单因素而言,普遍认为植物在红橙光下光合速率最高且明显大于蓝紫光下[5];蓝光比红光能够更有效地诱导气孔打开[6]。但也有报道增加红光的比例能明显提高玉米气孔开度,从而增加蒸腾速率和光合速率。Sun等[7]试验结果表明,相同光合有效辐射下照射1h,玉米叶片净光合速率和气孔导度Gs(stomatal conductance)均在蓝光下较白光、红光下低。可见,光质对作物的Gs、光合速率(net photosynthesis rate,Pn)和蒸腾速率(transpiration rate, Tr)影响非常复杂[8-9],即使在相同的光合有效辐射条件下,因光质比不同,对作物光合和蒸腾速率的影响也不相同。
玉米是华北地区主要粮食作物之一,干旱对其生产的影响一直受到关注。目前,干旱胁迫对作物影响研究已取得很大进展[10-11],通常认为干旱胁迫对作物光合作用产生抑制作用。但针对土壤水分变化条件下同时考虑红蓝光比例对C4作物光合和蒸腾动态的影响尚未见报道。因此,本研究以华北地区主栽作物夏玉米为试验材料,利用LI-6400便携式光合仪提供红蓝光源,测定玉米叶片气孔导度、光合和蒸腾速率对红蓝光比和水分变化的瞬时响应,以期对未来光环境改变以及半干旱-干旱地区水分亏缺等逆境胁迫下气孔行为的定量模拟与最优调控提供理论依据。
1 材料与方法
1.1 试验点概况
试验于2015年6-10月在河北省农林科学院旱作农业研究所衡水试验站(37.54°N、115.42°E)进行。该站地处河北平原中部,属典型大陆性季风气候区,光照充足,无霜期平均188d,年平均日照数2600.5h,年平均气温12.6 ℃,年平均降水量500mm,且季节和年际分布不均。供试区土壤质地为潮土(0-60cm),土壤容重1.48g·cm-3,田间持水量(体积含水量)42.9%。播种前各小区0-30cm土层性质见表1。
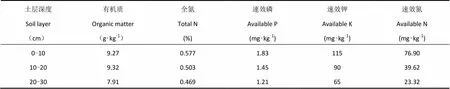
表1 试区土壤基本性质
1.2 试验处理
试验在大型自动防雨棚内进行,利用池栽方式以避免小区间土壤水分的相互渗透,小区面积6.6m2,池长3.3m,宽2m,深3m。池内土层厚度为280cm,底层为20cm粗砂层,池四周及底部通过混凝土防渗结构与周边土体隔离。地面安装高4m的移动式遮雨棚,降雨时自动遮挡,其余时间为自然光照。池内埋有PVC管,埋深3m,用时域反射仪Trime-TDR和EM50数据采集器分别测定20、40、60、80和100cm深处土壤含水量。用自来水表控制灌水量,灌水方式为漫灌。
供试玉米品种为郑单958,行距41.25cm,株距33.33cm,采用穴播方式,每穴播2~3粒。2015年6月17日播种,播种前统一灌一次底墒水,6月23日出苗,三叶期时每穴定苗1株,9月28日收获。试验共设2个处理,灌水(用W表示)和不灌水(整个生育期不灌溉,用D表示)。W在大喇叭口期(7月28日)、抽雄期(8月13日)、灌浆期(9月12日)灌溉,灌水定额分别为45.5mm、60.6mm和45.5mm,每个处理3次重复,共6个栽培试验池。如图1所示,W处理全生育期0-60cm各层土壤含水量均值在31.3%~36.5%区间变化,水分适宜。D处理0-60cm各层土壤含水量均值,拔节期为31.6%~33.8%,水分适宜;抽雄期为28.9%~29.7%,轻度干旱;灌浆期为23.5%~25.0%,中度干旱。这里的水分适宜、轻度干旱和中度干旱是指其土壤含水量分别为田间持水量的70%以上、60%~70%和50%~60%[12]。
注:W表示在大喇叭口期(7月28日)、抽雄期(8月13日)、灌浆期(9月12日)灌溉,灌水定额分别为45.5mm、60.6mm和45.5mm,D表示整个生育期内不灌水。误差线表示标准差。下同
Note:W indicates irrigation at bugle stage (28thJuly), heading stage (13thAugust) and grain filling (12thSeptember), irrigating quota are 45.5mm, 60.6mm and 45.5mm, respectively. D indicates no irrigation during the growth period. Error bars represent standard deviation. The same as below
1.3 测定项目与方法
分别于2015年7月19日(拔节期)、8月8日(抽雄期)和8月24日(灌浆期)对每个处理随机选取长势良好、基本一致且无病虫害的玉米植株3株。测定时间为9:00-12:00,设定光合仪LI-6400-40光合有效辐射为500µmol·m-2·s-1,预设置程序从蓝光占红蓝光总和的比例依次为0、25%、50%、75%、100%共5个梯度。为保证测定参数稳定,每2个辐射水平时间间隔至少10 min,叶室温度为28℃,CO2浓度为380 µmol·mol-1。设定好后选择同一株玉米第一片功能叶片中部进行自动测定。测定叶面积按2cm2计算,测定参数包括净光合速率(Pn,µmol·m-2·s-1),蒸腾速率(Tr,mmol·m-2·s-1)和气孔导度(Gs,mol·m-2·s-1),并计算叶片瞬时水分利用效率(WUE, µmol·mmol-1),即WUE=Pn /Tr。
1.4 数据处理
试验数据用Excel 2013和SPSS19.0分析,对不同处理指标去除奇异值后取平均值并进行方差分析,如果差异显著(P<0.05),则通过Duncan法进行多重比较。
2 结果与分析
2.1 两种水分条件下气孔导度对红蓝光比的瞬时响应
由图2a可知,在玉米拔节期,灌水条件下(W),单色红光(R)照射时叶片气孔导度(Gs)最大(0.14mol·m-2·s-1),随着蓝光比例的增加,Gs持续降低;当为75%蓝光照射时,Gs为0.11mol·m-2·s-1;当变至单色蓝光(B)照射时,Gs略有提高,较75%蓝光提高了6%。不灌水条件下(D),玉米拔节期0-60cm土层平均土壤含水量为31.6%~33.8%,水分适宜(图1)。与其它光质照射相比,单色红光照射时叶片Gs也表现为最大,增加25%蓝光后Gs的变化并不显著;当蓝光比例继续增至50%和75%时,Gs显著降低(P<0.05);当变为单色蓝光(B)时,Gs降至最低,仅为单色红光照射时的59.0%。
由图2b可见,在玉米抽雄期,灌水条件下(W),单色红光照射时叶片气孔导度(Gs)最大(0.20mol·m-2s-1),蓝光比例增至50%时,Gs显著降低,仅为单色红光照射时的76.1%;随着蓝光比例的再增加,Gs持续降低,当变至单色蓝光时,Gs最小,仅为单色红光照射时的54.9%。不灌水条件下(D),玉米抽雄期0-60cm土层平均土壤含水量为28.9%~29.7%,处于轻度水分胁迫(见图1),单色红光照射时,叶片Gs显著低于灌水条件下,但与同等条件其它光质相比其Gs也为最大(0.14mol·m-2·s-1);蓝光比例增至25%后Gs显著降低,变至单色蓝光(B)时,Gs降至最低(0.10mol·m-2·s-1)。
由图2c可见,在玉米灌浆期,灌水条件下(W),叶片气孔导度变化规律与抽雄期一致,但平均气孔导度值低于其它时期。单色红光照射时Gs最大(0.12mol·m-2·s-1),单色蓝光照射时Gs最小,仅为单色红光照射时的42.7%。不灌水条件下(D),玉米灌浆期0-60cm土层平均土壤含水量为23.5%~ 25.0%,处于中度水分胁迫(见图1),叶片气孔导度仍受红蓝光比例显著影响,单色红光照射时叶片气孔导度为0.11mol·m-2·s-1,随着蓝光比例增加,Gs显著降低,当变为单色蓝光照射时,Gs为0.05mol·m-2·s-1。
可见,在全生育期内,玉米Gs受水分影响显著,与不灌水相比,灌水处理Gs相对较高,尤其在抽雄期表现出显著差异。无论在灌水还是不灌水条件下,单色红光照射时Gs均最大,随着蓝光比例增加,Gs呈不同程度降低。
注:小写字母表示光质处理间在0.05水平上的差异显著性。R表示红光,B表示蓝光。下同
Note: Lowercase indicates the difference significance among different R/Bratio treatments at 0.05 levels. R is red light, B is blue light. The same as below
2.2 两种水分条件下光合速率对红蓝光比的瞬时响应
由图3a可知,在玉米拔节期,灌水条件下单色红光照射时净光合速率(Pn)最大(11.84µmol·m-2·s-1),之后随着蓝光比例的增加,Pn持续降低;蓝光比例增至50%时,Pn仅为单色红光照射时的68.9%,而75%蓝光与单色蓝光照射时Pn差异并不显著。不灌水条件下,单色红光照射时Pn虽然较充分灌水条件下略小,但在同等光质条件下,其Pn则最大(10.04µmol·m-2·s-1);蓝光比例增至25%时Pn变化并不显著,之后再增至50%和75%时,Pn均显著降低;当变为单色蓝光照射时,Pn降至最低,仅为3.48µmol·m-2·s-1。
由图3b可见,在玉米抽雄期,灌水条件下单色红光照射时叶片Pn最大(25.33µmol·m-2·s-1),蓝光增至50%后,Pn仅为单色红光的87.7%;之后随着蓝光比例的增加,Pn降低显著(P<0.05);当变为单色蓝光时,Pn最小,仅为单色红光照射的43.9%。不灌水条件下,同等光质时Pn较灌水条件下整体大幅度降低,当单色红光照射时Pn最大,仅为13.56µmol·m-2·s-1;蓝光比例增至25%和50%时Pn略有降低,之后蓝光比例再增至75%时,Pn显著降低(P<0.05),仅为单色红光照射时的44.7%;变为单色蓝光时,Pn仅为5.36µmol·m-2·s-1。
由图3c可见,在玉米灌浆期,灌水条件下叶片Pn变化规律同其它两个时期一致。单色红光照射时Pn最大(18.48µmol·m-2·s-1),之后随着蓝光比例的增加,Pn持续降低;变为单色蓝光照射时最小(6.04µmol·m-2·s-1),仅为单色红光照射时的32.7%。不灌水条件下,Pn受红蓝光比例的影响仍然显著,单色红光照射时较灌水条件下虽略小,但在其同等光质条件下也为最大(17.2µmol·m-2·s-1),当蓝光比例增至25%时Pn变化并不显著,之后蓝光比例增至50%和75%时,Pn均显著降低(P<0.05);变为单色蓝光时,Pn降至最低(7.78µmol·m-2·s-1)。
可见,与不灌水相比,灌水条件下Pn较高,尤其在抽雄期两种水分处理差异表现最为明显。但从全生育期看,两种灌水条件下Pn均表现为单色红光照射时最大,之后随着蓝光比例增加,Pn不同程度地降低。

图3 两种水分处理下不同红蓝光比对主要生育阶段夏玉米叶片光合速率(Pn)的影响
2.3 两种水分条件下蒸腾速率对红蓝光比的瞬时响应
由图4a可知,在玉米拔节期,灌水条件下单色红光照射时叶片蒸腾速率(Tr)最大(2.31mmol·m-2·s-1);之后蓝光比例增至50%时,Tr显著降低,仅为单色红光照射时的73.6%;变至单色蓝光时,Tr略有增加,较75%蓝光提高了7.1%。不灌水条件下,同等光质时Tr与灌水条件无明显差异,单色红光仍为最大(2.24mmol·m-2·s-1),蓝光比例增至25%时Tr变化并不显著;当蓝光比例增至50%和75%时,Tr显著降低;变至单色蓝光照射时,Tr降至最低(1.30mmol·m-2·s-1),仅为单色红光时的58.0%。
由图4b可见,在玉米抽雄期,灌水条件下单色红光照射时Tr最大(2.66mmol·m-2·s-1),随着蓝光比例的增加,Tr持续降低;变为单色蓝光时,Tr最小,仅为单色红光照射时的63.4%。不灌水条件下,同等光质时Tr较灌水条件下整体上大幅降低,且Tr受红蓝光比例影响很小,无显著性差异。说明不灌水时土壤水分抑制了蒸腾速率。
由图4c可见,在玉米灌浆期,灌水条件下单色红光照射时Tr最大(1.66mmol·m-2·s-1),之后随着蓝光比例的增加,Tr显著减小;变至单色蓝光时Tr最小(0.93mmol·m-2·s-1)。不灌水条件下,Tr仍受红蓝光比例显著影响,变化规律与灌水条件下一致,且同等光质条件下较灌水均略有降低,但差异不显著。
可见,与不灌水相比,灌水条件下Tr较高,尤其在抽雄期两种水分处理差异表现最为明显,在拔节和灌浆期差异并不显著。全生育期内,两种水分条件下Tr随着蓝光比例的增加呈下降趋势,其变化规律与Gs一致,说明蒸腾作用直接受气孔开闭程度的影响。

图4 两种水分处理下不同红蓝光比对主要生育阶段夏玉米叶片蒸腾速率(Tr)的影响
2.4 两种水分条件下叶片水分利用效率对红蓝光比的瞬时响应
由图5a可知,在玉米拔节期,灌水条件下,WUE在单色红光照射时最大(5.15µmol·mmol-1),之后蓝光比例增至75%,WUE随之减小,当变为单色蓝光时,WUE为3.83µmol·mmol-1,但各光质处理间WUE差异性不显著。不灌水条件下,同等光质条件较灌水处理其WUE无显著差异,其中50%蓝光照射时WUE最大(5.17µmol·mmol-1),单色蓝光WUE最低(2.37µmol·mmol-1)。
由图5b可见,在玉米抽雄期,灌水条件下单色红光照射时WUE最小(6.08µmol·mmol-1);之后随着蓝光比例增加,WUE持续增加;当为单色蓝光时,则略有降低,但差异并不显著。不灌水条件下,平均WUE较灌水条件降低28.43%;在单色红光25%和50%蓝光照射时,WUE较高,最大为7.89µmol·mmol-1,但三者无显著差异;之后蓝光比例增至75%时,WUE显著降低(P<0.05),为3.81µmol·mmol-1,但单色蓝光与之并无显著差异。
由图5c可见,在玉米灌浆期,灌水条件下单色红光照射时WUE最大(11.66µmol·mmol-1),随着蓝光比例增至75%时,WUE持续降低,但无显著性差异;当变为单色蓝光时,WUE显著降低,为6.86µmol·mmol-1。不灌水条件下,WUE变化规律与灌水条件一致,但平均WUE较灌水时下降16.2%。 可见,水分对叶片WUE影响显著,相较于灌水,不灌水条件下WUE在拔节期无显著差异;在抽雄和灌浆期因处于轻度、中度水分胁迫WUE有所降低。在全生育期内,两种水分条件下随着蓝光比例增加,叶片水分利用效率WUE呈下降趋势(W处理抽雄期除外),但差异不显著;当变为单色蓝光照射时,WUE明显低于其它光质比。
3 讨论与结论
3.1 讨论
土壤水分是影响作物生长发育最重要的环境因子,因为水分既是光合作用的原料,又可影响叶片气孔的开闭,从而间接影响光合和蒸腾作用的进行以及CO2的吸收[13]。当土壤水分出现胁迫时,作物体内水分含量降低,叶片气孔阻力加大,蒸腾减小,光合速率降低[14]。本研究结果表明玉米叶片通过减少气孔开度和蒸腾速率来提高叶片WUE,以抵御蓝光和水分对叶片光合作用产生的胁迫作用。蓝光照射可降低叶片气孔导度(Gs)、净光合速率(Pn)和蒸腾速率(Tr),其原因可能是蓝光环境下玉米对光能利用率较低[15]。光合作用是植物叶片对光能吸收、传递和利用的过程,水分胁迫下植物叶片净光合速率降低的主要因素包括两类,一类是气孔部分关闭导致气孔限制,另一类是叶肉细胞光合活性的降低导致的非气孔限制因素[16]。气孔因素造成Pn下降,表现为Gs和胞间二氧化碳浓度Ci同时下降,非气孔因素造成Pn下降则表现为Gs下降而Ci上升。本研究中Gs随着蓝光比例增加而降低,Ci随之升高(由于篇幅所限,本文未给出),表明净光合速率降低是由于非气孔因素导致,而很可能是由于蓝光破坏了玉米光合作用过程中叶片光合电子传递系统I或II平衡[17],与Sun等[7]结果一致。Takemiya等[5]认为蓝光可以促进气孔开度增加,但因作物品种、试验条件的不同,也有研究表明气孔导度在红光照射时较蓝光高[18-19],本研究玉米叶片气孔导度在较高蓝光比例下并未提高,可见,光质对植物叶片气孔和光合作用的影响及机制还未明确,玉米作为C4作物的代表对光质的响应有着明显的再适应自我调节机制,表现出植物对光质响应的复杂性。
3.2 结论
在灌水和不灌水条件下,同等光合有效辐射照射时,玉米叶片气孔导度(Gs)、净光合速率(Pn)和蒸腾速率(Tr)均表现为单色红光照射时最大,之后随着蓝光比例的增加,各指标均有不同程度的降低。从节水角度来看,高红光比例的光质对玉米叶片WUE有明显的提高。
[1] 王治海,刘建栋,刘玲,等.几种气孔导度模型在华北地区适应性研究[J].中国农业气象,2012,33(3):412-416.
Wang Z H,Liu J D,Liu L,et al.Research on the applicability of several stomatal conductance models on the North China Plain[J].Chinese Journal of Agrometeorology, 2012,33(3): 412-416.(in Chinese)
[2] 郑洁,胡美君,郭延平.光质对植物光合作用的调控及其机理[J].应用生态学报,2008,19(7):1619-1624.
Zheng J,Hu M J,Guo Y P.Regulation of photosynthesis by light quality and its mechanism in plants[J].Chinese Journal of Applied Ecology,2008,19(7):1619-1624.(in Chinese)
[3] Machlis L,Torrey J G.A laboratory manual of plant physiology[M].San Francisco,Calif W.H.:Freeman and Co., 1959:282.
[4] Gressel J,Rau W.Photo control of fungal development [M].Berlin Heidelberg:Springer,1983:603-639.
[5] Takemiya A,Inoue S,Shimazaki K.Blue light response of stomata[J].Tanpakushitsu Kakusan Koso Protein Nucleic Acid Enzyme,2007,52(6 Suppl):601-605.
[6] Messori A,Maratea D,Fadda V,et al.Light regulation of stomatal movement[J].Annual Review of Plant Biology, 2007,58(1):219-247.
[7] Sun W,Ubierna N,Ma J Y,et al.The influence of light quality on C4 photosynthesis under steady-state conditions inand×:changes in rates of photosynthesis but not the efficiency of the CO2concentrating mechanism[J]. Plant,Cell and Environment, 2012,35(5):982- 993.
[8] 叶子飘,于强.植物气孔导度的机理模型[J].植物生态学报,2009,33(4):772-782.
Ye Z P,Yu Q.Mechanism model of stomatal conductance [J].Chinese Journal of Plant Ecology,2009,33(4):772-782. (in Chinese)
[9] 张宝忠,刘钰,许迪,等.基于夏玉米叶片气孔导度提升的冠层导度估算模型[J].农业工程学报,2011,27(5):80-86.
Zhang B Z,Liu Y,Xu D,et al.Estimation of summer corn canopy conductance by scaling up leaf stomatal conductance [J].Transactions of the CSAE,2011,27(5): 80-86.(in Chinese)
[10] Wang J,Wei L,Tong Y X,et al.Leaf morphology, photosynthetic performance,chlorophyll fluorescence, stomatal development of lettuce (L.) exposed to different ratios of red light to blue light[J]. Frontiers in Plant Science, 2016,7(250):1-10
[11]杨帆,苗灵凤,胥晓,等.植物对干旱胁迫的响应研究进展[J].应用与环境生物学报,2007,13(4):586-591.
Yang F,Miao L F,Xu X,et al.Progress in research of plant responses to drought stress[J].Chinese Journal of Applied and Environmental Biology,2007,13(4):586-591.(in Chinese)
[12]邱新强,路振广,张玉顺,等.不同生育时期干旱对夏玉米耗水及水分利用效率的影响[J].中国农学通报, 2013,29(27): 68-75
Qiu X Q,Lu Z G,Zhang Y S,et al.Effects of drought in different growth stages on water consumption and water use efficiency of summer maize[J].Chinese Agricultural Science Bulletin,2013,29(27):68-75.(in Chinese)
[13] Sharp R E, Poroyko V,Hejlek LG,et al.Root growth maintenance during water deficits: physiology to functional genomics[J]. Journal of Experimental Botany, 2004, 55(407): 2343-2351.
[14]张喜英. 高农田水分利用效率的调控机制[J].中国生态农业学报,2013,21(1):80-87.
Zhang X Y.Regulating mechanisms for improving farmland water use efficiency[J].Chinese Journal of Eco- Agriculture,2013,21(1):80-87.(in Chinese)
[15]Grantz D A,Assmann S M.Stomatal response to blue light:water use efficiency in sugarcane and soybean[J]. Plant,Cell and Environment,2006,14(7):683-690.
[16] 韩艳,韩晨光,崔荣华,等.外源水杨酸对UV-B增强下花生叶片光合特性的影响[J].中国农业气象,2016,37(4):437- 444.
Han Y,Han C G,Cui R H,et al.Effects of exogenous salicylic acid on photosynthetic characteristics of peanut leaves under elevated UV-B radiation[J].Chinese Journal of Agromenteorology, 2016,37(4):437-444.(in Chinese)
[17]Sun W,Ubierna N,Ma J Y,et al.The coordination of C4 photosynthesis and the CO2concentrating mechanism inand×in response to transient changes in light quality[J].Plant Physiology,2014, 164(3): 1283-1292.
[18]苏天星,杨再强,黄海静,等.不同光质对温室甜椒气孔导度的影响[J].干旱气象,2010,28(4):443-448.
Su T X,Yang Z Q,Huang H J,et al.Effect of light quality on stomatal conductance of sweet pepper in greenhouse[J]. Journal of Arid Meteorology,2010,28(4):443-448.(in Chinese)
[19]Mott K A,Peak D.Alternative perspective on the control of transpiration by radiation[J].Proceedings of the National Academy of Science of the United States of America,2011, 108(49):19820-19823.
Instantaneous Response of Leaf Stomatal Behavior to Light Quality under Two Irrigation Levels in Summer Maize
LI Yuan-yuan1, GONG Dao-zhi1, YAN Wei-guang1, TANG Da-hua, MEI Xu-rong1, Zhang Wen-ying2
(1. Institute of Environment and Sustainable Development in Agriculture, Chinese Academy of Agricultural Sciences/State Key Engineering Laboratory of Crops Efficient Water Use and Drought Mitigation/Key Laboratory of Dryland Agriculture, Ministry of Agriculture, Beijing 100081, China; 2. Dryland Farming Institute, Hebei Academy of Agriculture and Forestry Sciences, Hengshui 053000)
The LI-6400 portable photosynthesis system was used to measure the stomatal conductance (Gs), net photosynthetic rate (Pn) and transpiration (Tr) of the first functional leaf of summer maize (Zhengdan 958) under irrigation and no irrigation during three growth periods (jointing, tasselling and filling stages). While measuring these physiological indicators, red to blue ratio was set at 0, 25%, 50%, 75% and 100% to analyze its effects on the stomatal behavior of summer maize. The instantaneous leaf water use efficiency was also calculated from measurements of these physiological indicators. The results showed that compared with no-irrigation, the mean values of Gs, Pn and Tr in leaves were significantly higher under the irrigation treatment at the tasselling stages, but the differences between both treatments were not significant at the jointing and filling stage. Under both two water treatments, the Gs, Pn and Tr were maximum under the pure red light and decreased with the increase of blue light proportion. Considering the water-saving effect, higher ratio of red to blue light can improve the WUE of maize leaves.
Water stress; R/B ratio; Maize; Photosynthesis; Leaf water use efficiency
10.3969/j.issn.1000-6362.2017.02.006
2016-07-19
国家863计划课题(2013AA103004);国家科技支撑计划课题(2015BAD24B01)
李沅媛(1991-),女,硕士生,研究方向为作物水分生理与高效用水。E-mail: 524797046@qq.com
**通讯作者。E-mail: gongdaozhi@caas.cn
