MEFV基因突变与儿童过敏性紫癜遗传易感性的Meta分析
2017-02-10廉国利吴红艳黄燕萍
何 敏,廉国利,吴红艳,黄燕萍
(西安交通大学医学院第一附属医院儿科,陕西 西安 710061)
MEFV基因突变与儿童过敏性紫癜遗传易感性的Meta分析
何 敏,廉国利,吴红艳,黄燕萍
(西安交通大学医学院第一附属医院儿科,陕西 西安 710061)
目的 探讨MEFV基因突变与过敏性紫癜(HSP)的相关性。方法 计算机检索PubMed、Web of Science、Medline、Cochrane Library、中国期刊全文数据库(CNKI)、万方数据库,检索从建库至2015年12月31日公开发表的关于MEFV基因突变与HSP相关性的文献,使用Rev Man 5.0软件进行Meta分析。结果 最终纳入6篇英文文献,累计总病例数433例,其中MEFV基因突变136例,Meta分析结果显示合并的MEFV基因突变率为0.3(95%CI:0.23,0.37);3个亚组(关节炎组、消化道症状组、肾脏损害组)每组中MEFV基因突变与非突变比较均P>0.05,提示MEFV基因突变与临床症状无显著性差异。结论 MEFV基因突变可能是儿童HSP遗传易感因素,但在临床表现方面MEFV基因突变与非突变无明显的区别。
儿童;MEFV基因突变;过敏性紫癜;Meta分析
过敏性紫癜(henoch-schönlein purpura,HSP)是一种lgA介导的全身性小血管炎,主要临床表现为特征性皮肤紫癜、腹痛、消化道出血、关节肿痛及肾脏损害等,其发病率约为(12.9~15.0)/10万[1]。近些年研究发现,患有家族性地中海热(familial mediterranean fever,FMF)的患儿并发HSP几率较普通人较高[2]。FMF是一种常染色体隐性遗传性疾病,属于单基因自身炎症性疾病,临床表现以反复发作性发热、腹膜炎、胸膜炎、关节炎、皮肤病变和心包炎等,长期反复发作的炎性反应会导致肾脏淀粉样变。MEFV基因是FMF的致病基因,编码的蛋白质在炎症初期的白细胞促炎-抗炎机制中起负调节作用。MEFV基因突变导致蛋白表达减少或功能异常,引起自身炎症性损伤。有学者发现,MEFV基因突变的HSP患儿临床表现和实验室检查更严重[3]。目前有关HSP患儿MEFV基因突变率的报道都以小样本为主,不足以全面了解HSP患儿的MEFV基因突变概况,因此本文通过Meta分析对HSP的MEFV基因突变率进行分析,为HSP的发病遗传学研究提供循证医学证据。
1材料与方法
1.1文献检索
1.1.1数据库
检索PubMed、Web of Science、Medline和Cochrane Library,中国期刊全文数据库(CNKI)和万方数据库查找文献,检索时间均为建库时间开始至2015年12月31日。
中文检索词:过敏性紫癜、MEFV基因突变、家族性地中海热;英文检索词:Henoch-Schönlein purpura/HSP or allergic purpura、MEFV gene mutations、Familial Mediterranean fever(FMF)。
1.1.3文献纳入标准
1.1.3.1研究内容 研究HSP患儿MEFV基因突变,基因突变检测需涉及MEFV基因的所有外显子,各文献研究方法相似,文中报告数据完整,能直接或间接提供统计指标计算基因突变率。
1.1.3.2研究对象 年龄0~16岁,性别、种族和教育程度不限,符合HSP诊断标准[4]的患者。排除患有明显心肺疾病、结缔组织病、内分泌代谢异常、原发性血小板减少性紫癜、凝血功能异常等出血性疾病。
1.1.4文献排除标准
①包括成人MEFV基因突变的文献;②综述和重复收录的文献;③研究内容仅涉及MEFV基因的某些多态性位点,而非所有的MEFV基因外显子;④数据不完整无法提取相关内容。
1.2方法
每年可给牦牛进行1次定期驱虫,流行严重的地方可进行2次驱虫。第1次最好在秋末冬初,由夏季草场转场到冬季草场前进行。第2次可在春末夏初,在由冬季草场转场到夏季草场前进行。驱虫应集中时间和地点,对驱虫后的家畜粪便进行集中处理,防止二次污染。驱虫药品可选用肝蛭净(牦牛10 mg/kg体重)、丙硫咪唑(牦牛10 mg/kg体重)、蛭得净(牦牛12 mg/kg体重,绵羊16 mg/kg体重)及吡喹酮等。由于西藏政府每年均为农牧民群众免费配发一定量的丙硫咪唑和吡喹酮等驱虫药品,因此只要做好组织和示范,定期驱虫工作并不难开展。
1.2.1资料提取
由2名研究者独立提取资料,交叉核对,有不一致观点通过讨论解决。所提取资料包括:①文献的基本特征,包括文题、年份、出处、研究者姓名等;②纳入文献研究对象的基本特征、研究方法和结局指标等。
1.2.2文献质量评价
对观察性研究采用纽卡斯尔-渥太华量表(The Newcastle-Ottawa Scale,NOS)进行评价[5]。量表总分共9分,根据量表的条目文献质量可分为3个等级,7~9分属于高质量文献,4~6分属于中质量文献,1~3分属于低质量文献。
1.3统计学方法
对原始数据进行整理,采用Rev Man 5.0进行率的Meta分析,绘制森林图进行异质性检验,选择模型计算合并统计量,同时进行敏感性分析,利用漏斗图分析发表偏倚。
2结果
2.1文献检索及流程图
按制定的检索策略,检索出相关文献共36篇,经阅读标题、摘要或全文,最后筛选出符合纳入标准的有6篇文献,均为英文文献,文献检索纳入排除流程具体见图1。
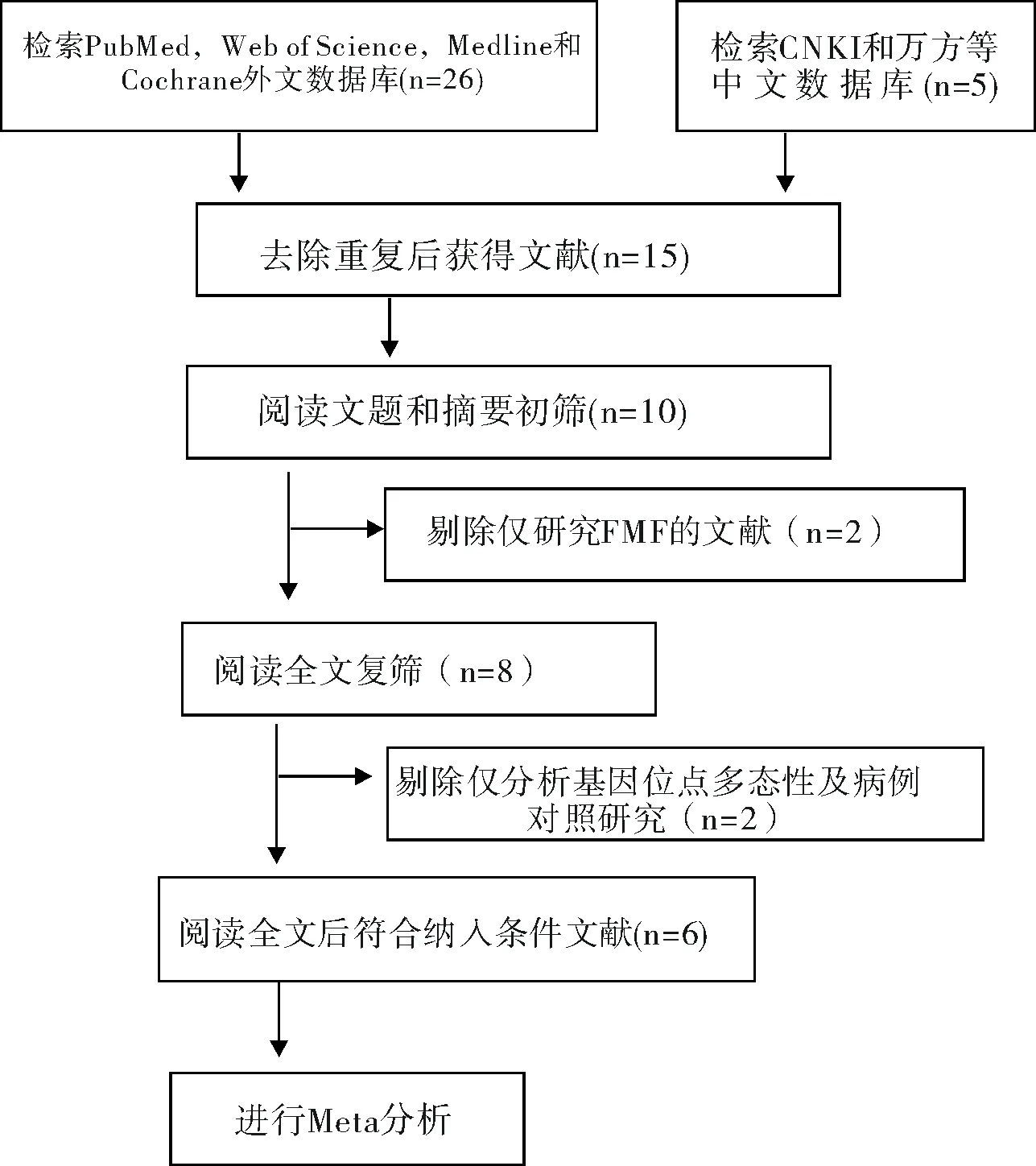
图1 文献检索流程图
Fig.1 Flow chart of the procedure for literature search
2.2纳入文献的基本情况
本研究纳入Meta分析文献共6篇,均为队列研究。研究对象为HSP患儿,年龄为1~16岁,总病例数为433例,其中男性244例,女性189例,来自于土耳其、伊朗及以色列,其中突变人数共136例。纳入基本特征见表1。

表1 纳入文献的基本特征
2.3Meta分析结果
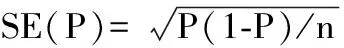
P及SE数据用Rev Man 5.0软件计算所得结果如图2所示,从图中可知该研究结果间存在异质性(I2=59%,P=0.03),采用随机效应模型,合并的MEFV基因突变率为0.3(95%CI:0.23,0.37)。
2.4发表偏倚
MEFV基因突变率的漏斗图显示散点不太对称,说明存在一定的发表偏倚,见图3。
表2 MEFV基因突变率(P)及标准误(SE)
Table 2 MEFV gene mutations rate and standard error

作者年份突变数/病例数(n)PSEGershoni等[2]200314/520.2690.061Ozcakar等[6]200827/800.3340.053Bayram等[7]201147/1070.4390.048Nikibakhsh等[8]201212/500.2400.060Dogan等[9]201318/760.2360.049Altug等[10]201318/680.2650.054

图2 HSP患儿MEFV基因突变率的森林图
Fig.2 Forest plot of MEFV gene mutation rate in HSP patients
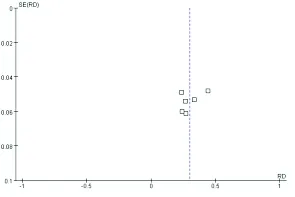
图3 HSP患儿MEVF基因突变率的漏斗图
Fig.3 Funnel plot of MEFV gene mutation rate in HSP patients
2.5亚组分析
在6篇文献中,有4篇提供了MEFV基因突变与临床症状的数据,根据临床症状划分进行亚组分析,分为关节炎组、消化道症状组、肾脏损害组,分析结果显示P值均大于0.05,提示MEFV基因突变组与非突变组比较差异无显著性,见图4。

图4 HSP患儿临床症状关节炎、消化道症状及肾脏损害与MEFV
基因突变关系的森林图
Fig.4 Forest plot of the association between clinical manifestations including arthritis, gastrointestinal symptoms and renal involvement and MEFV gene mutation
3讨论
3.1过敏性紫癜的特征及发病机制
HSP是在儿童中最常见的系统性血管炎之一,其基本病变是弥漫性小血管炎伴有免疫球蛋白IgA免疫复合物沉积在皮肤、关节、肾脏、胃肠道等所致损害的多系统疾病。IgA免疫复合物沉积在肾脏组织而导致肾脏损害,即为紫癜性肾炎(henoch-schönlein purpura nephritis,HSPN),是HSP最严重的远期并发症。HSP的发病机制尚不完全明确,目前研究发现与IgAl异常糖基化密切相关[13],而与IgA1异常糖基化密切相关的C1GALTl(β1,3半乳糖基转移酶,C1β-3-GalT)基因、IL基因、血管舒缩和内皮功能调节基因、血管紧张素转化酶基因、血管紧张素原基因、MEFV基因等与HSP的发病、病程进展及疾病严重程度有一定的相关性[14-15]。
3.2 MEFV基因突变与过敏性紫癜的关系
MEFV是FMF的致病基因,由10个外显子组成,全长约10kb,mRNA为3.7kb,编码产物由781个氨基酸组成,分子量为86kD的蛋白pyrin。Pyrin蛋白主要在人的多形核白细胞和单核细胞中表达,促炎细胞因子如干扰素λ(interferon,IFN-λ)和肿瘤坏死因子(tumor necrosis factor-alpha,TNF-α)可刺激pyrin的合成。Pyrin蛋白可能在炎症反应中对白介素1β(interleukin-1 beta,IL-1β)和核转录因子(nuclear transcription factor-kappa B,NF-κB)的激活起负调节作用,而与疾病相关的突变可能会导致起始反应细胞处于异常的持续激活状态,使机体对有害刺激的反应不断放大,引起自身炎症性病理损伤。因此,许多研究认为MEFV基因突变导致其编码的蛋白pyrin功能异常可能是引起自身炎症反应的重要原因[9,16]。
国外研究发现,在儿童血管炎性和风湿性疾病中存在MEFV基因突变,例如HSP和幼年类风湿性关节炎,与MEFV基因突变导致炎症反应扩大有关[17]。目前已发现MEFV基因有90多个突变位点,最常见的突变有5种:M694V、V726A、M680I、M694I和E148Q。Nikibakhsh等[8]对50例伊朗HSP患儿检测发现MEFV基因突变率达24%,其中M694V占22%。Mandana等[18]研究发现,土耳其儿童在临床特征方面MEFV基因突变组与非突变组无区别,但其中M680I突变率较高,可能是诱发HSP的易感因素。Salah等[19]检测埃及HSP患儿MEFV基因突变率高达61.7%,其中V726A等位基因频率最高,并认为MEFV基因突变与HSP易感性相关。韩丽芳等[20]对57例中国志愿者的研究发现,MEFV基因突变率达54%,其中E148Q突变率较高;He等[16]发现E148Q多态性可能与儿童HSP的发病有关,与同为亚洲人群日本的报道相似,也是以E148Q突变多见(约40%)[21]。各项研究中突变率的差异与不同的种族、地区、研究人群的选择及研究设计不同有关。本研究通过Meta分析,对HSP患儿MEFV基因突变与患者特征进行综合分析,在433例患者中,136例有MEFV基因突变合并的MEFV基因总突变率为30%,突变率较高,提示MEFV基因突变可能是HSP发病的遗传学因素之一。MEFV基因突变亚组分析中,提示突变组与非突变组在关节炎、消化道症状及肾脏损害等临床表现方面无相关性,与Mandana等[18]的研究一致。
3.3本文局限性
本研究中,从MEFV基因突变率森林图中可以看出各研究存在一定异质性,同时漏斗图不完全对称提示有发表偏倚,考虑其原因:纳入文献较少,研究涉及人种单一,仅为高加索人种,研究数量及样本量相对小,缺乏对照组,影响Meta分析的结果;纳入研究均为公开发表的文献,可能会导致发表偏倚;不同年龄段儿童HSP的发生率差异较大,但部分纳入文献中未提及患儿准确年龄范围;关于各突变位点的原始数据不完整,无法进行进一步的讨论。因此需开展更多设计严谨、大样本、多中心的前瞻性随机病例对照研究,进一步明确MEFV基因突变与HSP的相关性。
[1]Yang Y H, Hung C F, Hsu C R,etal.A nationwide survey on epidemiological characteristics of childhood Henoch-Schonlein purpura in Taiwan[J].Rheumatology (Oxford),2005,44(5):618-622.
[2]Gershoni-Baruch R, Broza Y, Brik R.Prevalence and sigficance of mutations in the Familial Mediterranean Fever gene in Henoch-Schonlein Purpura[J].J Pediatr,2003,143(5):658-661.
[3]Aksu K, Keser G.Coexistence of vasculitides with Familial Mediterranean Fever[J].Rheumatol Int,2011,31(10):1263-1274.
[4]Ozen S, Pistorio A, Iusan S M,etal.EULAR/ PRINTO/PRES criteria for Henoch-Schonlein purpura, childhood polyarteritis nodosa, childhood Wegener granulomatosis and childhood Takayasu arteritis. Ankara 2008; Part II:final classification criteria[J].Ann Rheum Dis,2010,69(5):798-806.
[5]曾宪涛,刘慧,陈曦,等.Meta分析系列之四:观察性研究的质量评价工具[J].中国循证心血管医学杂,2012,4(4):297-299.
[6]Ozcakar Z B, Yalcinkaya F, Cakar N,etal.MEFV mutations modify the clinical presentation of HenochSchonlein Purpura[J].J Rheumatol,2008,35(12):2427-2429.
[7]Bayram C, Demircin G, Erdogan O,etal.Prevalence of MEFV mutations and their clinical correlations In Turkish Children with HenochSchonlein Purpura[J].Acta Pediatr,2011,100(5):745-749.
[8]Nikibakhsh A A, Houshmand M, Bagheri M,etal.MEFV 2012 gene mutations (M694V, V726A, M680I, and A744S) in Iranian children with Henoch-Schonlein purpura[J].Pneumologia,2012,61(2):84-87.
[9]Dogan C S, Akman S, Koyun M,etal.Prevalence and signficance of the MEFV gene mutations in childhood Henoch-Schonlein Purpura without FMF symptoms[J].Rheumatol Int,2013,33(2):377-380.
[10]Altug U, Ensari C, Sayin D B,etal.MEFV gene mutations in Henoch-Schonlein purpura[J].International Journal of Rheumatic Diseases,2013,16(3):347-351.
[11]陈月红,杜亮,耿兴远,等.无对照二分类数据的Meta分析在Rev Man软件中的实现[J].中国循证医学杂志,2014,14(7):889-896.
[12]方积乾.生物医学研究的统计方法[M].北京:高等教育出版社,2007:65.
[13]CHEN Jun-yi, MAO Jian-hua.Henoch-Schönlein purpura nephritis in children:incidence, pathogenesis and managenment[J].World J Pediatr,2015,11(1):29-34.
[14]汪莉,鹿玲.儿童过敏性紫癜遗传学机制研究进展[J].国际儿科学杂志,2013,40(5):497-500.
[15]He X, Yu C, Zhao P,etal.The genetics of Henoch-Schonlein purpura:a systematic review and meta-analysis[J].Rheumatol Int,2013,33(6):1387-1395.
[16]He X, Lu H, Kang S,etal.MEFV E148Q polymorphism is associated with Henoch-Schonlein purpura in Chinese children[J].Pediatr Nephrol,2010,25(10):2077-2082.
[17]Aksuk K, Keser G.Coexistence of vasculitis of FMF[J].Rheumatol Int,2011,31(10):1263-1274.
[18]Mandana R, Bonyadi M, Aliyari B,etal.Prevalence of the MEFV gene mutations and their clinical correlations in Azeri Turkish patients with childhood Henoch-Schonlein purpura:The role of M680I and E148Q mutations[J].J Anal Res Clin Med,2015,3(2):112-117.
[19]Salah S, Rizk S, Lotfy H M,etal.MEFV gene mutations in Egyptian children with Henoch-Schonlein purpura[J].Pediatric Rheumatology,2014,12(1):1-6.
[20]韩丽芳,蔡军伟,颜亮,等.中国人群MEFV基因多态性研究[J].实用医学杂志,2006,22(11):1234-1235.
[21]Kishida D, Nakamura A, Yazaki M,etal.Genotypephenotype correlation in Japanese patients with familial Mediterranean fever:differences in genotype and clinical features between Japanese and Mediterranean populations[J].Arthritis Res Ther,2014,16(5):439.
[专业责任编辑:孙晓勉]
Meta-analysis of the association between MEFV gene mutations and susceptibility to children with Henoch-Schönlein purpura
HE Min, LIAN Guo-li, WU Hong-yan, HUANG Yan-ping
(DepartmentofPediatrics,FirstAffliatedHospitalofMedicalCollege,Xi’anJiaotongUniversity,ShaanxiXi’an710061,China)
Objective To explore the association between MEFV gene mutations and susceptibility to Henoch-Schönlein purpura (HSP). Methods A comprehensive literature search of PubMed, Web of Science, Medline, Cochrane Library, National Knowledge Infrastructure of China (CNKI) and Wanfang Database was conducted to collect relevant studies till December 31, 2015, and the extracted data were statistically analyzed by using Rev Man version 5.0. Results A total of 433 cases from 6 English articles were enrolled in this study, in which 136 cases had MEFV gene mutations. The results of Meta-analysis showed that the pooled MEFV gene mutation rate was 0.3 (95%CI:0.23, 0.37). In three subgroups (arthritis group, gastrointestinal symptoms group and renal involvement group),Pvalue was greater than 0.05 when comparing MEFV gene mutations adn non-mutation, which indicated that MEFV gene mutation was not significantly correlated with clinical manifestation. Conclusion MEFV gene mutation may be a susceptible factor for children with HSP. There is no difference in the clinical manifestations between patients with and without MEFV mutation.
children; MEFV gene mutations; Henoch-Schönlein purpura (HSP); Meta-analysis
2016-08-07
何 敏(1979-),女,主治医师,硕士,主要从事小儿肾脏及免疫学疾病的临床诊治及研究。
黄燕萍,教授。
10.3969/j.issn.1673-5293.2017.01.014
R725.4
A
1673-5293(2017)01-0038-04
