新生儿G-6-PD缺乏症合并高胆红素血症的临床分析
2017-02-10钟元枝肖体海范倩倩程旺松罗科兵
钟元枝,刘 玲,肖体海,范倩倩,程旺松,罗科兵
(深圳市龙华新区中心医院,广东 深圳 518110)
【临床研究】
新生儿G-6-PD缺乏症合并高胆红素血症的临床分析
钟元枝,刘 玲,肖体海,范倩倩,程旺松,罗科兵
(深圳市龙华新区中心医院,广东 深圳 518110)
目的 探讨红细胞葡萄糖-6-磷酸脱氢酶(G-6-PD)缺乏症合并新生儿高胆红素血症的影响因素及其特点。方法 收集2014年10月至2016年2月在深圳市龙华新区中心医院新生儿科住院的1 091例新生儿高胆红素血症患儿的临床资料,患儿分为G-6-PD缺乏症组和非G-6-PD缺乏症组,对两组患儿的临床资料进行比较分析。结果 入院时平均胆红素值G-6-PD缺乏组明显高于非G-6-PD缺乏组,差异有统计学意义(t=20.31,P=0.000);入院时胆红素值<256μmol/L的范围内,两组的人数占比差异无统计学意义(P=0.878>0.05),但在256~342μmol/L及>342μmol/L的范围内两组差异均有统计学意义(χ2值分别为7.84、15.93,均P<0.05)。合并症和并发症中新生儿肺炎、宫内细菌感染、胆红素脑病两组比较差异均有统计学意义(χ2值分别为10.11、3.90、22.28,均P<0.05),两组合并细菌感染发生率比较差异有统计学意义(χ2=10.55,P<0.05)。G-6-PD缺乏组发病籍贯主要以广东、广西地区为主,非G-6-PD缺乏组地域现象不明显,两组比较差异有统计学意义(χ2=36.81,P<0.05)。G-6-PD缺乏组伴有贫血较非G-6-PD缺乏组明显增多,差异有统计学意义(χ2=5.81,P<0.05)。结论 G-6-PD缺乏症黄疸出现时间早、进展快,胆红素峰值高,且易并发胆红素脑病,细菌感染是诱发G-6-PD缺乏患儿合并新生儿高胆红素血症的主要原因。
G-6-PD缺乏症;高胆红素血症;新生儿;细菌感染
红细胞葡萄糖-6-磷酸脱氢酶(glucose-6-phosphate dehydrogenase,G-6-PD)缺陷病是指G-6-PD活性降低或性质改变引起的红细胞溶血性贫血,是常见的一种X连锁遗传性酶病。该病常在一些诱因下发病,在新生儿期的发病主要表现为新生儿高胆红素血症,病情变化快,且易引起胆红素脑病,是新生儿急症之一[1]。该病又有明显的地域性差异,在我国多发生于两广地区,发病率呈南高北低[2]。为了解G-6-PD缺陷病导致的新生儿高胆红素血症的影响因素及其特点,现总结分析资料如下。
1对象与方法
1.1对象
选取深圳市龙华新区中心医院新生儿科2014年10月至2016年2月收治出生胎龄≥35周的新生儿高胆红素血症患儿1 091例为研究对象,将其中确诊为G-6-PD缺陷病的90例设为高胆1组,非G-6-PD缺陷病1 001例设为高胆2组。
1.2诊断标准
对G-6-PD缺陷病的诊断采用G-6-PD定量试剂盒(速率法)(广州科方生物技术有限公司),按说明书的检测方法测定,检测值<2 500IU/L诊断为G-6-PD缺乏。细菌感染诊断标准包括临床诊断和实验室诊断:临床表现(呼吸>60次/分钟、呼吸暂停、呼吸功能不全,皮肤发灰,反应差,肌张力减低,腹胀,嗜睡等);外周血白细胞计数(WBC)升高或减低,出生24小时内WBC≥25.0×109或≤5.0×109,C-反应蛋白(CRP)≥8mg/L,降钙素原(PCT)≥0.5ng/mL;24小时后WBC≥20.0×109或≤5.0×109,CRP≥10mg/L,PCT≥0.5ng/mL;血培养阴性或阳性。治疗干预措施参照我国2001年的新生儿黄疸干预推荐方案及美国2004年制定新的≥35周新生儿黄疸临床诊疗指南。
1.3统计学方法
2结果
2.1两组的一般情况
高胆1组男女比例为2.6:1,高胆2组男女比例为3.1:1;入院平均年龄、平均住院时间两组差异均有统计学意义(均P<0.05);两组患儿的性别、出生胎龄、体重比较差异均无统计学意义(均P>0.05),见表1。
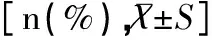
表1 两组患儿一般情况及结局比较结果
2.2两组籍贯分布情况
高胆1组中,父母均为广东或父母一方为广东籍的有65例,广西籍的有12例,两广籍合计77例(85.56%),其他为湖北籍1例,湖南籍4例,江西籍2例,甘肃籍1例,四川籍(包括重庆)2例,云南籍1例,贵州籍1例,河南籍1例,合计13例(14.44%);父母一方确诊有G-6-PD缺乏的有9例。高胆2组中,父母均为广东或父母一方为广东籍的有412例,广西籍的有112例,两广籍合计524例(52.35%),其他省份合计477例(47.65%)。
高胆1组父母祖籍一方或双方主要以两广地区为主(85.56%),高胆2组这种地域现象不明显,两广稍多(52.35%),两组比较差异有统计学意义(χ2=36.81,P=0.000<0.05)。
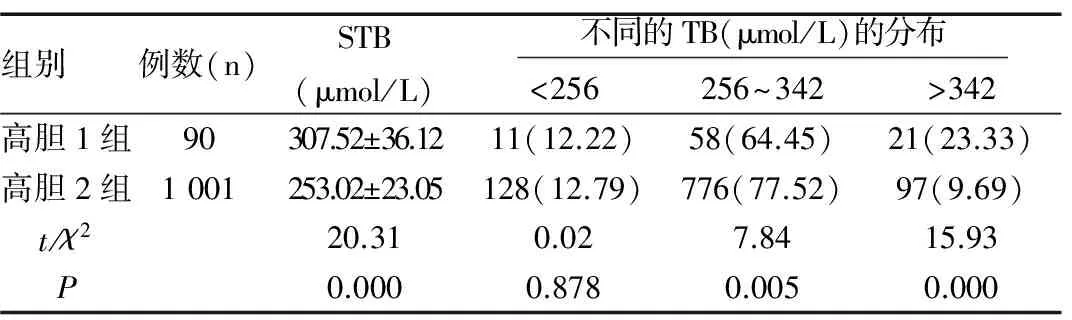
2.3两组胆红素值及不同的分布情况
入院时高胆1组中,血清总胆红素(STB)平均值为307.52±36.12μmol/L,其中胆红素(TB)范围在256~342μmol/L的人数比例最高,达64.45%,其次是TB>342μmol/L者,占比23.33%,其中最高1例TB达762μmol/L。入院时高胆2组中,血清STB平均值为253.02±23.05μmol/L,其中TB范围在256~342μmol/L的人数比例最高,达77.52%,其次是TB<256μmol/L者,占比12.79%,且均表现为间接胆红素升高为主。两组入院时胆红素平均值比较差异有统计学意义(P<0.05),两组胆红素值在<256μmol/L的人数差异无统计学意义(P>0.05),但在256~342μmol/L及>342umol/L的人数差异均有统计学意义(均P<0.05),见表2。
2.4两组合并症及并发症情况
高胆1组中,合并症中占前3位的是新生儿肺炎(占28.89%)、新生儿宫内细菌感染(占16.67%)、糖尿病母亲婴儿(占7.78%);因本资料中无严重感染如败血症病例,故将贫血归为G-6-PD缺乏症的并发症,贫血(非地中海原因贫血)占40.00%;其他因素无明显合并症及并发症占20.00%(18/90),有细菌感染(以感染的疾病结合实验室炎症指标,以下同此标准)因素存在占57.78%(52/90),超过半数。
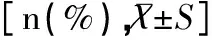
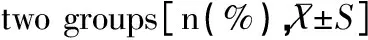
组别 例数(n)STB(μmol/L) 不同的TB(μmol/L)的分布 <256256~342>342高胆1组90307.52±36.1211(12.22)58(64.45)21(23.33)高胆2组1001253.02±23.05128(12.79)776(77.52)97(9.69)t/χ220.310.027.8415.93P0.0000.8780.0050.000
高胆2组中,合并症中占前3位的是新生儿肺炎(占15.78%)、新生儿宫内细菌感染(9.99%)、糖尿病母亲婴儿(7.89%);并发症中贫血(非地中海原因贫血)占27.97%,无胆红素脑病;其他因素无明显合并症及并发症占58.84%(589/1 001),超过半数,有细菌感染因素存在占40.16%(402/1 001)。
两组在新生儿肺炎、宫内细菌感染、非地中海原因贫血、胆红素脑病、其他因素、细菌感染比较差异均有统计学意义(均P<0.05),其余病种差异均无统计学意义(均P>0.05),见表3。
2.5治疗与转归
全部病例均采用新生儿黄疸治疗箱给予双面蓝光光疗,治疗上以间断光疗为主[1],一般每日光疗时间为8~12h,最初入院黄疸严重者每日延长至20~24h,间歇一段时间视黄疸反复者再次光疗,光疗同时加用肝酶诱导剂(苯巴比妥注射液)8~10mg/kg。光疗失败是指光疗后4~6h血清总胆红素不但没有下降,反而在原有基础上增加86μmol/L,光疗失败者予以换血治疗。血清TB>342μmol/L的患儿均加用白蛋白(1g·kg-1·次-1)静脉滴注,增加与未结合胆红素的联接,预防胆红素脑病的发生。对有感染的患儿使用抗生素治疗,并予以维生素B2片补充核黄素。高胆1组中,有换血治疗1例,治愈76例(84.44%),好转14例(16.56%),治愈好转率100.00%,未出现死亡病例。高胆2组中,未出现换血治疗病例,治愈839例(83.82%),好转162例(16.18%),治愈好转率100.00%。两组治愈好转率差异无统计学意义(χ2=0.02,P=0.872>0.05)。
表3 两组合并症、并发症等因素分析[n(%)]
Table 3 Analysis of complications in two groups[n(%)]

病种高胆1组(n=90)高胆2组(n=1001)χ2P合并症 新生儿肺炎26(28.89)158(15.78)10.110.001 新生儿脓疱病5(5.56)56(5.59)0.000.988 宫内细菌感染15(16.67)100(9.99)3.900.048 上呼吸道感染5(5.56)55(5.49)0.001.000 糖尿病母亲婴儿7(7.78)79(7.89)0.000.969 疱疹性咽峡炎6(6.67)69(6.89)0.010.935 头颅血肿5(5.56)46(4.60)0.020.879 地中海贫血5(5.56)26(2.60)1.650.198并发症 非地中海原因贫血36(40.00)280(27.97)5.810.016 胆红素脑病2(2.22)022.280.000 其他因素18(20.00)589(58.84)50.470.000 细菌感染52(57.78)402(40.16)10.550.001
注:因有些患儿可能同时合并或并发1种或几种疾病,故合计病人总数大于样本量。
3讨论
3.1两组黄疸出现时间与程度
本研究显示,G-6-PD缺乏症组入院平均年龄小,平均住院时间长,胆红素的峰值高,即胆红素值在256~342μmol/L及>342μmol/L的患儿,两组差异有统计学意义,且高胆1组最高1例TB值达762μmol/L,还有2例发生胆红素脑病,这说明G-6-PD缺乏症合并高胆红素血症的黄疸出现时间早且重,与李丽梅等[3]报道相似。
3.2两组的病因及新生儿结局
导致新生儿高胆红素血症的原因很多,但临床上常见且易查找的原因分为感染因素和非感染因素所致。感染因素包括细菌和病毒(本资料单指细菌感染)感染,非感染因素包括:母婴ABO或RH血型不和溶血病,红细胞增多症,G-6-PD缺乏症,地中海贫血,血管外溶血(如头颅血肿、颅内出血等),其他如窒息、缺氧、酸中毒、代谢等综合因素所致。
G-6-PD缺陷新生儿红细胞受外源性/内源性氧化应激诱发或自发地发生新生儿溶血症,导致高胆红素血症,常见外源性诱因为感染和药物。近年新生儿用药不慎较以前少见,而感染仍然常见,严重感染可能使G-6-PD缺陷新生儿溶血加重,从而使血清STB峰值明显升高。本组资料中细菌感染是诱发G-6-PD缺乏患儿黄疸的主要原因,而非G-6-PD缺乏中其他因素占58.84%,这与国内李丽梅等[3]报道G-6-PD缺乏症患儿新生儿期血清总胆红素与感染、异常产科史呈正相关相似。G-6-PD缺乏症患儿新生儿期发生高胆红素血症的原因可能与病原微生物及其产生的毒素、氧化性代谢产物等诱发溶血有关,因而控制感染也是治疗G-6-PD缺乏症的主要方法。G-6-PD缺陷病引起高胆红素血症,更易透过血脑屏障,渗入基底核脑细胞,引起胆红素脑病,其发生率比ABO溶血病更高,且可在血清胆红素较低水平时发生,是新生儿急危重症之一[4]。本组资料中G-6-PD缺乏症引起的高胆红素血症患儿中,出现胆红素脑病2例,非G-6-PD缺乏组中未见胆红素脑病发生。两组治疗转归效果均满意,治愈好转率均达100%,但在临床工作中有些家属不能正确认识高胆红素血症给患儿带来的伤害,甚至耽误治疗或使治疗不彻底,乃至患儿未治愈则强行出院,使再入院或发生胆红素脑病的机会增加。本组资料中2例胆红素脑病患儿均入院迟,且入院时血清总胆红素水平均在500μmol/L以上,最高达762μmol/L。但由本院爱婴区转入者无胆红素脑病发生,本院产科爱婴区每日均由新生儿科医生查房,及时监测胆红素,一旦达到高胆红素血症的时龄、日龄胆红素干预标准应及时收入新生儿病房,提示早期监测、早期干预是预防G-6-PD缺乏症引起胆红素脑病的关键。
3.3红细胞葡萄糖-6-磷酸脱氢酶缺乏症对新生儿贫血的影响
G-6-PD缺陷病引起溶血可导致高胆红素血症同时伴有贫血。本组资料中G-6-PD缺陷病伴贫血较非G-6-PD缺乏组明显增多。李丽梅等[3]报道G-6-PD缺乏症导致高胆红素血症患儿血红蛋白与感染无相关性,贫血多为轻、中度。本组资料虽未行G-6-PD缺乏者胆红素值与感染相关性研究,但鉴于本组资料中无严重感染如败血症病例,故将贫血归为G-6-PD缺陷的并发症。本组资料中G-6-PD缺乏组有3例接受过输血治疗,但本资料未统计贫血的严重程度。虽患儿血红蛋白的下降也与医源性丢失、生理性下降以及蓝光等因素影响有关,红细胞G-6-PD缺陷导致的高胆红素血症机理是溶血[5],但临床上并不是每例都会发生贫血,该病发生高胆红素血症的机理还值得进一步研。有研究显示,新生儿肝酶缺陷会影响机能不成熟儿甚至正常的婴儿肝脏代谢胆红素的能力[6],故有观点认为应谨慎使用蓝光照射,其会破坏红细胞膜的完整性,进而加重溶血反应[7]。我国南方G-6-PD缺陷病较多见,两广地区是G-6-PD缺乏症的高发地区。本组资料中G-6-PD缺乏症组较非G-6-PD缺乏症组两广籍人数比较差异有统计学意义,非G-6-PD缺乏症组籍贯地域差异不明显,但两广人数略多于其他地区,这可能与深圳人口结构中仍以广东本省和周边相邻省份外来人口占大多数有关。深圳是一个外来人口较多的城市,导致了很多省份的G-6-PD缺乏合并高胆红素血症的患儿均集中被发现。
新生儿G-6-PD缺乏症容易误诊,存在严重的溶血发作,风险极高的高胆红素血症和胆红素脑病[8],引起的黄疸具有出现时间早、进展快,如何早期防治该病发生至关重要。曾在希腊举行的“新生儿黄疸和核黄疸”会议上,与会者一致认为,有必要扩大新生儿G-6-PD筛查,婴儿从出生到筛查结果出来之前应该住在医院[9]。在深圳新生儿疾病筛查中,将G-6-PD缺陷的筛查列入新生儿疾病筛查的常规项目,但筛查结果回报慢,常不能用于早期发现和指导新生儿期黄疸治疗。对于防止G-6-PD缺乏症引起的高胆红素血症,应坚持做到以下几点:①加强婚检、产检时G-6-PD缺陷的筛查,对有G-6-PD缺乏症家族史的父母进行宣教。Kaplan等[10]通过各种视听教材将筛查工作和对父母的积极宣教结合起来,其不失为一种很有效的手段。患有G-6-PD缺乏症的孕妇禁止使用氧化性药物及食物,对于这些孕妇的新生儿,生后及时进行脐血筛查,发现有该病者,生后严密监测胆红素的动态变化,并积极控制诱因;②加强对新生儿高胆红素血症的随访,采用不同时龄、不同日龄需要进行干预的胆红素阈值作为监测指标,对G-6-PD缺乏症者应积极早期干预,从而减少换血和胆红素脑病的发生;③G-6-PD缺乏症所引起的高胆红素血症患儿容易发生胆红素脑病[11],且可在胆红素较低水平发生胆红素脑病,特别是存在感染、酸中毒等高危因素,可适当放宽换血指征。该病的早诊断、早治疗可大大减少医疗资源的浪费,减轻社会、家庭的负担,同时对优生优育、提高本地区出生人口素质及新生儿疾病防治工作也有着重要的意义。
[1]邵肖梅,叶鸿瑁,丘小汕.实用新生儿学[M].4版.北京:人民卫生出版社,2011:273-276,301.
[2]Luzzatto L.G6PD deficiency and malaria selection[J].Heredity (Edinb),2012,108(4):456.
[3]李丽梅,彭华保,李丽霞,等.新生儿葡萄糖-6-磷酸脱氢酶缺乏症临床特点分析[J].现代医药卫生,2016,32(1):100-102.
[4]邵肖梅,叶鸿瑁,丘小汕.实用新生儿学[M].4版.北京:人民卫出版社,2011:611-614.
[5]Riskin A, Gery N, Kugelman A,etal.Glucose-6-phosphate dehydrogenase deficiency and borderline deficiency:association with neonatal hyperbilirubinemia[J].J Pediatr,2012,161(2):191-196.
[6]Christensen R D,Nussenzveig R H, Yaish H M,etal.Causes of hemolysis in neonates with extreme hyperbilirubinemia[J].J Perinatol,2014,34(8):616-619.
[7]花少栋,温建武,刘楚芹,等.蓝光治疗对新生儿红细胞葡萄糖-6-磷酸脱氢酶缺乏症所致高胆红素血症患儿溶血反应的影响[J].中华妇幼临床医学杂志(电子版),2015,11(2):50-54.
[8]Kitcharoen S, Dechyotin S, Khemtonglang N,etal.Relationship among glucose-6-phosphate dehydrogenase(G-6-PD) activity, G-6-PD variants and reticulocytosis in neonates of northeast Thailand[J].Clin Chim Acta,2015,442:125-129.
[9]Kaplan M, Hammerman C.The need for neonatal glucose-6-phosphate dehydrogenase screening:a global perspective[J].J Perinatol,2009,29(Suppl 1):S46-S52.
[10]Kaplan M, Hammerman C, Bhutani V K.Parental education and the WHO neonatal G-6-PD screening program: a quarter century later[J].J Perinatol,2015,35(10):779-784.
[11]Stanton R C.Glucose-6-phosphate dehydrogenase, NADPH, and cell survival[J].IUBMB Life,2012,64(5):362-369.
[专业责任编辑:周熙惠]
Clinical analysis of neonatal G-6-PD deficiency complicated with hyperbilirubinemia
ZHONG Yuan-zhi, LIU Ling, XIAO Ti-hai, FAN Qian-qian, CHENG Wang-song, LUO Ke-bing
(LonghuaNewDistrictCentralHospitalofShenzhen,GuangdongShenzhen518110,China)
Objective To explore the influencing factors and characteristics of red blood cell glucose-6-phosphate dehydrogenase (G-6-PD) deficiency complicated with neonatal hyperbilirubinemia. Methods Clinical data of 1 091 neonates with hyperbilirubinemia hospitalized in neonatal department of Longhua New District Central Hospital of Shenzhen during the period of October 2014 to February 2016 was collected, and cases were divided into G-6-PD deficiency group and non G-6-PD deficiency group. Clinical data between two groups was compared and analyzed. Results Mean bilirubin level on admission in G-6-PD deficiency group was significantly higher than that in non G-6-PD deficiency group, and difference had statistical significance (t=20.31,P=0.000). Number of cases in range of bilirubin value lower than 256umol/L between two groups was not statistically different (P=0.878>0.05), but the number of cases in range of 256-342umol/L and higher than 342umol/L between two groups had statistical difference (χ2value was 7.84 and 15.93, respectively, bothP<0.05). Differences in number of cases with neonatal pneumonia, intrauterine bacterial infection or bilirubin encephalopathy between two groups were statistically significant (χ2value was 10.11, 3.90 and 22.28, respectively, allP<0.05). Difference in incidence of bacterial infection between two group was statistically significant (χ2=10.55,P<0.05). Cases in G-6-PD deficiency group were mainly from Guangdong and Guangxi province, whereas those in non G-6-PD deficiency group had no such regional phenomenon, and difference between two groups had statistical significance (χ2=36.81,P<0.05). More cases in G-6-PD deficiency group had anemia than in non G-6-PD deficiency group, and difference had statistical significance (χ2=5.81,P<0.05). Conclusion For cases with G-6-PD deficiency, jaundice appears early and develops rapidly. Peak value of bilirubin is high, and it is easy for cases to be complicated with bilirubin encephalopathy. Bacterial infection is the main factors inducing hyperbilirubinemia in G-6-PD deficiency neonates.
glucose-6-phosphate dehydrogenase (G-6-PD)deficiency; hyperbilirubinemia; neonates; bacteria infection
2016-04-21
钟元枝(1972-),女,副主任医师,主要从事新生儿及儿童感染性疾病的研究。
10.3969/j.issn.1673-5293.2017.01.024
R722.1
A
1673-5293(2017)01-0069-03
