基于多克隆抗体包被磁性纳米粒子的ELISA法检测西维因
2017-02-08崔涵雨韩玉凤王现平
张 灿,崔涵雨,韩玉凤,王现平,何 铭,陈 波,刘 源
基于多克隆抗体包被磁性纳米粒子的ELISA法检测西维因
张 灿1,崔涵雨1,韩玉凤1,王现平1,何 铭1,陈 波2,刘 源2
(1.江苏大学食品与生物工程学院,江苏 镇江 212013;2.镇江药品检验所,江苏 镇江 212000)
建立一种基于抗体包被氨基化Fe3O4磁性纳米粒子,建立免疫磁珠酶联免疫吸附测定(enzyme-linked immunosorbent assay,ELISA)法用于检测氨基甲酸酯农药西维因。结果表明:在最佳条件下,西维因质量浓度在1×10-3~10 mg/L范围内,建立的免疫磁珠ELISA法具有较好的线性关系(y=8.87lnx+72.77,R2=0.994),抑制率最高可达90.6%;测得的半抑制浓度(half maximal inhibitory concentration,IC50)为0.077 mg/L,检出限(IC15)为1.48×10-3mg/L。以质量浓度1 mg/L的西维因在相同条件下重复检测3 次,相对标准偏差为1.67%。以大米和卷心菜为实际样品进行西维因加标回收率实验,通过免疫磁珠ELISA法测得的回收率为70.5%~123.1%,同时采用高效液相色谱法进行相关性验证,结果表明,2 种方法检测结果的相关性较好(R2=0.91)。通过一系列分析表明,所建立的抗体包被磁性纳米粒子ELISA法可用于快速检测西维因。
西维因;免疫磁珠;酶标记免疫分析;检测;相关性
西维因,1-萘基-N-甲基氨基甲酸酯,属于氨基甲酸酯类农药,20世纪50年代以其相对低毒、高效进入市场,成为继有机磷农药后应用最广泛的农药[1-3]。目前,西维因的检测方法主要包括仪器分析[4-6],以生物抗体为识别元件的免疫分析[7-9]和传感器技术[10-12]。其中基于抗原抗体结合反应的免疫分析检测具有灵敏度高、特异性强、检测快速便捷的优点,主要的检测形式有酶联免疫吸附测定(enzyme-linked immunosorbent assay,ELISA)法[13-14]和试纸快速检测技术[15-16]。
免疫磁珠(immune magnetic beads,IMB)作为一种新型免疫分析方法,具备固相化试剂的特有优点和免疫学高度专一性的特点,在医学检验、微生物检测等方面得到了广泛的应用与发展[17-20]。IMB对物质的检测有2 种方式:直接法和间接法。直接IMB法具有检测流程简单,步骤简化,有效缩短检测时间,适合应用于食品安全快速检测领域[21-22]。
本研究通过合成西维因半抗原,将其与载体蛋白偶联形成完全抗原免疫动物制备西维因多克隆抗体。采用一步水热法制备氨基功能化四氧化三铁磁性纳米粒子(magnetic nanoparticles,MNPs),以戊二醛为偶联剂将西维因抗体与四氧化三铁MNPs结合作为IMB识别元件,以辣根过氧化物酶标记西维因半抗原制备酶标抗原为信号放大器,通过直接竞争实现对西维因的检测,实验过程如图1所示。
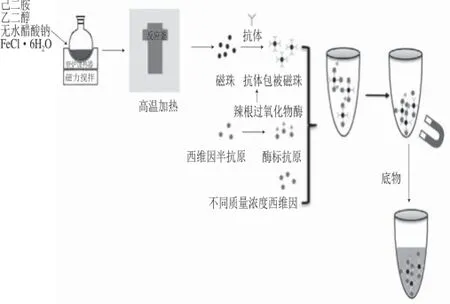
图1 IMB的制备及检测过程Fig. 1 Schematic illustration of the preparation of IMB
1 材料与方法
1.1 材料与试剂
大米、卷心菜 市购;西维因、克百威、异丙威、速灭威、N-羟基琥珀酰亚胺(N-hydroxysulfosuccinimide,NHS)、N,N’-二环己基碳二亚胺(dicyclohexylcarbodiimide,DCC)、牛血清蛋白(bovine serum albumin,BSA)、对硝基苯氯甲酸酯、二氯甲烷、吡啶、四氢呋喃、乙二醇、己二胺、无水醋酸钠、FeCl3·6H2O、25%戊二醛(均为分析纯)上海百灵威化工科技有限公司;血蓝蛋白、辣根过氧化物酶(horseradish peroxidase,HRP)、3,3’,5,5’-四甲基联苯胺(3,3’,5,5’-tetramethylbenzidine,TMB)上海西格玛试剂公司;α-萘酚、6-氨基己酸、无水硫酸钠、甲醇、乙醇乙酸乙酯、石油醚、Na2HPO4☒12H2O、NaH2PO4·2H2O、NaCl(均为分析纯) 上海国药集团化学试剂有限公司。
1.2 仪器与设备
W2-100SP旋转蒸发仪 上海亚荣生化仪器厂;XSeries Ⅱ电感耦合等离子体质谱、傅里叶变换红外分光光度计 美国赛默飞世尔公司;Cary 100-Bio紫外-可见分光光度计 美国Varian公司;HH-A恒温磁力搅拌器江苏金坛市中大仪器厂;FA1004电子天平 上海浦东荣丰科技仪器有限公司;电热鼓风干燥箱 上海一恒科学仪器有限公司;Inf nite 200多功能酶标仪 瑞士Tecan公司;JEM-2100透射电子显微镜 日本JEOL公司;1100高效液相色谱仪 美国Agilent公司。
1.3 方法
1.3.1 西维因抗原的合成
西维因半抗原的合成参照文献[23],合成目标化合物6-(1-萘氧基甲酰胺基)己酸。将目标物6-(1-萘氧基甲酰胺基)己酸和1.5 mmol/L NHS溶液,溶于5 mL N,N-二甲基甲酰胺(N,N-dimethylformamide,DMF)中,冰浴磁力搅拌条件下逐滴加入1.5 mmol/L DCC溶液,搅拌过程中有混浊物产生,反应6 h后,转入4 ℃冰箱过夜。次日取出离心去除沉淀,将上层活化酯液加入到10 mL质量浓度为5 mg/mL BSA溶液(溶于0.01 mol/mL pH 7.0的磷酸盐缓冲液(phosphate buffer saline,PBS))中,放于4 ℃搅拌反应5 h后装入透析袋,4 ℃条件下PBS透析3 d,分装备用,得到完全抗原。
1.3.2 抗体制备
西维因多克隆抗体为实验室自制,选择雄性新西兰大耳白兔,体质量约2 kg,月龄3 个月,饲养于标准实验动物房,连续观察7 d,确定身体状况正常后开始免疫。初次免疫剂量为1 mg完全抗原溶解于0.9% NaCl溶液0.5 mL,加入等量的弗氏完全佐剂充分混合乳化,采取背部皮下多点注射免疫。加强免疫时用不完全佐剂,免疫原剂量减半,每隔2 周加强免疫一次,4 次加强免疫后,血清效价达到平台期进行颈动脉采全血。离心分离得到的血清采用Protein A-Sepharose 4B作亲和层析介质纯化得到抗体蛋白,采用紫外-可见分光光度计测定吸光度经计算质量浓度为5 mg/mL。
1.3.3 IMB的制备
IMB的制备方法参照文献[24],第1步合成表面氨基功能化Fe3O4磁性纳米材料,第2步以戊二醛为交联剂将氨基化Fe3O4磁性纳米材料与西维因抗体偶联制备IMB。将10 mg氨基化,MNPs溶于10 mL PBS中,加入25%戊二醛溶液2.5 mL,于25 ℃条件下搅拌反应2 h。PBS洗涤3 次后用磁石收集,定容至10 mL,加入5 μmol/L抗体于37 ℃条件下搅拌2 h。PBS洗涤3 次后用磁石收集,得到质量浓度为1 mg/mL的IMB,于4 ℃贮存。
1.3.4 酶标抗原稀释比例
西维因酶标抗原的制备步骤同1.3.1节,将活化酯溶液与载体蛋白HRP进行偶联,得到西维因的酶标抗原。将150 μL制得的IMB加入1.5 mL离心管,将西维因酶标抗原用PBS稀释成不同比例(1∶1 000、1∶2 000、1∶4 000、1∶8 000、1∶16 000、1∶32 000、1∶64 000、1∶128 000),分别加入离心管,每个100 μL,37 ℃条件下振荡反应一定时间,PBS洗涤,加入底物显色。1.25 mol/L硫酸溶液终止后,通过多功能酶标仪测定吸光度。
1.3.5 反应平衡时间
将150 μL制得的IMB加入1.5 mL离心管,选取反应时间5、10、20、30、40、50、60、70、80 min,将西维因酶标抗原与1 mg/L西维因标准液各50 μL加入管中,37 ℃条件下振荡反应,PBS洗涤,加入底物显色。1.25 mol/L硫酸溶液终止后,通过多功能酶标仪测定吸光度。
1.3.6 IMB检测农药西维因
酶标抗原稀释比例及反应时间优化后,建立IMB检测农药西维因,通过测定得到吸光度计算抑制率,并绘制抑制标准曲线。待测物质量浓度与抑制率呈正比关系,通过测定吸光度,计算得到抑制率带入抑制标准曲线确定待测物质量浓度。吸光度测定条件为:检测波长450 nm,参比波长650 nm。抑制率按下式计算。

式中:ABlank、AControl、A[C]分别为空白、不含西维因和含有西维因的吸光度;[C]为西维因的质量浓度/(mg/L)。
1.3.7 交叉反应
选取速灭威、克百威和异丙威3 种氨基甲酸酯类农药为结构类似物,进行交叉反应实验。将150 μL制得的IMB加入1.5 mL离心管,将优化质量浓度后的西维因酶标抗原与一系列不同质量浓度的西维因、速灭威、克百威和异丙威标准溶液各50 μL加入孔中,PBS洗涤2 次,加入150 μL TMB底物显色,再加入50 μL 1.25 mol/L硫酸溶液终止后,通过多功能酶标仪测定吸光度,并计算抑制率。
1.3.8 实际样品的测定
经高效液相色谱检测不含西维因的大米和卷心菜样品进行添加回收率的测定。将样品剪切成细碎状,各称取2 g,样品添加西维因含量分别为0.05、0.5、1 mg/kg。用6 mL甲醇溶液浸没,200 r/min条件下振荡30 min,上清液过膜稀释后与酶标抗原各50 μL加入装有IMB的1.5 mL离心管,按优化的反应条件,结果通过多功能酶标仪测定。
同时采用高效液相色谱法作为对照进行检测结果的验证,高效液相色谱的检测方法参照文献[25],采用C18柱,以乙腈-水(2∶3,V/V)溶液为流动相,流速为1 mL/min。
2 结果与分析
2.1 实验机理的研究
通过对西维因半抗原的合成目标化合物6-(1-萘氧基甲酰胺基)己酸进行质谱分析,m/z 324.35是M+Na峰,m/z 625.00为2M+Na峰,质谱结果显示合成的物质与目标半抗原分子质量一致,表明半抗原目标化合物合成成功。采用直接竞争法,将西维因待测液与西维因酶标抗原同时与IMB上西维因抗体竞争结合,形成待测液-酶标抗原-抗体-IMB复合物,在外加磁场的作用下,复合物集聚在离心管底部,目标物质量浓度越高,酶标抗原结合越少,在底物作用下,颜色越浅,显现出不同深浅的变化,如图2所示,通过多功能酶标仪测得吸光度,绘制质量浓度-抑制曲线,达到定量检测西维因。以未结合抗体的MNPs为参照,与IMB同时检测西维因,结果如图3所示,未结合抗体的MNPs对西维因没有特异性吸附,不具有规律性的抑制率变化,而IMB对西维因具有规律性变化表明IMB对西维因的特异性吸附是由MNPs表面结合的抗体造成。

图2 IMB检测不同质量浓度西维因的结果示意图Fig. 2 Results of IMB detection of different concentrations of carbaryl

图3 MNPs和IMB检测西维因的抑制率变化Fig. 3 Inhibition rates of MNPs and IMB for carbaryl detection
2.2 氨基化Fe3O4磁性纳米材料的表征
选取一步水热法制得的氨基化MNPs,采用傅里叶红外分光光度计及透射电镜对其进行表征,如图4所示。从图4a可以看出,氨基化MNPs的特征峰:756 cm-1处的强峰表明Fe—O官能团的存在;1 701、1 402 cm-1和1 118 cm-1分别是N—H的弯曲振动和C—N的伸缩振动,以上说明成功合成出带有氨基功能基团的MNPs;从图4b可以看出,氨基化MNPs具有较好的分散性且形态较完整。

图4 磁性纳米材料的傅里叶红外光谱图(a)和透射电镜图(b)Fig. 4 FT-IR spectrum (a) and transmittance electron microscopy (TEM) (b) images of MNPs
2.3 酶标抗原稀释比例的优化
通过多功能酶标仪读数,选取吸光度处于0.8~1.0之间所对应的酶标抗原稀释比例。本实验中酶标抗原稀释比例为1∶4 000时吸光度为0.912 6,故选取1∶4 000为反应的最佳酶标抗原稀释比例。
2.4 反应平衡时间的优化
采用多功能酶标仪测定不同吸附时间条件下IMB的吸光度变化。在0~40 min,吸光度逐渐升高,说明随着时间的延长,反应逐渐达到平衡,40 min后,吸光度变化趋于平缓,表明40 min时反应基本达到平衡。故选取40 min为最佳反应时间。
2.5 交叉反应测定
选择速灭威、克百威和异丙威3 种氨基甲酸酯类农药进行交叉反应,如图5所示,IMB对目标物西维因的抑制率变化明显高于其他3 种结构类似物,说明制备的IMB对西维因具有较高的特异识别性。
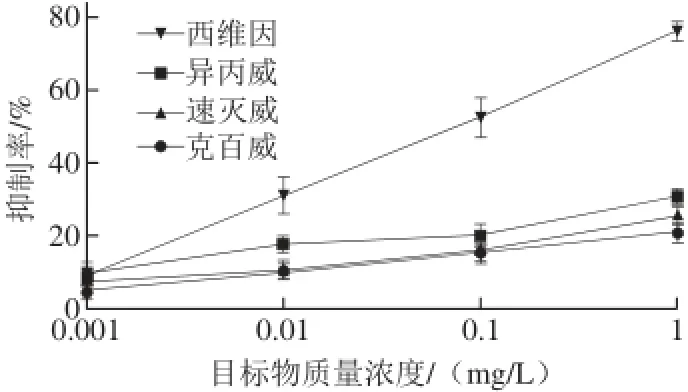
图5 IMB对西维因、速灭威、克百威和异丙威的交叉反应Fig. 5 Cross-reactivity of IMB for the detection of carbaryl, metolcarb, carbfuran and isoprocarb
2.6 IMB检测农药西维因
在本实验优化的最佳条件下,IMB测得西维因质量浓度在1×10-3~10 mg/L范围内具有较好的线性关系(y=8.87lnx+72.77,R2=0.994),抑制率最高可达到90.6%,如图6所示,测得的西维因半抑制浓度(half maximal inhibitory concentration,IC50)为0.077 mg/L,检出限(IC15)为1.48×10-3mg/L。选取1 mg/L质量浓度的西维因在相同条件下重复3 次检测,测得相对标准偏差为1.67%。
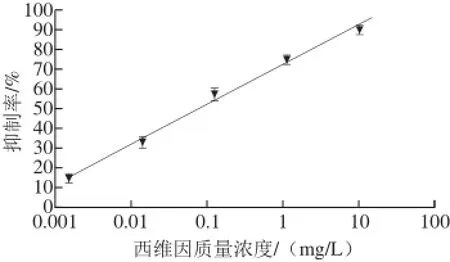
图6 IMB检测不同质量浓度西维因的抑制率变化Fig. 6 Inhibition rates of different concentrations of carbaryl detected by IMB
2.7 实际样品中的应用
为了评价本实验建立的方法的精确性,采用高效液相色谱方法作为对照,进行加标测定回收率实验。如表1所示,IMB回收率在70.5%~123.1%之间。与高效液相色谱法具有较好的相关性(R2=0.91),如图7所示。表明IMB方法可以用于大米和卷心菜样中西维因的检测。

表1 大米和卷心菜样品中西维因的加标回收率结果(n==33)Table1 Spiked recoveries for carbaryl in rice and Chinese cabbage (n == 33))

图7 IMB和HPLC检测结果的相关性Fig. 7 Correlation curve between IMB and HPLC
3 结 论
人工合成西维因半抗原,将其与载体蛋白偶联免疫新西兰大耳白兔得到西维因多克隆抗体,纯化得到质量浓度为5 mg/mL的抗体。一步水热法制得的氨基化MNPs,通过透射电镜和傅里叶红外分光光度计对其进行表征。采用戊二醛法偶联抗体和氨基功能化MNPs,以未包被抗体的MNPs为对照,检测不同质量浓度西维因,包被有抗体的IMB显现出有规律的变化且具有较好的抑制率而未包被抗体的MNPs未显现一定规律,表明成功合成具有特异性吸附能力的IMB,且对西维因的检测是由MNPs上包被的抗体所实现的。
通过优化酶标抗原稀释比例、反应平衡时间等条件,建立的IMB-ELISA法测得西维因质量浓度在1×10-3~ 10 mg/L范围内具有较好的线性关系(y=8.87lnx+72.77,R²=0.994),抑制率最高可达到90.6%,IC50为0.077 mg/L,检出限(IC15)为1.48×10-3mg/L。以1 mg/L质量浓度的西维因在相同条件下重复3 次检测,测得的相对标准偏差为1.67%。另外,以大米和卷心菜为实际样品进行加标测定回收率实验。采用高效液相色谱法为对照,建立的IMB-ELISA法测得的回收率在70.5%~123.1%之间,与高效液相色谱法得到的结果具有较好的相关性(R2=0.91)。通过一系列的实验,得出结论:所建立的IMB-ELISA法能够有效实现对西维因的快速检测且该方法操作简便快捷。
[1] 乔广浩, 刘欣. 杀虫剂西维因毒性及雌激素活性进展研究[J]. 环境科学与技术, 2010, 33(2): 99-105. DOI:10.3969/j.issn.1003-6504.2010.02.024.
[2] SAXEA P N, GUPTA S K, MURTHY R C. Comparative toxicity of carbaryl, carbofuran, cypermethrin and fenvaleratein Metaphire posthuma and Eisenia fetida: a possible mechanism[J]. Ecotoxicology and Environmental Safety, 2014, 100: 218-225. DOI:10.1016/ j.ecoenv.2013.11.006.
[3] YOON M, KEDDERIS G L, YAN G Z, et al. Use of in vitro data in developing a physiologically based pharmacokinetic model: carbaryl as a case study[J]. Toxicology, 2015, 332: 52-66. DOI:10.1016/ j.tox.2014.05.006.
[4] BEDASSA T, GURE A, MEGERSA N. Modif ed QuEChERS method for the determination of multiclass pesticide residues in fruit samples utilizing high-performance liquid chromatography[J]. Food Analytical Methods, 2015, 8(8): 2020-2027. DOI:10.1007/s12161-014-0081-7.
[5] CHOWDHURY M A Z, FAKHRUDDIN A N M, ISLAM M N, et al. Detection of the residues of nineteen pesticides in fresh vegetable samples using gas chromatography-mass spectrometry[J]. Food Control, 2013, 34(2): 457-465. DOI:10.1016/j.foodcont.2013.05.006.
[6] SHI Z H, HU J D, LI Q, et al. Graphene based solid phase extraction combined with ultra high performance liquid chromatography-tandem mass spectrometry for carbamate pesticides analysis in environmental water samples[J]. Journal of Chromatography A, 2014, 1355: 219-227. DOI:10.1016/j.chroma.2014.05.085.
[7] 张灿, 王硕, 段玉清, 等. 西维因毛细管电泳免疫分析方法的建立及其与固相酶联免疫分析方法(ELISA)的比较[J]. 食品工业科技, 2012, 33(19): 297-300. DOI:10.13386/j.issn1002-0306.2012.19.062.
[8] SUN J, DONG T, ZHANG Y, et al. Development of enzyme linked immunoassay for the simultaneous detection of carbaryl and metolcarb in different agricultural products[J]. Analytica Chimica Acta, 2010, 666(1/2): 76-82. DOI:10.1016/j.aca.2010.03.051.
[9] GUO Y, TIAN J, LIANG C, et al. Multiplex bead-array competitive immunoassay for simultaneous detection of three pesticides in vegetables[J]. Microchimica Acta, 2013, 180(5/6): 387-395. DOI:10.1007/s00604-013-0944-4.
[10] SONG Y H, CHEN J Y, SUN M, et al . A simple electrochemical biosensor based on AuNPs/MPS/Au electrode sensing layer for monitoring carbamate pesticides in real samples[J]. Journal of Hazardous Materials, 2016, 304: 103-109. DOI:10.1016/ j.jhazmat.2015.10.058.
[11] CLEVERSON S S, ROSANA M, CHRISTIANA A P. Biosensor for carbaryl based on gold modified with PAMAM-G4 dendrimer[J]. Journal of Applied Electrochemistry, 2015, 45(4): 325-334. DOI:10.1007/s10800-015-0791-6.
[12] ÇELEBI M S, OTURAN N, ZAZOU H, et al. Electrochemical oxidation of carbaryl on platinum and boron-doped diamond anodes using electro-Fenton technology[J]. Separation and Purification Technology, 2015, 156: 996-1002. DOI:10.1016/j.seppur.2015.07.025. [13] SHAHILA P, PRADIP N. Image-based ELISA on an activated polypropylene microtest plate-A spectrophotometer-free low cost assay technique[J]. Biosensors and Bioelectronics, 2013, 48: 287-292. DOI:10.1016/j.bios.2013.04.020.
[14] JESTER E L E, ABRAHAM A, WANG Y S, et al. Performance evaluation of commercial ELISA kits for screening of furazolidone and furaltadone residues in f sh[J]. Food Chemistry, 2014, 145: 593-598. DOI:10.1016/j.foodchem.2013.08.090.
[15] JIRO H, SHINYA S. A new competitive ELISA detects West Nile virus infection using monoclonal antibodies against the precursor-membrane protein of West Nile virus[J]. Journal of Virological Methods, 2013, 188(1/2): 132-138. DOI:10.1016/j.jviromet.2012.12.002.
[16] XU M, XIE Y F, JIANG C H, et al. A novel ELISA using a recombinant outer membrane protein, rTp0663, as the antigen for serological diagnosis of syphilis[J]. International Journal of Infectious Diseases, 2016, 43: 51-57. DOI:10.1016/j.ijid.2015.12.013.
[17] MENDES R K, LASCHI S, STACH-MACHADO D R, et al. A disposable voltammetric immunosensor based on magnetic beads for early diagnosis of soybean rust[J]. Sensors and Actuators B, 2012, 166/167: 135-140. DOI:10.1016/j.snb.2012.02.004.
[18] BARIZUDDIN S, BALAKRISHNAN B, STRINGER R C, et al. Highly specific and rapid immuno-fluorescent visualization and detection of E. coli O104:H4 with protein-A coated magnetic beads based LST-MUG assay[J]. Journal of Microbiological Methods, 2015, 115: 27-33. DOI:10.1016/j.mimet.2015.05.017.
[19] CHU P T, WEN H W. Sensitive detection and quantif cation of gliadin contamination in gluten-free food with immunomagnetic beads based liposomal fluorescence immunoassay[J]. Analytica Chimica Acta, 2013, 787: 246-253. DOI:10.1016/j.aca.2013.05.014.
[20] WANG Y K, WANG Y C, WANG H A, et al. An immunomagneticbead-based enzyme-linked immunosorbent assay for sensitive quantification of fumonisin B1[J]. Food Control, 2014, 40: 41-45. DOI:10.1016/j.foodcont.2013.11.025.
[21] 刘细霞, 涂俊铭. 免疫磁珠分离技术及其在食源性致病菌检测中应用的进展[J]. 中国抗生素杂志, 2014, 39(12): 956-960. DOI:10.13461/j.cnki.cja.005470.
[22] SONG F, ZHOU Y, LI Y S, et al. A rapid immunomagnetic beads-based immunoassay for the detection of β-casein in bovine milk[J]. Food Chemistry, 2014, 158: 445-448. DOI:10.1016/j.foodchem.2014.02.150.
[23] 杨耀军, 渠桂荣, 孟凡涛, 等. 西维因人工抗原的合成新方法[J].过程工程学报, 2005, 5(2): 201-204. DOI:10.3321/j.issn:1009-606X.2005.02.020.
[24] WU S J, WANG Y Q, DUAN N, et al. Colorimetric aptasensor based on enzyme for the detection of Vibrio parahemolyticus[J]. Journal of Agricultural and Food Chemistry, 2015, 63(35): 7849-7854. DOI:10.1021/acs.jafc.5b03224.
[25] 于春娣, 慕鸿雁, 赵梅, 等. 直接竞争酶联免疫法测定西维因残留[J]. 食品科技, 2008, 33(11): 266-270. DOI:10.13684/j.cnki. spkj.2008.11.069.
Development of Immunoagnetic Bead-Based ELISA for the Detection of Carbaryl
ZHANG Can1, CUI Hanyu1, HAN Yufeng1, WANG Xianping1, HE Ming1, CHEN Bo2, LIU Yuan2
(1. School of Food and Biological Engineering, Jiangsu University, Zhenjiang 212013, China; 2. Zhenjiang Institute for Drug Control, Zhenjiang 212000, China)
This paper develops an immunomagnetic bead-based enzyme-linked immunosorbent assay (ELISA) for the detection of carbaryl. Under optimum conditions, the method exhibited a good linear relationship in the range of 1 × 10-3-10 mg/L, with a correlation coefficient (R2) of 0.994. The maximum inhibition rate reached 90.6%, and the halfmaximum inhibitory concentration (IC50) was 0.077 mg/L. The detection limit (LOD) of this method was 1.48 × 10-3mg/L. The precision for three replicate detections of carbaryl (1 mg/L) was 1.67% (relative standard deviation, RSD). The recovery of rice and Chinese cabbage spiked with carbaryl was between 70.5% and 123.1%. Also, it was found that the detection results were highly correlated with those obtained by high performance liquid chromatography (R2= 0.91). In conclusion, the immunomagnetic bead-based ELISA can be used for rapid detection of carbaryl.
carbaryl; immunomagnetic beads; enzyme-linked immunosorbent assay (ELISA); detection; correlation
10.7506/spkx1002-6630-201702046
TS201.6
A
1002-6630(2017)02-0296-05
张灿, 崔涵雨, 韩玉凤, 等. 基于多克隆抗体包被磁性纳米粒子的ELISA法检测西维因[J]. 食品科学, 2017, 38(2): 296-300. DOI:10.7506/spkx1002-6630-201702046. http://www.spkx.net.cn
ZHANG Can, CUI Hanyu, HAN Yufeng, et al. Development of immunoagnetic bead-based ELISA for the detection of carbaryl[J]. Food Science, 2017, 38(2): 296-300. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201702046. http://www.spkx.net.cn
2016-06-01
国家自然科学基金青年科学基金项目(31000783);镇江市科技支撑项目(SH2014019);江苏大学2016年大学生实践创新项目(136)
张灿(1979—),女,副教授,博士,研究方向为食品安全检测。E-mail:zhangcan@mail.ujs.edu.cn
